ORIGINAL
Evaluación de la microencapsulación de ácidos húmicos y fúlvicos para ser empleados en la fertilización de liberación controlada para plantas de ornato con alto valor comercial
Evaluation of the microencapsulation of humic and fulvic acids to be used in controlled release fertilization for ornamental plants with high commercial value
Aldo Andrés López-Nataret1, Diana Matías-Pérez1, Marco Antonio Sánchez-Medina2, Iván Antonio García-Montalvo1
1División de Estudios de Posgrado e Investigación, Tecnológico Nacional de México/Instituto Tecnológico de Oaxaca, Oaxaca, México.
2Departamento de Ingeniería Química y Bioquímica, Tecnológico Nacional de México/Instituto Tecnológico de Oaxaca, Oaxaca, México.
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Resumen
El objetivo del presente trabajo es evaluar la microencapsulación de ácidos humícos y fúlvicos para ser empleados en la fertilización a través de la liberación controlada para plantas de ornato con un alto valor comercial, con ello se busca generar una alternativa de reducción en el impacto ambiental provocado por otros tipos de fertilizantes para los mismos fines, es importante mencionar que la producción de plantas de ornato es considerada como una industria que requiere de costos elevados durante su iniciación y mantenimiento, destacando el incremento de costos debido a la utilización de materiales importados tales como: vermiculitas, lana roca, turbas, muzgos, nitrato de potasio, nitrato de calcio y fosfonitratos, se debe tomar en cuenta que los productos comerciales más utilizados para la fertilización han demostrado poseer propiedades fisicoquímicas adecuadas para el desarrollo de los cultivos por lo tanto, el desarrollo de fertilizantes alternativos a los tradicionales habrán de cuidar de manera especial dichos aspectos, además de no ocasionar daño al suelo evitando así la generación de contaminantes residuales.
Palabras clave
Microencapsulación; Ácidos humícos; Ácidos fúlvicos; Fertilizantes
Abstract
The objective of this work is to evaluate the microencapsulation of humic and fulvic acids to be used in fertilization through controlled release for ornamental plants with a high commercial value, thereby seeking to generate an alternative to reduce the impact environmental caused by other types of fertilizers for the same purposes, it is important to mention that the production of ornamental plants is considered as an industry that requires high costs during its initiation and maintenance, highlighting the increase in costs due to the use of imported materials such as: vermiculites, rock wool, peat, muzgos, potassium nitrate, calcium nitrate and phosphonitrate, it should be taken into account that the most used commercial products for fertilization have shown to have adequate physicochemical properties for the development of crops, therefore, the development of alternative fertilizers to the traditional ones will have to take special care of these aspects, in addition to not causing damage to the soil, thus avoiding the generation of residual contaminants.
Keywords
Microencapsulation; Humic acids; Fulvic acids; fertilizers
Introducción
La materia orgánica (MO) del suelo es considerado como un factor esencial para la fertilidad de este, por sus numerosas cualidades, los componentes orgánicos del suelo están relacionados con la productividad y el desarrollo benéfico de las plantas, ya sea que se acople íntegramente con los factores del medio, siendo biológicos o climáticos; las sustancias húmicas (SH) tienen una influencia directa en el crecimiento y nutrición vegetal, incrementando la productividad de los cultivos(1). Las SH provienen de desechos animales y plantas descompuestos química y microbiológicamente, son de color oscuro, con carácter ácido, elevado peso molecular, resistentes al ataque microbiano y con propiedades refractarias(2,3), en el suelo se encuentran formando complejos macromoleculares que pueden estar ligados a cationes como el Ca (II), Fe (III) y Al (III), combinados con los minerales de las arcillas, o asociados a algunas sustancias no húmicas como los carbohidratos, mediante uniones de carácter débil, aunque también se pueden unir covalentemente(3,4). El contenido de materia orgánica y SH difiere con el tipo de suelo, en los suelos naturales este porcentaje es mayor que en los suelos destinados a la agricultura, donde el tipo de cultivo y el grado de mecanización aplicado incrementa la mineralización de la materia orgánica, por lo que los nutrientes liberados asimilados por las cosechas(5), los contenidos de sustancias húmicas según el tipo de suelo van a oscilar entre el 33-75% del total de materia orgánica del suelo y dentro de un mismo suelo, el contenido y tipo de SH también difiere con la profundidad en el perfil del mismo(6,7), con el tiempo(8) y los factores ambientales(9,10) ya que en razón de su dinámica se van transformando además de evolucionar sin cesar, con ello la procedencia de las sustancias húmicas es un factor determinante en sus propiedades fisicoquímicas. Hoy en día, las tendencias a utilizar productos orgánicos permiten a los agricultores incrementar sus rendimientos sin alterar el medio ambiente, los ácidos fúlvicos han despertado un gran interés en los productores del campo, entre sus múltiples beneficios posibilitan un mejor aprovechamiento de fertilizantes foliares y radiculares, además de estimular el crecimiento general de la planta, lo cual se traduce en un aumento de rendimientos y mejor calidad de cosechas. Además de que mejoran la estructura del suelo al favorecer la formación de agregados y la reproducción exponencial de microorganismos(11). Los ácidos húmicos y fúlvicos son componentes principales de los complejos órgano-minerales presentes en los suelos, por ello es determinante conocer sus propiedades fisicoquímicas, se han establecido técnicas de extracción, separación y purificación que permiten su caracterización y su dosificación a suelos para diferentes tipos de plantas, la esferificación se propone como una alternativa de fertilización de liberación controlada, la esferificación es una gelificación controlada de un líquido que, sumergido en un recipiente conteniendo una solución de sales de calcio, forma pequeñas esferas con un líquido a su interior, con la esferificación se desea modificar las propiedades texturales de los alimentos, fertilizantes o medicamentos, por lo anterior el objetivo de este trabajo fue el de desarrollar, formular y evaluar la esferificación de ácidos húmicos y fúlvicos para ser empleados en la fertilización de liberación controlada para plantas de ornato con alto valor comercial, generando así una alternativa de reducción en el impacto ambiental provocado por otros tipos de fertilizantes para los mismos fines.
Materiales y métodos
· Determinación de parámetros fisicoquímicos y estandarización de la mezcla de los ácidos húmicos (AH) y ácidos fúlvicos (AF)
Se caracterizaron los parámetros fisicoquímicos de los ácidos a emplear, posteriormente estos mismos parámetros serán evaluados, pero ahora para los AH/AF, el cual el reactivo a evaluar es una mezcla de los antes mencionados AH/AF, posteriormente todas ellas serán microencapsuladas y evaluadas para así determinar cuál es la más idónea para lograr en crecimiento en cultivos.
· Determinación de pH
La determinación de pH se realizó a través del método electrométrico, esté consiste en la determinación de la concentración producida por los iones hidronios a través de mediciones potenciométricas usando un electrodo de vidrio con un electrodo de referencia.
· Determinación de la viscosidad
La medida reológica de materias primas y de productos en elaboración, resulta de gran utilidad para el control de procesos y para conocer la funcionalidad de determinados ingredientes en el desarrollo de nuevos productos. Además, influye de forma muy considerable en el grado de aceptación del producto por parte del consumidor. La viscosidad es una característica de los fluidos en movimiento, muestra una tendencia de oposición hacia su flujo ante la aplicación de una fuerza. Esta oposición es debida a las fuerzas de adherencia que poseen las moléculas de un líquido con respecto a las otras moléculas del mismo líquido. Para llevar a cabo la medida de la viscosidad de las muestras destinadas a la elaboración de las esferas se empleó un viscosímetro Saybolt (Sagaon Tech, sT5).
· Determinación de la relación de densidades ópticas
Para celdas de 1 ml se emplearon 1000 μl de agua como celda de referencia, serán empleadas para una segunda celda 100 μl del aminoácido con 900 μl de agua y para una tercera celda se empleará 100 μl de AH/AF con 900 μl, medir la absorbancia a 465 nm y 665 nm, la relación de ambas absorbancias es la relación denominada E4/E6. La mitad de esta relación estará inversamente proporcionada con el tamaño de partículas de los ácidos, una baja relación indica un tamaño mayor de partícula y alta relación, lo inverso.
· Estandarización de la formulación adecuada para llevar a cabo el proceso de microencapsulado a través de una membrana semipermeable conformada por alginato de sodio y cloruro de calcio
Se realizó la estandarización de la formulación más acorde de la relación de Alginato de Sodio y de Cloruro de Calcio, tomando como criterios esenciales la formación de la esfera, el tamaño de esta, así como la forma obtenida y su resistencia a temperaturas. La esferificación indica que la mezcla de ácidos deberá de unirse al Alginato de Sodio (2.2, 2.3, 2.5 % m/v), utilizando así mismo un estabilizador (goma xantana) en un 2% dependiendo de la mezcla y posterior a ello se sumergirá en el baño con Cloruro de Calcio al 8 % m/v alrededor de 10 min para obtener un esferificado más consistente, posteriormente se sumergirá en un baño de agua destilada para quitar el contenido de cloruro de calcio sobrante de la esfera.
· Determinación del color
El color supone un factor decisivo en la intención de compra de un producto por parte del consumidor, lo que hace necesario su control al evaluar la calidad comercial del producto. Esto es así debido a que está correlacionado muchas veces con la calidad nutricional, el estado sanitario, la presencia de defectos externos o internos o la concentración en determinados colorantes entre otros muchos aspectos. Para realizar la medición del color de las esferas se realizarán tres medidas a cada una de las formulaciones diseñadas, empleando para ello un espectrofotómetro (625, 550, 495 y 445 nm) y determinar la luminosidad, el tono, el croma y el ángulo de la tonalidad (Velab; VE-5600UV PC).
· Tiempo de gelificación
Para estimar el tiempo de Gelificación se procedió a emplear una pipeta Pasteur con la solución de AH/HF, y Alginato de Sodio posteriormente se realizó una liberación gota a gota poco a poco en solución de Cloruro de Calcio al 8% p/v, cuantificando el tiempo de en qué tarda en esferificarse y adicionando el tiempo en que tarde en lavarse con agua destilada.
· Determinación de la acidez
La determinación de acidez se realizó a través del método de titulación, en el cual se buscan los iones de hidrógeno presentes en una muestra como resultado de la disociación o hidrólisis de solutos reaccionan con adiciones de álcali estándar (NaOH 0.1 N), la acidez depende del pH del punto final o indicador.
· Determinación del tamaño de la esfera
Se determinó el grosor promedio de las esferas utilizando un vernier, midiendo el largo y ancho de un total de 20 esferas.
· Determinación de la conductividad eléctrica
La determinación de la conductividad eléctrica es la capacidad de una sustancia de conducir la corriente eléctrica y es lo contrario de la resistencia, el valor de la conductividad es directamente proporcional a la concentración de sólidos disueltos, por lo tanto, cuanto mayor sea dicha concentración, mayor será la conductividad. Se determinó a través del método electrométrico, esté consiste en la determinación de la concentración producida por los movimientos moleculares en la sustancia a través de mediciones potenciométricas usando un electrodo de vidrio con un electrodo de referencia.
· Determinación de la capacidad de retención del agua
En tubos de 50 ml, se pesaron 1 g de esferas por muestra y se adicionaron 30 ml de agua destilada en cada uno, se agitó y se dejó en reposo en un lapso de 0 hasta 21 h; cada hora se tomará un tubo y las esferas ya hidratadas se equilibraron sobre membranas Millipore colocadas en la posición intermedia de tubo de centrifuga, centrifugando (1800 rpm, 10 minutos). Posteriormente se pesarán las esferas centrifugadas y se expresará la capacidad de retención de agua como el porcentaje de ganancia de peso (agua retenida) en las esferas con AH/AF, tomando el peso ganado dividido entre peso inicial por 100 %.
· Determinación de la densidad
Se utilizó un método indirecto, pesando inicialmente las esferas en una balanza analítica para encontrar su masa. Para obtener su volumen se sumergirán completamente las esferas, y con cuidado, en una probeta que tiene un volumen exacto de agua (V0); luego se leyó el volumen final (Vf), el volumen del sólido correspondido a la diferencia (Vf-V0), la densidad de las esferas se calculará dividiendo la masa sobre el volumen.
· Temperatura de la ruptura de la membrana
El método más utilizado para determinar materia seca parcial es el de la eliminación de agua libre por medio del calor de circulación seguida por determinación del peso del residuo, esta técnica se basa en someter a los insumos a temperaturas entre 55-60 °C la temperatura se regula para efectuar un secado máximo y para evitar un mínimo de pérdidas de sustancias volátiles y otras que se descomponen. Para esto se colocó 473 gramos de muestra fresca en una charola de aluminio y se dejó en un horno a 65° C durante 14 horas(12).
· Tiempo de la ruptura de la membrana
Se empleó el mismo procedimiento que en la determinación de la Temperatura de la ruptura de la membrana, y observar-registrar el tiempo en el que las esferas se rompen para determinar una media de rompimiento.
· Vida de anaquel
Es considerado el periodo de viabilidad que posee un producto por ello se realizó un ensayo con 250 g de esferas en un recipiente de vidrio (emulando así el empaquetamiento) y se observó el tiempo en que tardan en comenzar a romperse, ya que una vez rota la membrana el líquido liberado puede funcionar como medio de cultivo para microorganismo llevando a la descomposición de todo el producto.
· Tiempo de liberación
El tiempo de liberación será registrado a través de una prueba establecida por un mes y registrada mediante la observación de la ruptura de las esferas en una planta, con ello puede estimarse el tiempo que tarda en fragmentarse y liberarse el contenido de AH/AF, lo que permitirá dar un valor de dosificación de referencia.
· Determinación de cenizas
Se empleará para saber lo que queda de la combustión total de la esferificación para esto se pesarán 3-5 g de la muestra deshidratada y se colocará en una capsula de porcelana puesta a peso constante posteriormente la muestra se carbonizará en una estufa a mecha directa. Una vez carbonizada la muestra se pasará a una mufla a 400°C por 3 h. La cápsula de porcelana se pasará a una estufa a 110°C para su enfriamiento, y luego se colocará en un desecador hasta enfriarse a temperatura ambiente. Finalmente, se pesará y se obtendrá el porcentaje de cenizas dividiendo el peso de éstas entre el peso de la muestra inicial, multiplicado por 100(12).
· Determinación del %H
La determinación del porcentaje de humedad se calculará obteniendo el porcentaje de la materia seca total, la materia seca total está constituida por una porción susceptible de quemarse ya que está constituida por sustancias que contienen carbono o materia orgánica y que constituyen a dar energía, la otra porción incombustible se encuentra formada por sustancias que no pueden quemarse y que los residuos que forman son cenizas cuando se someten a calcinación. La muestra ya completamente seca se triturará en un mortero posteriormente se colocarán 2-5 g de esta muestra en un crisol a peso constante y este se introducirá en una estufa a 100 °C durante 12 horas(12). Posterior a ello se calculará la diferencia de pesos tomando en cuenta el peso del crisol con muestra seca restado al peso del crisol solo y dividido entre los 2 g de muestra y el resultado se multiplicará por 100 %. Para determinar la humedad como tal se restará al 100 % el % de materia seca total.
· Determinación de proteínas
Se pesará 0.1- 1 g de muestra seca y se realizará una digestión de la muestra con 5 ml de ácido sulfúrico concentrado en presencia de 1.5 g de mezcla digestora como catalizador. El matraz Kjeldhal se dejará enfriar y después se agregarán 130 ml de agua destilada y 6 ml de ácido bórico al 4 % agregando también 10 gotas de indicador Shiro Toshiro. La solución ácida se alcalinizará con 8 ml de una solución de hidróxido de sodio al 1:1. La solución será llevada al aparato de destilación kjeldhal; donde se recogerán 80 ml de la solución y se titularán con una solución de ácido sulfúrico al 0.01787 N(12), calculando con ello el % de N que contiene la muestra, después se realizará el cálculo para la determinación total de proteína cruda.
· Determinación de lípidos
Para determinar el contenido de extracto etéreo se pesarán 1-2 g de muestra deshidratada en tubos de celulosa, los cuales se depositarán en el equipo de extracción aparato Soxleth. Se utilizarán 250 ml de éter de petróleo, para la extracción de lípidos por reflujo durante 6 h, los matraces serán llevados a peso constante en una estufa a 40°C durante 12 h. El porcentaje de grasa se obtendrá por la diferencia en peso del matraz antes y después de la extracción dividido entre la cantidad de muestra por 100 %(12).
· Determinación de fibra cruda
Se utilizarán 0.1-0.5 g de muestra y el contenido de fibra será determinado por una digestión secuencial con un digestor utilizando 100 ml de H2SO4 al 0.255 N y después con NaOH al 0.3 N. El residuo insoluble se obtendrá por filtración posteriormente será secado en una estufa y pesado. Ahí se obtendrá el peso de la fibra junto al de los minerales. Y luego este será incinerado en una mufla, quedando solo el residuo de las cenizas constituido por minerales. Por diferencia entre el primer peso (antes de la incineración) y el de las cenizas se obtendrá el de la fibra cruda(12).
· Determinación de la estabilidad física
Se estimará la estabilidad mediante el análisis de la pérdida de humedad de las esferas utilizando una balanza analítica y empleando 10 gramos de muestra fresca y revisando a los 30, 60 y 90 minutos. Al pasar el tiempo, se observará su forma y se presionará levemente las esferas para comprobar si mantenían líquido en su interior.
Resultados
Se determinó el potencial de hidrogeno de la muestra de AH/AF y de un aminoácido que se tomó como blanco, cada una de las muestras se analizó por triplicado por un potenciómetro obteniéndose un pH promedio para la muestra de AH/AF de 9.81 y para el aminoácido un pH de 6.23 (Tabla 1). La determinación de la viscosidad de las muestras de AH/AF y del aminoácido (muestra de referencia), fue desarrollado por un viscosímetro Saybolt. La cuales se realizó por triplicado obteniéndose un promedio, para después calcular la viscosidad cinemática la cual fue para la muestra de AH/AF de 5.08 centistokes y para el aminoácido de 3.14 centistokes aproximadamente, las cantidades de la viscosidad medidas se muestra en la Tabla 1. Tomando en cuenta los datos del desarrollo experimental se realizó las mediciones del AH/AF, aminoácido y agua como celda de referencia en un espectrofotómetro para obtener la absorbancia y tener el tamaño aproximado de partículas de las muestras. Los resultados obtenidos se pueden observar en la Tabla 2. La mitad de esta relación estará inversamente proporcionada con el tamaño de partículas de los ácidos, una baja relación indica un tamaño mayor de partícula y alta relación, lo inverso. Se realizó el procedimiento correspondiente para encontrar el tamaño de partículas de los acido dando una baja relación para el AH/AF de 9.666X10-3 dando como significado que contiene partículas de tamaño considerable.
Tabla 1. Medición del potencial de hidrogeno y viscosidad.
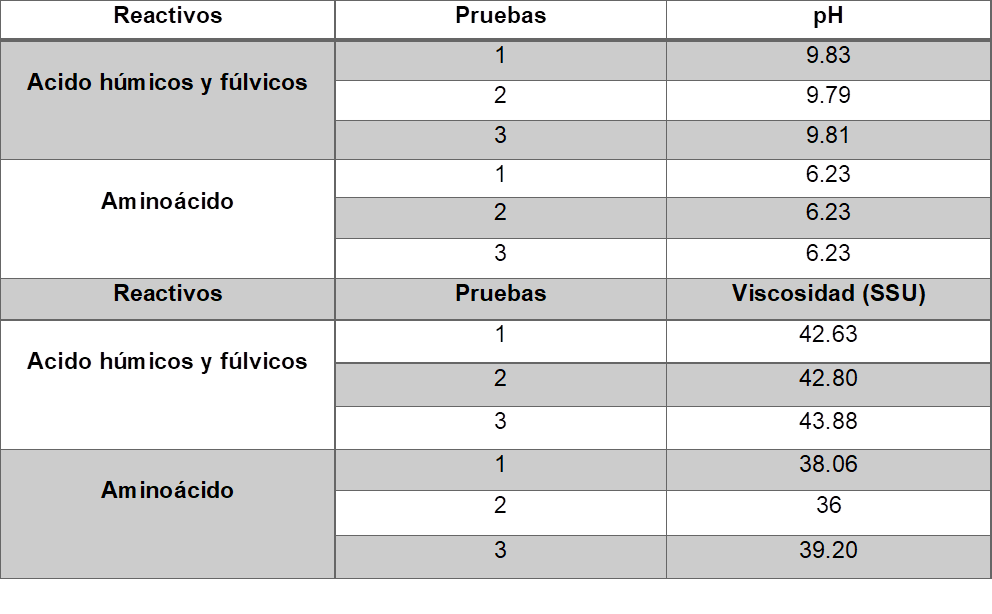
Tabla 2. Densidades ópticas medición de absorbancia.

Se realizó la estandarización de la formulación acorde a la relación de Alginato de Sodio y de Cloruro de Calcio, se tomaron como criterios esenciales la formación de la esfera, el tamaño de esta, así como la forma obtenida y su resistencia a temperaturas. La esferificación indica que la mezcla de ácidos deberá de unirse al Alginato de Sodio (2.2, 2.3, 2.5 % m/v), utilizando así mismo un estabilizador (goma xantana) en un 2% dependiendo de la mezcla y posterior a ello se sumergirá en el baño con Cloruro de Calcio al 8 % m/v alrededor de 10 min para obtener un esferificado más consistente, posteriormente se sumergirá en un baño de agua destilada para quitar el contenido de cloruro de calcio sobrante de la esfera. La formación de la esfera se basó en el tiempo que se mantenía la muestra de AH/AF con alginato de sodio en la solución de cloruro de calcio, el tamaño de la esfera fue proporcional a la boquilla de una jeringa de 10 ml obteniendo un tamaño aproximado entre 5 mm a 7 mm, la forma obtenida de la esfera fue vista como óvalos o esferas con protuberancias (ver Figura 1a). La realización de la mezcla utilizada para las esferas, en caso de el ácido húmico y fúlvico, se tomaron 0.210 gr de alginato de sodio en 10 ml de AH/AF y 0.190 de goma xantana, se utilizó una licuadora para que la muestra sea uniforme, para el aminoácido se tomaron 0.230 gr de alginato de sodio en 10 ml del reactivo y 0.200 gr de goma xantana y al igual que el anterior se le licuo la mezcla hasta quedar uniforme (Figura 1b).

Figura 1. Productos esferificados, a) Esferificación de aminoácidos control, b) Esferificación de AH/AF.
Se determinó el grosor promedio de las esferas utilizando un vernier como herramienta de medición, midiendo el largo y ancho de un total de 20 esferas para después obtener un promedio aproximado de 6 mm. La determinación de pH se realizó a través del método electrométrico, utilizando un potenciómetro usando un electrodo de vidrio con un electrodo de referencia y obteniendo la medición directa de las esferas. Se determino, pesando directamente las esferas en una balanza analítica al menos por triplicado para obtener su masa. Para la determinación de esta prueba, se hizo por medio de la observación de al menos 10 esferas de cada una de las muestras, para ver la tonalidad de cada una de ellas. El ensayo determinado para la textura de las esferas fue mediante el tacto, se comprobó la resistencia y la deformación de las esferas analizadas. Se estimo el tiempo de gelificación, mediante el procedimiento de la jeringa de 10 ml tomando la muestra del AH/AF y liberando gota a gota en la solución de cloruro del calcio y se cuantifico el tiempo en que tarda en esferificarse y se adiciono el tiempo en que tardo en lavarse en el agua destilada. El mismo procedimiento se aplicó para el aminoácido (ver Tabla 3).
Tabla 3. Pruebas fisicoquímicas del producto esferificado.

Para la determinación de cenizas se empleó para saber lo que queda de la combustión total de la esferificación, para esto se pesaron 3-5 g de la muestra deshidratada y se colocó en una capsula de porcelana puesta a peso constante posteriormente la muestra se carbonizo en una estufa a mecha directa. Una vez carbonizada la muestra se pasó a una mufla a 400°C por 3 horas. La cápsula de porcelana se pasó a una estufa a 110°C para su enfriamiento, y luego se colocó en un desecador hasta enfriarse a temperatura ambiente. Finalmente, se pesó y se obtuvo el porcentaje de cenizas dividiendo el peso de éstas entre el peso de la muestra inicial, multiplicado por 100. La determinación del porcentaje de humedad fue calculando por medio del porcentaje de la materia seca total. La muestra ya completamente seca se colocó 2-5 g de esta muestra en un crisol a peso constante y este se introdujo en una estufa a 100 °C durante 12 horas. Posterior a ello se calculó la diferencia de pesos tomando en cuenta el peso del crisol con muestra seca restado al peso del crisol solo y dividido entre el peso de la muestra inicial y el resultado se multiplicará por 100 %. Para determinar la humedad como tal se restará al 100 % el % de materia seca total. Se pesaron 0.1 - 1 g de muestra seca y se realizó una digestión de la muestra con 5 ml de ácido sulfúrico concentrado en presencia de 1.5 g de mezcla digestora como catalizador. El matraz Kjeldhal se dejó enfriar y después se agregó 130 ml de agua destilada y 6 ml de ácido bórico al 4 % agregando también 10 gotas de indicador Shiro Toshiro. La solución ácida se alcalinizo con 8 ml de una solución de hidróxido de sodio 1:1. La solución se llevó al aparato de destilación kjeldhal; donde se recogió 80 ml de la solución y posteriormente se tituló con una solución de ácido sulfúrico al 0.01787 N, calculando con ello el % de N que contiene la muestra, después se realizó el cálculo para la determinación total de proteína cruda. Para determinar el contenido de extracto etéreo se pesó 1-2 g de muestra deshidratada en tubos de celulosa, los cuales se depositaron en el equipo de extracción aparato Soxleth. Se utilizarán 250 ml de éter de petróleo, para la extracción de lípidos por reflujo durante 6 h, los matraces fueron llevados a peso constante en una estufa a 40°C durante 12 h. El porcentaje de grasa se obtendrá por la diferencia en peso del matraz antes y después de la extracción dividido entre la cantidad de muestra por 100 %. Se utilizaron 0.1 - 0.5 g de muestra (W1) y el contenido de fibra fue determinado por una digestión secuencial con un digestor utilizando 100 ml de H2SO4 al 0.255 N, esto se llevó a ebullición y se mantuvo el reflujo durante 30 minutos, se filtró y lavo 3 veces con agua destilada caliente utilizando 50 ml aproximadamente en cada lavado. Posteriormente con NaOH al 0.3 N al igual se llevó a ebullición y se mantuvo el reflujo durante 30 minutos para después filtrarlo y lavar con agua destilada como se hizo con el ácido, al finalizar con el procedimiento anterior se lavó 3 veces con acetona y se llevó los crisoles a la estufa a 130 ºC por una hora, se sacó los crisoles de la estufa enfriándolos en el desecador para posteriormente pesarlos (W2) y se trasladó a una mufla a 300 ºC para finalmente enfriarlo en un desecador y pesarlo (W3). Por diferencia entre el primer peso (antes de la incineración) y el de las cenizas se obtendrá el de la fibra cruda (ver Tabla 4). Se determinó la estabilidad mediante la pérdida de humedad de las esferas en donde se utilizó una balanza analítica y se empleó 10 gramos de muestra fresca y revisando periódicamente a los 30, 60 y 90 minutos. Al pasar el tiempo, se observó que la forma se mantuvo alrededor esos intervalos de tiempo y por lo consiguiente el líquido se mantuvo en el interior de la esfera.
Tabla 4. Análisis bromatológico del producto esferificado.

Discusión
Qiao et al., en el 2016(13), menciona que la agricultura abastece a la población mundial en rápido crecimiento con alimentos, ropa y otras necesidades de la vida diaria, y es indispensable para el surgimiento de la civilización humana(14). Para satisfacer la creciente demanda de alimentos y otros productos agrícolas, se han empleado grandes cantidades de diversos fertilizantes (N, P y K) para mejorar los rendimientos de los cultivos. Sin embargo, la eficiencia de la mayoría de los fertilizantes, especialmente el nitrógeno se reduce en gran medida debido a la volatilización y la lixiviación de los nutrientes. También, esto da lugar a la contaminación ambiental y a problemas de salud debido a la eutrofización del agua y emisiones peligrosas (NH3, N2O, etc.) resultante de la hidrólisis de nutrientes y por la acción de microorganismos(15). Se han desarrollado fertilizantes de liberación lenta que podrían satisfacer al mismo tiempo las necesidades de nutrientes de las plantas, mejorando los rendimientos de los cultivos al tiempo que reducen pérdida de nutrientes en el entorno. Los fertilizantes de liberación lenta se preparan físicamente encapsulando los fertilizantes solubles con materiales hidrofóbicos inorgánicos y/o materiales orgánicos que actúan como una barrera para suprimir la "explosión" repentina de los fertilizantes. Entre esos materiales de recubrimiento inorgánicos insolubles tales como el azufre solían ser candidatos atractivos, ya que no solo podrían retrasar la liberación de nutrientes de los fertilizantes sino también tienen funciones adicionales como planta secundaria nutrientes y agentes que neutralizan la alcalinidad del suelo(16). Después de ello, los polímeros fueron ampliamente utilizados como materiales de revestimiento, como películas formadas en la superficie de los gránulos de fertilizantes, pero resultaron ser frágiles ya que presentaron algunas grietas y poros(17), y también son vulnerables a los microorganismos. Por los altos costos, complejidad del proceso y contaminación ambiental ya que algunos polímeros eran a base de petróleo, se optó por usar biopolímeros renovables como la lignina(18), la celulosa y el almidón se utilizan como alternativa de materiales de recubrimiento para mejorar el rendimiento de liberación lenta en fertilizantes, por lo anterior propusieron una mezcla de matrices que involucraban almidones, acrilamidas, nitratos de amonio, y etil celulosa, ellos encontraron que el emplear etil celulosa como parte de membranas internas y almidones en la parte externa, todo ello permite que exista una absorción mucho más adecuada de agua y con ello se presenta una liberación controlada del fertilizante funcionando como una alternativa viable en la producción de productos agrícolas.
Pérez en el 2016(19), menciona que la agricultura depende en gran medida de la adición de fertilizantes, el uso excesivo de fertilizantes se ha asociado con la contaminación causada por altos niveles de nutrientes en el suelo y en aguas superficiales(20-22), causando problemas de salud, ambientales y aumentando los costos de purificación de agua(21). La degradación de la calidad del suelo después de muchos ciclos de uso agrícola intensivo conduce a una mayor demanda para la fertilización, el riego y la energía para mantener la productividad de esos suelos(23). Un enfoque para reducir los problemas asociados con el uso excesivo de fertilizantes es idear un método que reduzca la cantidad y frecuencia de su aplicación(24). Una forma de lograr este objetivo es utilizar fertilizantes de liberación controlada (FLC), estos productos agroquímicos usan una barrera física para reducir la velocidad de disolución de los fertilizantes, sus características físicas (reservorio o sistema de matriz), a lo largo de con el mecanismo que rige la liberación de fertilizante (difusión, hinchazón o degradación de la matriz polimérica), puede modular el patrón de liberación de nutrientes(25). El costo es un parámetro importante al analizar la viabilidad de los FLC para la fabricación industrial. La producción de los FLC que utilizan hidrogeles como matrices portadoras todavía tiene un mayor costo que el uso de fertilizantes minerales convencionales(26). Algunos polímeros pueden caracterizarse como de "bajo costo", ya que requieren poco procesamiento, son abundantes en la naturaleza y son subproductos o materiales de desecho de otros procesos industriales. Por ello el objetivo de su estudio fue investigar la viabilidad de un método simple de preparación de hidrogeles no contaminantes basados en mezclas de quitosano y almidón para usar en la industria agrícola como matrices para la liberación controlada de fertilizantes. Macroesferas se prepararon por entrecruzamiento ionotrópico de quitosano usando sodio tripolifosfato, las condiciones de preparación (tiempo de reticulación y composición de las mezclas) fueron analizados para producir un bajo costo de macroesferas con el menor contenido posible de quitosano, los hidrogeles que prepararon fueron caracterizados para dilucidar su estructura, propiedades termales y morfológicas. La estructura final de las esferas determinó su comportamiento durante la absorción, que es la principal determinante de la capacidad y liberación cinética de carga de fertilizantes. Como resultado final encontraron, que la realización de macroesferas por entrecruzamiento ionotrópico de quitosano con almidón son excelentes candidatos como alternativa de fertilizantes de liberación controlada con ello puede tener amplia cabida en la agroindustria.
De acuerdo con el porcentaje establecido con la elaboración de las esferas (microencapsulados) dentro de la experimentación pertinente realizada, la cual será utilizada para el cultivo de plantas ornamentales, está en el margen porcentual de otras experimentaciones de liberación controlada. Por ejemplo, para la producción de plantas de Pinus halepensis, utilizaron dosis de fertilizantes de liberación controlada recubiertos de OSMOCOTE 9-13-18 y OSMOCOTE 16-8-9 con porcentajes (1.5¬; 3.25 y 5 g/l) y (3.25; 5 y 7 g/l) respectivamente, dando un buen aporte de fosforo, potasio y nitrógeno a la planta(27). El éxito al esferificar con alginato de sodio y cloruro de calcio es darle a la esfera una consistencia adecuada, además al agregarle un porcentaje de la goma xantana se le dio mayor firmeza, resistencia y forma requerida. El recubrimiento antes mencionado es amigable con el suelo donde se encontrará la planta de ornato. Dando una efectividad a la experimentación realizada con los datos obtenidos en base a otras investigaciones.
Conclusiones
A manera de conclusión podemos decir que, la esferificación, en base a lo recabado experimentalmente dando la certeza al procedimiento realizado satisface los parámetros establecidos al inicio de la propuesta. Aplicando todos los análisis fisicoquímicos de los ácidos y aminoácidos ocupados experimentalmente, como el potencial de hidrogeno (pH), viscosidad (μ), y densidades ópticas (DO), para facilitar la estandarización adecuada de la membrana semipermeable para la correcta esferificación con alginato de sodio y cloruro de calcio de los aminoácidos y los ácidos pertinentes, aplicando como método una esferificación directa, dándole resistencia, firmeza y durabilidad, logrando así su fácil manipulación y aplicación. Beneficiando y fortaleciendo minuciosamente al crecimiento y desarrollo adecuado de las plantas de ornato dándole todos los nutrimentos necesarios (Nitrógeno-Potasio-Fosforo) tanto a ella como al suelo en su periodo de crecimiento. La esferificación aplicada a los agroquímicos da una vida útil más prologada al fertilizante, una resistencia a cambios de temperaturas ambientales, protegiendo así la mayoría de su propiedades y nutrientes, para que sean aprovechadas en su totalidad por las plantas de aplicación y el suelo dando a este ultimo mayor fertilidad para el crecimiento notorio de las plantas. En el estado de Oaxaca la esferificación a fertilizantes de liberación controlada es un tema muy poco explotado, ya que se trata de un proceso tardado de realizar siguiendo minuciosamente sus cuidados, sin embargo, podemos inferir que ello le puede otorgar beneficios a un largo periodo de tiempo a los cultivos aplicados.
Referencias
1. Hayes MHB. In advances in soil organic matter research: the impact on agriculture and the environment. WS Wilson (Eds.), Royal Society of Chemistry, Cambridge. 1991; 3-22.
2. Stevenson FJ. Humus chemistry. Genesis, composition, reaction. Second Edition. John Wiley & Sons, Inc. New York. 1994.
3. Schnitzer M. Life time perspective on the chemistry of soil organic matter. Sparks DL (Ed.). Advances in Agronomy. Academic Press. 2000; 98: 3-58.
4. MacCarthy P, Clapp CE, Malcom RL, Bloom PR. An introduction to soil humic substances. In Humic substances in soil and crop sciences: Selected readings. P Maccarthy, CE Clapp, RL Malcom, PR Bloom (Eds.). 1990. Proceedings of a symposium by the IHSS, Chicago, Illinois, December 1985. 161-86.
5. Gallardo J. La materia orgánica del suelo, su importancia en suelos naturales y cultivados. Temas de divulgación. Instituto de Orientación y Asistencia Técnica del Oeste, No. 6, Salamanca. 1982.
6. Kalbitz K, Popp P, Geyer W, Hanschmann G. HCH mobilization in polluted wetland soils as influenced by disolved organic matter. The Science of the total enviroment. 1997; 204: 37-48.
7. Zysset M, Berggren D. Retention and reléase of dissolved organic matter in podzol B horizons. European J. Soil Sci. 2001; 52: 409-21.
8. Zsolnay A. Dissolved organic matter: artefacts, defenitions and functions. Geoderma. 2003; 113: 187-209.
9. Senesi N, Miano TM, Provenzano MR, Brunetti G. Spectroscopic and compositional comparative characteization of I.H.S.S. reference and standard fulvic and humic acids of various origin. Sci. Total Environ. 1989; 81-82: 143-56.
10. Barancikova G, Senesi N, Brunetti G. Chemical and spectroscopic characterization of humic acids isolated from diferrent Slovak soil types. Geoderma. 1997; 78 (3-4): 251-66.
11. AGRO. Revista Industrial del Campo. Sección Agroindustria. Benedetti A, Figliolia A, Izza C, Indiati R, Canali S. Fertelization with NPK Aiken GR, Mcknight DM, Wershaw RL, Maccarthy P. 1985. An introduction to humic substances in soil, sediment, and wáter. In Humic substances in soil, sediment and wáter: Geochemistry, isolation and characterization. Aiken GR et al. (Eds) Wiley-Interscience, New York. 2000; 1-9.
12. AOAC. Official Methods of Analysis. 14th Edition, Association of Official Analytical Chemists, Washington DC, No. 43.292. 7.001, 7.009, 7.006. 1985.
13. Qiao D, Hongsheng L, Yu L, Bao X, Simon GP, Petinakis E, Chen L. Preparation and characterization of slow-release fertilizer encapsulated by starch-based superabsorbent polymer. Carbohydrate polymers. 2016; 147: 146-154.
14. Tilman D, Cassman KG, Matson PA, Naylor R, Polasky S. Agricultural sustainability and intensive production practices. Nature. 2002; 418(6898): 671-677.
15. Azeem BS, KuShaari K, Man ZB, Basit A, Thanh TH. 2014. Review on materials & methods to produce controlled release coated urea fertilizer. Journal of Controlled Release, 181: 11-21.
16. Tsai BS. Continuous spouted bed process for sulphur-coating urea. chemical and biological engineering (Vol. master of applied science). Vancouver: University of British Columbia. 1986.
17. Bao X, Ali A, Qiao Dl, Liu HS, Chen L, Yu L. Application of polymer materials in developing slow/control release fertilizer. Acta Polymerica Sinica. 2015; 9: 1010-1019.
18. Mulder W, Gosselink R, Vingerhoeds M, Harmsen P, Eastham D. Lignin based controlled release coatings. Industrial Crops and Products. 2011; 34(1): 915–920.
19. Perez JJ, Francois NJ. Chitosan-starch beads prepared by ionotropic gelation as potential matrices for controlled reléase of fertilizers. Carbohydrate polymers. 2016; 148: 134-142.
20. Valiela I, Foreman K, LaMontagne M, Hersh D, Costa J, Peckol P, et al. Couplings of watersheds and coastal waters: sources and consequences of nutrient enrichment in Waquoit Bay, Massachusetts. Estuaries. 1992; 15(4): 443-457.
21. Carpenter S, Caraco N, Correll D, Howarth R, Sharpley A, Smith V. Nonpoint pollution of surface waters with phosphorus and nitrogen. Ecological Applications. 1998; 8(3): 559-568.
22. Shaviv A. Advances in controlled-release fertilizers. Advances in Agronomy. 2001; 71: 1-49.
23. Chien SH, Prochnow LI, Cantarella H. Recent developments of fertilizer production and use to improve nutrient efficiency and minimize environmental impacts. Advances in Agronomy. 2009; 102: 267-322.
24. Rashidzadeh A, Olad A, Salari D, Reyhanitabar A. 2014. On the preparation and swelling properties of hydrogel nanocomposite based on Sodium alginate-g-poly(acrylic acid-co-acrylamide)/Clinoptilolite and its application as slow release fertilizer. Journal of Polymer Research. 2014; 21(2): 1-15.
25. Zhong K, Lin Z, Zheng X, Jiang G, Fang Y, Mao X, et al. Starch derivative-based superabsorbent with integration of water-retaining and controlled-release fertilizers. Carbohydrate Polymers. 2013; 92(2): 1367-1376.
26. Diez C, Rodrigo N, Mora ML, Gallardo F. Efecto de la adición de efluentes de celulosa Kraft sobre la actividad biológica del suelo volcánico. En: Actas del XV congreso Latinoamericano y V Cubano de las Ciencias del Suelo, Nov. 2001. Cuba. pp. 74.
27. Olied J, Segura ML, Blanco E, Artero F. Los fertilizantes de liberación controlada lenta aplicados a la producción de planta forestal de vivero. Efecto de dosis y formulaciones sobre la calidad de Pinus halepensis mill. 1999; 225-226.