REVISIÓN
Análisis del ejercicio físico en la Insuficiencia Cardíaca
Analysis of physical exercise in Heart Failure
Juan Ramón Romero Gómez1, Loreto Tárraga Marcos1, Beatriz Romero Gomez2, Pedro J. Tárraga López1
1 Departamento Ciencias Medicas Facultad de Medicina de Albacete. España
2 EVE Zona 5 A de Albacete. España
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Resumen
La rehabilitación cardiaca (RC) ha demostrado ser una intervención eficaz y segura para mejorar el pronóstico de los pacientes con insuficiencia cardiaca (IC). Sin embargo, existen dudas sobre cuál es el mejor método de entrenamiento en estos pacientes. Actualmente, el más recomendado es el entrenamiento aeróbico continuo de intensidad moderada (MICT). En este trabajo se compara este tipo de entrenamiento con el entrenamiento de alta intensidad basado en intervalos (HIIT). La variable de estudio principal es la capacidad física, medida con el Vo2max. Además, también se valoran la función cardiaca y la calidad de vida relacionada con la salud. Se obtiene una ligera mejoría con HIIT, pero ambos métodos son eficaces y válidos, por lo que lo más importante será la individualización en función de las características, contexto y preferencias de cada paciente. Por otro lado, también se compara el entrenamiento basado en MICT en solitario con el entrenamiento concurrente, es decir, la combinación de MICT y entrenamiento de fuerza (EF), obteniendo conclusiones favorables para el segundo grupo. De esta manera, el EF no sustituye al entrenamiento aeróbico, pero si es fundamental para complementarlo ya que las adaptaciones son diferentes y el aumento de la fuerza y masa muscular en pacientes con IC es altamente beneficioso.
Palabras clave
Insuficiencia cardiaca; Actividad fisica; Rehabilitacion cardiaca
Abstract
Cardiac rehabilitation (CR) has proven to be an effective and safe intervention to improve the prognosis of patients with heart failure (HF). However, there are doubts as to which is the best training method in these patients. Currently, the most recommended is the continuous moderate intensity aerobic training (MICT). In this work, this type of training is compared with high intensity interval training (HIIT). The study variable
The main one is physical capacity, measured with the Vo2max. In addition, heart function and health-related quality of life are also assessed. A slight improvement is obtained with HIIT, but both methods are effective and valid, so the most important thing will be individualization based on the characteristics, context and preferences of each patient. On the other hand, training based on MICT alone is also compared with concurrent training, that is, the combination of MICT and resistance training (PE), obtaining favorable conclusions for the second group. In this way, PE is not a substitute for aerobic training, but it is essential to complement it since the adaptations are different and the increase in strength and muscle mass in patients with HF is highly beneficial.
Keywords
Heart failure; Physical activity; Cardiac Rehabilitation
Introducción
El hombre ha evolucionado en un entorno muy diferente al actual, en el que el movimiento era imprescindible para su supervivencia. Sin embargo, hoy tener un estilo de vida sedentario, para el que no estamos genéticamente preparados, es algo habitual. Esta inactividad física suele acompañar a una alimentación basada en alimentos “ultraprocesados”, que junto a otros factores como la falta de sueño y el estrés crónico, condicionan que el organismo se encuentre en un estado pro-inflamatorio conocido como “inflamación crónica de bajo grado”.(1) Este contexto metabólico enfermo, íntimamente relacionado con una mala composición corporal (obesidad y sarcopenia) aumenta la probabilidad de sufrir patologías como hipertensión arterial, dislipemia o Diabetes Mellitus que, entre otras consecuencias, acaban produciendo enfermedad cardiovascular (ECV),(2) un gran problema de los países desarrollados por ser la primera causa de mortalidad y ocasionar un gran impacto socioeconómico.(3)
Todo ello es prevenible manteniendo un estilo de vida saludable. Por ello, la Sociedad Europea de Cardiología (ESC) recomienda realizar un mínimo de 150 minutos de entrenamiento de resistencia de intensidad moderada durante 5 días o 75 minutos de ejercicio vigoroso por semana durante 3 días, con un beneficio adicional derivado duplicando la cantidad a 300 min de intensidad moderada o 150 min de intensidad vigorosa.(4,5)
Sin embargo, el ejercicio físico no solo es importante como prevención primaria. Tal y como aportaron Pedersen y Saltin en 2016, existe sólida evidencia científica para asegurar que el ejercicio físico es un tratamiento efectivo en una gran cantidad de enfermedades crónicas diferentes, incluyendo las enfermedades cardiovasculares.(6)
¿Qué es la rehabilitación cardiaca?
La rehabilitación cardiaca (RC) consiste en programas integrales y multidisciplinares diseñados para limitar los efectos fisiológicos y psicológicos de las enfermedades cardiacas, reducir el riesgo de muerte súbita o infarto, controlar los síntomas cardiacos, estabilizar o revertir el proceso aterosclerótico y mejorar la capacidad funcional y el estado psicosocial de los pacientes seleccionados. (7)
Un equipo de RC debe estar constituido por médicos cardiólogos, profesionales de enfermería especialistas, psicólogos, fisioterapeutas, médicos rehabilitadores, profesionales de la actividad física, dietistas, médicos del deporte, terapeutas ocupacionales y asistentes sociales.
De forma resumida, los componentes de la RC son: (8,9)
Educación en salud: Aprender comportamientos nuevos y cambiar de estilo de vida no es sencillo. Así pues, un aspecto fundamental es enseñar a los pacientes a aceptar su enfermedad, a convivir con ella y a implementar nuevos hábitos para generar cambios duraderos en el tiempo. Mediante charlas educativas se explica a los pacientes la historia natural de su enfermedad, lo que realmente significa mantener un estilo de vida saludable, evitando conceptos cardiacos erróneos y asesorando sobre actividad y ejercicio físico, alimentación saludable, descanso nocturno, abandono del hábito tabáquico y otros hábitos nocivos, salud psicosocial y gestión del estrés, así como educar sobre el reconocimiento de síntomas inducido por esfuerzo.
Gestión de factores de riesgo médicos y medicación: Manejo de lípidos, monitoreo de presión arterial, frecuencia cardiaca y glucemia, así como asegurar el tratamiento farmacológico óptimo.
Entrenamiento físico: Es el eje central ya que muchas de las adaptaciones positivas que se producen y de las mejoras en los factores de riesgo cardiovascular pueden medirse a través de los programas físicos. Sin embargo, sin todo lo anterior, no se conseguirá el objetivo principal: mantener el nuevo estilo de vida a largo plazo. De hecho, los programas que consisten solo en entrenamiento físico no se consideran RC.
Es importante hacer una distinción entre actividad física y ejercicio físico, ya que aunque se suelen utilizar indistintamente no son lo mismo.
· Actividad física: Cualquier movimiento corporal realizado en la vida diaria producido por los músculos esqueléticos que incrementa el gasto energético por encima del basal.(10)
· Ejercicio físico: Actividad planificada, estructurada y repetitiva que tiene como objetivo la mejora o el mantenimiento de la forma física, incrementando la capacidad funcional del organismo.(11)
Fases de la rehabilitación cardiaca
1-Identificación de pacientes seleccionados y derivación: El objetivo es que todos los pacientes candidatos a RC sean identificados e invitados a participar en el programa.
2-Evaluación inicial completa y valoración del riesgo: Paradójicamente, el ejercicio físico intenso, de forma aguda supone un riesgo para la salud, que es mayor en pacientes con ECV, por lo que se debe estratificar el riesgo utilizando para ello diferentes recursos como la fracción de eyección del ventrículo izquierdo (FEVI) antecedentes de arritmia, síntomas, distintas escalas de riesgo cardiovascular y sobre todo, valoración de la capacidad funcional destacando para ello la función de la ergoespirometría, que además ayuda a determinar qué nivel de trabajo puede tolerar el paciente, pudiendo así realizar un plan individualizado. Sin embargo, es difícilmente aplicable en pacientes con FEVI<40% o tras una intervención quirúrgica, siendo preferible en estos casos la prueba de 6 minutos.
Además, tras esta evaluación se puede determinar qué pacientes son candidatos a la RC ambulatoria y qué pacientes por el contrario necesitan realizarla en el ámbito hospitalario. En general, los pacientes de alto riesgo necesitan mayor supervisión y las sesiones en casa se introducirán gradualmente
3-Provisión de plan estructurado: Tras la evaluación, se deben ofertar diferentes posibilidades que se adapten al paciente tanto en la programación de sesiones como en el lugar en el que se va a llevar a cabo.
Independientemente de la modalidad elegida, se aconsejará al paciente realizar un plan personalizado 2-3 veces por semana. Las sesiones de entrenamiento deben componerse de calentamiento, ejercicio y recuperación.
La duración mínima del contacto entre el paciente y el equipo multidisciplinar debe ser de 8 semanas. Sin embargo, el objetivo es mantener los hábitos aprendidos durante toda la vida.
4-Evaluación final: Una vez finalizado el plan de RC, se valorarán todos los parámetros evaluados al comienzo para determinar hasta qué punto se han logrado los objetivos del paciente, sirviendo para la formulación de nuevas estrategias a largo plazo, así como para el envío de datos a la Auditoría Nacional de Rehabilitación Cardiaca .(8,9)
Ejercicio físico en la Insuficiencia cardiaca
La insuficiencia cardiaca (IC) es un síndrome clínico debido a la incapacidad del corazón para expulsar sangre suficiente para los requerimientos metabólicos o lo hace a expensas de un aumento de presión, pudiendo deberse así a disfunción sistólica o diastólica del ventrículo izquierdo. La prevalencia en los países desarrollados se encuentra en torno al 1-2%, siendo >10% en mayores de 70 años. Las personas que padecen Insuficiencia cardiaca crónica (ICC) experimentan mala calidad de vida relacionada con la salud, mayor riesgo de mortalidad e ingreso hospitalario y altos costos de atención médica.(12)
Se ha demostrado que la RC es segura y mejora el pronóstico en pacientes con ICC. (13-15). Los metaanálisis de los estudios que han comparado el ejercicio físico con la atención clínica habitual han demostrado mejoras significativas en la capacidad física, tolerancia al ejercicio y calidad de vida relacionada con la salud, así como un efecto modesto sobre la mortalidad y hospitalización por todas las causas y específicamente por IC.(16-19)
Por lo tanto, en pacientes seleccionados con patología cardiaca estable, tras el control de los factores de riesgo y la optimización de la terapia y tras excluir contraindicaciones, debe recomendarse RC sin demora a todos los pacientes.
Algunos de los resultados esperables clínicamente relevantes son el aumento de aptitud cardiorrespiratoria, mayor flexibilidad, resistencia y fuerza, mejor tolerancia al ejercicio, reducción de síntomas y mejora del bienestar psicosocial.(20)
Una de las razones principales que explica este efecto beneficioso sobre la calidad de vida se debe a que en la patogénesis de la ICC, las alteraciones en el músculo esquelético contribuyen al deterioro funcional y a la sintomatología. Al disminuir el gasto cardiaco llega menos oxígeno a los músculos, provocando miopatía, que disminuye la tolerancia al ejercicio, e incrementa la disnea y la fatiga. Estos factores, junto a la excitación simpática e inhibición vagal, causan vasoconstricción e incremento de la poscarga, empeorando la función cardiaca, lo cual a su vez perpetúa el ciclo empeorando la miopatía y acelerando la sarcopenia, que en personas mayores favorece la entrada en el círculo de la fragilidad.(21) El ejercicio físico produce adaptaciones periféricas que aumentan la tolerancia al ejercicio al disminuir la miopatía y atrofia muscular (22).
Otros efectos fisiológicos de la RC son la mejora de la hemostasia sanguínea con aumento de la fibrinólisis y disminución de la coagulabilidad,(23) efectos antiinflamatorios,(24) mejora de la función autonómica,(25) mejora de la función endotelial (26) y en última instancia mejora de la función cardiaca, que en muchos casos supondrá reducir el tratamiento médico. Así pues, la RC también es una estrategia coste-efectiva ya que reduce las hospitalizaciones y los gastos sanitarios.(27)
Por otro lado, la mayoría de los estudios se han realizado en IC con FEVI reducida (HFREF). Sin embargo, un metaanálisis de 2015 (28) demostró que el entrenamiento físico mejora la aptitud cardiorrespiratoria y la calidad de vida en pacientes con insuficiencia cardiaca con FEVI preservada (HFPEF), por lo que la RC también está indicada en estos pacientes. Esto es especialmente importante dado que no existe ningún tratamiento farmacológico efectivo para HFPEF.
Por todo lo expuesto, los programas de RC son recomendados (IA) por la Sociedad Europea de Cardiología (ESC) (5) y por la Asociación Estadounidense del Corazón (AHA) (29). A pesar de existir más indicaciones, la RC es especialmente importante en pacientes tras un síndrome coronario agudo (SCA) y en pacientes con ICC.
Sin embargo, a pesar de la evidencia científica que existe a su favor, sigue siendo una estrategia infrautilizada hoy, principalmente debido a las pocas unidades de RC y a la falta de acceso, así como a la falta de adherencia de los pacientes debido a malos hábitos, comorbilidades y depresión, que conllevan una baja inscripción y altas tasas de abandono.(30)
Justificación
Hoy en día, el entrenamiento de resistencia continuo de intensidad moderada (MICT), realizado habitualmente en cinta rodante o cicloergómetro, es la recomendación estándar debido a su seguridad y eficacia demostradas. Esta recomendación se basa en que la mayoría de los ensayos clínicos aleatorizados (ECA) y metaanálisis que se han realizado sobre la RC han sido con esta modalidad, entre ellos un gran ensayo multicéntrico de intervención con ejercicio físico (18) en el que se incluyeron 2331 pacientes con IC.
La revisión Cochrane de 2019 (17) incluyó 44 ensayos con un total de 5783 pacientes que comparaban un programa de ejercicio físico (la mayoría de ellos basados en MICT) en pacientes con ICC con un control sin ejercicio físico concluyendo que la RC reduce el riesgo de ingresos hospitalarios por todas las causas y por IC a corto plazo (<12 meses), confiriendo una mejora en la calidad de vida y reduciendo probablemente la mortalidad a largo plazo (>12 meses) aunque parece no tener impacto en la mortalidad a corto plazo.
Sin embargo, en las últimas décadas, el entrenamiento de intervalos de alta intensidad (HIIT), basado en realizar episodios de alta intensidad intercalados con periodos de recuperación, ha despertado interés en la RC, ya que también ha demostrado ser una medida útil en la ICC. Esta modalidad pretende aumentar el estímulo de entrenamiento al aumentar el tiempo de ejercicio en zonas de alta intensidad y se ha postulado que al generar un mayor estrés sobre el sistema cardiovascular puede generar más adaptaciones y resultados más beneficiosos.(31) Ha tenido muchos detractores, pero ha demostrado ser una herramienta segura, así como ofrecer ciertas ventajas como la posible adherencia al entrenamiento y el ahorro de tiempo.
Finalmente, debido a la miopatía y sarcopenia característica de la ICC, se ha propuesto que el entrenamiento de fuerza (EF), que consiste en generar tensión mecánica en la musculatura implicada para vencer una resistencia, mejorase el pronóstico de la ICC. La fuerza ha demostrado ser un predictor independiente de mortalidad (32) y en un estudio reciente el EF redujo un 23% la mortalidad por cualquier causa,(33) por lo que parece razonable estudiar sus efectos en la ICC. En 2017, se realizó un metaanálisis (34) que demostró que el EF como intervención única mejora la fuerza muscular, la capacidad aeróbica y la calidad de vida en ICC pudiendo ser una buena alternativa, sobre todo para pacientes que no pudieran realizar entrenamiento aeróbico. Además, otro metaanálisis de 2010 observó mejoras en la distancia recorrida en la prueba de la marcha de 6 minutos (6MTW).(35)
Así, queda demostrado el efecto beneficioso del entrenamiento en la ICC, pero existe la duda sobre qué modalidad o combinación de ellas ofrece mejores resultados. Por ello, en este trabajo se plantea la comparación entre las diferentes alternativas.
Para ello, es necesario contar con medidas objetivas para prescribir la intensidad, así como para valorar las mejoras de la aptitud cardiorrespiratoria. La ergoespirometría es la prueba de referencia para ello.(36) Con ella, se puede medir el consumo máximo de oxígeno (Vo2 máx.), que refleja la capacidad del organismo de absorber, transportar y llevar al tejido muscular el oxígeno. Se ha demostrado que el aumento de 1ml/kg/min del Vo2max reduce un 5% la mortalidad en IC.(18) Otros parámetros importantes evaluados en la ergoespirometría son el slope VE/CO2, la respuesta oscilatoria, el VT1 (consumo de oxígeno en el umbral aeróbico) y el AT (umbral anaeróbico). El VT1 refleja el momento en el que la musculatura empieza a trabajar sin oxígeno y el paciente comienza a hiperventilar, siendo un parámetro muy importante en las actividades de la vida diaria y por tanto, en la calidad de vida).
Sin embargo, la ergoespirometría no siempre está disponible, por lo que otros métodos útiles pueden ser la frecuencia cardiaca (FC), la frecuencia cardiaca de reserva (FCR), que es la diferencia entre la FC basal y la FC pico (22) o la escala de Borg, que ha demostrado correlacionarse con la FC y el lactato en sangre, siendo una herramienta asequible, práctica y válida para monitorear y prescribir la intensidad del ejercicio (37)
Objetivos
Objetivo principal
· Comprobar mediante la evidencia científica si el entrenamiento de alta intensidad (HIIT) o el entrenamiento concurrente (EC), que consiste en la combinación de entrenamiento de fuerza (EF) y entrenamiento de resistencia continuo de intensidad moderada (MICT) ofrecen mejores resultados en la capacidad física de pacientes con IC con FEVI reducida que el MICT, que es el protocolo estándar actualmente.
Objetivos secundarios
· Comprobar la efectividad de la RC integral en el pronóstico de los pacientes con IC, independientemente del método de entrenamiento utilizado.
· Estudiar el efecto de los diferentes tipos de entrenamiento en la calidad de vida y en la función cardiaca.
Metodología
La metodología consistió en una revisión bibliográfica de los artículos encontrados en las siguientes bases de datos: Pubmed y Scielo.
A la hora de llevar a cabo la búsqueda, se emplearon una serie de términos: “heart failure”, “exercise”, “resistance training”, “cardiac rehabilitation“ “endurance training”, “high-intensity interval training“ y “moderate-intensity continuous training”, los cuales se intodujeron en los diferentes buscadores con diferentes combinaciones. Después, se aplicó un filtro por año de publicación (artículos publicados desde el 2000) y por tipo de estudio (ECA o metaanálisis). Posteriormente, se eliminaron todos los artículos duplicados y los que no trataban el tema que se aborda en esta revisión, así como se descartaron aquellos estudios que no cumplían criterios de inclusión. Por último, se realizó una revisión bibliográfica de los artículos obtenidos.
· Estudios identificados utilizando las palabras clave en las diferentes bases de datos: 7816
· Estudios identificados tras aplicar los filtros de año de publicación y tipo de estudio: 1027
· Estudios identificados tras eliminar los artículos que no cumplían los criterios de inclusión, así como tras descartar estudios duplicados: (19)
Ø Criterios de inclusión:
· Artículos publicados desde el 01//01/2000 hasta el 01/01/2021
· Artículos en inglés.
· Ensayos clínicos aleatorizados o metaanálisis
· Los sujetos de estudio son humanos.
· Los sujetos de estudio son mayores de 18 años
· Los sujetos de estudio son pacientes con IC con FEVI reducida
· Estudios que comparasen el protocolo de entrenamiento MICT con otro método de entrenamiento que fuese HIIT o EC.
· Estudios que midiesen el consumo máximo de oxígeno (Vo2max).
Ø Criterios de exclusión:
· Estudios que solo compararan un método de entrenamiento con la atención clínica habitual.
· Pacientes con IC con FEVI conservada
· Cualquier otro estudio que no cumpliera criterios de inclusión.
Resultados
A. Estudios que comparan HIIT vs MICT
A continuación, describo los ECA que comparan una intervención basada en HIIT con una intervención basada en MICT. Todos los estudios son en pacientes con ICC con FEVI reducida, en tratamiento médico óptimo. Se valoran en todos los estudios los cambios en el Vo2 max (medida de capacidad cardiorrespiratoria) y se reflejan en la tabla II, junto con las características de la muestra y metodología. Al margen del Vo2 max, en cada estudio se explican las características importantes y los datos relevantes que se estudiaron en cuanto a otros parámetros de capacidad física, función cardiovascular, otros parámetros metabólicos y calidad de vida.
1.Wisloff et.al (38) se centró en investigar durante 12 semanas las diferencias de estos dos protocolos respecto a la función cardiovascular y pronóstico de la IC post-infarto. El VO2 max aumentó más en HIIT (46% VS 14%) así como el umbral anaeróbico (AT) con diferencias significativas (p<0,001), siendo el primer estudio en demostrar superioridad de HIIT en la capacidad física de pacientes con IC. La calidad de vida (puntuación global de MacNew) también fue significativamente superior en HIIT (p<002). El remodelado ventricular izquierdo también fue superior en el grupo HIIT, disminuyendo solo en este grupo el VTD (volumen telediastólico) (18%) y el telesistólico (25%). La FEVI aumentó un 35%. La función endotelial (dilatación de la arteria braquial) también fue superior en HIIT así como la función mitocondrial en el vasto lateral, que aumentó solo en este grupo.
2. Ellingsen et.al (estudio SMARTEX) (39) es un ECA multicéntrico, que comparó un grupo HIIT, un grupo MICT y otro grupo al que se recomendó ejercicio regular (RRE). La intervención duró 12 semanas, tras la cual no se observaron diferencias significativas entre HIIT y MICT en el Vo2 max (HIIT 9,5% vs MICT 5%) ni en ningún parámetro de capacidad física, ecocardiográfico o de calidad de vida. En la comparación con RRE solo fue estadísticamente significativo el VTD y el VO2 max al comparar HITT vs RRE (P=0,02) y el VO2 max al comparar MICT vs RRE, como (Tabla 1).
Tabla 1. Resultados Estudio SMARTEX
|
|
HIIT vs MCT |
HIIT vs RRE |
MCT vs RRE |
|
VTD (mm) |
-1.2 (-3,6 a 1,2) |
-2,8 (-5,2 a -0,4) p=0,02 |
-1,6 (-4,2 a 1,1) |
|
FEVI |
1,5 (-2,1 a 5,1) |
2,5 (-0,5 a 5,5) |
0,9 (-2,7 a 4,6) |
|
Vo2 max (ml/kg/min) |
-0´4 (-1,7 a 0,8) |
1,4 (0´2 a 2,6) p=0,02 |
1,8 (0,05 a 3,0) p=0,003 |
|
NT-proBNP ng/L |
-95 (-729 a 538) |
-52 (-489 a 384) |
43 (-500 a 587) |
Cabe destacar que el 51% del grupo HIIT se ejercitó a intensidad más baja de la prescrita, mientras que el 80% del grupo MICT lo hizo a una intensidad más alta de la propuesta.
Después de las 12 semanas, no se realizaron más sesiones supervisadas pero se mantuvo contacto telefónico cada 4 semanas para registrar eventos clínicos y fomentar actividad física hasta las 52 semanas, momento en el que se realizó una segunda evaluación clínica obteniendo peores resultados que a las 12 semanas, lo que sugiere que las prescripciones de ejercicio no se siguieron igual que en el período supervisado.
3. Benda et. al(40): El rasgo distintivo de este estudio es que en el HIIT los intervalos son más cortos (1 minuto) y el descanso activo se realiza a una intensidad más baja (30%) así como que la frecuencia de entrenamiento es de 2 días/semana. El Vo2 max mejoró en ambos grupos. Mejoró más en HIIT, pero sin llegar a la significación estadística (7% vs 0,5% p=0,09). De igual manera, ambos mejoraron el VT1 y el pulso máximo de oxígeno.
También valoraron la función y estructura cardiaca (ecocardiografía) sin encontrarse mejoras significativas en ninguno de los dos grupos. Por último, la calidad de vida, evaluada con el SF-36 y con el cuestionario de Minnesota para vivir con insuficiencia cardiaca (MLHFQ), tampoco mostró diferencias con la excepción del dominio físico del SF-36, que mejoró en ambos sin ser significativamente diferente entre grupos.
4. Dimopoulos et.al(41): Tras 36 sesiones en cicloergómetro, observaron aumentos en el Vo2 max (8% HIIT vs 6% MICT), así como en otros parámetros de capacidad física (slope VE/CO2, AT) en ambos grupos, pero sin diferencias significativas entre ellos (p>0,05). Además, estudiaron específicamente los efectos del HIIT y MICT sobre el HRR1 (recuperación de la FC inmediatamente tras el ejercicio, parámetro que refleja la actividad parasimpática, que está disminuida en pacientes con ICC). Después de las 12 semanas de intervención solo el grupo MICT tuvo un incremento significativo en HRR1 (p=0,02) y en la respuesta cronotrópica (p=0,02), sugiriendo una mayor contribución del sistema nervioso autónomo (SNA).
5. Freyssinet.al (42) parten de la teoría de que más fluctuaciones en las necesidades de oxígeno en el entrenamiento de alta intensidad maximizaría las adaptaciones por lo que el grupo HIIT realizó 3x (12 intervalos de 30 segundos a muy alta intensidad seguidos de 1 minuto de descanso completo) en cicloergómetro, separadas por 5 minutos de descanso. Por su lado, la intervención en el grupo MICT consistió en 45 minutos de ejercicio aeróbico, la mitad en cicloergómetro y la mitad en cinta rodante (por razones organizativas). En total realizaron 168 minutos el grupo HIIT y 360 minutos el grupo MICT por lo que no se igualó el volumen. Cabe mencionar que se realizó RC integral, es decir, se llevaron a cabo charlas educativas y asesoramiento completo sobre estilo de vida, así como se añadieron entrenamientos de fuerza de 45 minutos y balneoterapia (gimnasia en agua). La variable de estudio primaria fue el VT1 y fue el único parámetro de capacidad física que mejoró en ambos grupos pero de forma significativa más en HIIT. Respecto al Vo2 max también se obtuvieron mejoras significativas a favor de HIIT (27% VS 2%), así como en el 6MTW (p<0,001 en ambas). Los autores concluyen que el HIIT sea probablemente más eficaz que el MICT para mejorar los índices de capacidad de ejercicio submáxima, resaltando su importancia en las actividades de la vida diaria y calidad de vida. Por otro lado, midieron el nivel de ansiedad y depresión (escala HADS), que mejoró en ambos grupos sin diferencias sustanciales entre ellos.
6. Fu et.al (43) estudió concretamente como afectan estas dos modalidades de entrenamiento en la capacidad funcional al modular la eficiencia ventilatoria y la función hemodinámica cardiaca (dispositivo de biorrectancia no invasiva) cerebral (espectroscopia de infrarrojo cercano para evaluar la perfusión/extracción de O2 en el lóbulo cerebral frontal) y muscular (igual que el anterior en el vasto lateral) en pacientes con ICC. El Vo2 max mejoró significativamente en HIIT (22,5% VS 0,6%).
Por otro lado, el grupo HIIT también mejoró el gasto cardiaco (31%), el volumen sistólico máximo en el ejercicio (30%) y se observó una disminución sistémica de la resistencia vascular (23%). También mejoró la hemodinámica cerebral y muscular, así como se redujeron los niveles de péptido natriurético cerebral en plasma, mieloperoxidasa e interleucina-6, revelando una mejora de la inflamación y estrés oxidativo asociados a la enfermedad cardiaca.
Por último, el HIIT aumentó las puntuaciones de los componentes físicos y mentales del SF- 36 y disminuyó la puntuación del cuestionario MLHFQ (este último mejoró en ambos grupos).
7. Koufaki et.al (44) tuvo como objetivo evaluar la viabilidad y tolerancia del HIIT administrado en un entorno de RC ambulatoria en ICC y compararlo con MICT, siendo el Vo2 max la variable de resultado primaria, que mejoró un 21,6% a los 6 meses en el grupo HIIT y un 8,9% en el grupo MICT (diferencia no significativa). De igual forma, ambos mejoraron la capacidad funcional (sit to stand y velocidad de la marcha). Sin embargo, en este estudio las mejoras en la capacidad de ejercicio submáxima (VT1) son mayores con MICT. La calidad de vida no se modificó en ningún grupo y tampoco se observaron cambios en la variabilidad de la frecuencia cardiaca (VFC). Como conclusión, ambos procedimientos mejoraron la capacidad funcional y aptitud física, sin ser el HIIT superior a MICT.
Es importante recalcar que las intervenciones de este estudio no fueron isocalóricas por lo que el volumen de ejercicio de HIIT fue menor que MICT.
8. Roditis et.al (45), tras 12 semanas de intervención (3 sesiones/semana en cicloergómetro modulando la intensidad mes a mes) no encontró diferencias sustanciales entre grupos (p>0,05) ya que ambos mejoraron el VO2 max un 8,5%. También se encontraron mejoras en otros parámetros de capacidad física como AT y VE/CO2.
9. Smart & Steele (46): Duró 16 semanas, y se estudió la capacidad cardiorrespiratoria (El Vo2max aumentó un 21% en el grupo HIIT frente a un 13% en el grupo MICT, y la comparación entre ellos no fue estadísticamente significativa), la calidad de vida (el grupo HIIT mejoró significativamente el Hare-Davis, herramienta general para pacientes cardiacos, mientras que el grupo MICT hizo lo propio con el MLFHQ, test específico de calidad de vida en IC) y la función cardiaca y endotelial (sin cambios). En este estudio se realizó el mismo volumen absoluto de trabajo (30 minutos por sesión) y se concluye que siempre que se complete un volumen de trabajo similar el HIIT es una herramienta igualmente válida para los pacientes con ICC.
10. Ubrichet.al (47):Se trata de un ECA que evalúo el potencial de HIIT por encima de MICT para mejorar la calidad de vida y el estado físico en pacientes con ICC. La medida de intensidad fue la FC, argumentando que existe una relación relativamente lineal entre FC y VO2 max, pero reconocen que suele sobreestimar la intensidad del ejercicio. La investigación se realizó en un solo lugar y solo en hombres.
En ambos grupos se observó una mejora de la capacidad funcional demostrándose una diferencia estadísticamente significativa entre grupos en el VO2 max y en la distancia de 6MTW (p<0,03 en ambos) concluyendo que el entrenamiento de alta intensidad puede ser importante para mejorar la capacidad aeróbica.
Respecto a los parámetros ecocardiográficos, destaca la mejora de la FEVI en el grupo HIIT (De 35,40% a 39,9%; p=0,013). Sin embargo el grupo MICT mejoró menos (32,8% al comienzo y 35,7% a las 12 semanas; p=0,36). No se objetivó diferencia significativa entre ellos (p=0,315). También se realizó el SF-36, en el que se encontraron diferencias entre grupos solo en el dominio físico, respaldando las mejoras en la capacidad física.
En cuanto a la calidad de vida (MLFHQ) mejoraron tanto HIIT (Puntuación de 39,1 al comienzo y 20,8 a las 12 semanas; p=0,001) como MICT (De 33,5 a 18,9; p=0,005). De nuevo, sin diferencias significativas entre grupos (p=0,82).
11. Nechwatal et.al (48) es el estudio más antiguo incluido, y su intervención duró solo 3 semanas, en las que se ejercitaron 6 veces a la semana durante 15 minutos en cicloergómetro. Ambos grupos mejoraron tanto el Vo2 max (8% HIIT vs 9% MICT) como el resto de parámetros de capacidad física sin diferencias significativas entre ellos. Respecto a otras variables de estudio, se observaron mejoras hemodinámicas con HIIT: índice cardiaco (p <0,05), índice de volumen sistólico (p<0,01) y una caída de la resistencia vascular sistémica del 7% (p<0,05. No hubo cambios en MICT. También se estudió la calidad de vida (evaluada con el SF-36), y ambos grupos mejoraron, destacando que el dominio psicológico aumentó un 24,2% en MICT (el triple que en HIIT).
12. Iellamo et.al (49) parte de la hipótesis de que HIIT y MICT generan adaptaciones y beneficios similares sobre la capacidad funcional, la hemodinámica central y el perfil metabólico en pacientes con ICC post-infarto, siempre que la carga de entrenamiento se equipare. Para ello, se aumenta progresivamente la frecuencia y carga de entrenamiento conforme pasaban las semanas de forma individualizada con el método TRIMP, utilizando la FC individual y el perfil de lactato, con el objetivo de ajustar lo mejor posible la carga interna. El Vo2max aumentó un 22% en ambos grupos sin diferencias entre ellos. La FC también disminuyó de forma significativa en los dos. En cuanto a la función cardiaca, ningún parámetro (FEVI, VTD y gasto cardiaco en reposo) cambió respecto a valores anteriores. Por último, el perfil de lípidos y el metabolismo de la glucosa tampoco fueron alterados de forma significativa, salvo una mejora en el colesterol en el MICT y en la glucemia en ayunas en el HIIT pudiendo reflejar estos datos que el primero utiliza más la oxidación de grasas y el segundo los hidratos de carbono durante el ejercicio. Como conclusión, ambos métodos son efectivos para mejorar la capacidad aeróbica en pacientes con ICC post-infarto, siempre que la dosis de entrenamiento sea individualizada.
13. Iellamo et.al (50) estudió el efecto de HIIT y MICT sobre el perfil de presión arterial (PA) ambulatoria de 24h y sobre la resistencia a la insulina en pacientes con ICC mediante una intervención de 12 semanas.
La PA sistólica y diastólica (tanto la de 24h, la diurna y la nocturna) disminuyó en ambos grupos, sin diferencias entre grupos a excepción de la PA diastólica diurna que mejoró significativamente más con HIIT (p<0,05).
Ambos redujeron sustancialmente la glucosa y la insulina en ayunas, pero solo con HIIT disminuyó significativamente el índice de resistencia a la insulina (HOMA-IR) (p=0,02). Sin embargo, ninguno de ellos tuvo efecto sobre el perfil lipídico.
Respecto a la capacidad física, tanto el Vo2 max (19% HIIT vs 16% MICT) como el AT aumentaron sustancialmente en ambos grupos, sin diferencias significativas al compararlos.
Tabla 2. Tabla de representación de los ensayos controlados aleatorizados que comparan HIIT vs MICT con sus resultados.
|
|
Tipo de estudio y muestra |
Metodología |
Resultados VO2 max (ml/kg/min) |
||
|
HIIT |
MICT |
HIIT VS MICT |
|||
|
Wisloff et. al (2007) |
n=18 Edad:75,5 años |
Cinta rodante. 12 semanas (3 sesiones/semana): HIIT:4x (4minutos al 90-95% de la FC máxima seguidos de 3 minutos al 50-70% de la FC máxima) MICT: 47 minutos al 70-75% de la FC máxima |
Pre: 13 Post: 18,98 Mejora:46% P <0,05 |
Pre: 13 Post: 14,82 Mejora: 14% P >0,05 |
P<0,05 |
|
Freyssin et. al (2012) |
n=26 Edad=54 50% hombres NYHA (no documentado) |
5 sesiones/semana de RC durante 8 semanas: HIIT: 3x(12 intervalos de 30 segundos al 50-80% seguidos de 1 minuto de descanso completo) separadas por 5 minutos de descanso. En cicloergómetro: MICT: 45 min de intensidad moderada (mitad en cicloergómetro, mitad en tapiz rodante) |
Pre:10,7 Post:13,6 Mejora:27%
|
Pre: 10,6 Post: 10,8 Mejora: 2%
|
P<0,001 |
|
Dimopulos et. al |
n=24 Edad= 60,5 95´8% hombres NYHA I-III |
12 semanas, 3 sesiones/semana.40´en total. En cicloergómetro: HIIT: 30seg de ejercicio al 100, 110 y 120% el primer, segundo y tercer mes respectivamente, seguidos de 30 seg de descanso MICT: Al 50, 55 y 60% el primer, segundo y tercer mes respectivamente. |
Pre:15,4 Post:16,6 Mejora: 8% p <0,02 |
Pre:15,5 Post:16,4 Mejora: 6% P: 0,01 |
p>0,05 |
|
Nechwatal et. al (2002) |
n=50 Edad=47,4 94% hombres NYHA I-III |
HIIT: 90 segundos de alta intensidad (Aumento de 25W cada 10 segundos), 30 segundos al 50% y 60 segundos de descanso activo (15W) MICT: 75% de la FC máxima |
Pre:18,5 Post:20 Mejora: 8% P= 0,028 |
Pre:17,2 Post:18,8 Mejora: 9% P=0,006 |
p>0,05 |
|
Roditis et. al (2007) |
n=21 Edad= 62,5 90,5% hombres NYHA I-III
|
3 sesiones/ semana durante 12 semanas,40´en total. En cicloergómetro: HIIT: 30 segundos al 100% el primer mes, 110% el segundo y 120% el tercero de la tasa máxima de trabajo basal y 30 segundos de descanso) MICT: El primer mes al 50%, el segundo mes al 55% y el tercer mes al 60%. |
Pre: 14,2 Post: 15,4 Mejora: 8,5% P=0,03 |
Pre: 15,3 Post: 16,6 Mejora: 8,5% P=0,03 |
P>0,05 |
|
Smart & Steele et. al (2012) |
n=23 Edad=62,5 92,3% hombres NYHA II-III |
16 semanas, 3 sesiones/ semana. En cicloergómetro: HIIT:30x (1minuto a alta intensidad, 1 minuto descanso): 60minutos totales MICT: 30 minutos al 70% del Vo2max |
Pre:12,2 Post: 14,76 Mejora:21% P=0,03 |
Pre 14 Post: 15,82 Mejora: 13% P=0,12 |
P=0,72 |
|
Fu et. al (2013) |
n=27 Edad=67 63% hombres NHYA II-III |
3 sesiones/semana durante 12 semanas. En cicloergómetro: HIIT (5 intervalos de 3 minutos al 80% y 3 minutos al 40% del Vo2 max) MICT (30 minutos al 60%). |
Pre: 16 Post:19,6 Mejora: 22,5% P <0,05 |
Pre: 15,9 Post: 16 Mejora:0,6% P>0,05 |
P<0,05 |
|
Koufaki et.al (2014) |
n=33 Edad=59 81,8% hombres NYHA I-III |
3 sesiones/ semana durante 24 semanas: HIIT: 2x15 minutos con intervalos de 1minuto al 20-30% y 30 segundos al 100% MICT: 3X 7-10minutos al 40-60% VO2 max |
Pre:14,6 Post:17,7 Mejora:21,6% P<0,05 |
Pre:15,5 Post: 16,9 Mejora: 8,9% P<0,05 |
P>0,05 |
|
Lellamo et. al (2012) |
n=16 Edad=62,4 NYHA II-III |
12 semanas, 2sesiones/semana el primer mes, 3 el segundo y 4 el tercero. En cinta rodante: HIIT: 2-4 ciclos de 4minutos al 75-80% del HRR seguidos de 3 minutos de recuperación activa al 45-50% del HRR MICT:30-45 minutos al 40-60% HRR |
Pre : 18,78 Post: 23,02 Mejora: 22% P<0,05 |
Pre: 18,44 Post:22,53 Mejora: 22% P<0,05 |
P>0,05 |
|
Lellamo et. al (2013) |
n=36 Edad=67,8 86,1% hombres NYHA I-II
|
3 sesiones/ semana durante 12 semanas. En cinta rodante: HIIT: 4x (4 minutos al 75-80% de HRR alternando con 3 minutos de descansos activo al 45-50% de HRR) MICT: 30-45 minutos al 45-60% de HRR |
Pre:15,3 Post: 18,2 Mejora: 19% P <0,05 |
Pre:16,2 Post: 18,8 Mejora:16% P <0,05 |
p>0,05 |
|
Benda et. al (2015) |
n=20 Edad:64 95% hombres NYHA II-III
|
2 sesiones/semana, durante 12 semanas. En cicloergómetro. HIIT: 10x (1minuto al 90% con objetivo de puntuación de Borg de 15-17 y 2,5 minutos al 30%) MICT: 30 minutos al 60-75% con objetivo de obtener una puntuación de Borg de 12-14.
|
Pre: 19,1 Post: 20,4 Mejora:7% |
Pre: 21,2 Post:21,3 Mejora: 0,5% |
P=0,09 |
|
Ulbrich et. al (2016) |
n=22 edad=53,8 100% hombres NYHA II-III |
3 sesiones/ semana, durante 12 semanas: HIIT: 4-6 intervalos de 3 minutos al 95% de la FC máxima y 3 minutos de recuperación activa al 70% de la FC máxima. MICT: 30 minutos al 75% de la FC máxima
|
Pre:21,41 Post:24,2 Mejora:13% P=0,001 |
Pre: 18,39 Post: 20,23 Mejora:10% P=0,04 |
P<0,03 |
|
Ellingsen et. al (2017) |
n= 142 Edad=62,5 81,5%hombres NHYA II-III |
12semanas,3 sesiones/semana: HIIT:4 x ( 4 minutos al 90-95% de de FC máxima, seguidos de 3 minutos de recuperación activa al 60-70% de la FC máxima. MICT: 47 minutos al 60-70% de la FC máxima.
|
Pre:16,8 Post:18,2 Mejora:9,5% p>0,05 |
Pre:16,2 Post: 17 Mejora: 5% p>0,05 |
P=0,7 |
B. Metaanálisis que comparan HIIT vs MICT
1. Ismail et. al (51) es un metaanálisis que se centra en estratificar la intensidad del ejercicio en diferentes niveles de intensidad (tabla III). Se incluyeron 74 estudios con un total de 3265 sujetos que hacían ejercicio (11,8% de alta intensidad, 50% de intensidad vigorosa, 31,6% de intensidad moderada y 6,6% de baja intensidad) y 2612 sujetos de control, con un total de 5877 participantes. Para clasificar la intensidad utilizaron el porcentaje de FC máx., la FC reserva, el Vo2 máx. y la puntuación de Borg.
Tabla 3. Ismail et.al (2013). Comparación del Vo2 max en 4 grupos establecidos según la intensidad del entrenamiento.
|
|
Número de estudios |
Vo2max basal |
Diferencia |
Cambio porcentual |
|
Alta intensidad |
3 estudios |
17,5 +/-3,4 |
3,33 ml/kg/min (IC 95%: 0,53 a 6,13; p=0,02) |
23% |
|
Vigorosa intensidad (*) |
26 estudios |
15+/-1,7 |
2,27 ml/kg/min (IC 95%: 1,79 a 2,84 ml/kg/min; p<0,00001) |
8% |
|
Moderada intensidad |
18 estudios |
16,3 +/- 0,6 |
2,17 ml/kg/min (IC 95%: 1,34 a 2,99 ml/kg/min; p<0,00001) |
13% |
|
Baja intensidad |
2 estudios |
15,5 +/-0,4 |
1,04 ml/kg/min (IC 95%: -2,5 a 4,57 ml/kg/min; p=0,57)
|
7% |
(*) El estudio HF-ACTION contribuyó en un 50% en el grupo de intensidad vigorosa por lo que se hizo un subanálisis de este grupo sin HF-ACTION (Figura 1) y se mostraron aumentos del Vo2max de 2,46 ml/Kg/min (IC 95%: 1,80 a 3,13; p<0,00001), lo que supone un cambio del 16%.
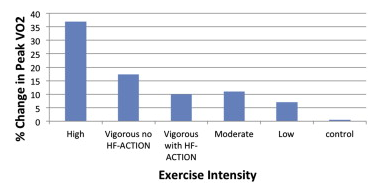
Figura 1. Comparación del Vo2 max en los diferentes grupos establecidos en función de la intensidad del entrenamiento. Extraído de Ismail et.al.
Por otro lado, este estudio tenía también el objetivo de demostrar la seguridad del ejercicio físico de alta intensidad, y comprobó que no se relacionó con el abandono del estudio, eventos adversos, hospitalización y mortalidad. Sumando las horas de ejercicio físico de todos los pacientes, 123479 horas no produjeron ninguna muerte mientras se estaba realizando ejercicio. Además, parece aumentar la adherencia conforme aumenta la intensidad, ya que se objetivó una tasa de retiros significativamente menor en el entrenamiento de alta intensidad que en el grupo de control (p<0,05).
La principal limitación de este estudio es que la muestra en los grupos de alta intensidad y baja intensidad es limitada.
2. Haykowsky et.al (52) es un metaanálisis de 2013 que analizó los estudios que había hasta la fecha que comparasen HIIT vs MICT en HFREF (FEVI <50%). Se incluyeron 7 ECA. La variable de estudio primaria fue el Vo2max y secundariamente estudiaron la FEVI en reposo.
Los resultados reflejaban un aumento significativamente mayor del Vo2 max a favor de HIIT (2,14 ml/kg/min; IC 95%: 0,66 a 3,63). Respecto a la función cardiaca, los resultados no fueron significativos (FEVI 3,29%; IC 95%: -0,7% a 7,28%).
Además, esta revisión informó sobre la seguridad de HIIT ya que no hubo eventos cardiacos adversos con esta modalidad de entrenamiento y el porcentaje de pacientes que completaron la intervención fue similar en ambos grupos.
3. El metaanálasis Gomes Neto et.al (53) mostró que HIIT era más eficiente que MICT en la mejora del Vo2max en pacientes con HFREF (+2,57ml/kg/min VS +1,43 ml/kg/min, mejora de 1,4 ml/kg/min (IC 95%: 0,11 a 2,6; n=411). Sin embargo, esta superioridad desapareció al hacer un análisis de subgrupos separando estudios con y sin protocolo de ejercicio isocalórico:
No isocalórico: Diferencia de 1 ml/kg/min (IC 95%: -0,3 a 2,23; n=146)
Isocalórico: Diferencia de 1,5ml/kg/min (IC 95%; -0,4 a 3,3; N=265)
Además, no encuentran diferencias en slope VE/CO2 ni en la calidad de vida relacionada con la salud.
C. Estudios que comparan EC vs MICT
A continuación, se describen los artículos que comparan una intervención basada en MICT con una intervención basada en entrenamiento concurrente (EC), que consiste en la combinación de MICT y EF. Se compara de nuevo el Vo2 max y también parámetros que midan los cambios producidos en la fuerza (Tabla 4).
Tabla 4. Representación de la metodología de los ECA que comparan una intervención basada en MICT con una intervención basada en EC.
|
|
Tipo de estudio y muestra |
Metodología |
|
Degache et.al (2007) |
N=23 NYHA II-III Edad: 52 años |
Duración: 8 semanas (3 sesiones/semana) MICT: 45 minutos en cicloergómetro al 65% VO2 max EC: 45 minutos en cicloergómetro al 65% VO2 max + 10x10 al 70% RM |
|
Beckers et.al (2008) |
N=58 NYHA II-III Edad: 59años |
Duración: 6 meses (3 sesiones de 60 minutos/semana) MICT: Los 4 primeros meses 40minutos (8minutos x 5 dispositivos diferentes:cinta rodante, bicicleta, escalera, remo, ciclismo reclinado). Al 5º mes: 45 minutos (15 minutos en 3 dispositivos) EC: 1º y 2º mes: 40 min entrenamiento de fuerza y 10 min MICT. 3º y 4º mes: 30 min de fuerza y 2x8 min MICT 5º y 6º mes: 10 min de fuerza y 3x15 min MICT.
|
|
Mandicet.al (2009) |
N=42 NYHA I-III Edad: 62 años |
Duración:12 semanas (3 sesiones/semana): MICT:15 min en cinta rodante y 15 minutos en cicloergómetro al 50-70% FC max o 11-14 escala Borg EC: press pecho, press hombro, remo, flexión bíceps, extensión de tríceps y extensión de cuádriceps (1-2 series de 10-15 repeticiones al 50-70%RM) |
1. Mandic et.al (54) es un ECA realizado en un centro de RC de Canadá, en el que evaluaron en 42 pacientes con IC (clase I-III de la NYHA), durante 12 semanas (3 sesiones/semana) el Vo2 max, la FEVI, la fuerza muscular (evaluada con el RM, que consiste en el máximo peso que se puede levantar en una repetición en un ejercicio determinado), la resistencia muscular (repeticiones) y la calidad de vida. Se aleatorizaron los pacientes a tres grupos: MICT, EC, y atención médica habitual. Entre los pacientes que terminaron el estudio, los dos grupos de intervención mejoraron el Vo2max respecto a la atención habitual (p=0,026 y p=0,058 respectivamente) sin diferencias entre ellas.
Por otro lado, comparado con el grupo control, el EC mejoró significativamente la fuerza y resistencia muscular en el tren superior (press de pecho) y tren inferior (extensión de cuádriceps). Sin embargo, comparado con el MICT, solo fue estadísticamente significativa la mejora en la fuerza y resistencia del tren superior (Tabla 5).
Tabla 5. Mandic et. al (2009). Comparación de la fuerza y resistencia en el tren superior y en el tren inferior en EC vs MICT.
|
|
Media de la mejora en EC |
Media de la mejora en MICT |
Significación estadística |
|
Fuerza en tren superior (Press de pecho) |
7,8 kg |
1kg |
P<0,05 |
|
Resistencia en tren superior (Press de pecho |
6,9 repeticiones |
1,8 repeticiones |
P<0,05 |
|
Fuerza en tren inferior (extensiones cuádriceps) |
6,9kg |
1,8kg |
P>0,05 |
|
Resistencia en tren inferior (extensiones cuádriceps) |
5,1 repeticiones |
2,5 repeticiones |
p>0,05 |
Por último, la calidad de vida solo mejoró con el MICT y ninguno de los dos grupos mejoró la FEVI.
2. Degache et.al (55) es un ECA realizado en 23 pacientes con ICC. La intervención se realizó 3 días por semana durante 8 semanas y se evaluó la capacidad aeróbica y la fuerza isocinética. El grupo MICT mejoró el Vo2 max un 20% mientras que el grupo EC lo hizo un 10%, sin llegar a la significación estadística entre grupos.
La fuerza isocinética solo mejoró en el grupo EC, siendo significativos los cambios en el torque máximo extensor a 180º (10,5% de mejora) y en el torque máximo extensor a 60º (5,6% de mejora), y mejorando sin llegar a la significación estadística en el torque máximo flexor a 60 y 180º.
3. Beckers et. al (56) comparó estas dos alternativas durante 6 meses en 58 pacientes con ICC con FEVI reducida clase II-III NYHA (Tabla VI). La intervención se realizó tres veces por semana.
El Vo2 máx. evolucionó de manera similar en ambos grupos. Sin embargo, EC fue superior en parámetros de capacidad aeróbica submáxima.
Respecto a la fuerza, en el tren inferior no hubo diferencias (p=0,3), pero en el tren superior observaron diferencias significativas a favor de EC (p<0,003).
La calidad de vida también mejoró a favor de EC. (OR = 3,86; IC del 95%: 1,11-12,46; P = 0,03).
En cuanto a la función cardiaca, no hubo mejoras significativas en ningún grupo en la FEVI y dimensiones de ventrículo izquierdo, pero tampoco empeoró, apoyando la seguridad de este tipo de intervenciones.
Por último, no hubo diferencias en cuanto a mortalidad e ingresos hospitalarios cardiovasculares.
En conclusión, en este estudio, EC tuvo un efecto mayor sobre la capacidad de ejercicio submáxima, fuerza muscular y calidad de vida.
Tabla 6. Beckerset.al (2008). Comparación de la fuerza en tren superior y tren inferior y el Vo2 max en EC vs MICT.
|
|
Media de la mejora en EC |
Media de la mejora en MICT |
Significación estadística |
|
Fuerza en tren superior (Press de pecho) |
13,2kg |
5,7kg |
P<0,003 |
|
Fuerza en tren inferior (extensiones de cuádriceps) |
12,8 kg |
10,9kg |
P=0,5 |
|
Vo2max |
2,1 ml/kg/min |
0,9 ml/kg/min |
0,3 |
Discusión
1. HIIT vs MICT
En esta revisión se han incluido 13 ECA que comparaban un protocolo de HIIT con un protocolo de MICT (intervención estándar), así como 3 metaanálisis que tratan esta cuestión. Se ha comparado principalmente el Vo2 máx. por haber demostrado ser un predictor de mortalidad en IC. Wislloff et.al (38) fue el primer estudio en el que comparando HIIT con MICT se obtuvo una superioridad significativa a favor de HIIT. Desde entonces, la bibliografía al respecto ha sido controvertida, algunos estudios (42,43,47) han encontrado mejoras significativas a favor de HIIT, mientras que otros (39-41,44-46,49,50) no las han encontrado, aunque la tendencia en general es favorable para HIIT. Solo hay un estudio (48) que inclinó la balanza hacia el MICT, pero sin diferencias significativas.
En general, salvo el estudio SMARTEX(39), un ensayo multicéntrico con 142 pacientes que no encontró diferencias en el VO2 máx., la muestra de los estudios incluidos fue pequeña, lo que dificulta la interpretación de los datos. Dicho estudio también fue el único que informó sobre la intensidad real a la que se ejecutaron los entrenamientos reflejando que el 51% del grupo HIIT entrenó a una intensidad más baja de la prescrita, mientras que el 80% del grupo MICT se ejercitó a una intensidad más alta de lo propuesto, por lo que al comparar los datos tenemos que tener en cuenta que la diferencia de intensidad entre ambos no alcanzó el objetivo que se pretendía. Este dato, que no aportaron el resto de los estudios, es importante porque realmente es complicado que una persona desentrenada alcance un porcentaje alto del Vo2 máx. durante el tiempo suficiente como para considerarlo HIIT.
Por otro lado, como observamos en la tabla II, respecto a la metodología de entrenamiento utilizada, hay bastantes diferencias entre unos estudios y otros en la duración, frecuencia, intensidad y volumen de entrenamiento, haciendo más difícil extraer conclusiones generales de un método de entrenamiento. Por ejemplo, en la metodología HIIT, algunos estudios alternaron intervalos cortos de muy alta intensidad con intervalos de descanso completo y otros combinaron intervalos más largos de intensidad menor con descanso activo a baja intensidad.
En cuanto a otros factores referentes a la metodología de los estudios, resaltar que, debido a la naturaleza de la intervención, los estudios no podían ser doble ciego.
Los metaanálisis de Haykowsky et.al (52) y Gomes Neto et.al (53) incluyeron la gran mayoría de estudios mencionados en esta revisión. En ambos se obtuvieron diferencias significativas a favor de HIIT. Sin embargo, en el segundo, al realizar un análisis de subgrupos según si habían realizado protocolo isocalórico o no, las diferencias desaparecían.
El objetivo de los protocolos isocalóricos es ajustar el gasto energético dentro de las sesiones de ejercicio aeróbico realizadas con diferente intensidad. Esto tiene especial importancia ya que se ha demostrado que el gasto energético total es la característica del entrenamiento más importante para mejorar la capacidad de ejercicio (57). Además, si el estímulo proporcionado de forma global en uno de los grupos es sustancialmente mayor que en otro, las adaptaciones serán superiores, aunque el método de entrenamiento no fuese superior.
Relacionado con lo anterior, para comprobar si una intervención de ejercicio físico es superior a otra, es imprescindible tener en cuenta que la carga externa (el plan de entrenamiento pautado) no es lo mismo que la carga interna (el estímulo que recibe el organismo). Las adaptaciones producidas en cada persona dependerán de si la carga interna es adecuada en ese sujeto de forma individualizada ya que cada paciente tiene su propia carga interna óptima. Un mismo entrenamiento sin individualizar puede suponer un estímulo excesivo para un sujeto, insuficiente para otro y adecuado para otro, siendo algo a tener en cuenta a la hora de valorar los resultados (principio de individualización). Además, conforme se van generando adaptaciones, el organismo requiere un estímulo progresivamente mayor para seguir adaptándose (principio de progresión). Solo un estudio (49) fue aumentando la frecuencia y carga de entrenamiento conforme pasaban las semanas de forma individualizada utilizando la FC individual y el perfil de lactato, por lo que probablemente sea el estudio con menos errores respecto a la carga interna recibida por cada sujeto. En este estudio observaron iguales mejoras en el Vo2 máx. en ambos grupos.
A pesar de que la variable de estudio principalmente estudiada ha sido el Vo2max, la limitación principal de los pacientes con ICC en las actividades de la vida diaria está más vinculada con la capacidad aeróbica submáxima que con la capacidad aeróbica máxima, siendo el VT1 de especial relevancia para medirlo, ya que refleja el momento en el que la musculatura comienza a trabajar sin oxígeno y por tanto implica hiperventilar y experimentar fatiga. Varios estudios valoraron este parámetro, obteniendo mejoras similares con ambos métodos. Se alcanzó la significación estadística a favor de HIIT en dos estudios (38,42) y a favor de MICT en un estudio (44).
Respecto a la función y estructura cardiaca lo más destacable es que los estudios que muestran mejoras significativas son de una duración mayor, pudiendo deberse a que se requiere más tiempo para que las adaptaciones cardiovasculares se produzcan de forma sustancial. Haykwosky et.al (52), analizando conjuntamente los estudios que incluían estos parámetros, encontró mejoras a favor de HIIT, pero las diferencias no fueron significativas. Para concluir, cabe destacar que un estudio (41), analizó el HRR1 y encontró diferencias a favor de MICT, reflejando posiblemente más adaptaciones en el SNA por esta modalidad.
La calidad de vida ha sido estudiada en 8 de los 13 ECA (38-40,43,44,46-48) con diferentes cuestionarios (MLHFQ, SF-36, MacNew) mostrando mejoras con ambos métodos también. El metaanálisis Gomes Neto et. al (53) no encontró diferencias significativas entre ellos. Es destacable una mejora considerablemente mayor en el dominio físico del SF-36 en varios estudios (40,43) apoyando la mejora en la capacidad física experimentada por los pacientes.
La modalidad HIIT ha tenido estas últimas décadas muchos detractores por considerar que la alta intensidad podía ser perjudicial para el corazón. Sin embargo, dos metaanálisis (51,52) estudiaron esta cuestión y no se registró ningún evento adverso.
Por último, pero no menos importante, la principal ventaja que tiene el HIIT es que requiere menos tiempo y teniendo en cuenta que muchos pacientes con ICC suelen reportar falta de tiempo para hacer ejercicio, este factor puede suponer una mayor adherencia al ejercicio, que en última instancia es lo más importante. El mejor método de entrenamiento es el que se realiza de forma constante y mantenida en el tiempo.
2. EC vs MICT
Los estudios analizados que comparan un protocolo de EC con un protocolo de MICT (54-56) reflejan que la capacidad cardiorrespiratoria mejora de forma similar en ambos grupos. En gran parte esto se debe a que el EF también aumenta el número y mejora la funcionalidad de las mitocondrias.(58)
Por otro lado, con EC se observan más mejoras de fuerza, algo esperable al trabajar esta capacidad física en concreto. No obstante, el entrenamiento aeróbico, sobre todo en personas desentrenadas, también tiene un pequeño efecto en las mejoras de fuerza, principalmente en los grupos musculares que involucre la modalidad MICT practicada (tren inferior en los estudios analizados). Esto principalmente se debe a que las unidades motoras se reclutan de forma gradual, de más bajo umbral a más alto umbral, en función de la intensidad que un determinado estímulo de entrenamiento suponga para cada persona.
La ventaja principal del EF radica en que es considerablemente superior al entrenamiento aeróbico en la mejora de la composición corporal.(59) Anteriormente, al tejido muscular solo se le atribuían connotaciones estéticas y deportivas. Incluso se creía que era perjudicial para la salud cardiovascular debido a sus efectos agudos, como el aumento de la PA. A día de hoy, sabemos que el tejido muscular es un órgano endocrino que libera mioquinas antinflamatorias con acción autocrina, paracrina y endocrina,(60) por lo que el EF mejora la inflamación crónica (61) y el exceso de estrés oxidativo,(62) ambos mecanismos subyacentes de las enfermedades crónicas como la IC.(63)
Actualmente, la sarcopenia no se considera un factor de riesgo cardiovascular establecido. Sin embargo, sabemos que el IMC es un mal estimador de la composición corporal. Un estudio de 2016 (64) analizó la relación entre la composición corporal y la mortalidad cardiovascular, dividiendo 4 grupos: bajo tejido muscular/bajo tejido graso, bajo tejido muscular/alto tejido graso, alto tejido muscular/bajo tejido graso y alto tejido muscular/alto tejido graso. Como era de esperar, el grupo de alto tejido muscular/bajo tejido graso fue el que menos mortalidad presentó y el grupo de alto tejido graso/bajo tejido muscular el que más. No obstante, lo relevante fue que, entre los dos grupos restantes, presentó mayor mortalidad el grupo de bajo tejido graso y bajo tejido muscular demostrando la importancia del tejido muscular en la salud y su impacto en la morbilidad y mortalidad cardiovascular.
Por otro lado, no debemos olvidar que la mayoría de los pacientes con ICC son personas mayores. La sarcopenia y dinapenia (pérdida de fuerza), son procesos inherentes al paso de los años pero que se aceleran con la inactividad física, reduciendo la reserva funcional y siendo un factor fundamental en la génesis del círculo vicioso de la fragilidad. Un paciente frágil es muy vulnerable a cualquier evento adverso, aumentando la discapacidad, las caídas y las consecuencias funcionales que ello acarrea. El EF es fundamental para evitar este deterioro al mejorar la fuerza, la potencia, la densidad ósea y por tanto la capacidad funcional e independencia de estos pacientes.(65,66)
Todo lo anterior es especialmente importante en los pacientes con ICC ya que tienen alterada la función del músculo esquelético, lo que condiciona que aumente la sarcopenia y atrofia muscular. Además, esto repercute directamente en la intolerancia al ejercicio que sufren los pacientes con ICC y por tanto en la calidad de vida, al interferir en las actividades de la vida diaria. Por lo tanto, en pacientes con la función muscular alterada, se recomienda priorizar el EF con el objetivo de aumentar la cantidad y calidad de masa muscular.(59,67)
Por último, una comorbilidad frecuente en los pacientes con ICC es la Diabetes Mellitus (DM). Los pacientes con alteraciones del metabolismo de la glucosa se benefician especialmente también del EF. La razón es que aunque los receptores de insulina del tejido muscular y del tejido graso son similares, el tejido muscular es mucho más eficiente utilizando la glucosa sanguínea mediada por la insulina tras la ingesta.(68) Por consiguiente, en individuos con un exceso de grasa en comparación con el tejido muscular cualquier carga de glucosa dada requiere una secreción de insulina pancreática mayor de lo normal para su eliminación adecuada.
Por ello, el EF no debe sustituir al entrenamiento aeróbico, pues como hemos comentado tenemos mucha evidencia científica de la mejora de la capacidad física en los pacientes con IC con esta modalidad, pero sí complementarlo, porque las adaptaciones producidas no son iguales, y el EF tiene efectos adicionales importantes. La cantidad de masa muscular y la calidad de esta (fuerza ejercida a igualdad de masa muscular) es fundamental. Entrenar fuerza es medicina.
Conclusiones
1. Tanto HIIT como MICT son intervenciones eficaces para mejorar la capacidad física, la función cardiaca (no de forma significativa) y la calidad de vida.
2. Los resultados muestran una ligera mejoría con HIIT, pero ningún método de entrenamiento es claramente superior al otro como para elegir esa modalidad por defecto.
3. El EF aporta beneficios adicionales muy importantes en la ICC, por lo que debe formar parte de la RC, siendo el EC una intervención más completa y beneficiosa que el entrenamiento aeróbico solo.
Lo más importante es realizar un abordaje individualizado, valorando posibles riesgos y beneficios de cada modalidad y teniendo en cuenta el contexto global de cada paciente, así como sus preferencias y objetivos ya que la adherencia es la base del éxito de cualquier intervención de entrenamiento.
Referencias
1. Pullen AB, Jadapalli JK, Rhourri-Frih B, Halade GV. Re-evaluating the Causes and Consequences of Non-Resolving Inflammation in Chronic Cardiovascular Disease. Heart Fail Rev. marzo de 2020;25(2):381-91.
2. Danesh J, Whincup P, Walker M, Lennon L, Thomson A, Appleby P, et al. Low grade inflammation and coronary heart disease: prospective study and updated meta-analyses. BMJ. 22 de julio de 2000;321(7255):199-204.
3. Estadísticas de ECV 2017 [Internet]. [citado 2 de mayo de 2021]. Disponible en: https://ehnheart.org/cvd-statistics/cvd-statistics-2017.html
4. Piepoli MF, Hoes AW, Agewall S, Albus C, Brotons C, Catapano AL, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts)Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J. 1 de agosto de 2016;37(29):2315-81.
5. Pelliccia A, Sharma S, Gati S, Bäck M, Börjesson M, Caselli S, et al. 2020 ESC Guidelines on sports cardiology and exercise in patients with cardiovascular disease. Eur Heart J. 1 de enero de 2021;42(1):17-96.
6. Pedersen BK, Saltin B. Exercise as medicine - evidence for prescribing exercise as therapy in 26 different chronic diseases. Scand J Med Sci Sports. diciembre de 2015;25 Suppl 3:1-72.
7. European Association of Cardiovascular Prevention and Rehabilitation Committee for Science Guidelines, EACPR, Corrà U, Piepoli MF, Carré F, Heuschmann P, et al. Secondary prevention through cardiac rehabilitation: physical activity counselling and exercise training: key components of the position paper from the Cardiac Rehabilitation Section of the European Association of Cardiovascular Prevention and Rehabilitation. Eur Heart J. agosto de 2010;31(16):1967-74.
8. Balady GJ, Williams MA, Ades PA, Bittner V, Comoss P, Foody JAM, et al. Core components of cardiac rehabilitation/secondary prevention programs: 2007 update: a scientific statement from the American Heart Association Exercise, Cardiac Rehabilitation, and Prevention Committee, the Council on Clinical Cardiology; the Councils on Cardiovascular Nursing, Epidemiology and Prevention, and Nutrition, Physical Activity, and Metabolism; and the American Association of Cardiovascular and Pulmonary Rehabilitation. J Cardiopulm Rehabil Prev. junio de 2007;27(3):121-9.
9. Cowie A, Buckley J, Doherty P, Furze G, Hayward J, Hinton S, et al. Standards and core components for cardiovascular disease prevention and rehabilitation. Heart. 1 de abril de 2019;105(7):510-5.
10. Corbin CB, Pangrazi RP, Franks BD. Definitions: Health, Fitness, and Physical Activity. President’s Council on Physical Fitness and Sports Research Digest. President’s Council on Physical Fitness and Sports, 200 Independence Avenue, S; 2000.
11. Fletcher GF, Balady G, Froelicher VF, Hartley LH, Haskell WL, Pollock ML. Exercise standards. A statement for healthcare professionals from the American Heart Association. Writing Group. Circulation. 15 de enero de 1995;91(2):580-615.
12. Ponikowski P, Anker SD, AlHabib KF, Cowie MR, Force TL, Hu S, et al. Heart failure: preventing disease and death worldwide. ESC Heart Fail. septiembre de 2014;1(1):4-25.
13. Piepoli MF, Davos C, Francis DP, Coats AJS, ExTraMATCH Collaborative. Exercise training meta-analysis of trials in patients with chronic heart failure (ExTraMATCH). BMJ. 24 de enero de 2004;328(7433):189.
14. Long L, Mordi IR, Bridges C, Sagar VA, Davies EJ, Coats AJ, et al. Exercise-based cardiac rehabilitation for adults with heart failure. Cochrane Database Syst Rev. 29 de enero de 2019;1:CD003331.
15. Taylor RS, Walker S, Smart NA, Piepoli MF, Warren FC, Ciani O, et al. Impact of exercise-based cardiac rehabilitation in patients with heart failure (ExTraMATCH II) on mortality and hospitalisation: an individual patient data meta-analysis of randomised trials. Eur J Heart Fail. diciembre de 2018;20(12):1735-43.
16. Rees K, Taylor RS, Singh S, Coats AJS, Ebrahim S. Exercise based rehabilitation for heart failure. Cochrane Database Syst Rev. 2004;(3):CD003331.
17. Taylor RS, Walker S, Smart NA, Piepoli MF, Warren FC, Ciani O, et al. Impact of Exercise Rehabilitation on Exercise Capacity and Quality-of-Life in Heart Failure: Individual Participant Meta-Analysis. J Am Coll Cardiol. 2 de abril de 2019;73(12):1430-43.
18. O’Connor CM, Whellan DJ, Lee KL, Keteyian SJ, Cooper LS, Ellis SJ, et al. Efficacy and safety of exercise training in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA. 8 de abril de 2009;301(14):1439-50.
19. Sagar VA, Davies EJ, Briscoe S, Coats AJS, Dalal HM, Lough F, et al. Exercise-based rehabilitation for heart failure: systematic review and meta-analysis. Open Heart. 2015;2(1):e000163.
20. Pelliccia A, Sharma S, Gati S, Bäck M, Börjesson M, Caselli S, et al. Guía ESC 2020 sobre cardiología del deporte y ejercicio físico en pacientes con enfermedad cardiovascular. Rev Esp Cardiol [Internet]. [citado 1 de mayo de 2021]; Disponible en: http://www.revespcardiol.org/es-guia-esc-2020-sobre-cardiologia-avance-S0300893221000750
21. Gielen S, Adams V, Niebauer J, Schuler G, Hambrecht R. Aging and heart failure--similar syndromes of exercise intolerance? Implications for exercise-based interventions. Heart Fail Monit. 2005;4(4):130-6.
22. Piepoli MF, Conraads V, Corrà U, Dickstein K, Francis DP, Jaarsma T, et al. Exercise training in heart failure: from theory to practice. A consensus document of the Heart Failure Association and the European Association for Cardiovascular Prevention and Rehabilitation. Eur J Heart Fail. abril de 2011;13(4):347-57.
23. El-Sayed MS, El-Sayed Ali Z, Ahmadizad S. Exercise and training effects on blood haemostasis in health and disease: an update. Sports Med Auckl NZ. 2004;34(3):181-200.
24. Milani RV, Lavie CJ, Mehra MR. Reduction in C-reactive protein through cardiac rehabilitation and exercise training. J Am Coll Cardiol. 17 de marzo de 2004;43(6):1056-61.
25. Malfatto G, Blengino S, Annoni L, Branzi G, Bizzi C, Facchini M. Original articles primary coronary angioplasty and subsequent cardiovascular rehabilitation are linked to a favorable sympathovagal balance after a first anterior myocardial infarction. Ital Heart J Off J Ital Fed Cardiol. enero de 2005;6(1):21-7.
26. Linke A, Erbs S, Hambrecht R. Effects of exercise training upon endothelial function in patients with cardiovascular disease. Front Biosci J Virtual Libr. 1 de enero de 2008;13:424-32.
27. Papadakis S, Oldridge NB, Coyle D, Mayhew A, Reid RD, Beaton L, et al. Economic evaluation of cardiac rehabilitation: a systematic review. Eur J Cardiovasc Prev Rehabil Off J Eur Soc Cardiol Work Groups Epidemiol Prev Card Rehabil Exerc Physiol. diciembre de 2005;12(6):513-20.
28. Pandey A, Parashar A, Kumbhani D, Agarwal S, Garg J, Kitzman D, et al. Exercise training in patients with heart failure and preserved ejection fraction: meta-analysis of randomized control trials. Circ Heart Fail. enero de 2015;8(1):33-40.
29. Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, Drazner MH, et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 15 de octubre de 2013;62(16):e147-239.
30. Bjarnason-Wehrens B, McGee H, Zwisler A-D, Piepoli MF, Benzer W, Schmid J-P, et al. Cardiac rehabilitation in Europe: results from the European Cardiac Rehabilitation Inventory Survey. Eur J Cardiovasc Prev Rehabil. 1 de agosto de 2010;17(4):410-8.
31. Tjønna AE, Lee SJ, Rognmo Ø, Stølen TO, Bye A, Haram PM, et al. Aerobic interval training versus continuous moderate exercise as a treatment for the metabolic syndrome: a pilot study. Circulation. 22 de julio de 2008;118(4):346-54.
32. Carbone S, Kirkman DL, Garten RS, Rodriguez-Miguelez P, Artero EG, Lee D-C, et al. Muscular Strength and Cardiovascular Disease: AN UPDATED STATE-OF-THE-ART NARRATIVE REVIEW. J Cardiopulm Rehabil Prev. septiembre de 2020;40(5):302-9.
33. Stamatakis E, Lee I-M, Bennie J, Freeston J, Hamer M, O’Donovan G, et al. Does Strength-Promoting Exercise Confer Unique Health Benefits? A Pooled Analysis of Data on 11 Population Cohorts With All-Cause, Cancer, and Cardiovascular Mortality Endpoints. Am J Epidemiol. 1 de mayo de 2018;187(5):1102-12.
34. Giuliano C, Karahalios A, Neil C, Allen J, Levinger I. The effects of resistance training on muscle strength, quality of life and aerobic capacity in patients with chronic heart failure - A meta-analysis. Int J Cardiol. 15 de enero de 2017;227:413-23.
35. Hwang C-L, Chien C-L, Wu Y-T. Resistance training increases 6-minute walk distance in people with chronic heart failure: a systematic review. J Physiother. 1 de enero de 2010;56(2):87-96.
36. Corrà U, Agostoni PG, Anker SD, Coats AJS, Crespo Leiro MG, de Boer RA, et al. Role of cardiopulmonary exercise testing in clinical stratification in heart failure. A position paper from the Committee on Exercise Physiology and Training of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. enero de 2018;20(1):3-15.
37. Scherr J, Wolfarth B, Christle JW, Pressler A, Wagenpfeil S, Halle M. Associations between Borg’s rating of perceived exertion and physiological measures of exercise intensity. Eur J Appl Physiol. enero de 2013;113(1):147-55.
38. Wisløff U, Støylen A, Loennechen JP, Bruvold M, Rognmo Ø, Haram PM, et al. Superior cardiovascular effect of aerobic interval training versus moderate continuous training in heart failure patients: a randomized study. Circulation. 19 de junio de 2007;115(24):3086-94.
39. Ellingsen Ø, Halle M, Conraads V, Støylen A, Dalen H, Delagardelle C, et al. High-Intensity Interval Training in Patients With Heart Failure With Reduced Ejection Fraction. Circulation. 28 de febrero de 2017;135(9):839-49.
40. Benda NMM, Seeger JPH, Stevens GGCF, Hijmans-Kersten BTP, van Dijk APJ, Bellersen L, et al. Effects of High-Intensity Interval Training versus Continuous Training on Physical Fitness, Cardiovascular Function and Quality of Life in Heart Failure Patients. PloS One. 2015;10(10):e0141256.
41. Dimopoulos S, Anastasiou-Nana M, Sakellariou D, Drakos S, Kapsimalakou S, Maroulidis G, et al. Effects of exercise rehabilitation program on heart rate recovery in patients with chronic heart failure. Eur J Cardiovasc Prev Rehabil Off J Eur Soc Cardiol Work Groups Epidemiol Prev Card Rehabil Exerc Physiol. febrero de 2006;13(1):67-73.
42. Freyssin C, Verkindt C, Prieur F, Benaich P, Maunier S, Blanc P. Cardiac rehabilitation in chronic heart failure: effect of an 8-week, high-intensity interval training versus continuous training. Arch Phys Med Rehabil. agosto de 2012;93(8):1359-64.
43. Fu T-C, Wang C-H, Lin P-S, Hsu C-C, Cherng W-J, Huang S-C, et al. Aerobic interval training improves oxygen uptake efficiency by enhancing cerebral and muscular hemodynamics in patients with heart failure. Int J Cardiol. 15 de julio de 2013;167(1):41-50.
44. Koufaki P, Mercer TH, George KP, Nolan J. Low-volume high-intensity interval training vs continuous aerobic cycling in patients with chronic heart failure: a pragmatic randomised clinical trial of feasibility and effectiveness. J Rehabil Med. abril de 2014;46(4):348-56.
45. Roditis P, Dimopoulos S, Sakellariou D, Sarafoglou S, Kaldara E, Venetsanakos J, et al. The effects of exercise training on the kinetics of oxygen uptake in patients with chronic heart failure. Eur J Cardiovasc Prev Rehabil Off J Eur Soc Cardiol Work Groups Epidemiol Prev Card Rehabil Exerc Physiol. abril de 2007;14(2):304-11.
46. Smart NA, Steele M. A comparison of 16 weeks of continuous vs intermittent exercise training in chronic heart failure patients. Congest Heart Fail Greenwich Conn. agosto de 2012;18(4):205-11.
47. Ulbrich AZ, Angarten VG, Schmitt Netto A, Sties SW, Bündchen DC, Mara LS de, et al. Comparative effects of high intensity interval training versus moderate intensity continuous training on quality of life in patients with heart failure: Study protocol for a randomized controlled trial. Clin Trials Regul Sci Cardiol. 1 de enero de 2016;13:21-8.
48. Nechwatal RM, Duck C, Gruber G. Körperliches Training als Intervall- oder kontinuierliches Training bei chronischer Herzinsuffizienz zur Verbesserung der funktionellen Leistungskapazität, Hämodynamik und Lebensqualität – eine kontrollierte Studie. Z Für Kardiologie. 1 de abril de 2002;91(4):328-37.
49. Iellamo F, Manzi V, Caminiti G, Vitale C, Castagna C, Massaro M, et al. Matched dose interval and continuous exercise training induce similar cardiorespiratory and metabolic adaptations in patients with heart failure. Int J Cardiol. 10 de septiembre de 2013;167(6):2561-5.
50. Iellamo F, Caminiti G, Sposato B, Vitale C, Massaro M, Rosano G, et al. Effect of High-Intensity interval training versus moderate continuous training on 24-h blood pressure profile and insulin resistance in patients with chronic heart failure. Intern Emerg Med. agosto de 2014;9(5):547-52.
51. Ismail H, McFarlane JR, Nojoumian AH, Dieberg G, Smart NA. Clinical outcomes and cardiovascular responses to different exercise training intensities in patients with heart failure: a systematic review and meta-analysis. JACC Heart Fail. diciembre de 2013;1(6):514-22.
52. Haykowsky MJ, Timmons MP, Kruger C, McNeely M, Taylor DA, Clark AM. Meta-analysis of aerobic interval training on exercise capacity and systolic function in patients with heart failure and reduced ejection fractions. Am J Cardiol. 15 de mayo de 2013;111(10):1466-9.
53. Gomes Neto M, Durães AR, Conceição LSR, Saquetto MB, Ellingsen Ø, Carvalho VO. High intensity interval training versus moderate intensity continuous training on exercise capacity and quality of life in patients with heart failure with reduced ejection fraction: A systematic review and meta-analysis. Int J Cardiol. 15 de junio de 2018;261:134-41.
54. Mandic S, Tymchak W, Kim D, Daub B, Quinney HA, Taylor D, et al. Effects of aerobic or aerobic and resistance training on cardiorespiratory and skeletal muscle function in heart failure: a randomized controlled pilot trial. Clin Rehabil. marzo de 2009;23(3):207-16.
55. Degache F, Garet M, Calmels P, Costes F, Bathélémy J-C, Roche F. Enhancement of isokinetic muscle strength with a combined training programme in chronic heart failure. Clin Physiol Funct Imaging. 2007;27(4):225-30.
56. Beckers PJ, Denollet J, Possemiers NM, Wuyts FL, Vrints CJ, Conraads VM. Combined endurance-resistance training vs. endurance training in patients with chronic heart failure: a prospective randomized study. Eur Heart J. agosto de 2008;29(15):1858-66.
57. Vromen T, Kraal JJ, Kuiper J, Spee RF, Peek N, Kemps HM. The influence of training characteristics on the effect of aerobic exercise training in patients with chronic heart failure: A meta-regression analysis. Int J Cardiol. 1 de abril de 2016;208:120-7.
58. Groennebaek T, Vissing K. Impact of Resistance Training on Skeletal Muscle Mitochondrial Biogenesis, Content, and Function. Front Physiol. 2017;8:713.
59. Williams MA, Haskell WL, Ades PA, Amsterdam EA, Bittner V, Franklin BA, et al. Resistance exercise in individuals with and without cardiovascular disease: 2007 update: a scientific statement from the American Heart Association Council on Clinical Cardiology and Council on Nutrition, Physical Activity, and Metabolism. Circulation. 31 de julio de 2007;116(5):572-84.
60. Severinsen MCK, Pedersen BK. Muscle-Organ Crosstalk: The Emerging Roles of Myokines. Endocr Rev. 1 de agosto de 2020;41(4).
61. Ihalainen JK, Ahtiainen JP, Walker S, Paulsen G, Selänne H, Hämäläinen M, et al. Resistance training status modifies inflammatory response to explosive and hypertrophic resistance exercise bouts. J Physiol Biochem. noviembre de 2017;73(4):595-604.
62. Ribeiro AS, Deminice R, Schoenfeld BJ, Tomeleri CM, Padilha CS, Venturini D, et al. Effect of Resistance Training Systems on Oxidative Stress in Older Women. Int J Sport Nutr Exerc Metab. octubre de 2017;27(5):439-47.
63. Piccirillo R. Exercise-Induced Myokines With Therapeutic Potential for Muscle Wasting. Front Physiol. 2019;10:287.
64. Srikanthan P, Horwich TB, Tseng CH. Relation of Muscle Mass and Fat Mass to Cardiovascular Disease Mortality. Am J Cardiol. 15 de abril de 2016;117(8):1355-60.
65. Morley JE, Vellas B, van Kan GA, Anker SD, Bauer JM, Bernabei R, et al. Frailty consensus: a call to action. J Am Med Dir Assoc. junio de 2013;14(6):392-7.
66. Hunter GR, McCarthy JP, Bamman MM. Effects of resistance training on older adults. Sports Med Auckl NZ. 2004;34(5):329-48.
67. Conraads VM, Beckers PJ. Exercise training in heart failure: practical guidance. Heart Br Card Soc. diciembre de 2010;96(24):2025-31.
68. Eaton SB, Eaton SB. Physical Inactivity, Obesity, and Type 2 Diabetes: An Evolutionary Perspective. Res Q Exerc Sport. marzo de 2017;88(1):1-8
