REVISIÓN
Tratamiento antitrombótico en pacientes con fibrilación auricular tras intervención coronaria percutánea, un equilibrio difícil de conseguir
Antithrombotic treatment in patients with atrial fibrillation after percutaneous coronary intervention, a difficult balance to achieve
Marta Arrufat Sánchez1, Miguel Corbír Pascual1, Carlos Lafuente Gormaz1, Pablo Yago Gimenez2, Pedro J. Tarraga López1
1 Facultad de Medicina de Castilla la Mancha. España
2 Médico Residente Hospital General Universitario Virgen de la Arrixaca. Murcia. España
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Resumen
La combinación de tratamiento antitrombótico (anticoagulante/antiagregante) que deben llevar aquellos pacientes con FA que sufren un SCA y/o deben someterse a ICP no está claro. La asociación de anticoagulación oral con un inhibidor de P2Y 12 y aspirina, lo que se denomina triple terapia antitrombótica (TAT) asocia un elevado riesgo de hemorragia. Por otro lado, la terapia antitrombótica dual (DAT) sin aspirina conlleva un riesgo todavía desconocido de eventos isquémicos.(1) El tratamiento debe equilibrar el riesgo isquémico y hemorrágico alcanzando un beneficio clínico neto óptimo. El objetivo de esta revisión es establecer unas pautas más claras de tratamiento en estos pacientes. Analizamos 2 estudios observacionales previos para sentar el punto de partida y 5 ECA que incluían un total de 11532 pacientes. En ellos se comparó la DAT vs. TAT, en pacientes con FA que sufren un SCA y/o son sometidos a ICP.
La DAT asoció menor tasa de sangrados frente a la TAT sin aumentar los eventos isquémicos. Sin embargo, ningún ensayo consiguió la suficiente potencia estadística para evaluar de forma consistente los resultados isquémicos de eficacia. De las distintas terapias, mostraron mejores resultados de eficacia aquellas que emplearon DAT frente a TAT y ACOD frente a AVK. Conclusión: En pacientes con FA que sufren un SCA y/o deben someterse a ICP, el régimen de DAT asocia menos eventos hemorrágicos, sin diferencias significativas en cuanto a eventos isquémicos; El uso de ACOD muestra un mejor perfil de beneficio frente a los AVK, por lo que son de preferencia.
Palabras clave
TRATAMIENTO ANTITROMBÓTICO; FIBRILACIÓN AURICULAR; INTERVENCIÓN CORONARIA PERCUTÁNEA
Abstract
The combination of antithrombotic treatment (anticoagulant / antiplatelet) that those who
AF patients who have ACS and / or must undergo PCI is unclear. The association of
oral anticoagulation with a P2Y 12 inhibitor and aspirin, called triple antithrombotic therapy
(TAT) is associated with a high risk of bleeding. On the other hand, dual antithrombotic therapy (DAT) without
Aspirin carries a still unknown risk of ischemic events. (1) Treatment must balance the
ischemic and hemorrhagic risk reaching an optimal net clinical benefit. The purpose of this review
is to establish clearer treatment guidelines in these patients. We analyzed 2 previous observational studies to establish the starting point and 5 RCTs that included a total of 11,532 patients.
In them, DAT vs. TAT, in patients with AF who suffer from ACS and / or undergo PCI.
DAT was associated with a lower rate of bleeding compared to TAT without increasing ischemic events. Without
However, no trial achieved sufficient statistical power to consistently assess the
ischemic efficacy results. Of the different therapies, they showed better efficacy results
those that used DAT versus TAT and ACOD versus VKA. Conclusion: In patients with AF who
suffer an ACS and / or must undergo PCI, the DAT regimen associates fewer bleeding events, without
significant differences regarding ischemic events; The use of ACOD shows a better profile of
benefit versus AVK, so they are preferred.
Keywords
antithrombotic treatment; atrial fibrillation; coronary intervention percutaneous
Introducción
La cardiopatía isquémica y la fibrilación auricular (FA) son dos patologías muy prevalentes en la población. Con frecuencia, ambas patologías coinciden en un mismo paciente (la FA se presenta entre un 2-23% de los pacientes con síndrome coronario agudo (SCA) y el riesgo de aparición de FA se eleva en un 60 - 77% en pacientes con infarto de miocardio (IM)). El tratamiento de la FA se basa en la prevención de eventos tromboembólicos mediante la anticoagulación. A su vez, los pacientes con cardiopatía isquémica deben recibir tratamiento antiagregante. Entre un 10-15% de los pacientes con FA se someten en algún momento a ICP, procedimiento tras el cual las guías de práctica clínica actuales recomiendan doble terapia antiagregante. En aquellos pacientes en los que coinciden ambas patologías, será necesario optimizar ambos tratamientos, anticoagulación y antiagregación, equilibrando el riesgo trombótico y el hemorrágico.(2)
Fibrilación auricular
La fibrilación auricular se caracteriza por activación auricular desorganizada, rápida e irregular, con pérdida de la contracción auricular y con una frecuencia ventricular irregular que está determinada por la conducción del nódulo auriculoventricular (3).
A nivel mundial, la fibrilación auricular es la arritmia cardiaca sostenida más frecuente y es un grave problema de salud pública(3,4). Es, además, la arritmia más frecuente con repercusión clínica y la que genera mayor número de consultas a los servicios de urgencias, así como más días de ingreso hospitalario(5), por lo que representa una enorme carga para la sanidad pública que genera un elevado gasto sanitario tanto directo como indirecto. Se asocia a un deterioro de la clase funcional, un incremento de la morbilidad (especialmente ictus, siendo la FA su etiología hasta en el 30%, e insuficiencia cardiaca) así como a un incremento de mortalidad.
En torno al 1-2% de la población general (probablemente más cercano al 2% debido al posible retraso en el diagnóstico -FA asintomática-) padece esta patología y se prevé que la prevalencia se doble en los próximos 50 años. Como causas de este marcado incremento podemos mencionar la mayor de la esperanza de vida, envejecimiento de la población, mejoras en el diagnóstico y tratamiento de las enfermedades cardiovasculares, el aumento de los factores de riesgo relacionados con FA, etc. (5,6)
Clínica y diagnóstico
La clínica varía desde pacientes asintomáticos hasta palpitaciones, síncopes, mareos, disnea, dolor torácico, deterioro hemodinámico o exacerbaciones de su patología de base.
Para realizar el diagnóstico de FA es necesario un electrocardiograma. El patrón típico de esta arritmia se caracteriza por la ausencia de ondas P e intervalos irregulares de los RR (6). Para hacer una correcta evaluación diagnósticas de los pacientes con FA, debemos incluir: historia médica completa, evaluación de las condiciones concomitantes, patrón de FA, riesgo de accidente cerebrovascular (ACV) y síntomas relacionados con la FA, tromboembolia y disfunción del ventrículo izquierdo (VI). (2)
Cálculo del riesgo embólico y hemorrágico
La terapia anticoagulante ha demostrado de forma consistente reducir significativamente los eventos embólicos y la mortalidad en pacientes con FA. Pero el riesgo no es homogéneo en todos los pacientes con FA.
Existen factores de riesgo conocidos que predisponen a la aparición de tromboembolismos. La escala de riesgo CHA2DS2-VASc combina estos factores (Tabla 1) y es la actualmente recomendada por las guías de práctica clínica para estratificar el riesgo tromboembólico (Tabla 2) con el objetivo inicial de identificar aquellos pacientes candidatos a iniciar terapia anticoagulante.
Tabla 1. Escala de riesgo tromboembólico CHA2DS2-VASc
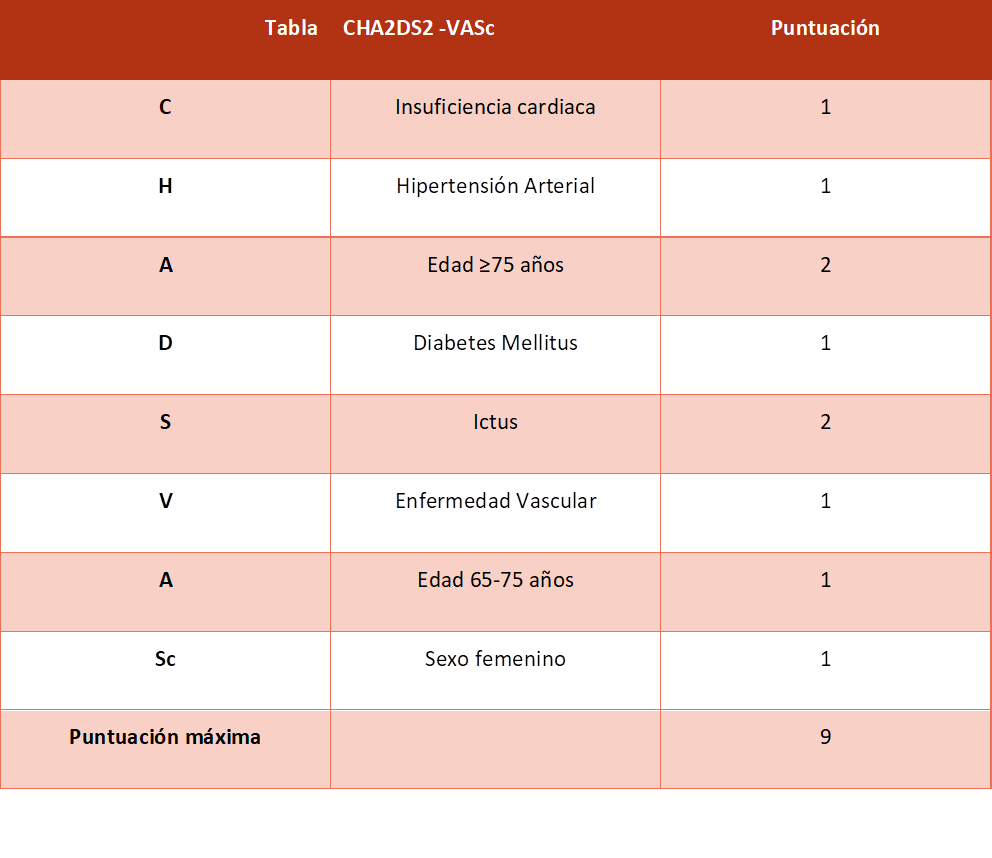
Tabla 2. Porcentaje de riesgo de ictus en función de la puntuación de las escalas CHADS2 y CHA2DS2 -VASc (7,8)
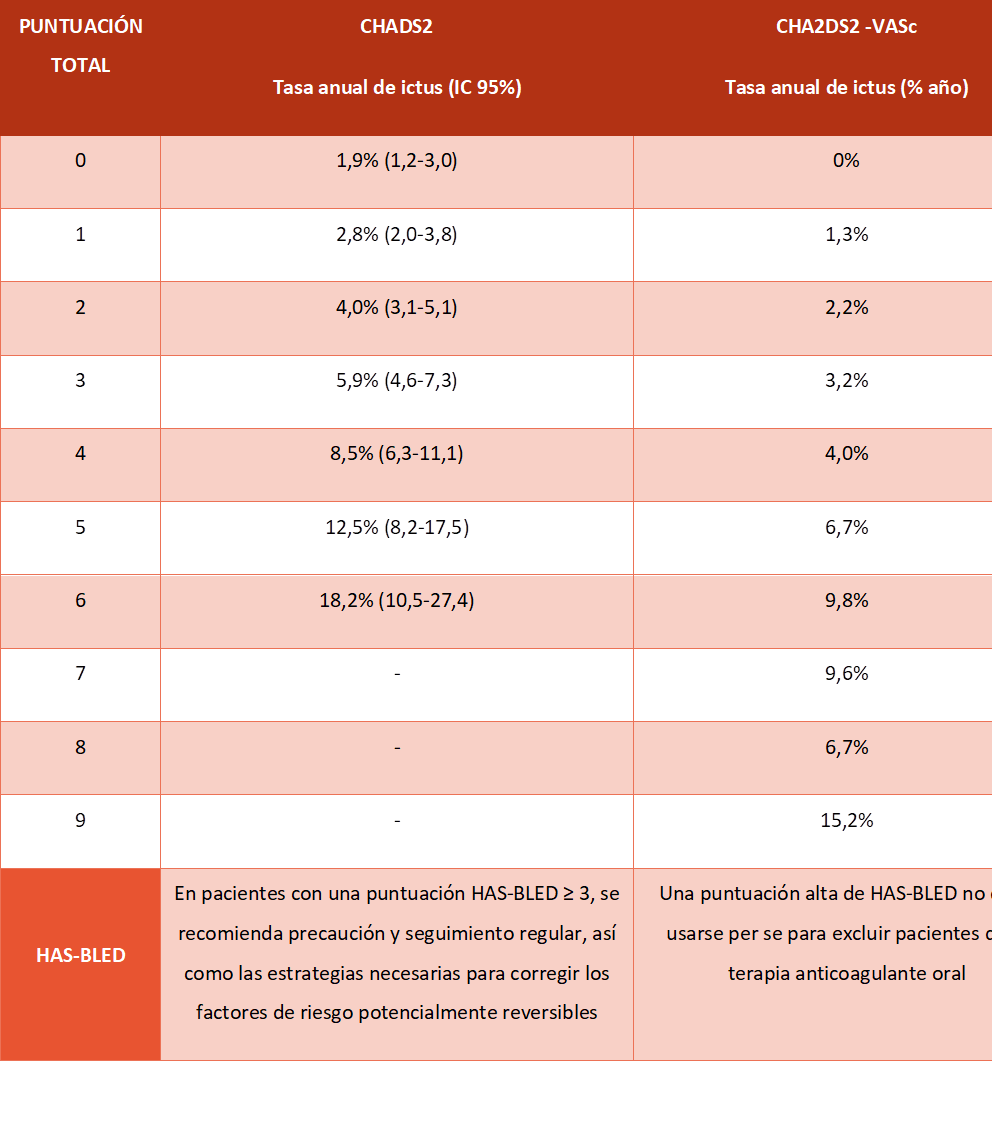
Las guías europeas(2) recomiendan el uso del esquema CHA2DS2-VASc como método de evaluación del riesgo embólico en pacientes con FA no valvular (recomendación Clase I nivel de evidencia B).
Se recomienda tratamiento con anticoagulantes orales (ACO) en aquellos pacientes con FA con puntuación CHA2DS2-VASc > 2 en hombres o > 3 en mujeres (clase I A); debiendo considerarlo en pacientes con FA con un CHA2DS2-VASc de 1 en hombres o 2 en mujeres (clase IIa B), pero siempre individualizando el tratamiento según el beneficio clínico neto y la consideración de los valores y preferencias del paciente (clase IIa B). (2)
Tabla 3. Escala HAS-BLED(2)
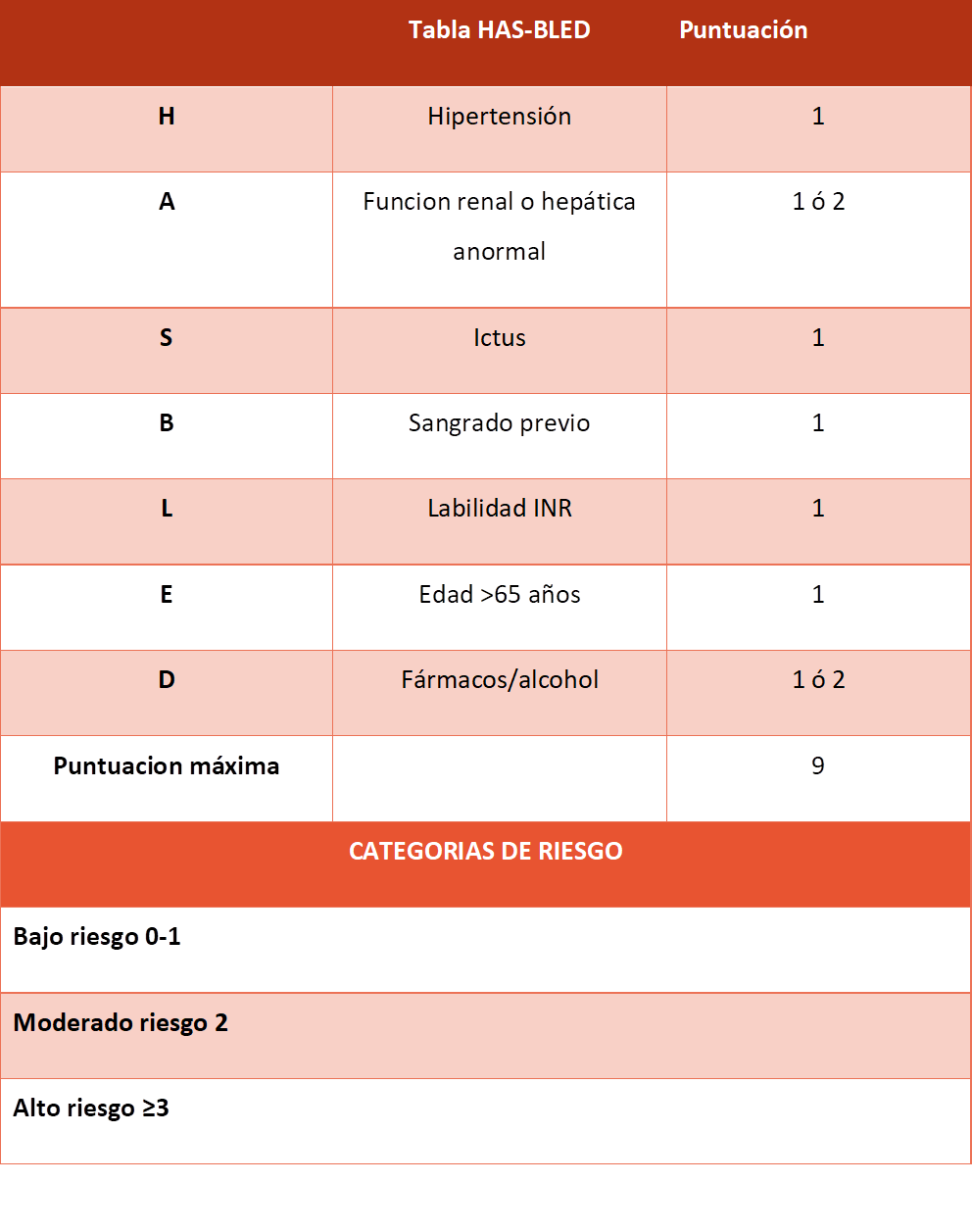
Es muy importante tener en cuenta que el tratamiento con ACO viene acompañado inherentemente de un incremento del riesgo de hemorrágico. Se han identificado una serie de factores de riesgo que favorecen el sangrado, a partir de los cuales se han desarrollado escalas como la escala HAS-BLED, que evalúan el riesgo hemorrágico (Tabla 3).
La escala HAS-BLED es válida para predecir riesgo de sangrado con anticoagulantes directos y el riesgo hemorrágico durante la terapia puente e intervencionismo coronario percutáneo. (6)
Las guías europeas recomiendan esta escala para una evaluación formal del riesgo de hemorragia (clase IIa B). (2) En ningún caso se utiliza esta escala para contraindicar la anticoagulación oral per se sino más bien para incidir en aquellos factores que se podrían modificar para reducir el riesgo hemorrágico.
Fármacos anticoagulantes
Antivitamina K (AVK): warfarina y acenocumarol. Intervienen en la síntesis de proteínas de la coagulación dependientes de la vitamina K (los factores de la coagulación II, VII, IX y X), así como en los factores reguladores de las proteínas C, S y Z. Su efecto antitrombótico es tardío y varía dependiendo de multitud de factores: factores genéticos, dieta, fármacos y diversos estados patológicos. Tienen una estrecha ventana terapéutica, por lo que es fundamental vigilar la coagulación para asegurar una respuesta terapéutica, además presenta una semivida prolongada con un inicio y fin de acción lentos. Esta vigilancia se realiza a través de los valores de índice internacional normalizado (INR). Sin embargo, hay que resaltar que estas mediciones presentan todavía importantes problemas que implican una variabilidad no desdeñable en la precisión de los resultados del INR. El principal efecto adverso es la hemorragia.
Anticoagulantes de acción directa (ACOD).
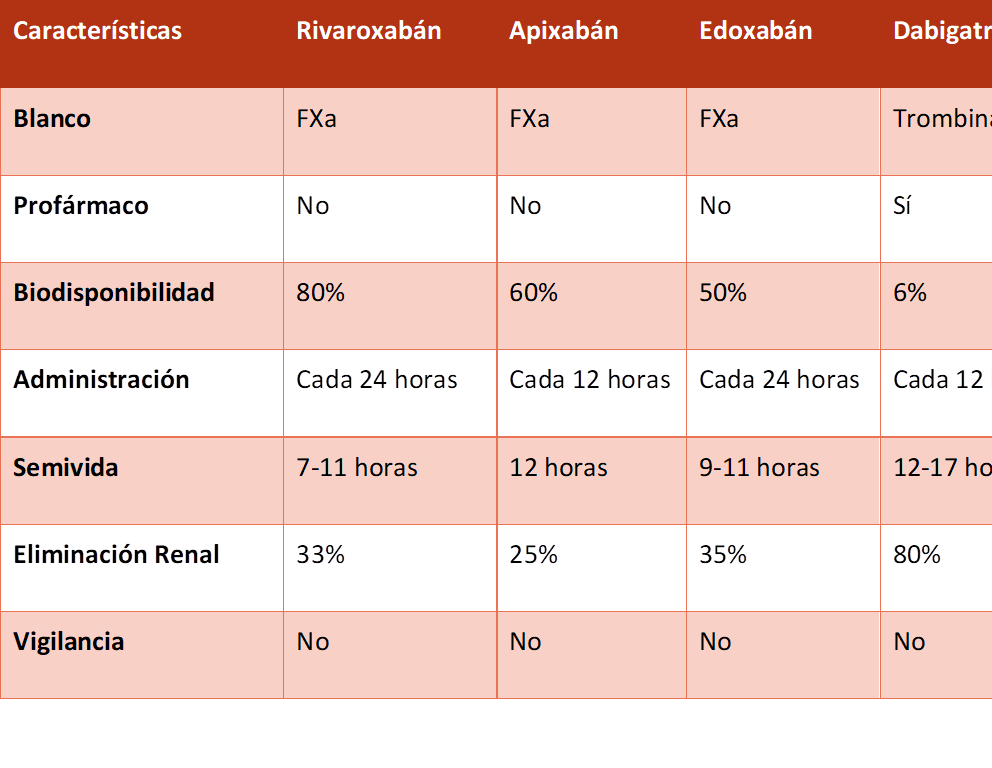
Representan una alternativa a los AVK. Se incluyen dabigatrán (inhibidor competitivo, selectivo, reversible y potente de la trombina), apixabán, rivaroxabán y edoxabán (los tres son inhibidores directos, selectivos y reversibles del factor Xa de la coagulación). Ventajas sobre los AVK: todos presentan inicio y fin de acción rápidos. Producen un nivel predecible de anticoagulación, con menos interacciones farmacológicas, y pueden administrarse en dosis fijas sin necesidad de vigilancia obligada de la coagulación. La Tabla 4 resume las distintas propiedades farmacológicas de estos compuestos.(3)
Actualmente dabigatrán es el único que posee antídoto comercializado: Idarucizumab, mientras que para los inhibidores del factor Xa se encuentra en fase de investigación: andexanet alfa.
Tabla 4. Comparación de las propiedades farmacológicas de los nuevos anticoagulantes orales. Fuente: Harrison. Principios de Medicina Interna.(3)
ACOD VS AVK
Los ACOD han demostrado en sus estudios pivotales ser al menos tan eficaces en la reducción del riesgo de ictus y embolismo sistémico (y en algunos casos asociaron disminuciones significativas de ACV, hemorragia intracraneal y mortalidad por todas las causas) en comparación con Warfarina, con un perfil de seguridad favorable (en algunos casos más seguros al presentar menos hemorragias mayores)(9-13) en comparación con los AVK en pacientes con FA no valvular.
El estudio RE-LY(10) fue un ensayo clínico aleatorizado que comparó dabigatrán vs Warfarina; el estudio ROCKET AF(11), rivaroxabán vs warfarina; el estudio ARISTOTLE)12), apixabán vs warfarina y el estudio ENGAGE AF-TIMI(13) edoxabán vs Warfarina.
Sindrome coronario agudo
El SCA es una causa muy importante de morbimortalidad en los países desarrollados y es causa de un importante gasto sanitario.(3)
Sin extendernos en la fisiopatología del SCA, pues no es el fin de este documento, podemos decir muy sucintamente que se produce por un desequilibrio entre el aporte y la demanda de oxígeno por el miocardio siendo la causa más frecuente la aterosclerosis coronaria.
La cardiopatía isquémica tiene diferentes formas de presentación, entre ellas el SCA. Esta entidad incluye: la angina inestable, el infarto agudo de miocardio (IAM) con o sin elevación del ST y la muerte súbita.
En España, según el Instituto Nacional de Estadística, en 2018 hubo 14.521 defunciones por IAM y 31.152 defunciones por cualquier cardiopatía isquémica, lo que supone un 7,28 % del total de defunciones de ese año.(14)
Diagnóstico y manejo inicial
El diagnóstico inicial es clínico. La forma de presentación más frecuente consiste en dolor torácico retroesternal de características opresivas con posible irradiación a brazo izquierdo, mandíbula o región interescapular, de duración variable y que clásicamente mejora con la administración de nitratos.
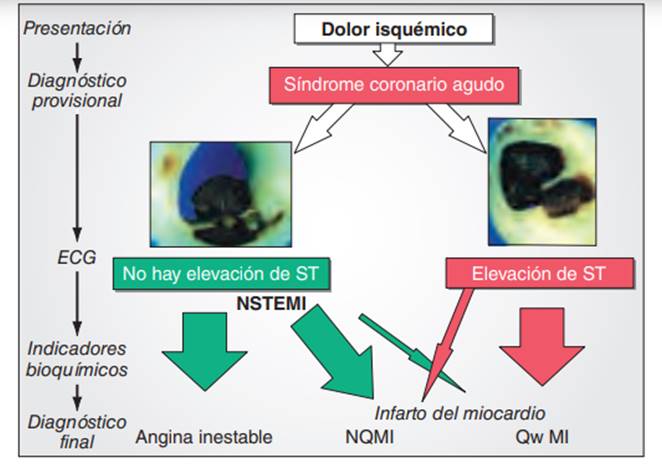
Figura 1. Algoritmo diagnóstico SCA. Fuente: Harrison. Principios de Medicina Interna.(3)
Tras el diagnóstico provisional clínico se realiza un electrocardiograma (ECG) que nos permitirá diferenciar dos entidades: el SCA sin elevación del ST (SCASEST) en el cual se estratificará el riesgo atendiendo a las características clínicas, analíticas y electrocardiográficas; y en base a eso, se llevará a cabo el intervencionismo coronario percutáneo (ICP) con implante de stent si lo precisa. Y el SCA con elevación de ST (SCACEST), donde se presupone la oclusión completa de una arteria por lo que se debe realizar terapia de reperfusión urgente bien farmacológica (fibrinolisis) o bien mecánica (actualmente es la estrategia de elección) mediante una coronariografía urgente seguida de revascularización coronaria con implante de stent en la mayoría de los casos.(15)
Tratamientos antitrombóticos en ICP
Los pacientes con enfermedad coronaria que van a ser sometidos a revascularización miocárdica deben recibir tratamiento antitrombótico.
Debemos tener en cuenta las características del paciente, sus comorbilidades, el contexto clínico (ICP electiva frente a SCA) y la modalidad de revascularización a la hora de elegir el tratamiento, la combinación, cuándo iniciarlo y la duración de este.
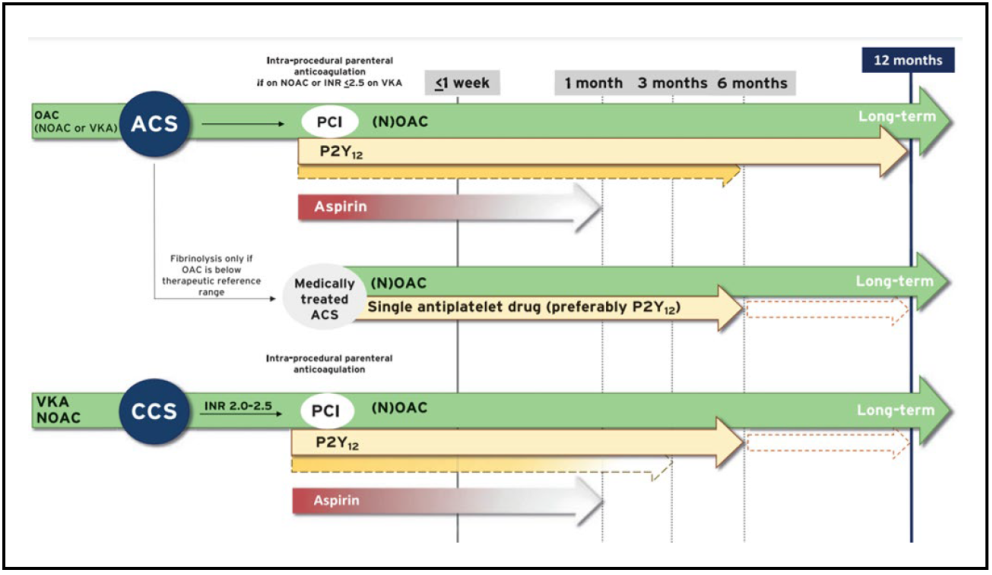
En aquellos pacientes que van a someterse a una ICP, ya sea un paciente con enfermedad coronaria estable (ICP electiva) o paciente con SCASEST o SCACEST, el tratamiento previo de elección según las guías de revascularización miocárdica(15) es tratamiento antiagregante plaquetario doble (TAPD) con ácido acetilsalicílico (AAS) y un inhibidor de los receptores del P2Y12.
En paralelo al tratamiento antiagregante, se usarán anticoagulantes durante el procedimiento de ICP. Dichos fármacos deben suspenderse tras el ICP, salvo en casos clínicos específicos, como la FA, y el trombo en el VI que requieren anticoagulación y otros motivos como portadores de prótesis valvulares mecánicas o necesidad de anticoagulación no cardiológicas como trombosis venosa profunda o tromboembolismo pulmonar.
Después del ICP se recomienda el TAPD con un inhibidor del receptor P2Y12 y AAS generalmente durante 6 meses en paciente con enfermedad coronaria estable y durante 12 meses en pacientes con SCASEST o SCACEST, manteniéndose posteriormente antiagregación simple de forma indefinida habitualmente con AAS.(15)
Fármacos antiagregantes
Ácido acetilsalicílico. Inhibidor irreversible de la ciclooxigenasa plaquetaria COX-1. Se trata del fármaco antiagregante más utilizado. Es económico y eficaz. A dosis elevadas (casi 1 g/día), el ácido acetilsalicílico también inhibe la COX-2, impidiendo la síntesis de tromboxano A2.(3)
Tienopiridinas (Clopidogrel y Prasugrel). Bloquea de forma no competitiva e irreversible la P2Y12 (receptor clave para la ADO en la plaqueta), inhibiendo de forma selectiva la agregación plaquetaria inducida por ADP. Son profármacos que requieren activación enzimática por el citocromo P450. El prasugrel es más potente que el clopidogrel y su inicio de acción es más rápido, pero con mayor tasa de sangrados.(3)
Ticagrelor. Es antagonista del receptor ADP y actúa inhibiendo P2Y12. Activo vía oral. A diferencia de los dos anteriores, no requiere activación y produce inhibición reversible del receptor para ADP. Presenta un inicio y final de acción más rápidos que clopidogrel. Su efecto sobre la inhibición de la agregación plaquetaria es más predecible que con el clopidogrel. (3)
Los mecanismos de acción de los fármacos antiagregantes se muestran en la Figura 2.
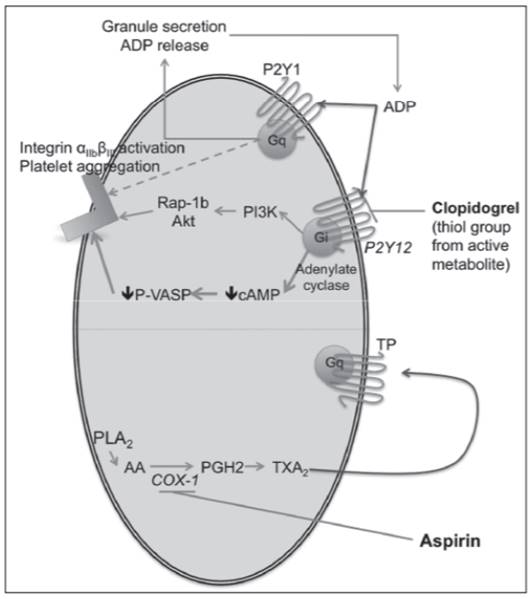
Figura 2. Mecanismo de acción de los fármacos antiagregantes.
La AAS actúa inhibiendo la enzima COX de forma irreversible, impide así la síntesis de prostaglandinas implicadas en la activación plaquetaria. Clopidogrel, Prasugrel y Ticagrelor inhiben el receptor P2Y12 del ADP, el cual está implicado en la activación y agregación plaquetaria. Fuente: Le Quellec S et al.(16)
Situaciones especiales: manejo antitrombótico cuando ambas enfermedades coinciden
La FA es un factor de riesgo de SCA y viceversa. Alrededor del 10% de los pacientes con FA se someten a ICP.(17)
Los ACO son necesarios como prevención de eventos tromboembólicos relacionados con la FA y la terapia antiplaquetaria es crucial para reducir los eventos isquémicos como el infarto miocardio o trombosis del stent (TS) en pacientes con SCA reciente o ICP. (3)
Sin embargo, la combinación de antitrombótico (anticoagulante/antiagregante) que deben llevar aquellos pacientes con FA que sufren un SCA y/o deben someterse a ICP no está claro, ya que la asociación de anticoagulación oral con un inhibidor de P2Y12 y aspirina, lo que se denomina triple terapia antitrombótica (TAT) en pacientes con FA que se han realizado ICP asocia un elevado riesgo de hemorragia. Por otro lado, la terapia antitrombótica dual (DAT) sin aspirina conlleva un riesgo todavía desconocido de eventos isquémicos.(1)
Objetivo estudio
Dado que el tratamiento de aquellos pacientes con FA y SCA o que deben someterse a ICP sigue sin estar bien establecido, nuestro objetivo es establecer si la DAT es la mejor pauta de tratamiento para estos pacientes. Por ello, realizamos una búsqueda sistemática de la literatura científica, analizando aquellos estudios que enfrenten DAT vs TAT.
Material y métodos
Se realizó una búsqueda sistemática de aquellos estudios que investigaran la estrategia antitrombótica en pacientes con FA, SCA y/o ICP.
Para ello, se buscó en las bases de datos Web Of Science (WOS) y Scopus estudios publicados en los últimos 5 años. En esta revisión se aplicaron los criterios de presentación de informes PRISMA(18). La búsqueda se inició el 20 de septiembre del 2020 y finalizó el 28 de febrero de 2021. No hubo restricción de idioma.
Se utilizaron las siguientes palabras clave en distintas combinaciones: atrial fibrillation, acute coronary síndromes, dual therapy, triple therapy y dual antiplatelet therapy.
Después se llevó a cabo una búsqueda manual de fuentes secundarias incluyendo referencias de artículos, revisiones, metaanálisis, páginas web inicialmente identificados. También se hizo una lectura de los metaanálisis más recientes y sus referencias para minimizar la falta de estudios relevantes.
Criterios de exclusión. Se hizo un cribado inicial en base a la lectura del título y resumen, descartando aquellos estudios que trataban de temas diferentes al interesado, estudios realizados en animales y artículos publicados en revistas inferiores al cuartil Q2.
Tras esto aplicamos los criterios de elegibilidad: ensayos clínicos aleatorizados en paciente con fibrilación auricular y síndrome coronario agudo y/o que deban someterse a intervención coronaria percutánea, cuartil mínimo Q2 y al menos dos brazos de tratamiento y que enfrentara DAT frente a TAT.
Después de todo esto, quedaron los 15 estudios (Figura 3), en los que se basa esta revisión.
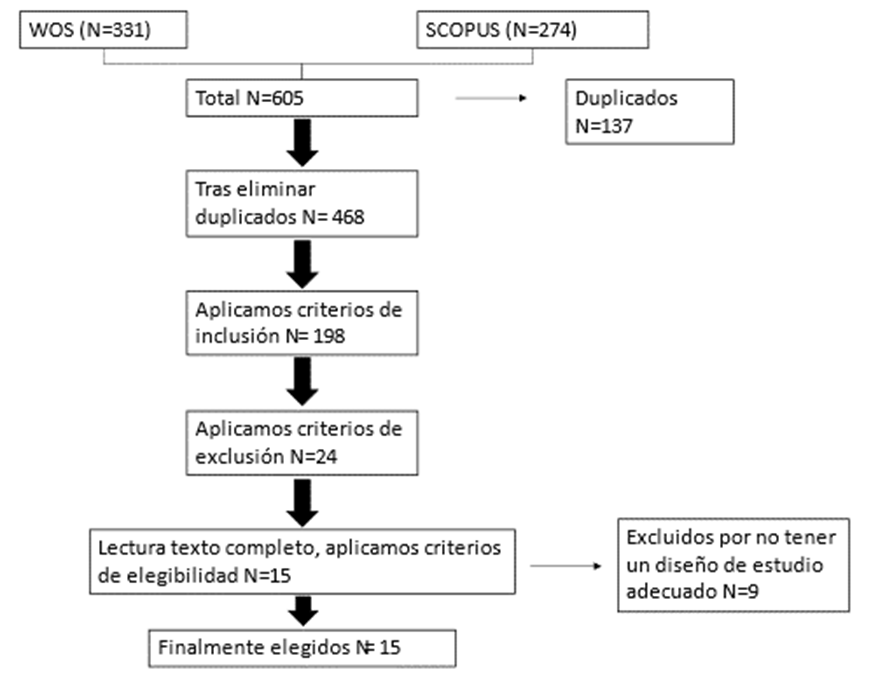
Figura 3. Diagrama de flujo del proceso de selección de ensayos clínicos.
Resultados
Estudios observacionales
Los primeros estudios publicados que comprararon la DAT con la TAT fueron observacionales, entre los que encontramos el estudio LAMBERTS Y D´ASCENZO.
El estudio LAMBERTS et al.(19) es un estudio prospectivo y observacional cuyo objetivo fue evaluar el beneficio y la seguridad de múltiples fármacos antitrombóticos en pacientes con FA después de IM o ICP (Tabla 5). Se incluyeron un total de 12.165 pacientes cuya edad media fue de 75,6 años. El seguimiento fue de un año.
Se estudiaron cuatro regímenes de terapia antitrombótica: AAS + clopidogrel; ACO + AAS; ACO + clopidogrel; y ACO + AAS más clopidogrel (TAT). Los ACO utilizados fueron warfarina y fenprocumón (ambos AVK).
El resultado principal de seguridad fue la combinación de hemorragia mortal o no mortal, mientras que los resultados de eficacia fueron definidos como IM o muerte coronaria, ACV isquémico mortal o no mortal y mortalidad por todas las causas.
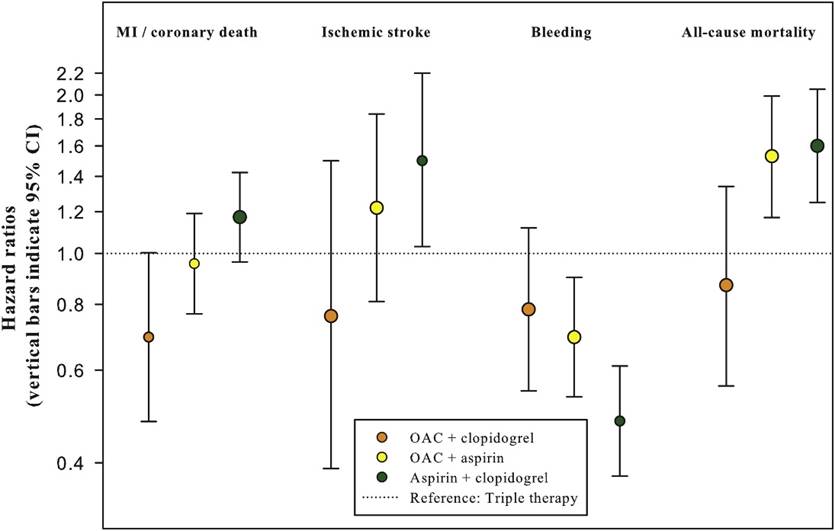
Figura 4. criterios de valoración de seguridad y eficacia con terapia triple versus terapias duales.(19)
La terapia triple (ACO+ AAS+ más clopidogrel [línea punteada]) se utiliza como referencia (razón de riesgo = 1,00). Los puntos naranjas indican ACO + clopidogrel; los amarillos indican ACO + AAS; los verdes indican AAS + clopidogrel. MI = infarto de miocardio, ACO= anticoagulante oral, AAS= aspirina
En comparación con la TAT, el riesgo de sangrado fue no significativamente menor para ACO + clopidogrel (Hazard ratio (HR) 0,78, intervalo de confianza (IC) 95%: 0,55-1,12). Sin embargo, sí fue significativamente menor para ACO + AAS (HR: 0,69, IC 95%: 0,53-0,90) y clopidogrel + AAS (HR: 0,48, IC 95%: 0,38-0,61) (Figura 4).
Para el resultado principal de eficacia, en términos de IM o muerte coronaria, se apreció un mayor beneficio de la terapia basada en ACO + clopidogrel vs TAT, pero éste no fue significativo (HR: 0,69, IC 95%: 0,48-1,00). El resto de los regímenes fueron comparables a la TAT. Para el ACV isquémico, sólo el tratamiento basado en clopidogrel + AAS mostró un mayor riesgo frente a la TAT (HR 1.50, IC 95%: 1.03-2.20). El riesgo de muerte por todas las causas fue significativamente mayor con el tratamiento de ACO + AAS y clopidogrel + AAS en comparación con la TAT (HR 1,52, IC 95%: 1,17 - 1,99; HR 1,60, IC 95%: 1,25 - 2,05, respectivamente). No fue así para el régimen ACO + clopidogrel (HR 0,87, IC 95%: 0,56 - 1,34).
La combinación que presenta mayor beneficio neto (balancea el riesgo hemorrágico y riesgo isquémico) sería la combinación de AVK + clopidogrel, pues como vemos en la figura es la única que en los cuatro ítems evaluados se encuentra por debajo de la línea de referencia. Ninguna de las ramas de tratamiento, fue estadísticamente significativa en términos de eficacia.
El estudio D'ASCENZO et al.(20) es un metaanálisis que incluye 2 ECA (ensayos controlados aleatorizados) y 13 estudios observacionales cuyo objetivo fue evaluar los resultados clínicos de DAT (ACO + clopidogrel) o DAPT (doble terapia antiagregante, basada en clopidogrel + AAS) frente a TAT (ACO + clopidogrel + AAS) en pacientes sometidos a ICP (Tabla 5).
El criterio de valoración principal de seguridad fue hemorragia mayor, mientras que el criterio secundario fue la combinación de muerte por todas las causas, IM, trombosis del stent (TS) y ACV. Se incluyeron un total de 7.182 pacientes. En todos los estudios, los pacientes asumieron DAPT o clopidogrel solo durante 12 meses. La dosis de AAS fue de 100 mg en la mayoría de ellos. El seguimiento fue de 1 año.
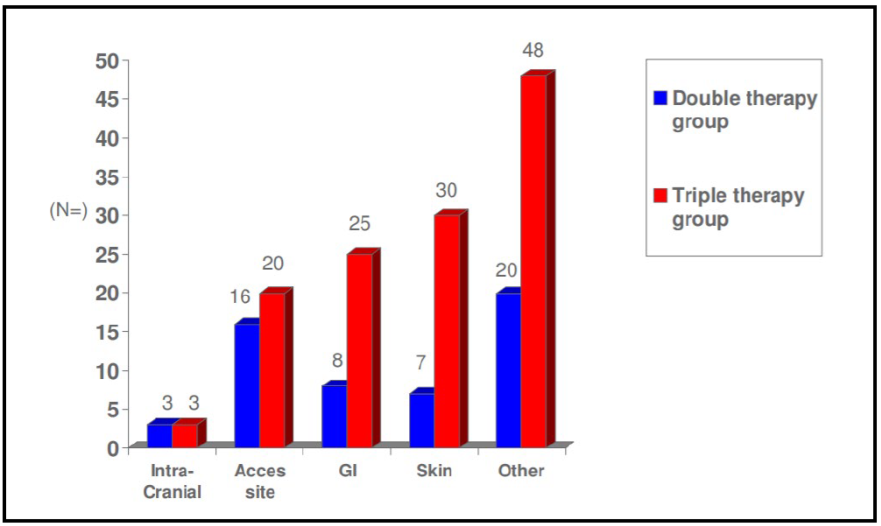
Se observaron hemorragias mayores en 3,5% de los pacientes con DAT frente al 5,5% de los pacientes del grupo de TAT (Figura 5).
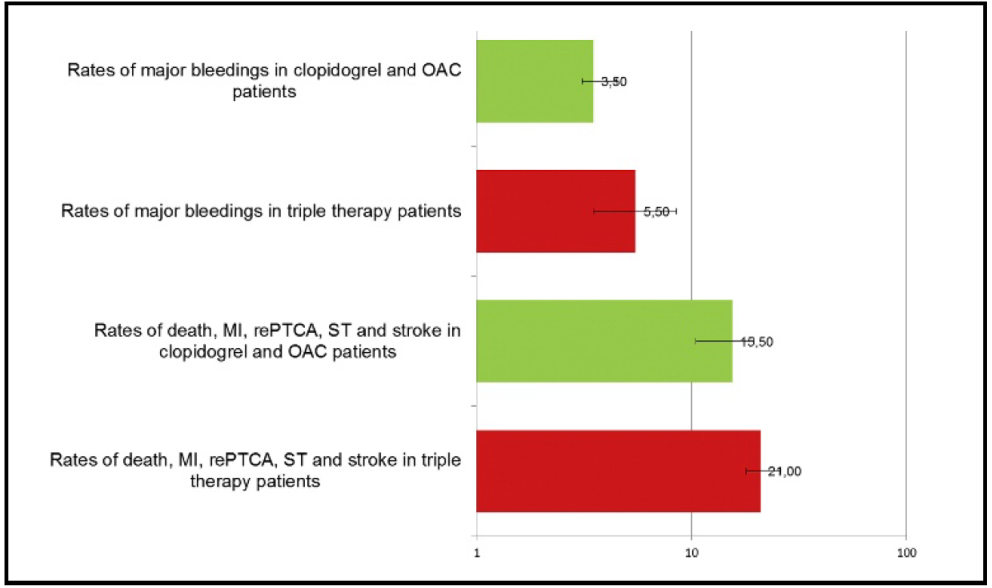
Figura 5. Tasas de criterios de valoración primarios y secundarios para los pacientes que reciben clopidogrel y OAC y TT al año. Las variables se informan como porcentajes(20). OAC: anticoagulantes orales, ST: trombosis del stent, MI: infarto de miocardio, re-ICP
El análisis agrupado indicó que DAT redujo significativamente el riesgo de hemorragia (OR 0,77; IC del 95%: 0,59 a 0,99), sin cambios en las tasas de muerte, IAM, ACV y TS (OR 0,90; IC del 95%: 0,70 a 1,17) incluso al incluir datos clínicos de ECA o ensayos de análisis multivariado (Figura 6 y Figura 7).
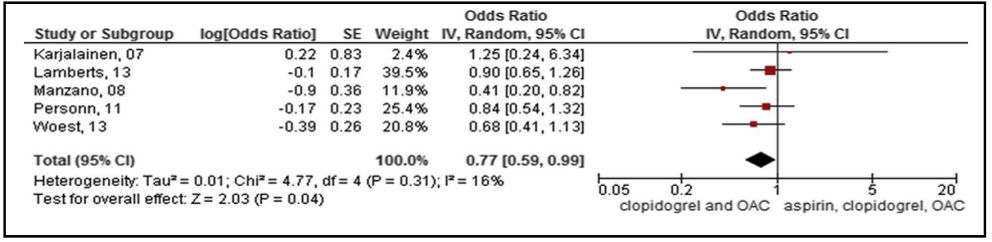
Figura 6. Análisis agrupado del riesgo de hemorragia en todos los estudios(20).
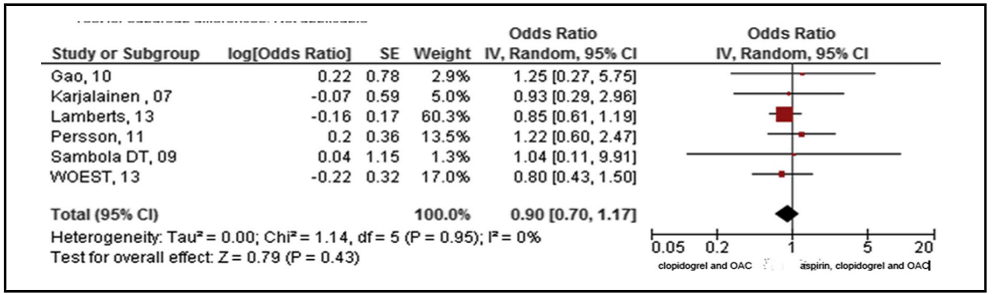
Figura 7. Análisis agrupado del riesgo de muerte, infarto de miocardio, ictus y trombosis del stent para todos los estudios(20).
Tabla 5. Principales características de ensayo LAMBERTS y D'ASCENZO
|
|
LAMBERTS(19) |
D'ASCENZO(20) |
|
Tipo de estudio |
Prospectivo y observacional |
Metaanálisis (2 ECA y 13 estudios observacionales) |
|
Objetivo |
Evaluar el beneficio y la seguridad de múltiples fármacos antitrombóticos |
Evaluar los resultados clínicos de DAT o DAPT frente a TAT |
|
Pacientes, n |
12.165 |
7.182 |
|
Población |
FA + IM +/- ICP |
ACO + ICP |
|
Motivo ACO |
FA |
FA (90%), VM, TVP/EP |
|
Comparación tratamiento |
VKA + clopidogrel vs VKA + AAS + clopidogrel |
ACO + clopidogrel vs ACO + clopidogrel + AAS |
|
Seguimiento |
12 meses |
12 meses |
|
Resultado principal de seguridad |
Hemorragia mortal o no mortal HR: 0,78 (IC 95%: 0,55-1,12) |
Hemorragia mayor HR 0,77 (IC 95%: 0,59-0,99) |
|
Resultado principal de eficacia |
Combinación de IM, muerte coronaria, ACV isquémico y mortalidad por todas las causas HR: 0,69 (IC 95%: 0,48-1,00) |
Combinación de lM, muerte por todas las causas, ST y ACV HR 0,90 (IC 95%: 0,70-1,17) |
FA fibrilación auricular, IM infarto de miocardio, ACV accidente cerebrovascular, AIT accidente isquémico transitorio, TEP tromboembolismo pulmonar, TVP trombosis venosa profunda, EP embolismo pulmonar, ST trombosis del Stent, VM válvula mecánica, ICP intervención coronaria percutánea, AVK antagonista dependiente de vitamina K, AAS aspirina, ACO anticoagulación oral, DAPT doble terapia antiagregante, DAT doble terapia antitrombótica, TAT triple terapia antitrombótica, tto tratamiento, HR Hazard Ratio, IC intervalo de confianza
Estudios aleatorizados con AVK
A los estudios observacionales, le siguieron los ensayos clínicos aleatorizados, con el objetivo de contrastar los datos encontrados hasta el momento, con un mayor nivel de evidencia.
El estudio ISAR-TRIPLE(21) se trata de un ensayo aleatorizado y abierto. Su objetivo fue valorar la seguridad del tratamiento con clopidogrel durante 6 semanas frente a 6 meses, tras la implantación de un stent liberador de fármacos (SLF) en paciente en tratamiento con ACO y AAS concomitante. Para ingresar en el ensayo, los pacientes tenían que haber recibido ACO durante mínimo 12 meses. Se excluyeron los pacientes menores de 18 años, TS previa, implante de stent farmacoactivo en el tronco principal izquierdo, sangrado activo, diátesis hemorrágica o antecedentes de sangrado intracraneal. Se aleatorizaron 614 pacientes y el seguimiento fue de 9 meses. El tratamiento consistió en clopidogrel 75 mg/d durante 6 semanas o 6 meses; AAS 75-200 mg/d; y un AVK (fenprocumón o warfarina).
Como criterio de valoración principal se usó la combinación de muerte, IM, TS, ACV o hemorragia mayor, según criterios TIMI (Thrombolysis In Myocardial Infarction), a los 9 meses después de la aleatorización. Los criterios de valoración secundarios se incluyó un criterio de valoración isquémico (combinación de muerte de causa cardíaca, IM, TS definido o ACV isquémico) y un criterio de valoración hemorrágico (hemorragia mayor definida por criterios TIMI).
El criterio de valoración principal se presentó en el 9,8% de los pacientes del grupo de 6 semanas en comparación con 8,8% en el grupo de 6 meses (IR 1,14; IC del 95%: 0,68 a 1,91; p = 0,63) (Figura 8).
El criterio de valoración isquémico ocurrió en el 4,0% de los pacientes del grupo de 6 semanas y en el 4,3% del grupo de 6 meses (IR 0,93; IC 95%: 0,43-2,05; p = 0,87). En cuanto al criterio hemorrágico, no hubo diferencia entre ambos grupos (5,3% vs 4,0%; IR 1,35 (IC 95%: 0,64-2,84; p = 0,44)) (Figura 8).
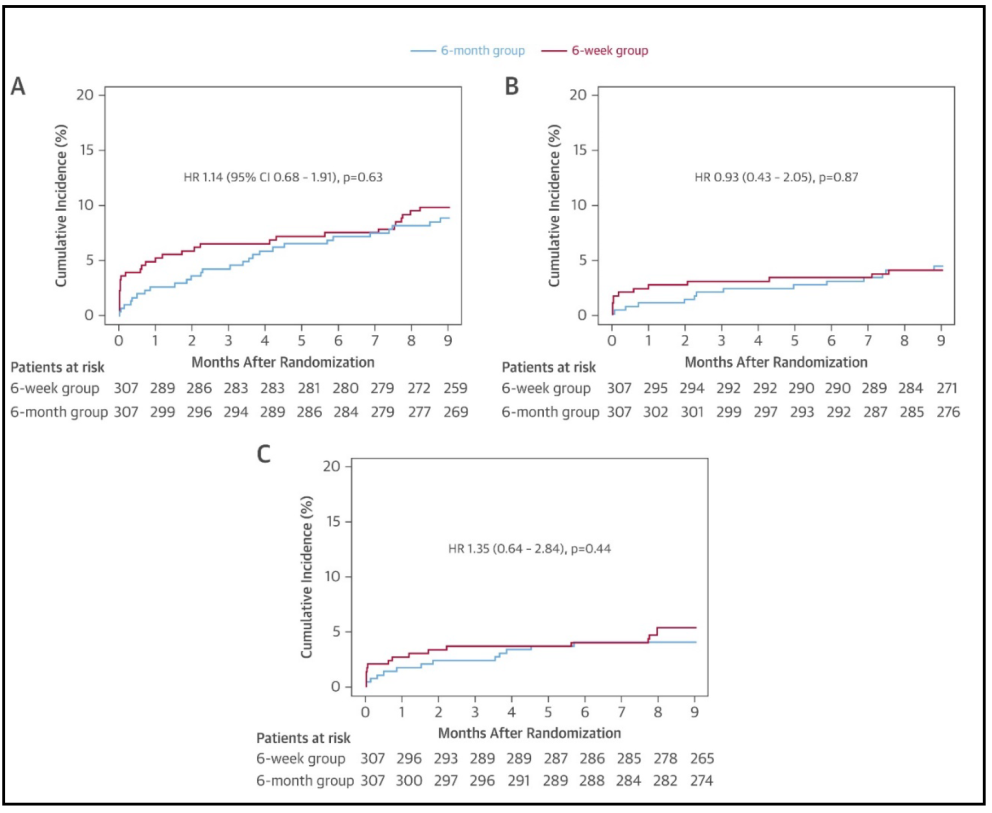
Figura 8. Análisis de Kaplan-Meier del (A) criterio de valoración principal (incidencia acumulada de muerte, IM, TS, ACV o trombólisis en IM [TIMI] hemorragia mayor), (B) criterio de valoración secundario isquémico (muerte cardíaca, IM, ST, ACV isquémico) y (C) criterio de valoración de hemorragia secundaria (hemorragia mayor TIMI) a los 9 meses. HR = índice de riesgo (IR).(21)
El estudio WOEST et al.(22), es un ensayo clínico controlado, abierto, aleatorizado y multicéntrico. El objetivo del estudio era evaluar la hipótesis de que la doble terapia basada en ACO + clopidogrel era más segura que la triple terapia basada en ACO + clopidogrel + AAS en pacientes con indicación de ACO a largo plazo y que se han sometido a ICP (Tabla 6).
Se incluyeron 537 pacientes que fueron aleatorizados a uno de los dos brazos de tratamiento. El seguimiento fue de 1 año y el análisis primario de resultados se evaluó por intención de tratar (ITT).
El criterio de valoración principal del estudio fue la aparición de cualquier evento hemorrágico, clasificado según los criterios TIMI y GUSTO (Global Use of Strategies to Open Occluded Arteries). Se produjo alguna hemorragia en el 19,4% de los pacientes del grupo de doble terapia frente al 44,4% en el grupo de triple terapia (IR 0.36 [IC,95% 0.26–0.50], p < 0.0001)). Sin embargo, aunque para las hemorragias TIMI mayor, la doble terapia pareció asociarse con un menor número de eventos, las diferencias no fueron significativas (3,3% vs 5,8%; p 0,159) (Figura 9).
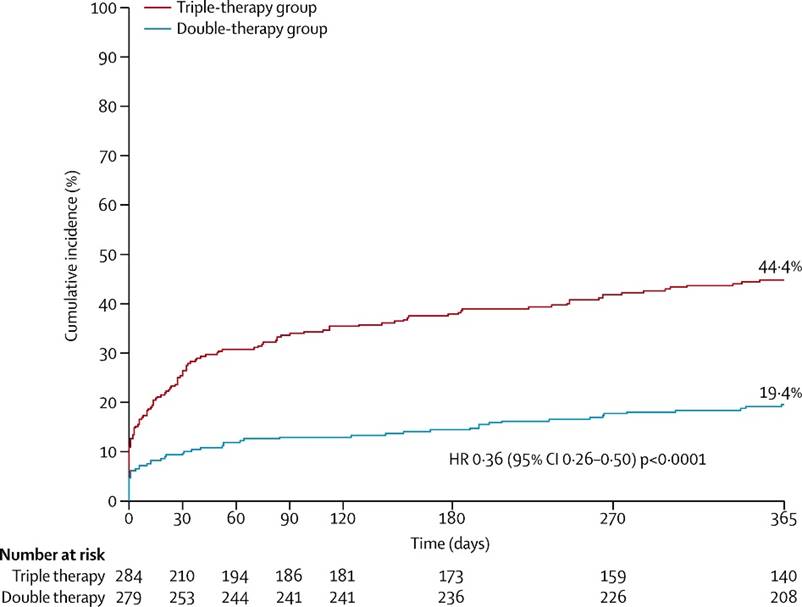
Figura 9. Incidencia del criterio de valoración principal (cualquier sangrado)
HR = índice de riesgo.(22)
El criterio de valoración de eficacia resultó de la combinación de muerte, IM, ACV, embolización sistémica, revascularización del vaso diana y TS según los criterios de Academic Research Consortium (ARC). Este criterio de eficacia apareció en el 11,1% de los pacientes del grupo de doble terapia y en el 17,6% del grupo de triple terapia (IR 0,60 [IC 95% 0.38–0.94], p = 0.025) (Figura 10).
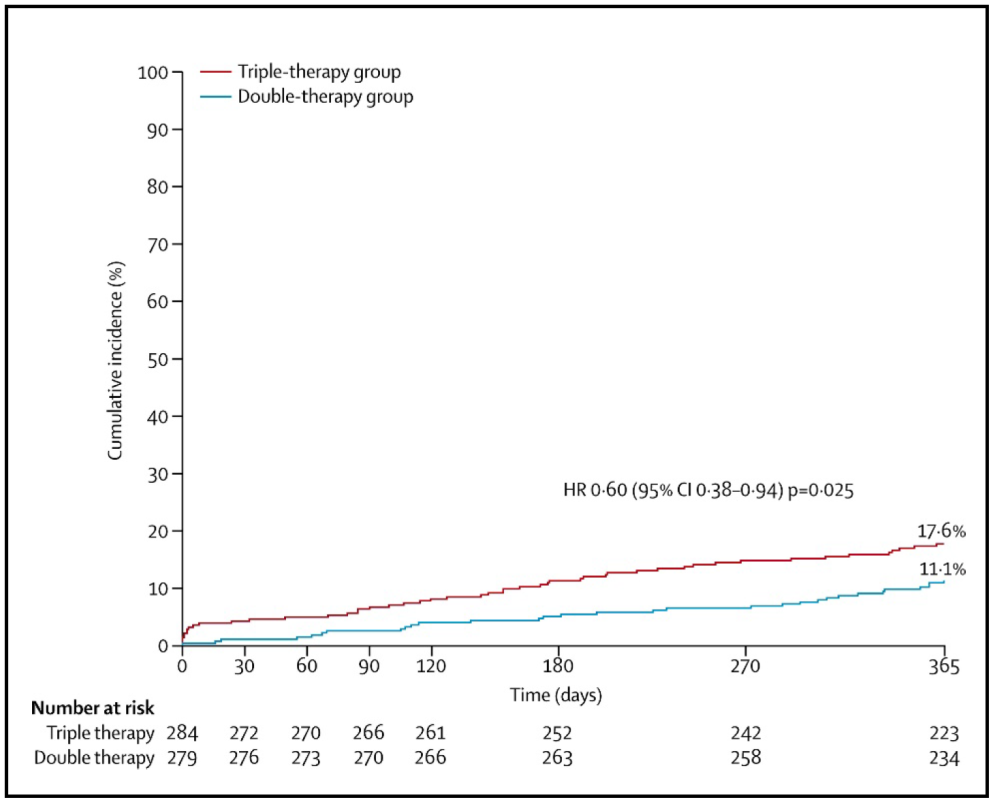
Figura 10. Incidencia acumulada del criterio de valoración secundario(muerte, IM, ACV revascularización de vaso diana y TS).(22) HR = índice de riesgo.
El PIONEER AF-PCI(23) es un ensayo clínico, abierto, aleatorizado y multicéntrico. El objetivo era valorar la seguridad de 2 regímenes diferentes de tratamiento con rivaroxabán (ACOD) más un inhibidor de P2Y12 (DAT) en comparación con el tratamiento estándar que incluía AVK (TAT) , en pacientes con FA sometidos a PCI con la colocación de un stent (Tabla 6).
El estudio incluyó 2124 pacientes, asignados al azar a recibir uno de los tres grupos de tratamiento durante 1, 6 o 12 meses (a criterio clínico) y el seguimiento fue de al menos 12 meses.
El grupo 1 recibió de tratamiento rivaroxabán (15mg/d o 10 mg/d) + inhibidor de P2Y12; el grupo 2, rivaroxabán 2,5 mg 2 veces/d + inhibidor de P2Y12 + AAS; y el grupo 3, AVK + inhibidor de P2Y12 + AAS.
El criterio de valoración principal de seguridad fue el porcentaje de hemorragia mayor o menor clínicamente significativa, según los criterios TIMI, analizada por ITT. De acuerdo con este criterio, se produjo hemorragia clínicamente significativa 16,8% de los pacientes del grupo 1, en el 18,0% del grupo 2 y en el 26,7% del grupo 3 (HR para el grupo 1 frente al grupo 3 de 0,59; IC 95 % 0,47 a 0,76; P <0,001; HR para el grupo 2 frente al grupo 3, 0,63; IC del 95%, 0,50 a 0,80; P <0,001) (Figura 11 A).
Los puntos de eficacia incluyeron: muerte por causa cardiovascular, IM, ACV y trombosis del stent. Este punto de eficacia se presentó en el 6,5% de los participantes del grupo 1, el 5,6% del grupo 2 y 6% del grupo 3 con p> 0,05 para ambas comparaciones (Figura 11 B).
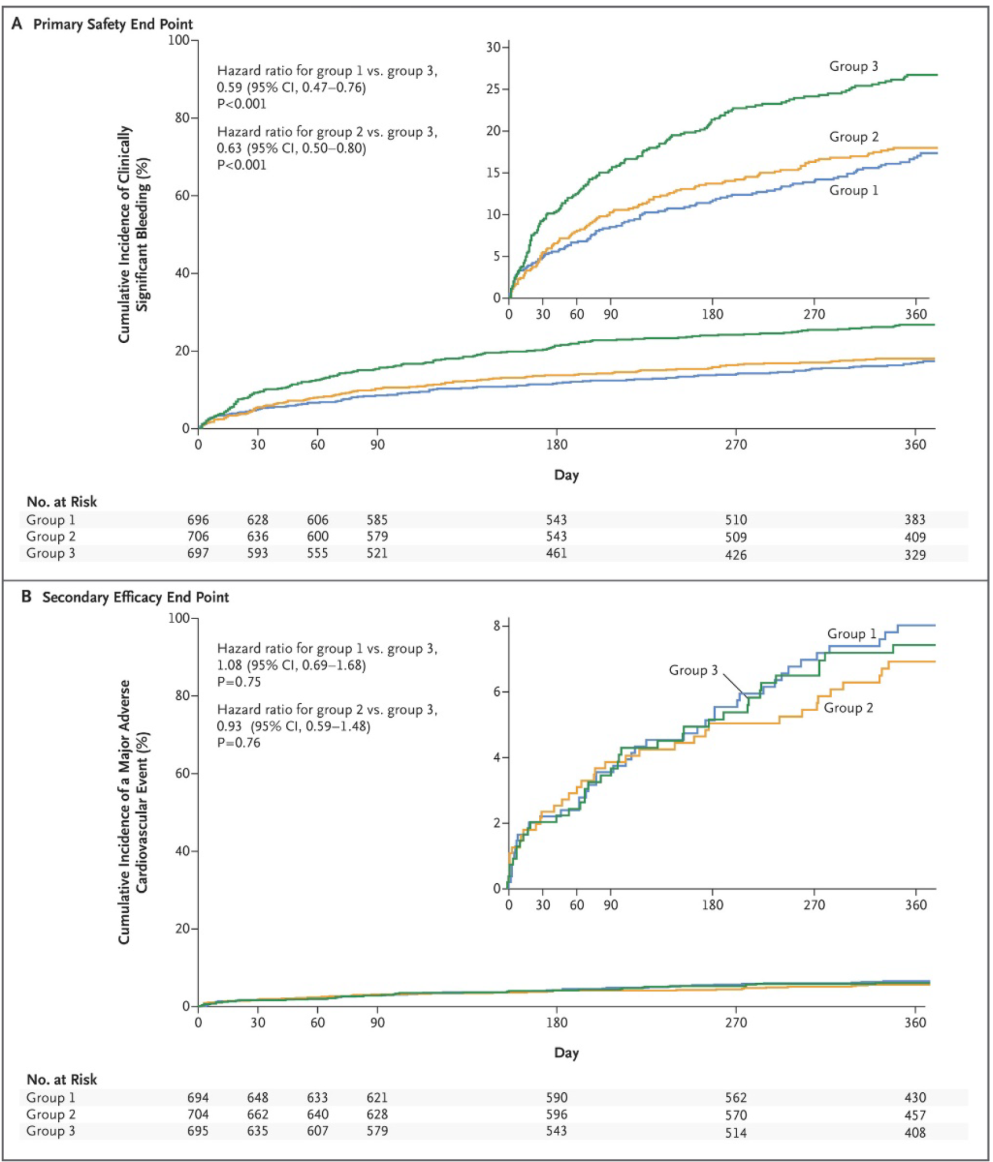
Figura 11. Incidencia acumulada del criterio de valoración principal de seguridad (A) y un criterio de valoración secundario de eficacia (B). Grupo 1: rivaroxabán 15 mg + inhibidor de P2Y12; Grupo 2: rivaroxabán 2,5 mg + inhibidor de P2Y12 + AAS; Grupo 3: AVK + inhibidor de P2Y12 + AAS. (23)
El RE-DUAL PCI (24) es un ensayo clínico abierto, aleatorizado, multicéntrico, prospectivo, de criterio de valoración ciego. El objetivo del estudio era comparar la seguridad de la terapia antitrombótica dual con dabigatrán (ACOD) más inhibidor de P2Y12 (clopidogrel o ticagrelor) frente a la triple terapia con Warfarina en paciente con FA sometidos a ICP (Tabla 6).
Tras la ICP, los 2725 pacientes fueron asignados aleatoriamente para recibir uno de los tres brazos de tratamientos.
El objetivo primario de seguridad fue la incidencia de sangrado mayor o clínicamente relevante, según criterios ISTH (Sociedad Internacional de Trombosis y Hemostasia), durante el seguimiento (media de 14 meses).
El ensayo también fue diseñado para evaluar la no inferioridad de la doble terapia en cuanto a la incidencia del combinado de eventos tromboembólicos (infarto de miocardio, ictus o embolismo sistémico), muerte o necesidad de revascularización. Otros criterios de valoración secundaria fue la incidencia de: trombosis definitiva del stent.
La incidencia de sangrado mayor o relevante fue inferior en el grupo de doble terapia con dabigatrán 110 mg respecto al grupo de triple terapia con Warfarina (15,4 % frente al 26,9%, IR 0,52 [IC del 95%, 0,42 a 0,63], P < 0,001 para la no inferioridad y para la superioridad (Figura 12 A)). La incidencia de sangrado tampoco fue superior en el brazo de doble terapia con dabigatrán 150 mg frente al grupo comparable de TAT (20,2% frente a 25,7%, HR 0,72, IC 95 0,58-0,88; p<;0,001 para no inferioridad (Figura 12 B).
En cuanto al criterio de valoración de eficacia, fue del 13,7% en los dos grupos de DAT combinados en comparación con el 13,4% en el grupo de TAT (IR 1,04; IC del 95%, 0,84 a 1,29; P = 0,005 para la no inferioridad (Figura 12 C)). La tasa de eventos adversos graves no difirió significativamente entre los grupos.
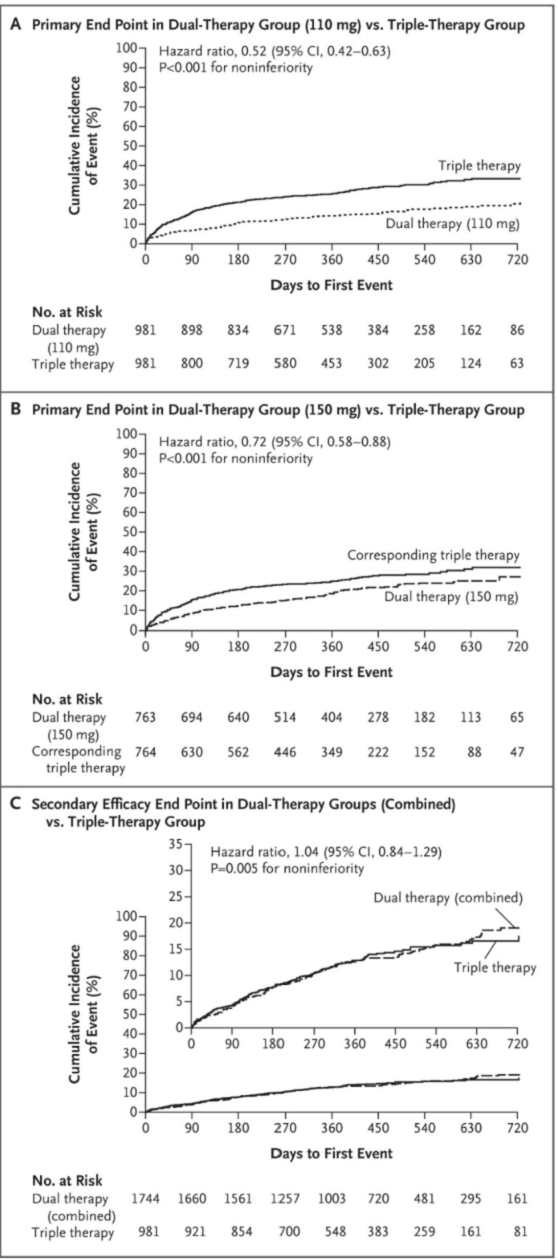
Figura 12. Resultados para los criterios de valoración principal y de valoración secundaria de eficacia del estudio RE-DUAL PCI(24).
El AUGUSTUS (25) es un ensayo clínico controlado, aleatorizado, prospectivo y multicéntrico con diseño factorial 2 por 2. El estudio tuvo como objetivo comparar la seguridad de apixabán (ACOD) frente a AVK y de AAS frente a placebo en pacientes con FA y SCA o ICP electiva (Tabla 6).
Se incluyeron un total de 4614 pacientes que fueron aleatorizados para recibir tratamiento con apixabán o con AVK y para recibir AAS doble ciego o placebo equivalente. El seguimiento fue de 6 meses y el análisis primario de resultados se evaluó por ITT.
El resultado primario de seguridad evaluó la presencia de hemorragia mayor o CRNM (hemorragia no mayor clínicamente relevante) según la definición del ISTH. Los resultados secundarios resultaron de la combinación de muerte u hospitalización por todas las causas además de la combinación de muerte o eventos isquémicos (ACV, IM, trombosis definitiva/probable del stent o revascularización urgente).
Los pacientes bajo tratamiento con apixabán presentaron de forma estadísticamente significativa menos hemorragias que los tratados con AVK (10,5% frente al 14,7%; HR 0,69; IC 95%: 0,58-0,81; p<0,001 para no inferioridad y superioridad (Figura 13 A)). Por otro lado, hubo más hemorragias en los tratados con AAS frente a placebo (16,1% frente a 9%; HR 1,89; IC 95%: 1,59-2,24; p<0,001 (Figura 13 B)). El porcentaje de pacientes con sangrado fue aún mayor en los tratados con AVK y AAS (18,7%), y menor si tomaron apixabán y placebo (7,3%) (Figura 13 C).
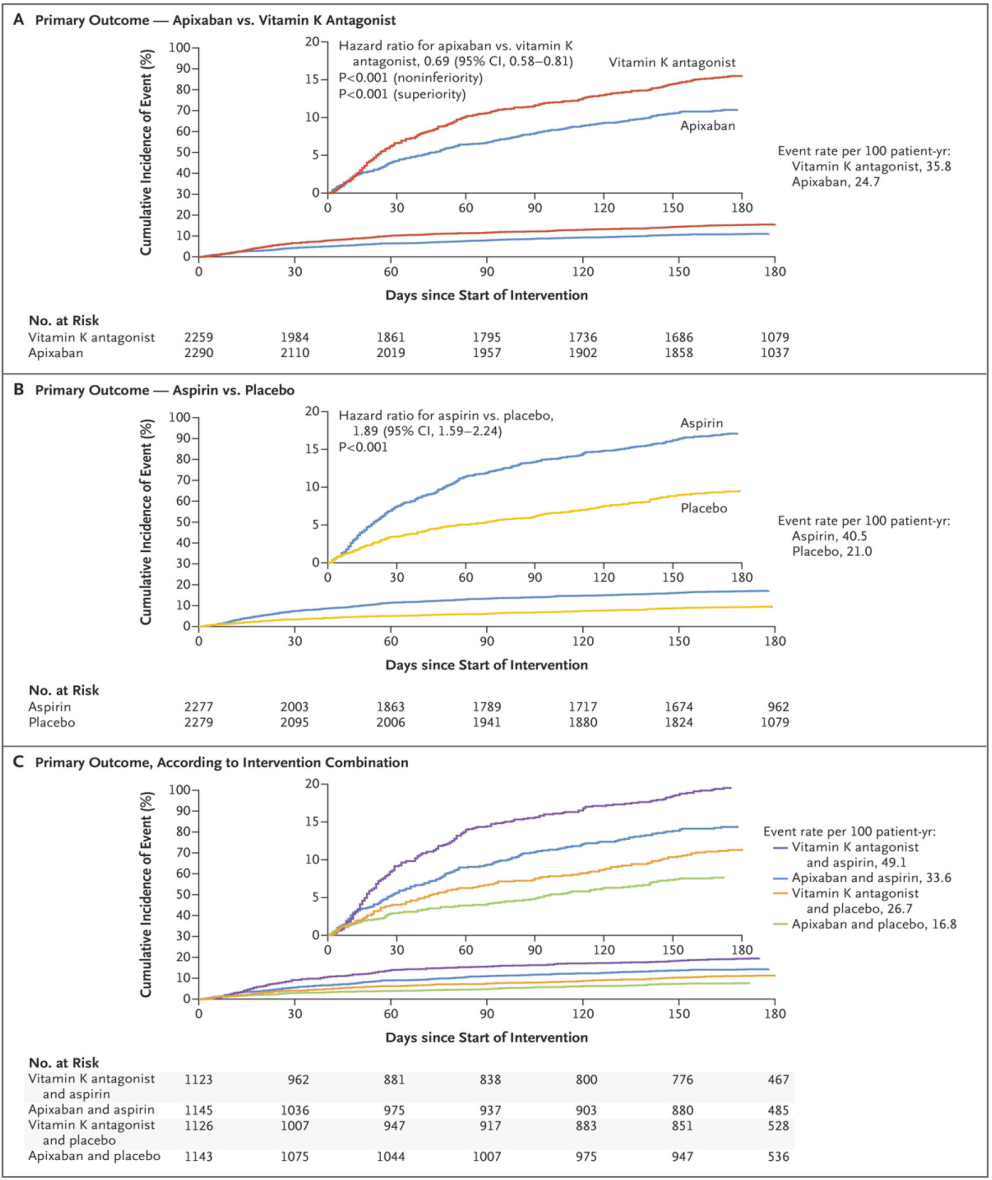
Figura 13. Curvas de Kaplan-Meier para el resultado primario de seguridad (hemorragia mayor o no mayor clínicamente relevante)(25)
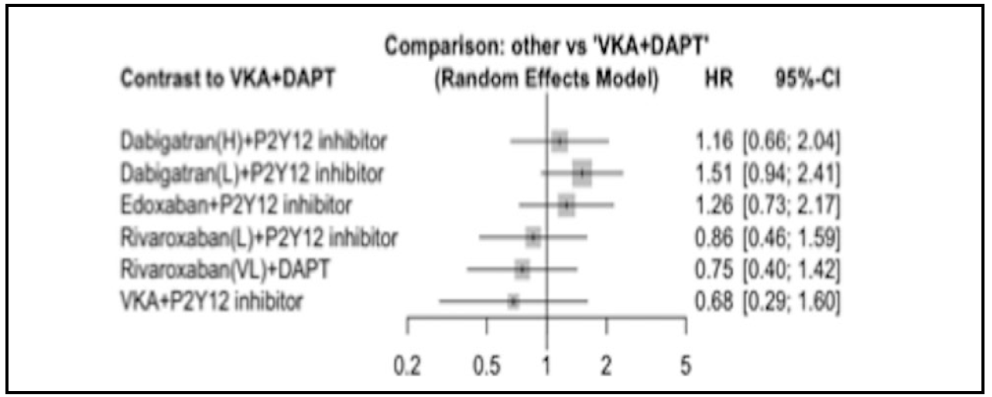
Al analizar la variable combinada de muerte u hospitalización, hubo menos mortalidad o ingreso en el brazo de apixabán frente a AVK de forma estadísticamente significativa (23,5% frente al 27,4%; HR 0,83; IC 95%: 0,74-0,93; p = 0,002 (Figura 14 A)). La diferencia fue a expensas de menor incidencia de hospitalización. En cambio, no se encontraron diferencias al comparar AAS frente a placebo (26,2% frente al 24,7%; HR 1,08; IC 95%: 0,96-1,21 (Figura 14 B)).
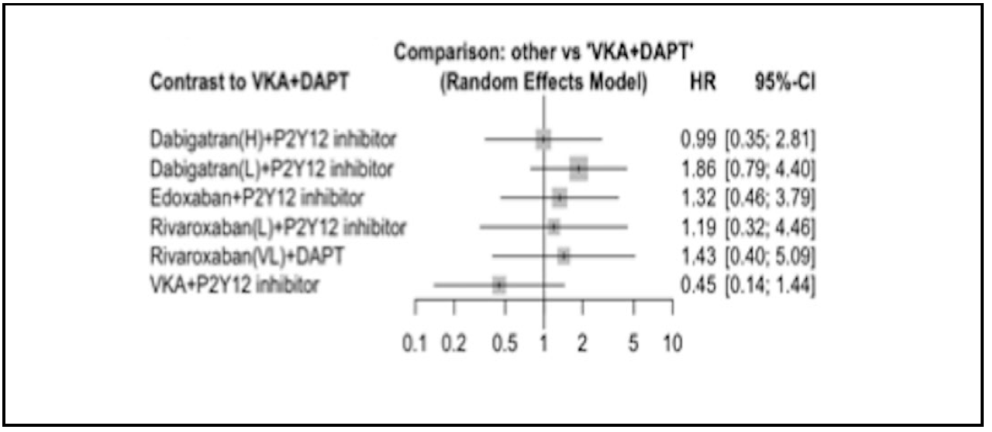
No hubo diferencias estadísticamente significativas en la variable muerte o evento isquémico entre los tratados con apixabán o AVK (6,7% frente al 7,1%). Los pacientes tratados con AAS tuvieron menor incidencia de eventos isquémicos, pero sin significación estadística (6,5% frente al 7,3%).
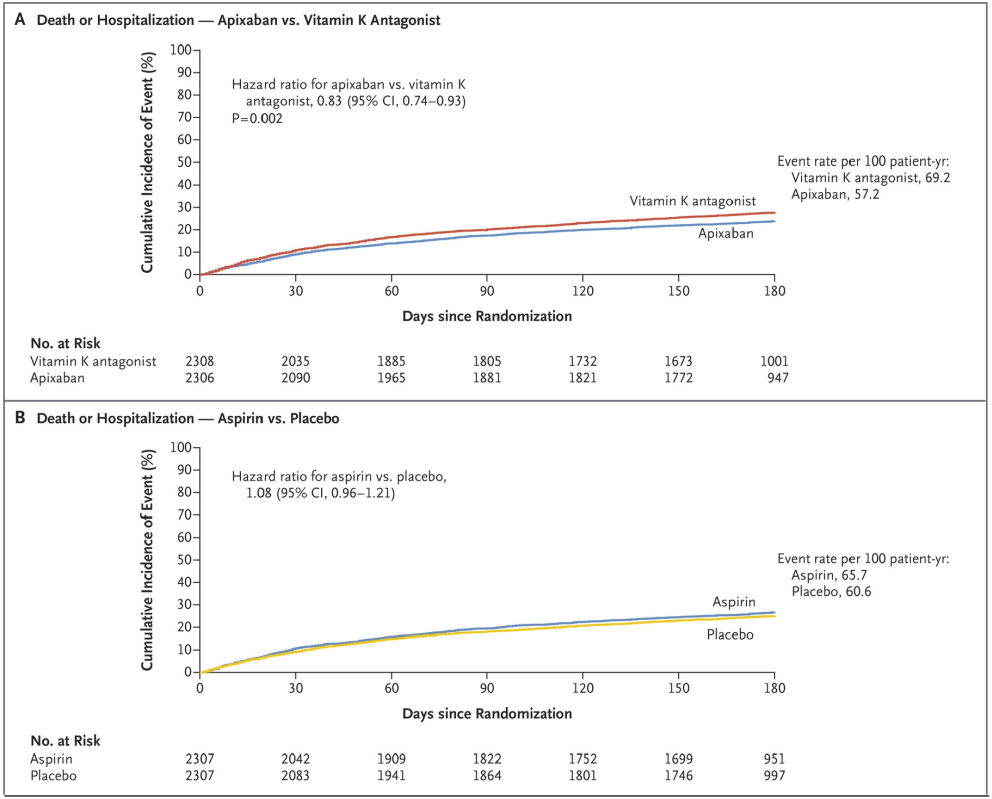
Figura 14. Curvas de Kaplan-Meier para la combinación de muerte u hospitalización.
El estudio ENTRUST-PCI(26) es un ensayo clínico abierto, aleatorizado, multicéntrico, con evaluación de resultados enmascarada. El objetivo era demostrar la no inferioridad del tratamiento con edoxabán (ACOD) más un inhibidor de P2Y12 frente a la triple terapia basada en AVK + inhibidor P2Y12 + AAS en pacientes con FA sometidos a ICP.
Se incluyeron 1506 pacientes con un seguimiento de 12 meses. Los brazos de tratamiento se detallan en la Tabla 6. Los resultados se analizaron en la población por intención de tratar (ITT).
El resultado primario fue una combinación de sangrado mayor o no mayor clínicamente relevante (CRNM) definida según ISTH. El principal resultado de eficacia fue la combinación de infarto de miocardio, TS definitiva, eventos embólicos sistémicos, ACV y muerte cardiovascular.
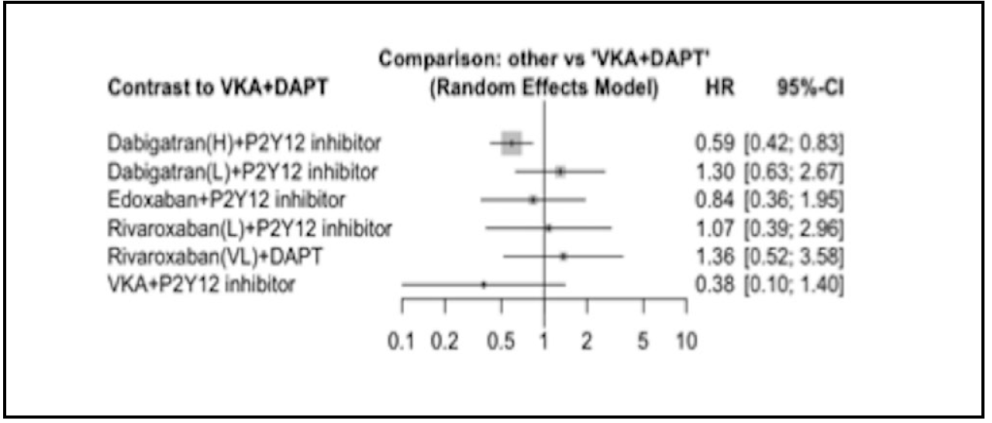
El resultado primario ocurrió en el 17% de los pacientes en régimen con edoxabán y en el 20% de los pacientes con el régimen basado en AVK. La tasa de eventos anuales fue del 20,7% vs 25,6% respectivamente. La HR para edoxabán fue 0,83 [IC 95%, 0,65-1,05], p=0,0010 para no inferioridad y una HR 1,20 con p= 0,1154 para superioridad (Figura 15).
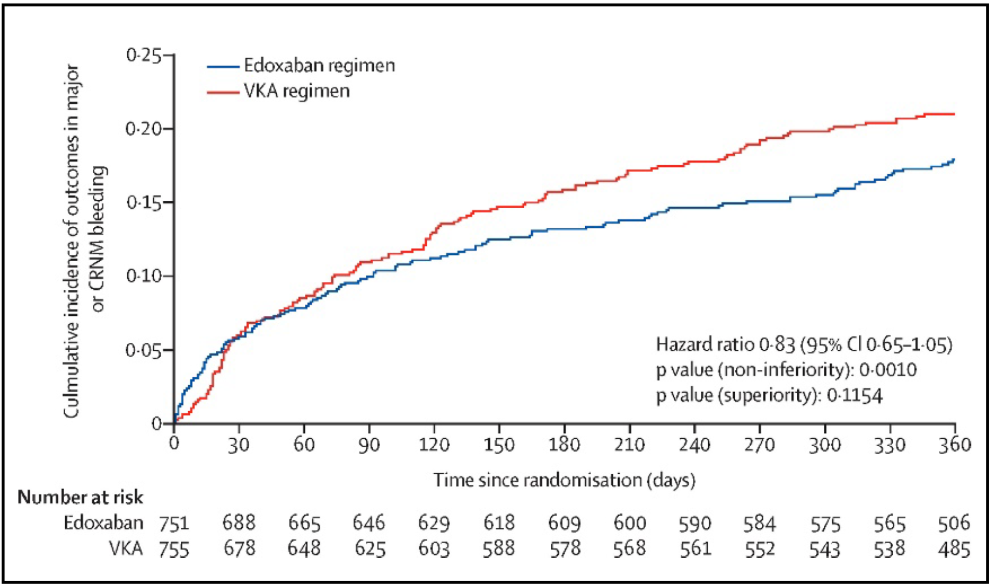
Figura 15. Resultados de hemorragia mayor o CRNM en población por intención de tratar. (26)
El principal resultado de eficacia se produjo en el 7% de los pacientes que recibieron edoxabán (tasa anual de eventos del 7,3%) frente al 6% de aquellos que recibieron tratamiento con AVK. La HR para edoxabán fue 1,06 (IC 95% 0,71–1,69).