CASOS CLÍNICOS
Consideraciones anestésicas de la electroporación. A propósito de un caso
Anaesthetic considerations of electroporation. In relation to a clinical case
Natalia Burgos Frías, María Victoria Caldera Álvarez, Rafael Uña Orejón, José María Muñoz y Ramón, Francisco Reinoso Barbero
Servicio de Anestesiología, Reanimación y Terapéutica del Dolor, Hospital Universitario La Paz, Madrid, España
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Introducción
En la última década, nuevos procedimientos han cobrado importancia para hacer frente a patologías tumorales, en las que, tras desestimar la cirugía, protocolos basados en quimioterapia y/o radioterapia conducían a resultados decepcionantes. Estas técnicas caracterizadas por una mínima invasividad, se basan en la aplicación de varias formas de energía (térmica, eléctrica, química, sónica y lumínica) que inducen una destrucción tisular. Se pueden clasificar en métodos térmicos: radiofrecuencia, microondas, ultrasonidos de alta frecuencia y crioablación; y métodos no térmicos: terapia fotodinámica y electroporación irreversible (EI)(1-4).
La electroporación es una técnica de ablación basada en la aplicación local de un campo eléctrico generado entre dos o más electrodos insertados mediante agujas en el tejido tumoral. Numerosos ciclos de pulsos cortos con voltaje eléctrico extremadamente alto cambian el potencial transmembrana celular, lo que lleva a la creación de defectos a nano-escala en la bicapa lipídica, generando múltiples poros que aumentan su permeabilidad produciendo una destrucción celular por la pérdida de la homeostasia. El efecto puede ser reversible o irreversible, según la amplitud, duración, número de pulsos, frecuencia e intensidad del campo eléctrico aplicado(5,6). En términos generales, los tratamientos se basan en la colocación de 2 a 6 electrodos monopolares de 19G (según el tamaño de la lesión), alineados de manera paralela y posicionados a una distancia entre sí de 1,5-2 cm; la aplicación de 70-90 pulsos de 70-100 µs; con un voltaje del campo eléctrico de 1.500-3.000 V cm-1; y una corriente entregada de 20-50 A (2,3,7).
Al ser una técnica no térmica, tiene un perfil de seguridad mejorado y ha demostrado ser eficaz en términos de supervivencia contra tumores sólidos cuando se combina con quimioterapia y/o radioterapia(2-4). Se puede realizar por abordaje percutáneo, laparoscópico o abierto, prefiriéndose este último para una correcta localización de los electrodos y la práctica de procedimientos adicionales en el mismo tiempo quirúrgico(3).
Descripción del caso
Presentamos el caso de un varón de 61 años diagnosticado de adenocarcinoma de cabeza de páncreas. Como antecedentes personales el paciente padecía: alergia al metamizol, obesidad, enfermedad pulmonar obstructiva crónica tipo enfisematoso, hipertensión arterial, diabetes mellitus tipo 2, varices esofágicas y hepatopatía crónica Child-Pugh A5 secundaria a una hepatitis C. Era consumidor habitual de alcohol (83 g diarios) y exfumador. Por ello seguía tratamiento con: inhalaciones de indacaterol/glicopirronio, bisoprolol, metformina, Kreon y lorazepam.
El estudio preoperatorio analítico destacó: hemoglobina: 15,2 g dl-1; actividad de protrombina: 66,4%; INR 1,25; fibrinógeno: 814 mg dl-1; AST 52 UI l-1; ALT 129 UI l-1; GGT 651 UI l-1; PCR 10,7 mg l-1; glucosa 121 mg dl-1; bilirrubina total 4,8 mg dl-1. Tenía un electrocardiograma en ritmo sinusal. Días previos al procedimiento, mediante colangiopancreatografía retrógrada endoscópica se colocó una prótesis biliar plástica debido a una estenosis de la vía biliar y la ecoendoscopia con punción aspiración con aguja fina confirmó el diagnóstico.
A su llegada a quirófano, el paciente se encontraba hipertenso (145/80 mm Hg) con frecuencia cardiaca de 80 latidos por minuto (lpm). Se canalizó una vía venosa periférica (18G). Se desestimó la técnica combinada por la coagulopatía y se realizó inducción intravenosa con propofol (2 mg kg-1), fentanilo (2 mcg Kg-1), rocuronio (0,6 mg kg-1) e intubación orotraqueal sin incidencias. También se canalizaron otra vena periférica (16G) y la arteria radial izquierda (20G). Para el mantenimiento se usó una mezcla de O2/Aire (60/40) y desflurano (6%), añadiendo bolos de fentanilo y perfusión continua de remifentanilo (0,1-0,2 mcg kg min-1) para control analgésico; y rocuronio para relajación neuromuscular según necesidades. Se administró profilaxis antibiótica con Cefazolina 2 g cada 3 h mientras duró la cirugía. Se monitorizó la electrocardiografía de 3 derivaciones y de 5 para la sincronización con el dispositivo Nanoknife® (Angiodynamics, Latham, NY, EUA). También se colocaron las pegatinas del desfibrilador con su monitorización electrocardiográfica correspondiente, pulsioximetría, capnografía, índice biespectral (BIS®), presión arterial invasiva y monitorización de la relajación neuromuscular mediante Train of Four (TOF)-Scan®. Se pusieron sondaje vesical, medias de compresión neumática intermitentes y manta de aire.
Se realizó una laparotomía subcostal derecha con apertura de la transcavidad de los epiplones y maniobra de Kocher para acceder a la celda pancreática. Se localizó la lesión mediante ecografía intraoperatoria y se colocaron cuatro agujas de electroporación (Figura 1). La planificación y características del tratamiento se muestran en la Figura 2. Durante la aplicación de los pulsos se observó una elevación marcada de las cifras de presión arterial (Figura 3) que precisó de la administración de remifentanilo en perfusión continua y bolos de urapidilo. No se observaron alteraciones en el electrocardiograma y se mantuvo una frecuencia cardiaca estable (70-80 lpm). Se comprobó la correcta relajación muscular confirmada con TOF, y aunque el paciente presentó contracciones locales en el área tratada, no se observó actividad epileptógena ni alteraciones en la electroencefalografía del BIS (Figura 4). El procedimiento duró 6 h. Tras la reversión neuromuscular con 200 mg de sugammadex y extubación, el paciente se trasladó a la unidad de recuperación para vigilancia. Se mantuvo estable sin alteraciones electrocardiográficas ni analíticas, salvo la coagulopatía e hipertransaminasemias previas. A las 24 h se trasladó a planta.
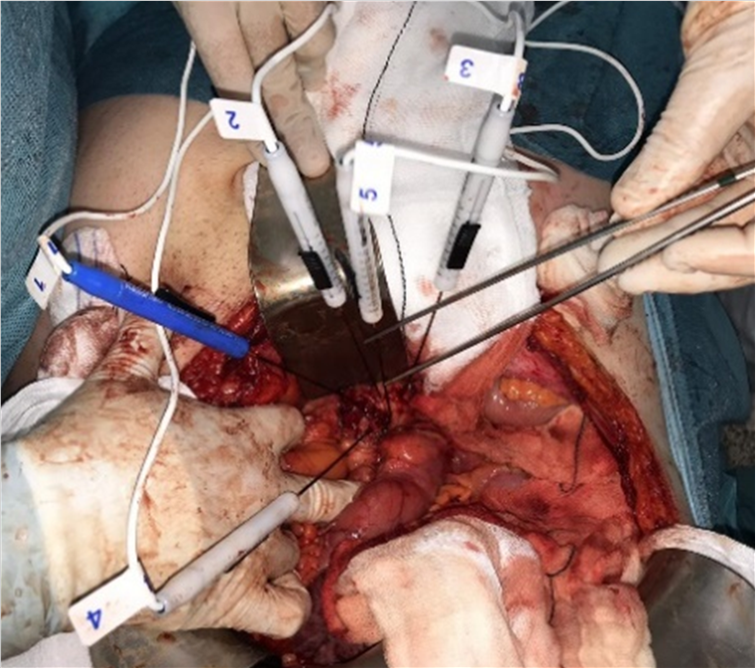
Figura 1. Procedimiento de electroporación irreversible en cabeza de páncreas con los electrodos in situ.
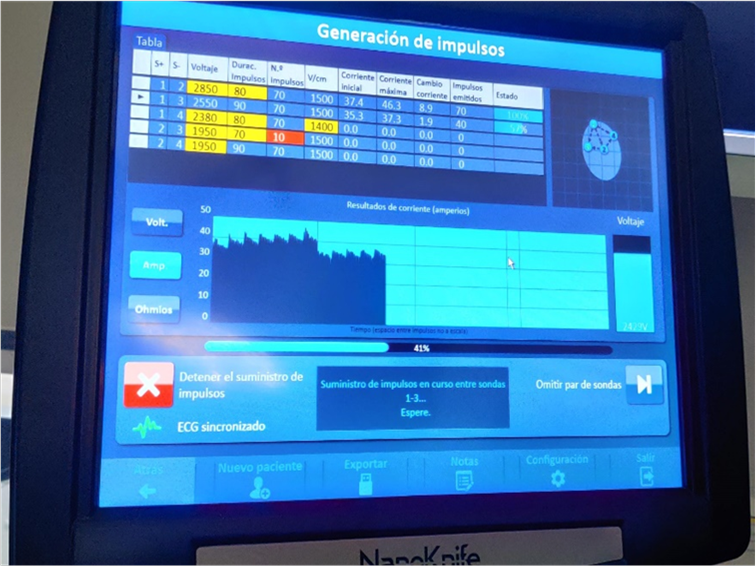
Figura 2. Dispositivo NanoKnife®, Angiodynamics, Latham, NY, USA. Se muestra la planificación y evolución de la intervención. Parámetros expresados en la tabla: S+ y S-: electrodos o agujas que muestran la dirección de la corriente, del polo positivo al negativo; voltaje de la corriente (voltios); duración de los impulsos (microsegundos); número de impulsos; voltaje por centímetro de tejido; corriente inicial y mímima administradas, y cambio de corriente (amperios); impulsos emitidos por el momento (número); y estado (%) del tratamiento administrado. En el borde superior derecho se muestra una imagen de la lesión y la disposición de los 4 electrodos colocados. Debajo hay una gráfica de los resultados de la corriente administrada a lo largo del transcurso del procedimiento. Así como un botón de detención del tratamiento y sincronización del ECG. El suministro de la corriente indica que los impulsos se están administrando entre las sondas 1 y 3, como igualmente se observa en la parte superior de la tabla con la flecha.
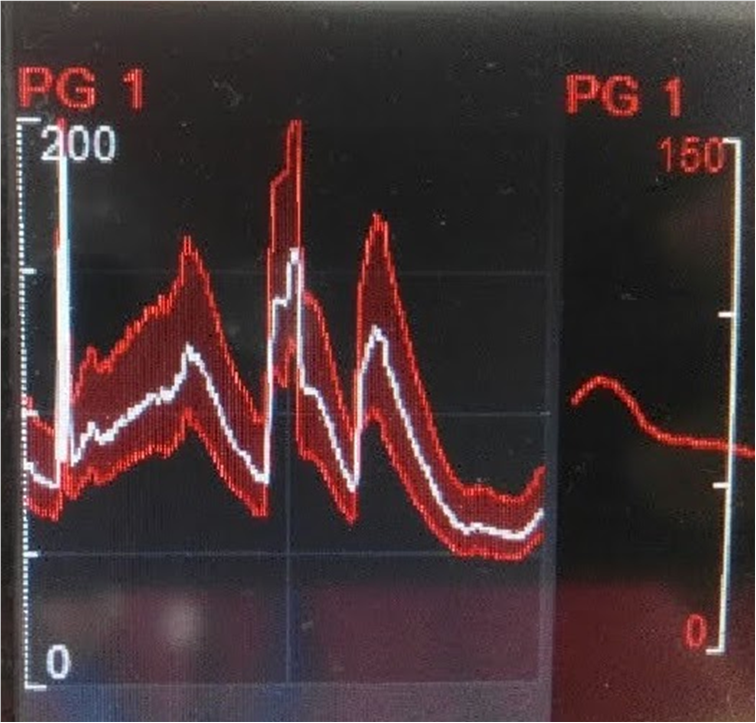
Figura 3. Monitorización de la presión arterial invasiva: se pueden visualizar los cambios hemodinámicos con aumento de la presión, coincidentes con la aplicación de la corriente, así como los descensos de la tensión al finalizar los pulsos de energía.
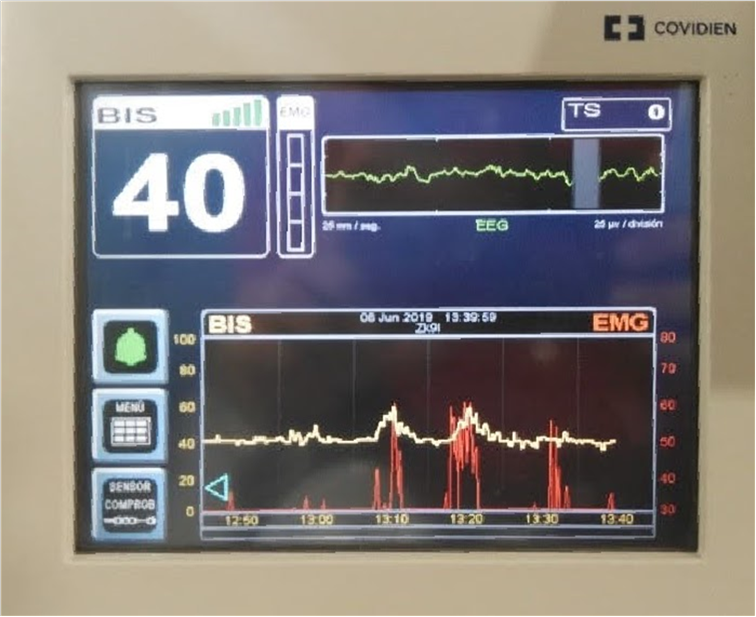
Figura 4. Monitorización de la profundidad anestésica mediante el BIS: se pueden visualizar los aumentos de la actividad electromiográfica coincidentes con la aplicación de la corriente.
Tras 48 h, el enfermo tuvo que reingresar en nuestra unidad por disnea súbita, objetivándose en una prueba de imagen urgente la trombosis de la rama portal izquierda. Una vez resuelto el episodio de coagulopatía y según el protocolo de la unidad de enfermedad tromboembólica de nuestro centro, se recomendó 12.500 UI subcutáneas de heparina no fraccionada, una inyección diaria de forma indefinida.
Discusión
Debido a su naturaleza electrofisiológica, la EI puede causar arritmias, ya que el impulso eléctrico puede coincidir con el periodo refractario absoluto del ciclo cardíaco. Para evitarlo, se utilizan dispositivos de sincronización que detectan la pendiente ascendente de la onda R y envían una señal al sistema de electroporación, que al cabo de 50 milisegundos, libera un pulso de energía. Se recomienda que la frecuencia sea menor de 115 lpm(2). En nuestro centro colocamos las palas del desfibrilador como prevención de arritmias malignas. La EI también puede afectar negativamente a la presión arterial. Diversos estudios describen un aumento transitorio de la tensión (hasta el 77% mayor a 15 mm Hg). Esto puede conducir a un accidente cardiovascular. Se debe contar con medicación antihipertensiva, ya sea remifentanilo, urapidilo o betabloqueantes de vida media corta (esmolol).
Otro de los efectos derivados de la aplicación de pulsos de energía, son las contracciones musculares. Es precisa la anestesia general con relajación neuromuscular profunda cuya parálisis muscular completa se debe confirmar con la monitorización de train-of-four (0/4).
Están descritas las alteraciones hidroelectrolíticas: acidosis metabólica, hiperpotasemia... La hipótesis es que la formación de nanoporos en la membrana plasmática de las células conduce a la liberación masiva de potasio intracelular al torrente circulatorio, similar al síndrome de lisis tumoral.
La EI está indicada en pacientes no subsidiarios de cirugía invasiva, tumores sólidos de pequeño tamaño, de carácter inoperable y en localizaciones adyacentes a estructuras críticas cuando otras técnicas están contraindicadas. Es un procedimiento con menos efectos secundarios (óptima paliación del dolor, menores úlceras y lesiones sangrantes)(4) que se está empleando en tumores primarios y metastásicos de hígado, riñón, próstata, pulmón y páncreas. Se puede aplicar en pacientes ya sometidos a múltiples líneas de quimio o radioterapia, donde el objetivo es controlar la enfermedad a nivel local; a enfermos con metástasis estables en el tiempo, para reducir el tamaño de la lesión y permitir su resección posterior; o bien en los ya operados, para tratar la recurrencia local. La combinación de EI y cirugía en el mismo tiempo quirúrgico se realiza para tratar los márgenes positivos sospechosos, y no se debe utilizar cuando la enfermedad residual macroscópica puede quedar atrás(5).
Dentro de las contraindicaciones de la técnica están: tamaño tumoral mayor a 3,5-4 cm, convulsiones recientes, coagulopatía que no se puede corregir, los que no pueden someterse a anestesia general o bloqueo neuromuscular. La presencia de un stent biliar metálico aumenta el riesgo de daño térmico del tejido circundante (perforaciones, hemorragia o incluso la muerte) (1). Se puede sustituir por una prótesis biliar plástica temporal (como fue el caso de nuestro paciente) o bien realizar una hepaticoyeyunostomía(5). Igualmente es contraindicación el padecimiento de arritmias cardiacas como la fibrilación auricular, ya que no se puede sincronizar el impulso con las ondas R, lo que incrementa el riesgo de arritmias ventriculares. También se debe evitar en pacientes con angina inestable o isquemia miocárdica inducible identificada en una prueba de esfuerzo, insuficiencia cardíaca, así como los portadores de marcapasos y/o desfibriladores(3,4).
La dificultad del procedimiento radica en la correcta colocación de las agujas. Éste desafío es el responsable de técnicas incompletas, fallos locales o recurrencias. El uso de imágenes en 3D, aunque incrementa el tiempo de inicio, reduce la duración global, aumenta la precisión quirúrgica, adecúa el plan preoperatorio y evita el daño de estructuras. En nuestro centro el Servicio de Digestivo con la ayuda de ecografía intraoperatoria, posiciona los electrodos.
Las complicaciones rondan del 18 al 57% según las series(3,8). Los eventos más frecuentes suelen ser: cambios hipertensivos o hipotensivos, arritmias, fugas duodenales, biliares o pancreáticas, episodios de pancreatitis, ascitis, lesiones derivadas de la colocación de los electrodos (perforaciones orgánicas, neumotórax o derrames pleurales, hemorragias y hematomas), dolor después del procedimiento desencadenado por la hiperestimulación muscular, abscesos o infecciones, incluso metástasis(1-3). Otra complicación a reseñar, que además padeció el paciente, es la trombosis venosa portal. Algunos artículos han observado esta posibilidad incluso a los 30-60 días del procedimiento, hasta en un 4-7% de sus series(4). Kluger et al.(9) y Su et al.(10) lo atribuyeron a la combinación de la hipercoagulabilidad asociada al cáncer, un estado de bajo flujo por estenosis previa, así como un daño teórico al endotelio venoso secundario a la EI, además del ascenso de varios mediadores inflamatorios. La clínica puede hacer sospechar en una pancreatitis postoperatoria. Debe confirmase mediante técnicas de imagen así como hacer un tratamiento que incluya: trombolisis y/o anticoagulación terapéutica posterior según los protocolos actuales(4).
La EI parece una técnica prometedora y alternativa factible al tratamiento de tumores no resecables, de los que en la actualidad, no se dispone de mejor opción terapéutica. Es fundamental la experiencia profesional y tener una curva de aprendizaje significativa para realizarla con seguridad, identificar los candidatos más apropiados, y contar con la infraestructura necesaria para el adecuado tratamiento de las posibles complicaciones. Los resultados publicados en la literatura son alentadores y abren la puerta a una investigación continua que descubra mayores usos clínicos.
Referencias
1. Petrou A, Moris D, Paul Tabet P, David Wensley Richards B, Kourounis G. Ablation of the locally advanced pancreatic cancer: An introduction and brief summary of techniques. J BUON Off J Balk Union Oncol. 2016;21(3):650-8.
2. Linecker M, Pfammatter T, Kambakamba P, DeOliveira ML. Ablation Strategies for Locally Advanced Pancreatic Cancer. Dig Surg. 2016;33(4):351-9.
3. Shah R, Ostapoff KT, Kuvshinoff B, Hochwald SN. Ablative Therapies for Locally Advanced Pancreatic Cancer. Pancreas. 2018;47(1):6-11.
4. Yan L, Chen Y-L, Su M, Liu T, Xu K, Liang F, et al. A Single-institution Experience with Open Irreversible Electroporation for Locally Advanced Pancreatic Carcinoma. Chin Med J (Engl). 2016;129(24):2920-5.
5. Al Efishat M, Wolfgang CL, Weiss MJ. Stage III pancreatic cancer and the role of irreversible electroporation. BMJ. 2015;350:h521.
6. de la Flor-Robledo M, Solís-Muñoz P, Sanjuán-Álvarez M, Abadal-Villayandre JM, Asensio-Merino F. Percutaneous irreversible electroporation of a renal tumor: Anesthetic management. Rev Esp Anestesiol Reanim. 2016;63(7):419-22.
7. Nielsen K, Scheffer HJ, Vieveen JM, van Tilborg AAJM, Meijer S, van Kuijk C, et al. Anaesthetic management during open and percutaneous irreversible electroporation. Br J Anaesth. 2014;113(6):985-92.
8. Martin RCG, Kwon D, Chalikonda S, Sellers M, Kotz E, Scoggins C, et al. Treatment of 200 locally advanced (stage III) pancreatic adenocarcinoma patients with irreversible electroporation: safety and efficacy. Ann Surg. 2015;262(3):486-94; discussion 492-494.
9. Kluger MD, Epelboym I, Schrope BA, Mahendraraj K, Hecht EM, Susman J, et al. Single-Institution Experience with Irreversible Electroporation for T4 Pancreatic Cancer: First 50 Patients. Ann Surg Oncol. 2016;23(5):1736-43.
10. Su J-J, Su M, Xu K, Wang P-F, Yan L, Lu S-C, et al. Postoperative inflammation as a possible cause of portal vein thrombosis after irreversible electroporation for locally advanced pancreatic cancer. World J Gastroenterol. 2017;23(32):6003-6.
