CARTA AL DIRECTOR
La excreción urinaria de creatinina en la reconstrucción de la composición corporal del ser humano
Urinary excretion of creatinine in the reconstruction of the body composition of the human being
Sergio Santana Porbén
Médico. Especialista de Segundo Grado en Bioquímica Clínica. Máster en Nutrición en Salud Pública. Profesor Asistente. Laboratorio de Estudios de la Función Renal. Servicio de Laboratorio Clínico. Hospital Pediátrico Docente “Juan Manuel Márquez”. La Habana. Cuba.
![]() http://orcid.org//0000-0001-6557-9875
http://orcid.org//0000-0001-6557-9875
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Sr. Director
Siempre ha existido la natural curiosidad en saber cómo está “construido” el ser humano.(1-2) La autopsia fue la primera herramienta desarrollada para responder a esta pregunta, y constituyó la base metodológica y conceptual sobre la que se edificaron después la Anatomía y la Medicina.(3-4) Se hace inmediato que la autopsia solo podría derivar conocimientos de cadáveres (muchas veces de personas enfermas y/o malnutridas), y ello introduciría sesgos debido a la preservación del cuerpo, y el estado de salud previo a la muerte, sin contar con la destreza del operario.
La siguiente revolución fue el desarrollo de métodos de “vivisección” para la reconstrucción de la composición de seres humanos a lo largo de los diferentes ciclos vitales de la existencia humana, así como en la salud como en la enfermedad.(5) Explotando un método desarrollado originalmente para estimar la cantidad de grasa existente en peces valiosos desde el punto de vista de la pesquería industrial, Siri (1956),(6) Siri(1961),(7) Keys & Brozek (1953),(8) y Brozek (1963)(9) concibieron la hidrodensitometría para estimar el tamaño respectivo de los compartimientos graso[1],[2] y no graso (léase también “magro”) del cuerpo. La estimación de la grasa corporal, y la construcción de modelos bicompartimentales[3], fueron durante mucho tiempo (aún lo son) insustituibles en el estudio de los vínculos entre la salud, la composición corporal del ser humano, y la aparición de las enfermedades crónicas no transmisibles.(10)
A pesar de todo lo dicho, los métodos bicompartimentales no podían aplicarse (por propia definición) en el estudio del músculo esquelético. El músculo esquelético (ME) constituye uno de los compartimentos corporales más importantes de la economía. El ME representa la tercera parte del peso de un sujeto de referencia(4,13) es uno de los determinantes del metabolismo energético del ser humano(14) y de la sensibilidad a la acción de la hormona insulina,(15) y sostiene tasas elevadas de agua y potasio.(16)
El ME puede ser estudiado mediante métodos imagenológicos (como la TAC y la RMN) y bioeléctricos (como la BIE).(17-20) Se tiene una aplicación de Medicina Nuclear que descansa en el recuento del isótopo K(40) del potasio.(21) Es inmediato que estos métodos puede que no estén disponibles de forma inmediata para profesionales e investigadores y/o demanden de una curva de aprendizaje y familiarización antes de explotarlos en todas sus capacidades.
La Antropometría podría ser otra herramienta para la cuantificación del tamaño de la ME.(22) Si se conoce la circunferencia de un segmento corporal especificado (siendo el brazo el de elección), y el grosor del panículo adiposo, entonces se puede reconstruir el área muscular del segmento corporal mediante una interpretación trigonométrica como la propuesta por Gurney & Jellife (1973).(23) Obtenida el área muscular del segmento corporal, ésta se puede escalar hasta el peso total del ME mediante ecuaciones validadas contra un método imagenológico.(24) Sin embargo, la reconstrucción antropométrica del ME descansa en muchos presupuestos muchas veces ideales antes que realistas, así como en la destreza del operario.
El tamaño del ME se podría obtener a una fracción de costo mediante la determinación de las cantidades de creatinina excretadas en una colección de orina de 24 horas.(25) En efecto, > 98 % de la creatinina corporal está contenida en el ME. La creatinina es el producto de la degradación del fosfato de creatina: la forma molecular de almacenamiento de la energía destinada a la contracción muscular. Una vez que se consume el grupo fosfato de alta energía que contiene, la creatina se transforma de forma irreversible en creatinina, y ésta se filtra libremente por el riñón en la orina[4].
La presencia de creatinina en una muestra de orina se puede revelar mediante la reacción de Jaffé: un clásico del trabajo del Laboratorio Clínico.(27-28) También están disponibles métodos enzimáticos para la cuantificación de la creatinina urinaria.(29)
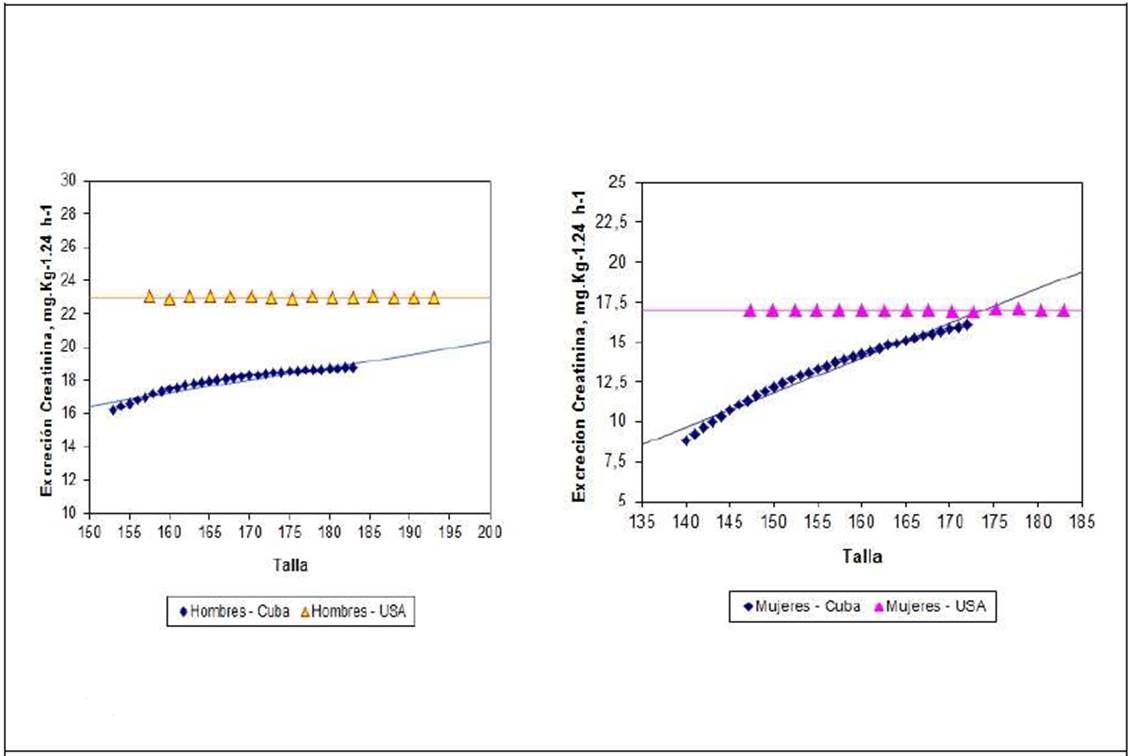
En condiciones naturales, 1 gramo de creatinina que se excreta en 24 horas representa entre 17 – 20 kg de ME[5].(30,31) Se ha estimado que un adulto cubano de 35 años, con un peso adecuado para la talla, excreta como promedio 1,200 mg/24 horas, lo que equivaldría a 20.4 – 24.0 kg de ME. Esto representaría entre el 29.1 – 34.3 % del peso corporal.(32-34) Por su parte, la excreción urinaria de creatinina en una cubana adulta de la misma, con un peso esperado según la talla, sería de 880 mg/24 horas. Estos resultados son cuanto más interesantes cuando se les compara con los obtenidos en estudiantes universitarios de uno u otro sexo.(35) (Figura 1).
La excreción urinaria de creatinina emula la acreción de tejido magro que ocurre durante la infancia y la adolescencia. En un estudio retrospectivo de niños y adolescentes atendidos en un Servicio de Laboratorio Clínico de un hospital pediátrico, se recuperaron las colecciones de 24 horas de orina que se juzgaron como “Adecuadas” para el cálculo de la excreción urinaria de creatinina.(36) Los valores estimados se distribuyeron según el sexo y la edad.(36) Las curvas obtenidas muestran el comportamiento en forma de “S” que se espera de la acreción de tejido magro durante las etapas de máximo crecimiento y desarrollo del ser humano.(36) La superposición de las curvas de excreción urinaria de creatinina obtenidas de niños y adolescentes cubanos y alemanes revelaron interesantes diferencias respecto de la edad del probando.(36.37)
Finalmente, la excreción urinaria de creatinina podría reflejar el cambio que se produce en el sujeto durante el envejecimiento y como resultado de la sarcopenia. En otro estudio retrospectivo de adultos mayores asistidos en un Servicio de Laboratorio Clínico de un hospital clínico-quirúrgico de la ciudad de La Habana, se observó que los hombres de 65 años exhiben una excreción de 800 mg/24 horas: la tercera parte de un sujeto de referencia; cambio éste que podría caracterizar mejor cómo se distribuye el peso corporal en estas edades entre los compartimientos graso y no graso.(38) En el caso de la mujer con 65 años de edad, la creatinina excretada se estimó en unos 600 mg/24 horas.(38) El estudio antes citado también avanzó un estimado de la tasa anual de cambio de la excreción urinaria de creatinina después de los 60 años de edad según el sexo.(38) Esta tasa fue mayor en las mujeres de la tercera edad, y sugeriría una mayor vulnerabilidad del sexo femenino ante la sarcopenia asociada | secundaria al envejecimiento.(38)
|
|
|
Reproducido con autorización de: Referencia(32). |
Figura 1. Excreción urinaria de la creatinina según el sexo y la población de pertenencia. Izquierda: Hombres. Derecha: Mujeres. La excreción urinaria de creatinina se ajustó según el peso corporal del sujeto. La población cubana de estudio comprendió personas de ambos sexos con edades entre 19 – 59 años atendidos en un Servicio hospitalario de Laboratorio Clínico. Por su parte, la población norteamericana se correspondió con estudiantes universitarios.
Si se asegura una colección de orina representativa de un día en la vida del paciente, y la observancia de las Buenas Prácticas Analíticas, la excreción urinaria de creatinina podría ser una herramienta insustituible en la reconstrucción corporal del ser humano en distintas condiciones de salud y enfermedad. Una tasa disminuida de excreción urinaria de creatinina refleja una depleción importante de la masa muscular esquelética.(31)
Adicionalmente, la excreción urinaria de creatinina obtenida en un paciente se puede correlacionar con la esperada para la población de pertenencia mediante el índice de excreción de creatinina[6].(35) Se puede establecer la depleción del ME en el paciente si el índice encontrado < 80 % respecto de sus pares. En una paciente atendida por una estenosis pilórica benigna complicada la excreción urinaria de creatinina representó menos de la mitad de la esperada para el sexo y la edad.(39,40) En otra paciente asistida por una rabdomiolisis en el curso de una polimiositis, la excreción urinaria de creatinina emuló la depleción ocurrida en la masa muscular esquelética.(41) Fue solo llamativo que el destete del ventilador fuera posible cuando se comprobó el aumento en las cantidades excretadas de creatinina como respuesta al programa de intervención alimentaria, nutricional y metabólica que se conducía en la paciente.(41)
Sin embargo, la excreción urinaria de creatinina ha sido objeto de críticas importantes. Hoy es una herramienta en desuso debido a la imposibilidad de asegurar una colección “correcta” de 24 horas de la orina del enfermo[7].(42) Por otro lado, la creatinina aparecida en la orina pudiera reflejar también la cuantía de la ingestión de carnes rojas[8].(43-45) Asimismo, se ha descrito la producción de creatinina a nivel del sistema tubular renal,(26) producción que puede ser bloqueada mediante la cimetidina. Igualmente, la introducción de métodos enzimáticos de determinación de creatinina en la actividad del Laboratorio Clínico obligaría a la recalibración de los sistemas analíticos para compensar diferencias en las respuestas instrumentales.(29)
Por último, y el orden una vez más no demerita la fuerza del argumento, la excreción urinaria de creatinina es calificado como un método doblemente indirecto de reconstrucción corporal por cuanto es un estimador del tamaño del ME que se basa en el comportamiento químico de uno de los componentes estructurales del mismo, pero que no se relaciona con el contenido de las proteínas propietarias del ME como la miosina y/o actina.(46,47)
No obstante todas estas críticas, la excreción urinaria de creatinina sigue siendo una ventana de estudio de la composición corporal del ser humano con aplicaciones insospechadas en la práctica clínica y asistencial. En tal sentido, se han de destacar los trabajos de Badell Moore et al. (2015a)(48) y Badell Moore et al. (2015b),(49) quienes han derivado ecuaciones predictivas de la excreción urinaria de creatinina a partir del conocimiento de las características antropométricas y la concentración sérica de creatinina del sujeto, y cuya exactitud ha sido validada independientemente mediante la tecnología DEXA.
Referencias
1. Wang Z, Shen W, Withers RT, Heymsfield SB, Lohman TG, Going SB. Human body composition. Human Kinetics. Champaign [Illinois]: 2005.
2. Wang Z-M, Wang Zh‐M, Heymsfield SB. History of the study of human body composition: A brief review. Am J Human Biol 1999;11:157-65.
3. Bischoff E. Einige gewichts- und trocken- bestimmungen der organe des menschlichen körpers. Z Ration Med 1863;20:75-118.
4. Clarys JP, Martin AD, Drinkwater DT. Gross tissue weights in the human body by cadaver dissection. Hum Biol 1984;56:459-73.
5. Ellis KJ. Human body composition: In vivo methods. Physiol Rev 2000;80:649-80.
6. Siri WE. The gross composition of the body. Adv Biol Med Phys 1956;4:239-80.
7. Siri WE. Body composition from fluid spaces and density: Analysis of methods. En: Techniques for measuring body composition [Editores: Brozek J, Henschel A]. National Academy of Sciences. Washington DC: 1961. pp. 223-244.
8. Keys A, Brozek J. Body fat in adult man. Physiol Rev 1953;33:245-345.
9. Brozek J. Densitometric analysis of body composition: Revision of some quantitative assumptions. Ann NY Acad Sci 1963;110:113-40.
10. Withers RT, Laforgia J, Heymsfield SB. Critical appraisal of the estimation of body composition via two‐, three‐, and four‐compartment models. Am J Hum Biol 1999;11:175-85.
11. Durnin JVGA, Ramahan MM. The assessment of the amount of fat in the human body from measurement of skinfold thickness. Br J Nutr 1967;21:681-9.
12. Durnin JVGA, Womersley J. Body fat assessed from total body density and its estimation from skinfold thickness: measurements on 481 men and women aged from 16 to 72 years. Br J Nutr 1974;32:77-97.
13. Janssen I, Heymsfield SB, Wang Z, Ross R. Skeletal muscle mass and distribution in 468 men and women aged 18-88 years. J Appl Physiol 2000;89:81-8.
14. Zurlo F, Larson K, Bogardus C, Ravussin E. Skeletal muscle metabolism is a major determinant of resting energy expenditure. J Clin Invest 1990;86:1423-7.
15. Petersen KF, Dufour S, Savage DB, Bilz S, Solomon G; et al. The role of skeletal muscle insulin resistance in the pathogenesis of the metabolic syndrome. Proc Nat Acad Sci 2007;104:12587-94.
16. Henneman E, Olson CB. Relations between structure and function in the design of skeletal muscles. J Neurophysiol 1965;28:581-98.
17. Evans WJ, Heymsfield SB, Gallagher D, Visser M, Nuñez C, Wang ZM. Measurement of skeletal muscle: laboratory and epidemiological methods. J Gerontol Ser A Biol Sci Med Sci 1995;50:23-9.
18. Proctor DN, O’Brien PC, Atkinson EJ, Nair KS. Comparison of techniques to estimate total body skeletal muscle mass in people of different age groups. Am J Physiol Endocrinol Metab 1999;277:E489-E495.
19. Heymsfield SB, Smith R, Aulet M, Bensen B, Lichtman S, Wang JPRJ, Pierson Jr RN. Appendicular skeletal muscle mass: measurement by dual-photon absorptiometry. Am J Clin Nutr 1990;52:214-8.
20. Janssen I, Heymsfield SB, Baumgartner RN, Ross R. Estimation of skeletal muscle mass by bioelectrical impedance analysis. J Appl Physiol 2000;89:465-71.
21. Wang Z, Zhu S, Wang J, Pierson Jr RN, Heymsfield SB. Whole-body skeletal muscle mass: development and validation of total-body potassium prediction models. Am J Clin Nutr 2003;77:76-82.
22. Lee RC, Wang ZM, Heo M, Ross R, Janssen I, Heymsfield SB. Total-body skeletal muscle mass: development and cross-validation of anthropometric prediction models. Am J Clin Nutr 2000;72:796-803.
23. Gurney JM, Jelliffe DB.. Arm anthropometry in nutritional assessment: Nomogram for rapid calculation of muscle circumference and cross-sectional muscle and fat areas. Am J Clin Nutr 1973;26:912-5.
24. Heymsfield SB, McManus C, Smith J, Stevens V, Nixon DW. Anthropometric measurement of muscle mass: Revised equations for calculating bone-free arm muscle area. Am J Clin Nutr 1982;36:680-90.
25. Forbes GB, Bruining GJ. Urinary creatinine excretion and lean body mass. Am J Clin Nutr 1976;29:1359-65.
26. Fitch CD, Lucy DD, Bomhofen JH, Dalrymple GV. Creatine metabolism in skeletal muscle: Creatine kinetics in man. Neurology 1968;18:32-42.
27. Narayanan S, Appleton HD. Creatinine: A review. Clin Chem 1980;26:1119-26.
28. Hervey GR. Determination of creatinine by the Jaffe reaction. Nature 1953;171: 1125-5.
29. Sugita O, Uchiyama K, Yamada T, Sato T, Okada M, Takeuchi K. Reference values of serum and urine creatinine, and of creatinine clearance by a new enzymatic method. Ann Clin Biochem 1992;29(Pt 5):523-8.
30. Burger M. The meaning of creatinine coefficient for the quantitative measurement of muscle mass and body composition. Creatine and creatinine excretion: Relationship to muscle mass. Z Gesamte Exp Med 1919;9:361-99.
31. Walser M. Creatinine excretion as a measure of protein nutrition in adults of varying age. JPEN J Parenter Enteral Nutr 1987;11(Suppl 5):S73-S78.
32. Barreto Penié J, Santana Porbén S, Consuegra Silverio D. Intervalos de referencia locales para la excreción urinaria de creatinina en una población adulta. Nutrición Hospitalaria [España] 2003;18:65-75.
33. Santana Porbén S. Valores locales de referencia para la excreción urinaria de creatinina: Una actualización. RCAN Rev Cubana Aliment Nutr 2014;24:220-30.
34. Bacallao Méndez R. La creatinina como indicador del tejido muscular esquelético y el estado nutricional. RCAN Rev Cubana Aliment Nutr 2015;25(1 Supl):S4-S23.
35. Bistrian BR, Blackburn GL, Sherman M, Scrimshaw NS. Therapeutic index of nutrition depletion in hospitalized patients. Surg Gynecol Obstet 1975;141:512-6.
36. Monteagudo Rodríguez Y, Santana Porbén S, Salabarría González JR. Intervalos locales de referencia para la excreción urinaria de creatinina en niños y adolescentes cubanos. RCAN Rev Cubana Aliment Nutr 2015;25(1 Supl):S59-S90.
37. Remer T, Neubert A, Maser-Gluth G. Anthropometry-based reference values for 24-h urinary creatinine excretion during growth and their use in endocrine and nutritional research. Am J Clin Nutr 2002;75:561-9.
38. Balmaseda Bataille I, Blanco Mesa B, Salabarría González JR, Santana Porbén S. Sobre la excreción urinaria de creatinina en la tercera edad. RCAN Rev Cubana Aliment Nutr 2015;25(1 Supl):S102-S111.
39. Santana Porbén S, Barreto Penié J, Martínez González C, Espinosa Borrás A, Morales Hernández L. Evaluación nutricional. Acta Médica 2003;11:26-37.
40. Santana Porbén S. ¿Cómo saber que el paciente quirúrgico está desnutrido? Nutrición Clínica [México] 2004;7:240-50.
41. Santana Porbén S. Apoyo nutricional en el destete del ventilador: A propósito de un caso. RCAN Rev Cubana Aliment Nutr 2010;20:10:351-60.
42. Webster J, Garrow JS. Creatinine excretion over 24 hours as a measure of body composition or of completeness of urine collection. Hum Nutr Clin Nutr 1985;39: 101-6.
43. Crim MC, Calloway DH, Margen S. Creatine metabolism in men: Urinary creatine and creatinine excretions with creatine feeding. J Nutr 1975;105:428-38.
44. Crim MC, Calloway DH, Margen S. Creatine metabolism in men: Creatine pool size and turnover in relation to creatine intake. J Nutr 1976;106:371-81.
45. Bleiler RE, Schedl HP. Creatinine excretion: Variability and relationships to diet and body size. J Lab Clin Med 1972;59:945-55.
46. Heymsfield SB, Arteaga C, McManus C, Smith J, Moffitt S. Measurement of muscle mass in humans: Validity of the 24-h urinary creatinine method. Am J Clin Nutr 1983;37:478-94.
47. Wang ZM, Gallagher D, Nelson M, Matthews DE, Heymsfield SB. Total-body skeletal muscle mass: Evaluation of 24-h urinary creatinine excretion by computerized axial tomography. Am J Clin Nutr 1996;63:863-9.
48. Badell Moore A, Bacallao Méndez R, Caldevilla Rodríguez Y. Excreción urinaria de creatinina en adultos sanos y su correlación con el tamaño de la masa magra corporal estimado mediante absorciometría de rayos x de doble emisión. RCAN Rev Cubana Aliment Nutr 2015;25(Supl 1):S112-S130.
49. Badello Moore A, Bacallao Méndez R, Mañalich Comas R. Sobre el establecimiento de valores de referencia de la excreción urinaria de creatinina para la población cubana. RCAN Rev Cubana Aliment Nutr 2015;25(1 Supl):S28-S58.