
REVISIÓN
Telómeros, telomerasa y envejecimiento. Una visita al Premio Nobel de Fisiología y Medicina de 2009
Telomeres, telomerase and aging. A visit to the 2009 Nobel Prize in Physiology and Medicine
Cristina Soriano Amador1, Francisco J. Sánchez-Muniz2
1 Alumna del Doble Grado Farmacia y Nutrición Humana y Dietética Universidad Complutense de Madrid.
2 Catedrático Emérito de Nutrición. Facultad de Farmacia de la Universidad Complutense de Madrid y Académico de número de la Real Academia Nacional de Farmacia, España
![]() https://orcid.org/0000-0002-2660-5126
https://orcid.org/0000-0002-2660-5126
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Resumen
Introducción. En octubre de 2009, Elizabeth H. Blackburn, Carol W. Greider y Jack W. Szostak fueron galardonados por sus descubrimientos sobre los telómeros y la enzima telomerasa con el Premio Nobel de Fisiología y Medicina. Posteriormente muchas investigaciones, entre las que destacan la de científicos españoles han demostrado el papel de los telómeros en el envejecimiento y en algunas patologías relacionadas.
Métodos. Para la realización de este trabajo se ha revisado tres aspectos: a) la información dada por el Comité del Nobel sobre las investigaciones de los tres galardonados; b) los mecanismos moleculares implicados en el proceso de protección de los telómeros por la acción de la telomerasa y c) la relación entre envejecimiento y sistema telómeros/telomerasa.
Resultados. En las células eucariotas los telómeros constituyen el extremo terminal de los cromosomas, los cuales se acortan en cada división celular. Cuando el acortamiento es crítico, se induce daño persistente al ADN en estos extremos, senescencia, apoptosis y pérdidas de la capacidad regenerativa de los tejidos. Dada la imposibilidad de replicación completa de los telómeros por la ADN polimerasa después de cada división celular, la telomerasa, una ribonucloproteína retrotranscriptasa, actúa alargando los extremos de los cromosomas, utilizando como molde una porción de su propio ARN. Muchos factores determinan la longitud de los telómeros, sobresaliendo el acortamiento de los telómeros y la pérdida de actividad telomerásica. Además, existen multitud de factores que condicionan las diferencias entre edad fisiológica y edad cronológica.
Conclusión. Entre las muchas teorías sobre el envejecimiento sobresale la que relaciona el acortamiento de los telómeros con la senescencia. No obstante se requieren más estudios en los que se determine qué mecanismos epigenéticos y de otra índole condicionan la pérdida de actividad telomerásica y la longitud de los telómeros.
Palabras clave
Disquerina; Premio Nobel; Shelterina; Telómeros; telomerasa; telosoma
Abstract
Introduction. In October 2009, Elizabeth H. Blackburn, Carol W. Greider, and Jack W. Szostak were awarded the Nobel Prize in Physiology and Medicine for their discoveries about telomeres and the enzyme telomerase. Subsequently, many investigations, including that of Spanish scientists, have demonstrated the role of telomeres in aging and in some very prevalent pathologies.
Methods. Three topics were reviewed to perform this article: a) the information given by the Nobel Committee on the research of the three winners of 2009 award; b) the molecular mechanisms involved in the protection process of telomeres by the telomerase enzyme; and c) the relationship between aging and the telomere/telomerase system.
Results. In eukaryotic cells, telomeres constitute the terminal end of chromosomes, which are shortened within each cell division. When the shortening becomes critical, persistent DNA damage at these ends, senescence, apoptosis and loss of the tissues regenerative capacity are induced. Given the unfeasibility of telomeres complete replication by the DNA polymerase after each cell division, the telomerase, a reverse transcriptase ribonucloprotein, works by lengthening the ends of chromosomes, using as a template a portion of its own RNA. Several factors determine the length of telomeres and/or the loss of telomerase activity, with aging standing out. In addition, there are many factors that determine the differences between physiological and chronological age.
Conclusion. Among aging theories, the one relating the shortening of telomeres with senescence stands out. However, more studies are required to determine which epigenetic and other mechanisms determine the loss of telomerase activity and the length of telomeres.
Keywords
Aging; dyskerin; Nobel prize; shelterin; telomeres; telomerase
Introducción
Este trabajo especial es la repuesta a una convocatoria que JONNPR realizó hace ya tres años a raíz del premio Nobel de Fisiología y Medicina concedido a tres americanos, Jeffrey C. Hall, Michael Rosbash y Michael W. Young por sus descubrimientos sobre los mecanismos moleculares que controlan el ritmo circadiano(1). En aquella publicación surgió la invitación a nuestros lectores para colaborar en un artículo que revisara y tratara cualquier tema premiado con el Nobel entre los años 2000 y 2016(1). Posteriormente y durante los años 2018 y 2019 hemos también hecho la misma convocatoria(2,3). Hace unas semanas, publicábamos una editorial sobre el Premio Nobel de Fisiología y Medicina de 2020 que premiaba la labor y trayectoria de Harvey J. Alter, Michael Houghton y Charles M. Rice por el descubrimiento del virus de la hepatitis C y por su contribución decisiva a la lucha contra dicha enfermedad que se transmite y que ha llevado a un control y cura casi absolutos de la hepatitis C(4). En ella señalábamos que estaba en marcha una revisión sobre los trabajos e investigaciones que condujeron a la concesión del Premio Nobel en 2009 sobre la significación de los telómeros y de la telomerasa evitando su acortamiento, y la implicación de este sistema ralentizando el envejecimiento.
El envejecimiento. Teorías más comunes
La lucha del ser humano contra la muerte buscando ampliar la expectativa de vida es un hecho irrefutable(5). Su importancia radica en el elevado número de personas mayores de 65 años en el mundo (prácticamente 700 millones; 9% de la población mundial)(6) y en el elevado número de enfermedades asociadas al envejecimiento(5). Se han propuesto más de 300 teorías para explicar los mecanismos implicados en el proceso del envejecimiento, que implica un declive endógeno y progresivo en la eficacia de los procesos fisiológicos tras la fase reproductora de la vida común a todos los organismos multicelulares. Conlleva cambios psicológicos y fisiológicos graduales y progresivos que no ocurren siempre a la misma velocidad y son muy variables entre individuos. Las teorías se agrupan en alteraciones o modificaciones Estocásticas (que implican aparición de daños al azar) y Genético-evolucionistas (los cambios están programados y/o dependen de variaciones genéticas debidas a la evolución). No obstante, puede afirmarse que ninguna teoría explica totalmente los procesos del envejecimiento(7). Entre las más reconocidas se encuentran la del estrés oxidativo que atañe al núcleo, mitocondrias y otras organelas celulares, afectando al ADN mitocondrial y nuclear. También se encuentra la teoría de los genes geroprotectores que alargan la vida, la existencia de mecanismos epigenéticos que reducen la actividad celular, etc. No obstante entre las teorías estocáticas, una de las que tiene un mayor reconocimiento mundial es la relacionada con el límite de la duplicación celular que implican a la longitud de los telómeros (7).
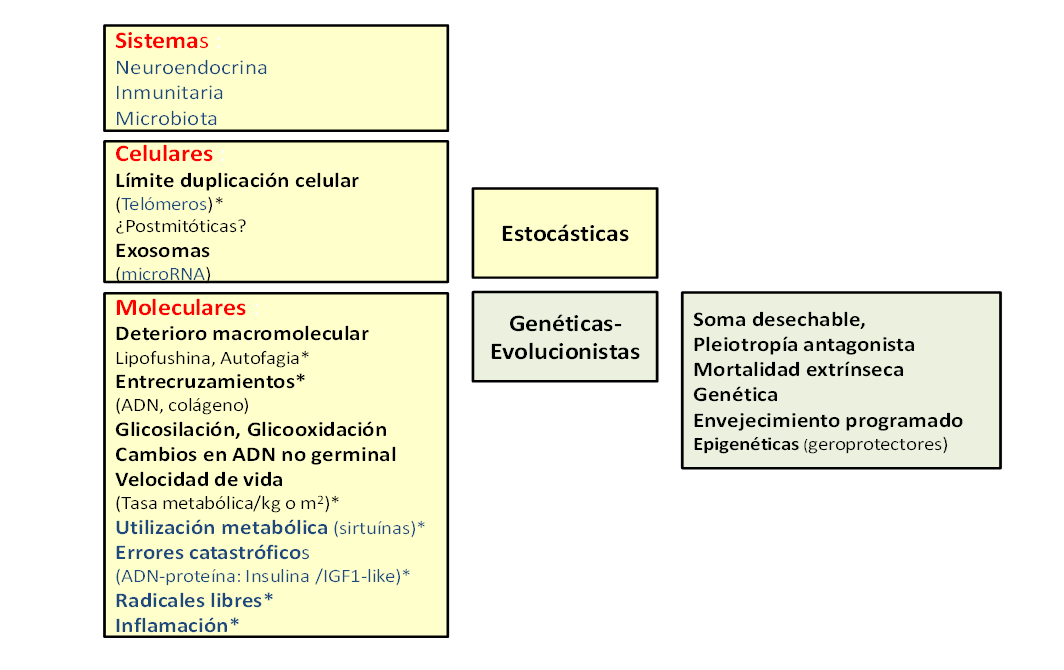
Figura 1. Teorías del envejecimiento. Se señalan las teorías estocásticas (en amarillo claro) y genético-evolucionistas (en celeste). Fuente: Sánchez-Muniz(7).
El Premio Nobel de Fisiología y Medicina de 2009. Burocracia y boato. Telómeros y telomerasa
Para el desarrollo y puesta al día de este tema complejo, se ha contado con la colaboración inestimable de una alumna avanzada y muy trabajadora del doble grado de Farmacia y Nutrición y Dietética Humana que ha ido revisando desde hace meses el tema y elaborando esquemas y conceptos que faciliten entender a los lectores de JONPPR los aspectos complejos de la biología molecular relacionada con la protección genética contra el acortamiento de los telómeros que implica la pérdida de funciones por la célula y por ende el envejecimiento.
En este trabajo especial se revisan primero los aspectos burocráticos que atañeron al Nobel en 2009(8). También las investigaciones que fueron preparando el camino del Nobel, para posteriormente señalar qué son los telómeros y cómo actúa la enzima telomerasa, para ultimar en una sección titulada «Telómeros y prevención del envejecimiento».
Este artículo no pretende hacer una revisión exhaustiva de estos aspectos, aunque sí recordar que las investigaciones que condujeron al Premio Nobel han cambiado el concepto del envejecimiento y abierto amplia discusión del papel de los telómeros en células mitóticas y no-mitóticas y la búsqueda de aspectos terapéuticos y nutricionales/ambientales que ralenticen el acortamiento de los extremos terminales de los cromosomas en las células eucarióticas.
Cada 10 de diciembre, fecha de la muerte de Alfred Nobel, tal como lleva haciéndose desde 1901 y con la excepción de los años marcados por las dos grandes guerras Mundiales, tiene lugar primero en Oslo la ceremonia de entrega del Premio Nobel de la Paz y unas horas después en Estocolmo para el resto de los Premios Nobel(8). Estos premios, instituidos por el químico e inventor Alfred Nobel en su testamento, y organizados y administrados desde hace más de un siglo por la Fundación que lleva su nombre, es uno de los galardones más prestigiosos del mundo y se concede tal como figura en la página oficial del Premio «For the greatest benefits to humankind» (traducción libre al castellano «Para mayor beneficio de la humanidad»(1-3).
El galardón del Premio Nobel demanda un exhaustivo proceso de nominación y selección donde intervienen numerosas personas e instituciones de reconocido prestigio en los diferentes campos que abarcan este premio y en particular en el de Fisiología y Medicina del que nos ocupamos en esta breve revisión. Grosso modo, el procedimiento comienza en septiembre del año previo a la concesión, cuando el Comité del Nobel de Fisiología y Medicina envía de forma confidencial invitaciones a renombrados profesionales miembros del Instituto Karolinska, profesores universitarios de Fisiología y Medicina en los países aledaños, y miembros de la Real Academia Sueca de las Ciencias para que propongan candidatos que puedan optar al galardón en esta modalidad. Las propuestas de los candidatos se envían posteriormente al Comité justo antes de terminar el mes de enero del año de concesión del Nobel, y durante el mes de febrero, dicho organismo examina los nombres propuestos. Entre los meses de marzo y mayo, dicho Comité consulta sobre la adecuación de los candidatos preliminares y emite un informe que recoge todos los antecedentes e información de la proposición y lo remite a la Asamblea del Nobel, la cual debate sobre estos aspectos en dos reuniones, sometiéndose a principio de octubre a votación de sus miembros la decisión inapelable sobre la designación de los elegidos ganadores(9).
El cinco de octubre de 2009 el Secretario del Comité del Nobel de Fisiología y Medicina, el profesor Göran K. Hansson, hacía público a los medios lo siguiente (sic) «The Nobel Assembly at Karolinska Institutet has today decided to award the Nobel Prize in Physiology or Medicine 2009 jointly to Elizabeth H. Blackburn, Carol W. Greider and Jack W. Szostak for the discovery of how chromosomes are protected by telomeres and the enzyme telomerase» (traducción libre «El comité de la Fundación Nobel en el Instituto Karolinska ha decidido hoy conceder el premio Nobel de Fisiología y Medicina conjuntamente a Elizabeth H. Blackburn, Carol W. Greider y Jack W. Szostak por su descubrimiento en cómo los cromosomas son protegidos por la enzima telomerasa»)(8).
Estos tres cientificos (Figura 2) habían conseguido resolver uno de las mayores incognitas de la biología: cómo los cromosomas podían ser copiados integramente durante la division celular y a la vez ser protegidos contra la degradación. Elizabeth Blackburn y Jack Szostak descubrieron que una secuencia de ADN única y presente en los telómeros protege a los cromosomas de ser degradados. Carol Greider y Elizabeth Blackburn identificaron a la enzima telomerasa, la enzima capaz de producir el ADN telomérico.



Figura 2. Carol W. Grieder (izquierda), Jack W. Szostak (centro) y Elizabeth H. Blackburn (derecha) galardonados con el premio Nobel de Fisiología y Medicina de 2009(8). Fuente: https://es.wikipedia.org/wiki/Anexo:Ganadores_del_Premio_Nobel_de_Fisiolog%C3%ADa_o_Medicina
Sin embargo esta noticia tan escueta, tuvo un camino largo y complejo hasta que vio la luz en 2009, como se muestra de forma esquemática en la Figura 3.
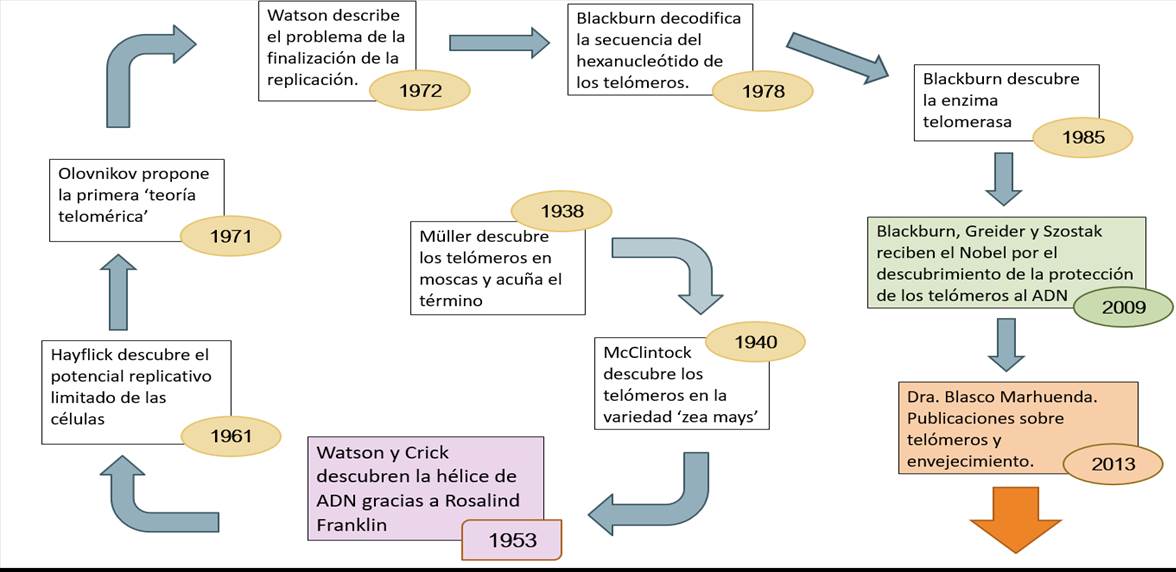 Figura
3. La carrera del Nobel 2009 en el descubrimiento de los
telómeros y su papel protector de la integridad de los cromosomas. Se
incluye una casilla en la que se destaca la personalidad de la Dra. Blasco por
sus investigaciones que relacionan a los telómeros con el envejecimiento.
Figura
3. La carrera del Nobel 2009 en el descubrimiento de los
telómeros y su papel protector de la integridad de los cromosomas. Se
incluye una casilla en la que se destaca la personalidad de la Dra. Blasco por
sus investigaciones que relacionan a los telómeros con el envejecimiento.
Así, ya en la década de los años 30 del siglo XX, Hermann Muller (Premio Nobel en 1946) y Barbara McClintock (Premio Nobel en 1983) habían observado en sus investigaciones
que las estructuras finales de los cromosomas, los telómeros, parecían evitar que los cromosomas se desestructurasen y se unieran entre sí, sugiriendo un posible papel protector de esta parte de los cromosomas(8). Pero de qué forma lo lograban seguía siendo un enigma que comenzó a ver la luz con las investigaciones de los tres laureados de 2009. En los primeros años de su carrera como investigadora, Elizabeth Blackburn “mapeó” secuencias de ADN. Mientras estudiaba los cromosomas de Tetrahymena, un organismo unicelular ciliado, identificó una secuencia de ADN que se repetía varias veces al final de los cromosomas.
La función de esta secuencia, CCCCAA, no estaba clara. A la vez, Jack Szostak había observado que una molécula de ADN lineal, un tipo de mini cromosoma, se degradaba con rapidez cuando era introducida en levaduras. En 1980, Blackburn presentó los resultados que había obtenido en un congreso, captando la atención de Szostak. Decidieron realizar un experimento conjunto enlazando resultados de dos especies muy distintas. Blackburn aislaba las secuencias CCCCAA de Tetrahymena, mientras que Szostak las acoplaba a los minicromosomas que introducía en las levaduras.
En 1982 publicaron los resultados en los que se indicaba que estas secuencias CCCCAA eran capaces de proteger a los minicromosomas de la degradación en el interior de las levaduras. El hecho de haber realizado esta investigación en dos especies tan distintas, Tetrahymena y las levaduras, les llevó a concluir inequívocamente que estaban frente al descubrimiento de un mecanismo “universal” y fundamental, no conocido previamente, pero que fue posteriormente puesto de manifiesto en la mayoría de las plantas y animales.
Carol Greider, por entonces una estudiante de posgrado, y Blackburn, su maestra, comenzaron a investigar si la formación del ADN telomérico podría ser debida a una enzima desconocida. El día de Navidad de 1984, Greider encontró signos de actividad enzimática en un extracto celular. Blackburn y Greider nombraron a la enzima desconocida con el nombre de telomerasa, la purificaron y comprobaron que en su ARN estaba contenida la secuencia CCCCAA. Posteriormente pudieron demostrar que esta secuencia servía como molde en la construcción del ADN telomérico, proporcionando una extensión de ADN que permitía a las ADN polimerasas celulares copiar toda la longitud del cromosoma sin perder la porción final de ADN.
Estructura de los telómeros. Su significación y sentido fisiológico y genético
Los telómeros (10,11) – del griego «telos» que significa «final» y «meros» que significa «parte» - son estructuras evolutivamente conservadas, de una longitud de varios pares de kilobases, localizadas en los extremos de los cromosomas lineales de las células eucariotas (Figura 4). Los telómeros están compuestos por secuencias repetidas de ADN no codificante(12) (miles de repeticiones del hexanucleótido TTAGGG) asociadas a proteínas con las que forman el complejo multiproteico denominado shelterina/telosoma(13-15) (Figura 4 y Figura 5).
Estas secuencias hexaméricas repetidas de ADN son potencialmente expansionables y no codificables. Van unidos al complejo multiproteico especializado denominado shelterina/telosoma (Figura 4).
Los telómeros cumplen un rol esencial en la preservación de la integridad cromosómica, protegiendo al ADN codificante de la acción enzimática y de su degradación, contribuyendo al mantenimiento de la estabilidad cromosómica; mediante importantes interacciones entre los cromosomas y la matriz nuclear, pudiendo además ejercer efectos sobre la transcripción de genes situados en regiones subteloméricas e interactúan con los mecanismos regulatorios del ciclo celular(12).
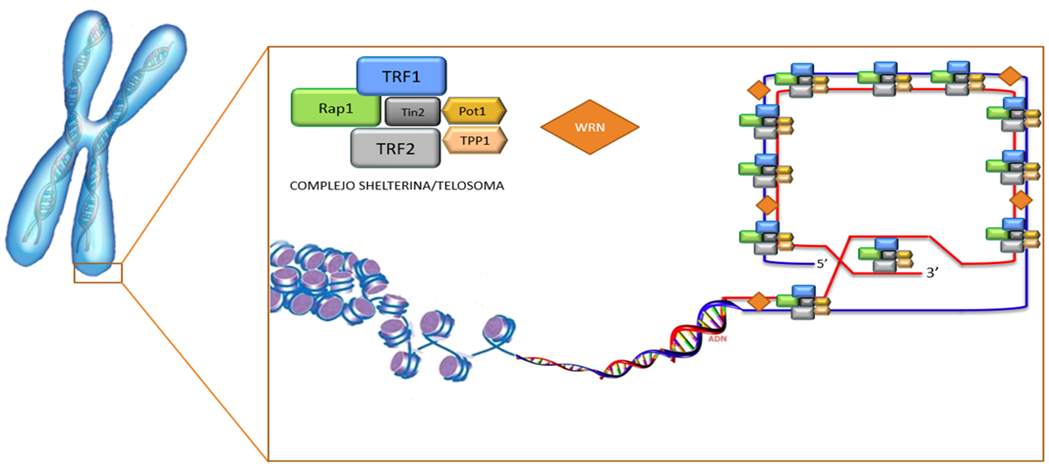
Figura 4. Estructura de los telómeros con el tapón telomérico. Los telómeros son estructuras especializadas de los extremos de los cromosomas que contienen repeticiones en tándem de una secuencia corta de ADN que se añade al extremo 3’ por la enzima telomerasa. Los telómeros estabilizan a los cromosomas previniendo la pérdida genómica después de cada replicación celular y se asocian con proteínas para formar un tapón que “oculta” los extremos cromosómicos de la maquinaria celular de reparación del ADN. Se señalan en colores las proteínas estabilizantes de los telómeros asociadas a la cadena de nucleótidos y que forman parte del sistema Shelterina/Telosoma y que ejerce un papel fundamental en la regulación de la longitud telomérica y en su protección. Modificado de Grifiths y col.(16)
La replicación de los telómeros presenta un dilema especial que se denomina «problema de la replicación terminal»(10-12,15-17). Durante la división celular, los telómeros de las células somáticas normales no pueden replicarse totalmente por el complejo ADN-polimerasa convencional, debido al “desajuste” en la replicación de las dos cadenas del ADN. Para solucionar este problema, las células eucariotas utilizan la enzima telomerasa (TER en ingles por sus iniciales de telomerase reverse transcriptase), una ribonucloproteína retrotranscriptasa que actúa alargando los extremos de los cromosomas con una secuencia específica utilizando como molde una porción de su propio componente integral RNA. De esta manera, la denominada senescencia celular, está asociada a la ausencia de actividad telomerasa que condiciona a su vez la pérdida de la capacidad replicativa y el acortamiento de los telómeros. La telomerasa reconoce el extremo 3’-OH en el extremo de los cromosomas y añade las secuencias repetidas de TTAGGG de novo(15-17) (Figura 5). La mayoría de los organismos multicelulares poseen cantidades limitadas de telomerasa, que hace que se verifique el acortamiento de los telómeros acoplado a la división celular. A su vez puede verse acelerado este acortamiento debido a la acción de nucleasas y otros agentes lesivos del ADN.
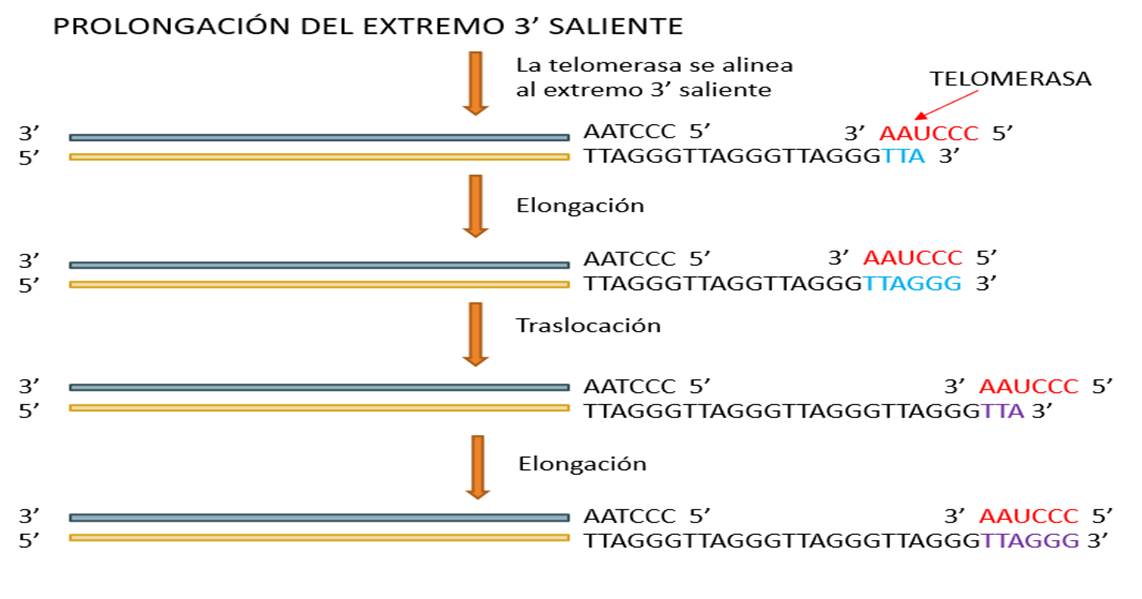
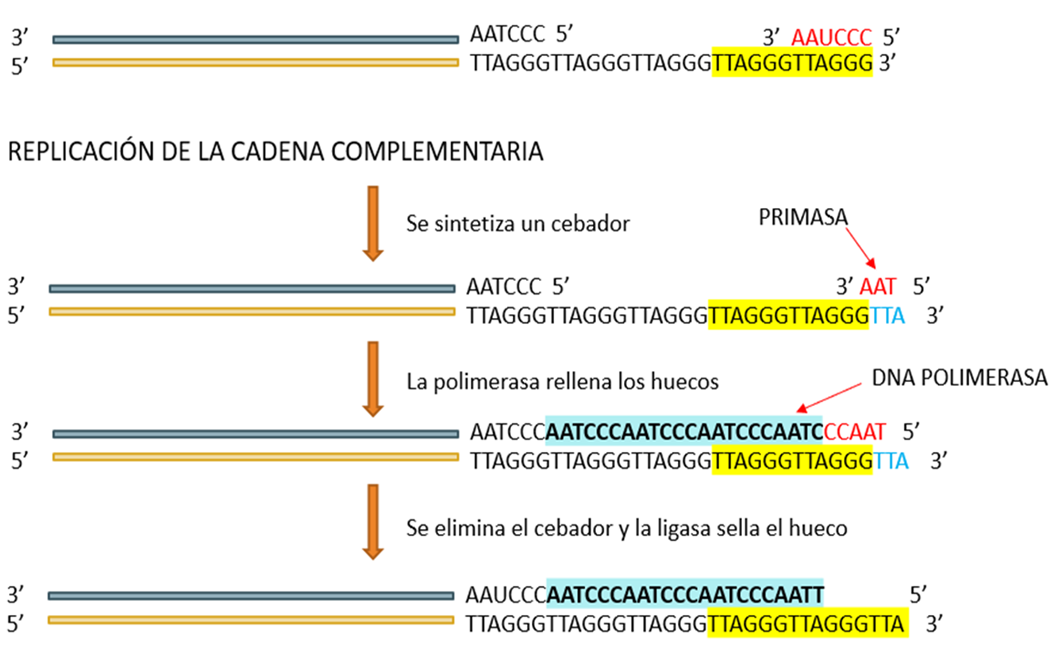
Figura 5. Fases en las que se observa como el sistema telomerasa garantiza la longitud de los telómeros mediante la adición de hexanucleótidos. a) la telomerasa se alinea en el extremo 3’; b) Elongación del extremo 3´(bases complementarias); c) translocación; d) elongación y separación de la telomerasa; e) replicación de la cadena complementaria (síntesis de un cebador y actuación de la enzima primasa; d) acción de la ADN polimerasa III , rellenando con nucleótidos complementarios); e) se elimina el cebador y la ligasa sella el hueco. Modificado de Grifiths y col.(16)
Son los telómeros secuencias repetitivas ricas en el nucleótido guanina (G) que se desarrollan en dirección 5’à3’ en el extremo de los cromosomas, con la cadena complementaria rica en citidina (C). En humanos y ratones, la secuencia repetida es TTAGGG. En el momento del nacimiento, los telómeros de las células somáticas humanas contienen unas 15kb de este fragmento de repetición y en cada división de la célula se pierden de 25 a 200 bases de los extremos teloméricos. Cuando este acortamiento ocurre entre 80 y 100 veces, los telómeros alcanzan una longitud crítica (4kb) desencadenan una respuesta de daño del ADN (DDR, del inglés «DNA damage response») persistente en los extremos de los cromosomas, fusiones cromosómicas de extremo a extremo, así como senescencia celular y / o apoptosis, lo que finalmente compromete la capacidad regenerativa de los tejidos y la célula deja de dividirse y envejece(10,11,15,17).
Los telómeros de los vertebrados terminan en una cadena 3’ que sobresale y que es rica en guanina, que se genera por el proceso post-replicativo de la cadena rica en citosina(10,16) y que es el sustrato para la elongación telomérica mediada por la telomerasa (Figura 6).
La cadena G sobresaliente puede doblarse e invadir la región de doble cadena del telómero y generar una estructura en bucle que se conoce como bucle-T (T-loop), que esconde el extremo 3’ de la telomerasa y de las actividades de reparación y degradación del ADN. Esto ocurre cuando este extremo sobresaliente 3’-OH se une consigo mismo formando enlaces anormales G-G. Las dos dobles cadenas generadas se vuelven a unir entre ellas formando una cuádruple hélice que es el bucle-T. Esta conformación cerrada del bucle-T oculta el 3’-OH libre que conforma el extremo de cada ADN, protegiéndolo así de ser reconocido como un daño a la doble cadena. Esta forma de bucle además es estructuralmente similar a los intermediarios de recombinación homóloga, lo cual sugiere que pueden ser regulados por actividades implicadas en esta vía de reparación del ADN. La estructura es un mecanismo primitivo de protección del fragmento libre final 3’-OH del ADN telomérico, que podría ser reconocido como una rotura de la doble hélice (DSB, del inglés «Double-strand DNA break»). Si los telómeros son disfuncionales, este reconocimiento activa la cascada de respuesta ante el ADN dañado (DDR) derivando en senescencia celular y, por tanto, en pérdida del material genético que contenía la célula.
El telosoma (Figura 6) es un complejo multiproteico especializado, cuyas proteínas están involucradas en el control de la longitud de los telómeros gracias a la regulación que hacen del acceso de la telomerasa a la cadena sobresaliente rica en guanina.
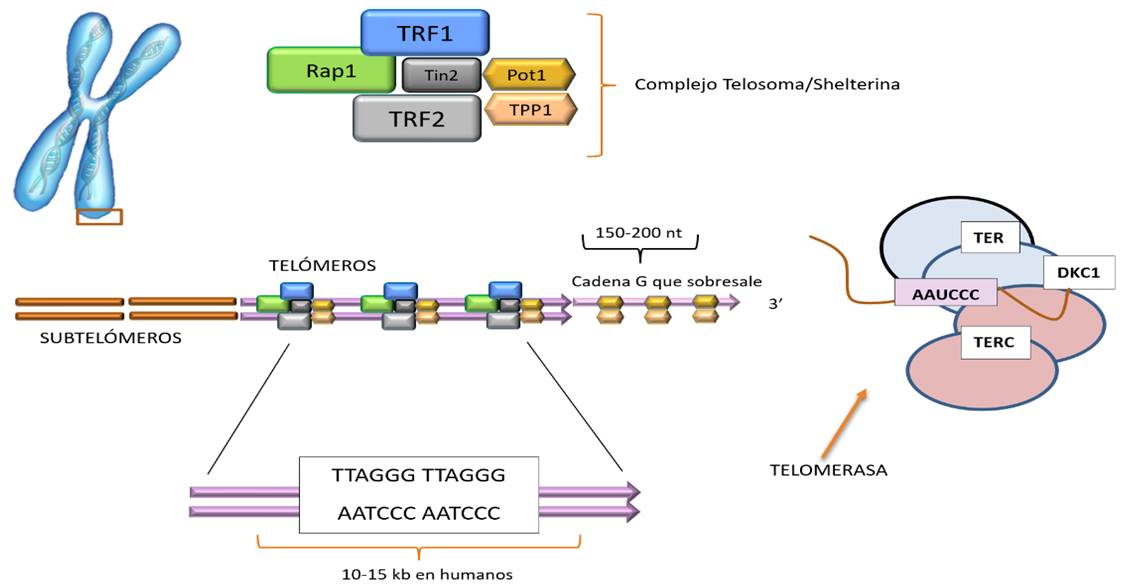
Figura 6. Estructuras teloméricas y su relación con la telomerasa. Se muestran las repeticiones de la secuencia nucleotídica TTAGGG, unidas al complejo shelterina/telosoma. Adyacentes a los telómeros están las regiones subteloméricas que son también ricas en ADN repetitivo. Modificado de Boticario Boticario y Cascales Angosto(18)
Para ello, cuenta con factores que son capaces de unirse directamente a la cadena G o a la región telomérica de doble cadena. Los factores del telosoma son seis proteínas teloméricas específicas que se unen a los factores de repetición: TRF1 (Telomeric Repeat Binding Factor 1), TRF2, RAP1 (Repressor/activator Protein 1), TIN2 (TRF1 Interacting Nuclear Factor 2), POT1 (Protector of Telomeres 1) y TPP1 (POT1-TPP1 organizing protein)(18) (Figuras 6 y 7).
Además del complejo telosoma/shelterina, los telómeros y subtelómeros están unidos a nucleosomas que están enriquecidos en modificaciones de histonas, características de dominios constitutivos de heterocromatina (Figura 7).
Como hemos comentado la telomerasa (Figuras 6 y 7) es una ribonucleoproteina que contiene un dominio altamente conservado que corresponde a una transcriptasa inversa (TERT) que, mediante adición “de novo” es capaz de añadir de nuevo los hexanucleótidos repetidos que conforman el ADN telomérico. Además, el complejo de la telomerasa lleva asociado un ARN molde (TERC) y una proteína auxiliar conocida como disquerina, que estabiliza el complejo telomerasa.
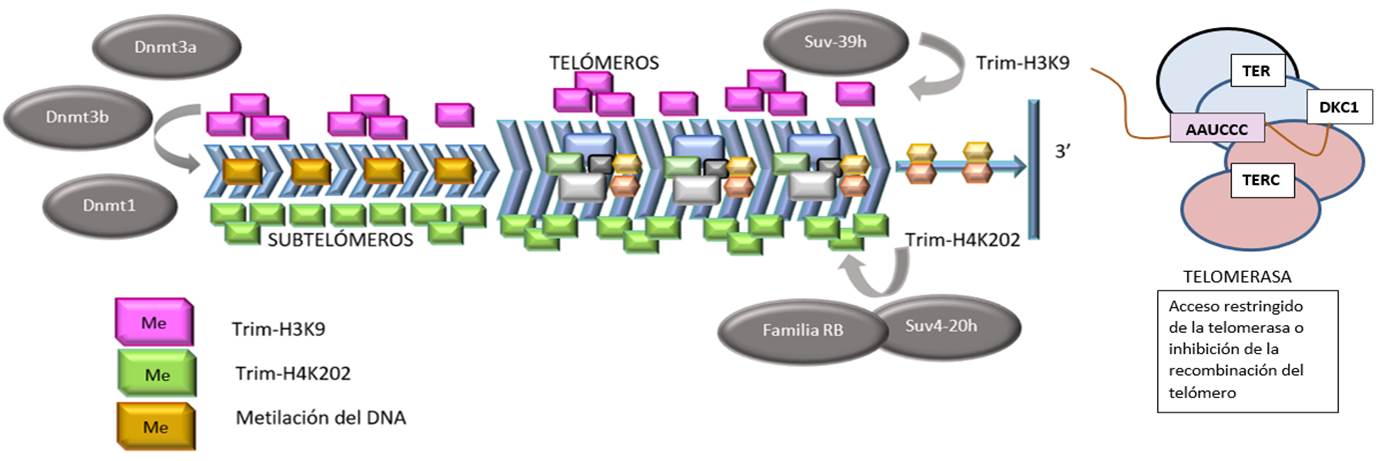
Figura 7. Estructura de los telómeros de mamíferos y su relación con la shelterina o telosoma y los nucleosomas. Además de la shelterina, los telómeros de mamíferos contienen también nucleosomas que muestran modificaciones en las histonas que son características de los dominios de heterocromatina. Además, el ADN subtelomérico está fuertemente metilado. Estas modificaciones en la cromatina de los telómeros y subtelómeros regulan negativamente la longitud telomérica y la recombinación de los telómeros. Trim-H3K9 y Trim-H4K202 son histonas trimetiladas, las Dnmt o DNMT son ADN metiltransferasas que metilan el ADN. Las enzimas Suv son una familia de proteínas cuya función es actuar como una histona metiltransferasa. La familia RB es a la que pertenece la proteína del retinoblastoma, proteína encargada de impedir la progresión del ciclo celular en el caso de que el ADN estuviera dañado. Modificado de Boticario Boticario y Cascales Angosto(18).
Aparte de la conformación tridimensional y el complejo protector, existe un tercer mecanismo(13,18) que regula la función de los telómeros. Esto es gracias a la epigenética, que incluye la metilación de ADN, especialmente en las islas CpG, - en la región subtelomérica - y la modificación de histonas por metilación y acetilación, por acción de las ADN metiltransferasas (DNMTs) (Figura 7).
Telómeros y prevención del envejecimiento
Como hemos comentado la deficiencia de telomerasa y la presencia de telómeros más cortos de lo normal induce la pérdida prematura de la capacidad regenerativa de los tejidos. Esta alteración condiciona la aparición de patologías de envejecimiento prematuro tanto en ratones como en humanos(19,20). En los humanos, el origen de los llamados síndromes de los telómeros, que se caracterizan por la presencia de telómeros críticamente cortos, reside en las mutaciones de la telomerasa o en los genes de mantenimiento de los telómeros. Estas enfermedades incluyen síndrome de Hoyeral-Hreidarsson, disqueratosis congénita, fibrosis pulmonar, anemia aplásica y fibrosis hepática(19,20). Los estudios que se han realizado en leucocitos han demostrado que la longitud de los telómeros se acorta significativamente desde el nacimiento a la vejez (11kbp a 4kbp en la vejez)(10,18,21). No obstante existen otros factores como la dieta y factores ambientales que inducen el acortamiento, que por su importancia merecen una revisión más detallada. Interesante es la diferencia observada en la longevidad media o esperanza de vida media entre hombres y mujeres(7), habiéndose encontrado en España una diferencia de unos 5 años menos en los hombres que en las mujeres. También merece comentarse que la persona de más edad de la que se tiene referencias demostrables es una mujer que vivió más de 122 años y que respondía al nombre de Jeanne Calment(7). Estas diferencias se ha sugerido pueden relacionarse con la menor longitud de los telómeros en hombres en relación con las mujeres, asociado, en particular, a los niveles de estrógenos. Así, se ha descrito que niveles elevados de estrógenos incrementan la actividad de la telomerasa y tienen efectos antioxidantes y esto afecta de manera directa a las mujeres llegada la menopausia, cuando sus niveles de estrógenos decaen. Las respuestas a los estrógenos son mediadas en los tejidos específicos por dos receptores de la familia de las hormonas nucleares, los receptores alfa y beta de estrógenos. Estos factores de transcripción son ligandos dependientes de proteínas, capaces de modular la expresión de una variedad de genes involucrados en la proliferación, la morfogénesis y la muerte celular programada(22).
La longitud de los telómeros en leucocitos (LTL) ha sido propuesta como marcador del acortamiento de los telómeros en todo el cuerpo. Esto es debido a que algunos estudios como el de Dlouha y col.(23) o el de Friedrich y col.(24) han demostrado la asociación entre LTL y los telómeros de otros tejidos, - como son cerebro, corazón y piel - lo que ha dado pie a una posible confirmación de la asociación entre un acortamiento acelerado de LTL y el envejecimiento.
La Figura 8 señala la relación entre el acortamiento de los telómeros en un periodo de 5 años y su relación con la mortalidad(15). La pérdida de ADN telomérico durante el envejecimiento es probable que sea resultado de cantidades limitantes de actividad telomerasa en el organismo adulto, que no puede compensar el progresivo acortamiento de los telómeros. Por otro lado, los tumores y líneas celulares inmortales poseen elevados niveles de telomerasa, propiciando así la evasión de la senescencia y apoptosis que caracteriza a estas células.
Algunas líneas celulares inmortales y tumores que carecen de actividad telomerasa son capaces de mantener y alargar sus telómeros mediante mecanismos que se conocen como alargamiento alternativo de los telómeros (ALT)(18) que implican eventos de recombinación homóloga entre secuencias teloméricas. Estos mecanismos ALT se han observado también en células que no son de líneas tumorales. Aunque estos mecanismos ALT son capaces de recuperar la viabilidad de las levaduras, no son capaces de hacerlo en células de organismos multicelulares, por lo que se llega a la conclusión de la existencia de mecanismos que reprimen activamente a ALT en células normales.
![]()
Figura 8. Cambios en la longitud de los telómeros y mortalidad. Mortalidad por deciles de cambios en 5 años de la longitud de los telómeros. DLTL, incremento de la longitud de los telómeros de los leucocitos. Modificado de Herrmann y col.(15)
El acortamiento de los telómeros es uno de los mecanismos mejor conocidos que impone un límite al crecimiento de células normales en cultivo, fenómeno que se llama senescencia replicativa. El acortamiento de los telómeros puede promover el envejecimiento al inducir la apoptosis y la parada del ciclo celular in vivo, lo que conlleva a la perdida celular, disfunción tisular y alteración de la capacidad regenerativa de las células madre.
A este respecto nos gustaría resaltar que un equipo de investigadores del Centro Nacional de Investigaciones Oncológicas (CNIO), liderados por la científica María Blasco (Figura 9), ha creado los primeros ratones nacidos con telómeros mucho más largos de lo normal en su especie. Estos animales, conocidos como «inmortales» viven más y con mejor salud, no padeciendo enfermedades como el cáncer ni obesidad(20).
También es importante señalar que este equipo ha logrado, por primera vez, aumentar de forma significativa la longitud de los telómeros, sin tener que realizar antes ninguna modificación genética. La alteración bioquímica que facilita el alargamiento de los telómeros en la fase de pluripotencia es de tipo "epigenético", es decir, actúa como una anotación química que modifica el trabajo de los genes, pero no altera su secuencia nuclotídica. Por lo tanto, al parecer bastaría con prolongar el tiempo en que las células embrionarias mantienen su pluripotencialidad para generar ratones con telómeros más largos, los cuales son más longevos y además están protegidos, entre otras patologías, del cáncer y de la obesidad.

Figura 9. María Blasco Marhuenda. Foto de AMIT. https://mujeresconciencia.com/2017/05/03/
maria-blasco-ejemplaridad-la-vanguardia-la-ciencia/
Según comentan estos mismos autores en una publicación(20), entre los activadores químicos de la telomerasa, el TA65, una pequeña molécula derivada de extractos de Astragalus membranaceus, es el más estudiado. Se ha demostrado que este activador conduce a un alargamiento moderado de los telómeros y a la mejora de algunos parámetros relacionados con el envejecimiento en ratones y humanos, aunque no se ha observado ningún efecto sobre la longevidad (Figura 10).
Posteriormente el equipo de la Dra Blasco encontró que las hormonas sexuales activan la transcripción de TERT(25). De hecho, la terapia con testosterona en ratones que padecían anemia aplásica regula al alza la expresión de la telomerasa, reduce el desgaste de los telómeros y alarga la vida útil de estos ratones(26). En humanos, la administración de un andrógeno sintético, danazol, en pacientes con telomeropatías resultó en alargamiento de los telómeros de leucocitos sanguíneos circulantes. junto a una mejoría hematológica(27). Sin embargo, las estrategias de reactivación de la telomerasa endógena son aplicables solo en aquellos casos clínicos no asociados con mutaciones en los genes de mantenimiento de los telómeros como TERT o TERC (20) (Figura 10).
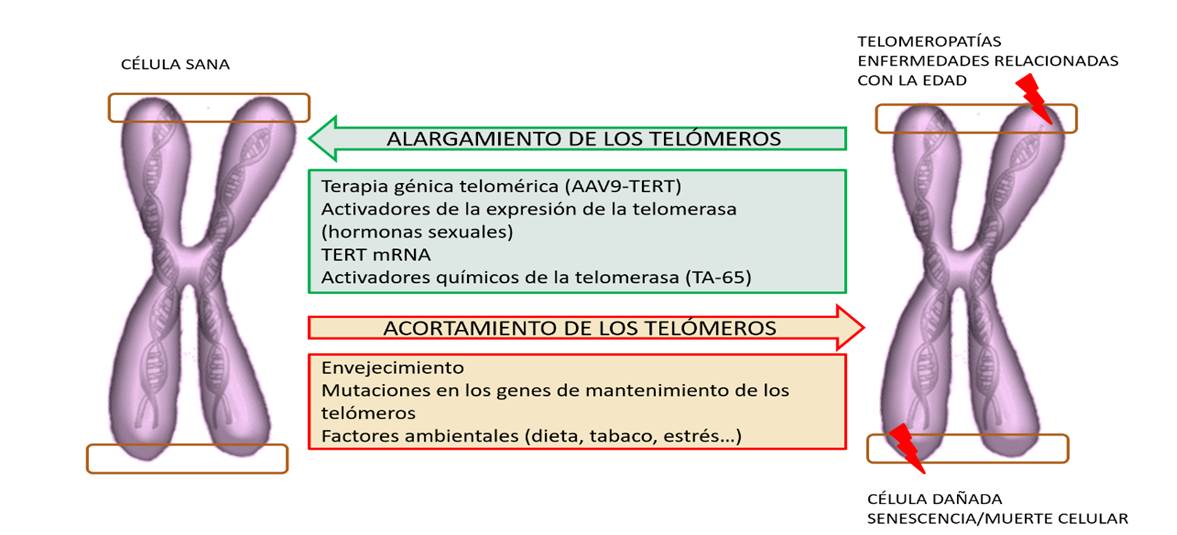
Figura 10. Factores naturales e intervenciones terapéuticas que afectan a las enfermedades mediadas por telómeros. El acortamiento de los telómeros se produce naturalmente como consecuencia de división celular a lo largo de la vida, cuyo ritmo puede verse influido por factores genéticos y ambientales. Los telómeros sin protección acortados provocan una respuesta al daño al ADN o DDR (DNA damage response) que induce senescencia celular, que afecta la capacidad regenerativa de los tejidos y da lugar a una amplia gama de enfermedades asociadas a la edad, así como a las llamadas telomeropatías, en las que la degeneración tisular se produce de forma prematura como consecuencia de defectos hereditarios en el mantenimiento de los telómeros. Posibilidades terapéuticas. Se han evaluado intervenciones para contrarrestar el acortamiento de los telómeros: entre otros, se encuentran los activadores químicos de la telomerasa (TA-65), los activadores de la transcripción de la telomerasa inversa (TERT), activación de la transcripción de la TERT por hormonas sexuales, administración intracelular de ARNm de TERT y terapia génica de telomerasa (AAV9-TERT). Modificado de Martínez y Blasco(20).
También han desarrollado una estrategia terapéutica utilizando AAV para activar transitoriamente a la enzima telomerasa en tejidos adultos(28) (Figura 10). La terapia génica Tert utilizando vectores AAV9 no integradores, fue capaz en ratones adultos de retrasar el envejecimiento y aumentar la longevidad al disminuir las patologías relacionadas con la edad como la osteoporosis y la intolerancia a la glucosa, así como el deterioro neuromuscular y cognitivo. Además, la aparición del cáncer se retrasó en los ratones tratados con TERT(29). Curiosamente, el aporte de AAV9-Tert al corazón fue suficiente para aumentar significativamente la supervivencia del ratón y la función cardíaca tras un infarto de miocardio. El aporte de AAV9-Tert después del tratamiento del infarto condujo a una menor cicatrización fibrótica del corazón y aumentó la proliferación de miocitos cardíacos concomitante con cambios transcripcionales que sugieren regeneración(28). Aunque algunos datos de estos autores señalan que el alargamiento excesivo de telómeros pudiera producir cáncer, la utilización de quimeras, ha demostrado que la existencia de telómeros hiperlargos no produjo cáncer, ni daño al DNA y redujo los niveles de la proteína apoptótica p53(30).
Se ha señalado que el ambiente nutricional que “baña” a las células también es clave en el proceso de envejecimiento. De hecho, la restricción moderada de energía y proteínas(7) incrementa la longevidad, entre otros aspectos por la reducción metabólica que implica y que inducen mecanismos epigenéticos que atañen a la desacetilación de histonas (desacetilasas de histonas o sirtuínas) con silenciamiento del genoma. La rapamicina o mTOR es una proteína quinasa de serina / treonina de la familia PI3K que funciona como un regulador maestro del crecimiento y metabolismo celular en respuesta fundamentalmente a los nutrientes. Se ha demostrado que la inhibición de la vía mTOR prolonga la vida útil y retrasa las patologías relacionadas con la edad en muchas especies diferentes, desde levaduras hasta ratones(31). Es interesante señalar que ratones no mutados tratados rapamicina mostraron un incremento de la longevidad(32).
Por tanto y para concluir las investigaciones de los premiados con el Nobel en 2009 han abierto campos de investigación sin precedentes en la lucha contra el envejecimiento y que hacen plantearnos, entre otros aspectos, que existe una interacción enorme entre nuestro yo y el ambiente, particularmente en periodos críticos de crecimiento y renovación celular, siendo de enorme y particular importancia el estatus nutricional desde incluso antes del nacimiento(33,34).
Conflictos de interés
Los autores declaran no tiene conflictos de interés
Agradecimientos
Este trabajo ha sido parcialmente subvencionado por el Proyecto Project PID2019-103872RB-I00.
Referencias
1. Sánchez-Muniz FJ, Culebras JM, Vicente-Vacas L. In the month of the Nobel Prize Awards, we pay tribute to Alfred Nobel and to the recipients of the 2017 Prize in Physiology and Medicine. JONNPR. 2017;2(11):577-580.
2. Sánchez-Muniz FJ, Culebras JM, Vicente-Vacas L. In the month of the Nobel Prize Awards, we pay tribute to Alfred Nobel and to the recipients of the 2018 Prize in Physiology and Medicine. JONNPR. 2018;3(11):857-865.
3. Sánchez-Muniz FJ, Culebras JM, Vicente-Vacas L. We pay tribute to Alfred Nobel and to the recipients of the 2019 Prize in Physiology and Medicine. JONNPR. 2020;5(3):236-245.
4. Sánchez-Muniz FJ, Culebras JM, Vicente-Vacas L. In the month of the Nobel Prize Awards, we pay tribute to Alfred Nobel and to the recipients of the 2020 Prize in Physiology and Medicine. JONNPR. 2020;5(11):1277-1295.
5. Ruiz López MD, Artacho Martin Lagos M. Nutrición y envejecimiento. En. Tratado de Nutrición. Tomo III. Nutrición en el estado de salud. Gil A (ed). Panamericana, Buenos Aires, 2010, pp. 319-343.
6. https://datos.bancomundial.org/indicator/SP.POP.65UP.TO.ZS
7. Sánchez-Muniz FJ. Estrategias para una longevidad saludable. III Jornada de integración de ómicas con perspectiva de género. Medicina Preventiva. Facultad de Medicina. Valencia. 5 de diciembre de 2019.
8. The Nobel Prize in Physiology or Medicine 2009. NobelPrize.org. Nobel Media AB 2020. https://www.nobelprize.org/prizes/medicine/2009/summary/
9. El Rincón del vago https://www.rincondelvago.com/informacion/premios-nobel/
10. Blasco MA. Telomere length, stem cells and aging. Nat Chem Biol. 2007;3:640-649.
11. Blasco MA. Telomeres and human disease: ageing, cancer and beyond. Nat Rev Genet. 2005;6:611-622.
12. Cottliar ASH, Slavutsky IR. Telómeros y actividad de telomerasa: su participación en el envejecimiento y el desarrollo neoplásico. Medicina. 2001;61(3): 331-342.
13. Blackburn EH. Telomeres and telomerase: the means to the end (Nobel-lecture). Angel Chem Int Ed Engl. 2010;49:7405-7421.
14. Blackburn EH. Switching and signaling at the telomere. Cell. 2001;106:661–673.
15. Herrmann M, Pusceddu I, März W, Herrmann W. Telomere biology and age-related diseases. Clin Chem Lab Med. 2018;56(8):1210-1222.
16. Griffiths AJF, Wessler SR, Lewontin RC, Carroll SB. (eds.). Genética, 9ª ed., McGraw Hill, Madrid, 2008.
17. Ferrara-Romeo I, Martinez P, Saraswati S, Whittemore K, Graña-Castro O, Poluha L T, Serrano R, Hernandez-Encinas E, Blanco-Aparicio C, Flores JM, Blasco MA. The mTOR pathway is necessary for survival of mice with short telomeres. Nature Commun. 2020;11:1168
18. Boticario Boticario C, Cascales Angosto M. ¿Por qué tenemos que envejecer? Enfermedades asociadas a la edad. UNED.. Artes Gráficas Batanero Palencia, 2009, pp. 117-121.
19. Armanios M, Blackburn EH. The telomere syndromes. Nat Rev Genet. 2012;13: 693-704.
20. Martínez P, Blasco MA. Telomere-driven diseases and telomere-targeting therapies. J Cell Biol. 2017;216(4):875-887.
21. Pusceddu I, Farrell CJ, Di Pierro AM, Jani E, Herrmann W, Herrmann M. The role of telomeres and vitamin D in cellular aging and age-related diseases. Clin Chem Lab Med. 2015;53:1661-1678.
22. Alnafakh RAA, Adishesh M, Button L, Saretzki G, Hapangama DK. Telomerase and telomeres in endometrial cancer. Front Oncol. 2019; 9:344.
23. Dlouha D, Maluskova J, Kralova Lesna I, Lanska V, Hubacek JA. Comparison of the relative telomere length measured in leukocytes and eleven different human tissues. Physiol Res. 2014; 63(Suppl 3):S343-S350.
24. Friedrich U, Griese E, Schwab M, Fritz P, Thon K, Klotz U. Telomere length in different tissues of elderly patients. Mech Ageing Dev. 2000;119(3):89-99.
25. Calado RT, Yewdell WT, Wilkerson KL, Regal JA, Kajigaya S, Stratakis CA, Young NS. Sex hormones, acting on the TERT gene, increase telomerase activity in human primary hematopoietic cells. Blood. 2009;114:2236-2243.
26. Bär C, Huber N, Beier F, Blasco MA. Therapeutic effect of androgen therapy in a mouse model of aplastic anemia produced by short telomeres. Haematologica. 2015;100:1267-1274.
27. Townsley DM, Dumitriu B, Liu D, Biancotto A, Weinstein B, Chen C, Hardy N, Mihalek AD, Lingala S, Kim YJ, et al. Danazol treatment for telomere diseases. 2016. N Engl J Med. 2016;374:1922-1931.
28. Bär C, Bernardes de Jesus B, Serrano R, Tejera A, Ayuso E, Jimenez V, Formentini I, Bobadilla M, Mizrahi J, de Martino A, et al. Telomerase expression confers cardioprotection in the adult mouse heart after acute myocardial infarction. Nat Commun. 2014;5:5863.
29. Bernardes de Jesus B, Vera E, Schneeberger K, Tejera AM, Ayuso E, Bosch F, Blasco MA. Telomerase gene therapy in adult and old mice delays aging and increases longevity without increasing cancer. EMBO Mol Med. 2012;4:691-704.
30. Varela, E., Muñoz-Lorente MA, Tejera AM, Ortega S, Blasco MA. Generation of mice with longer and better preserved telomeres in the absence of genetic manipulations. Nat Commun. 2016;7:11739.
31. Johnson SC, Rabinovitch P, Kaeberlein M. MTOR is a key modulator of ageing and age-related disease. Nature. 2013; 493:338–345.
32. Miller RA, Harrison DE, Astle CM, Fernandez E, Flurkey K, Han M, Javors MA, Li X, Nadon NL Nelson JF, et al. Rapamycin-mediated lifespan increase in mice is dose and sex dependent and metabolically distinct from dietary restriction. Aging Cell. 2014;13(3):468-477.
33. Sánchez-Muniz, FJ, Gesterio E, Espárrago Rodilla M, Rodríguez-Bernal B, Bastida S. La alimentación de la madre durante el embarazo condiciona el desarrollo pancreático, el estatus hormonal del feto y la concentración de biomarcadores al nacimiento de Diabetes mellitus y síndrome metabólico. Nutr Hosp. 2013;28:250-274.
34. Gesteiro E, Bastida S, Sánchez-Muniz FJ. Pregnancy and Mediterranean diet. En: Mediterranean diet. Preedy VR, Watson RR (eds.). (2nd edición). Elsevier. Amsterdam. 2020, pp. 409-427.