REVISIÓN
Papel de la expresión de regucalcina en el tejido hepático: Revisión sistemática
Role of regucalcin expression in liver tissue: systematic review
Juan Manuel Franco-García, Jorge Rojo-Ramos, Hadi Nobari, Jorge Pérez-Gómez
Health, Economy, Motricity and Education (HEME) Research Group, Faculty of Sport Sciences, University of Extremadura, 10003 Cáceres, Spain.
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Resumen
Objetivo. El propósito de este trabajo fue revisar la literatura científica con relación al papel de la expresión de la regucalcina (SMP30) en el hígado.
Método. Se realizó una búsqueda bibliográfica en la base de datos PubMed. Se encontraron 89 artículos. Tras analizar su contenido y aplicar los criterios de inclusión y exclusión, un total de 9 artículos fueron incluidos.
Resultados. Se determinó que la expresión de SMP30 es significativamente mayor en el hígado en comparación con otros tejidos como pulmones, bazo, miocardio, próstata y piel (P < 0.05). Se observó, tras obtener muestras de 137 pacientes (30 controles hepáticos normales, 10 con hepatitis B, 49 con cirrosis hepática y 48 con carcinoma hepatocelular (HCC)) que la expresión de SMP30 fue del 100% en todos los tejidos adyacentes al hígado, a excepción del HCC, que solo mostró el 81% de expresión de SMP30 en el hígado. Sobre las concentraciones séricas de SMP30 se observó que 3 grupos distintos mostraron concentraciones diferentes de SMP30: grupo control (1.72 ng/mL), pacientes con hepatitis crónica (3.76 ng/mL) y pacientes con insuficiencia hepática (5.46 ng/mL), teniendo los pacientes con insuficiencia hepática aguda una concentración significativamente mayor de SMP30 que el resto de grupos (P< 0.01), los pacientes con insuficiencia hepática también presentaron una concentración significativamente mayor que el grupo control de pacientes sanos (P< 0.01). Sobre la proliferación de células HepG2 se ha demostrado que la incorporación de manera exógena de SMP30 suprime la elevación del número de células HepG2, revelando así que la proliferación de las células HepG2 fue suprimida con los niveles fisiológicos de SMP30 presente en suero in vitro.
Conclusión. La SMP30podría desempeñar un papel fundamental sobre la supervivencia en pacientes con HCC, así como, su posible funcionamiento como proteína protectora de la apoptosis en células HepG2.
Palabras clave
Apoptosis; carcinoma hepatocelular; células HepG2; marcadores bioquímicos; RGN; SMP30
Abstract
Objective. The purpose of this work has been to review the scientific literature regarding the role of regucalcin expression in the liver.
Method. A bibliographic search was carried out on the PubMed database. Eighty-nine articles were found. After analyzing their content and applying inclusion and exclusion criteria, a total of 9 articles were included.
Results. It was determined that SMP30 expression is significantly higher in the liver compared to other tissues such as lungs, spleen, myocardium, prostate and skin (P < 0.05). It was observed, after obtaining samples from 137 patients (30 normal liver controls, 10 with hepatitis B, 49 with liver cirrhosis and 48 with hepatocellular carcinoma) that SMP30 expression was 100% in all tissues adjacent to the liver except for hepatocellular carcinoma (HCC), which showed only 81% of protein expression. On serum regucalcin concentrations it was observed, that 3 different groups with different concentrations of SMP30: control group (1.72 ng/ mL), patients with chronic hepatitis (3.76 ng/mL) and patients with liver failure (5.46 ng/ mL) patients with acute liver failure had higher concentrations of SMP30 than patients with hepatitis B (P< 0.01), as well as the serum concentrations of the latter showed to be higher than in healthy patients (P< 0.01). On the proliferation of HepG2 cells it has been shown that the addition of exogenous SMP30 suppresses the elevation of cell numbers, thus revealing that HepG2 cell proliferation was suppressed with the physiological levels of SMP30 present in serum in vitro.
Conclusion. Regucalcin could play a key role in survival in patients with hepatocellular carcinoma, as well as its possible role as a protective protein for apoptosis in HepG2 cells.
Keywords
Apoptosis; hepatocellular carcinoma; HepG2 cells; biochemical markers; RGN; SMP30
Introducción
La regucalcina (RGN) o “senescence marker protein 30” (SMP30) fue descubierta en 1978(1). El origen de su denominación se debe a la unión de la SMP30 con el Ca2+. En los últimos años, se ha demostrado que la SMP30 desempeña un papel multifuncional como proteína reguladora en el mecanismo de señalización intracelular en muchos tipos de células(2-5). La expresión de la SMP30 se manifiesta en el hígado, riñón, corazón, cerebro, huesos y otros tejidos de los ratones(6–8). Los estudios indican que la SMP30 desempeña un papel fundamental en el mantenimiento de la homeostasis celular, como proteína moduladora en el proceso de señalización celular implicada en la actividad de transcripción(9).
Teniendo en cuenta esta función celular de la SMP30, surge el planteamiento de si podría tener la misma relevancia en seres humanos, donde se ha visto que el cromosoma humano Xp 11.3-Xp 11.23 incluye el gen que codifica la SMP30(10). Además, se ha demostrado que la SMP30 se involucra en la carcinogénesis(11), observando que la expresión del gen y la proteína se reduce en los tejidos tumorales en pacientes humanos. Por lo tanto, la expresión suprimida del gen de SMP30 se propone para abordar la carcinogénesis, ya que esta desempeña un papel clave como molécula supresora en la proliferación celular y la carcinogénesis. De la misma manera, se ha demostrado que las tasas de supervivencia se prolongan en pacientes con cánceres de páncreas, mama, hígado y pulmón con una mayor expresión de SMP30(12–14).
En relación con la SMP30 y más concretamente con el efecto regulador del Ca2+ sobre la función de las células hepáticas, se ha demostrado que las expresiones de SMP30 son importantes en la progresión del cáncer de hígado, aunque no se sabe si la concentración de SMP30 en suero puede usarse como un indicador de diagnóstico de cáncer de hígado(15).
Asimismo, la baja expresión de esta proteína en pacientes con carcinoma hepatocelular (HCC) se relaciona con el pronóstico de supervivencia de los pacientes junto con el tamaño tumoral(16), así como, la presencia de SMP30 y anticuerpo de SMP30 en suero de pacientes se entiende como índices auxiliares para el diagnóstico de HCC(17), aunque el índice de diagnóstico serológico de HCC aún requiere mayor verificación serológica no tumoral(15).
También, se ha detectado una estrecha relación de la SMP30 hepática con patogénesis asociadas a la enfermedad de hígado graso no alcohólico(18), así como una sobreexpresión de la misma en las células del hígado que contribuye a la disminución de la formación de especies reactivas de oxígeno(19).
Por lo tanto, tras observarse la importancia de la expresión de la proteína SMP30 en el hígado, el propósito de este trabajo ha sido revisar la literatura científica con relación al papel de la SMP30 sobre el cáncer de hígado.
Métodos
Búsqueda bibliográfica.
Se realizó una búsqueda bibliográfica, hasta el 7 de octubre de 2020, en la base de datos Pubmed, utilizando las palabras clave: “SMP30 AND liver”, “Regucalcin AND liver” y RGN AND liver”, se encontraron 89 artículos.
Clasificación de artículos.
En la Figura 1, puede observarse la clasificación de los artículos. Tras el análisis de cada uno de ellos, se omitieron los estudios que no incluían “liver”, los que utilizaron vitamina C en combinación con SMP30 y aquellos que no tuvieron relación con el contenido a tratar en este trabajo. Un total de 9 artículos cumplieron los requisitos de inclusión, por lo tanto, fueron incluidos para su análisis en esta revisión.
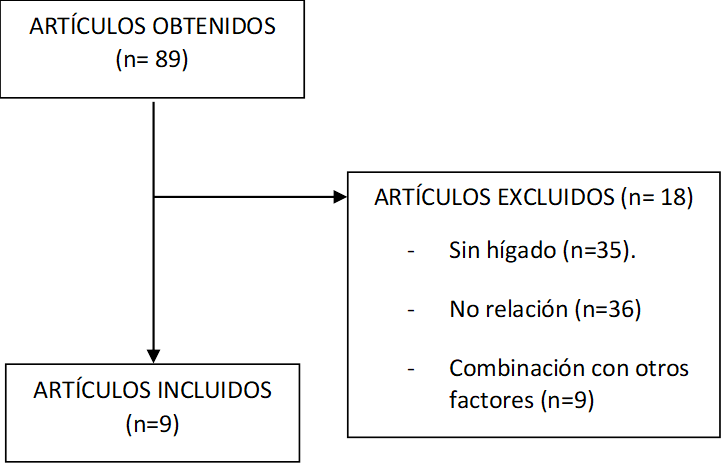
Figura 1. Diagrama de flujo
Criterios de inclusión.
Para la presente revisión sistemática, se tuvieron en cuenta aquellos artículos que cumplieron los siguientes criterios de elegibilidad: a) evaluar la SMP30, b) mostrar resultados relativos al efecto sobre el hígado o patologías del mismo, c) muestra formada por personas o animales, d) artículos escritos en inglés y español.
Criterios de exclusión.
Se consideró como motivo de exclusión de la presente revisión los siguientes puntos: a) no guarda relación con la SMP30, b) estudia la SMP30, pero no en el hígado, c) combina SMP30 con otros factores.
Resultados
Los resultados se han expresado de acuerdo con lo indicado por cada autor, por lo tanto, ninguno de los datos que se muestran a continuación han sido objeto de interpretación por los autores del presente trabajo.
Con el fin de una mejor intelección, este apartado se abordará mediante los siguientes subapartados: supervivencia prolongada en pacientes con HCC con aumento de la expresión del gen de SMP30. Expresión de SMP30 en tejidos adyacentes del hígado, sobreexpresión del gen SMP30 en células HepG2, sobreexpresión del gen SMP30 en células HepG2, concentraciones de SMP30 en suero.
Supervivencia prolongada en pacientes con HCC con aumento de la expresión del gen de SMP30.
Se ha observado que la expresión de SMP30 es significativamente mayor en el hígado en comparación con otros tejidos: pulmones, bazo, miocardio, próstata y piel (P < 0.05)(16).
Tras el hallazgo anterior y para comprender la participación de la SMP30 en pacientes humanos con HCC, se analizó los niveles de expresión del gen SMP30 en tejidos hepáticos normales y con HCC. La expresión global del gen SMP30 se redujo en pacientes con HCC en comparación con los tejidos normales(20). Esta reducción se asoció con pronósticos negativos en los pacientes con HCC junto con una notable relación entre la disminución de dicha proteína y el tamaño tumoral. Sin embargo, factores como el sexo y cirrosis hepática no mostraron diferencias significativas(16,21), aunque se ha observado que el factor edad si disminuye la expresión de la SMP30(22). En definitiva, una mayor expresión del gen SMP30 prolonga la supervivencia en pacientes con HCC.
Expresión de SMP30 en tejidos adyacentes al hígado.
La expresión de la proteína SMP30 disminuye en el cáncer de hígado, pero aumenta en tejidos adyacentes. Para comprobar esto, se realizaron análisis inmunohistoquímicos, tras obtener muestras de 137 pacientes (30 controles hepáticos normales, 10 con hepatitis B, 49 con cirrosis hepática y 48 con HCC) se observó que la expresión de SMP30 fue del 100% en todos los tejidos a excepción del HCC, donde la expresión fue del 81.3% en el tejido hepático (21).
Sobreexpresión del gen SMP30 en células HepG2.
Con respecto a la sobrexpresión del gen en células HepG2, se demostró que esta sobreexpresión de SMP30 suprime la proliferación de células HepG2 in vitro. De la misma manera, se indica que la transfección de SMP30 protegió a las células Hep2G de la muerte celular(23).
También se ha demostrado que la adición de SMP30 exógena suprime la elevación del número de células, revelando así que la proliferación de células HepG2 fue suprimida con los niveles fisiológicos de SMP30 presente en suero in vitro(24,25).
Otra función observada de la SMP30 es que suprimía la actividad transcripcional en las células HepG2, por lo tanto para unirse al ADN, se observó una autorregulación de la expresión de los genes nucleares, dicho de otra manera, la SMP30 podría regular la actividad de transcripción en las células HepG2(26).
Asimismo, se demostró que la sobreexpresión de SMP30 aumenta la expresión de genes supresores de tumores en ratones clonados con células H4II-E in vitro(27), por lo tanto, estos resultados apoyan la opinión de que la SMP30 media como efecto supresor en la proliferación de las células HepG2, regulando la expresión de proteínas supresoras de tumores y oncogenes(20).
Concentraciones de SMP30 en suero.
En el estudio de Wei et al, se observaron concentraciones séricas diferentes de SMP30 en los 3 grupos distintos analizados grupo control (1.72 ng/mL), pacientes con hepatitis crónica (3.76 ng/mL) y pacientes con insuficiencia hepática (5.46 ng/mL). Se vio que los pacientes con insuficiencia hepática aguda tenían mayores concentraciones de SMP30 que pacientes con hepatitis B (P< 0.01), así como las concentraciones séricas de estos últimos mostraron ser mayores que en los pacientes sanos (P< 0.01)(26).
Igualmente, la SMP30 inhibe la endonucleasa activada por el Ca+2 en el núcleo del hígado de ratones in vitro, así como suprime la actividad de la sintetasa de óxido nítrico que regula la expresión de genes involucrados en la apoptosis en los ratones con células de hepatoma H4-II-E in vitro(28,29).
Conclusión
El aumento de la expresión de SMP30 se asocia con una supervivencia prolongada en pacientes con HCC, ya que, suprime la proliferación de las células HepG2 a través de varias vías de señalización del hepatoma humano in vitro. Por lo tanto, se propone que la expresión de SMP30 endógena juega un papel potencial como proteína supresora en el desarrollo de la hepatocarcinogénesis.
También se ha comprobado que la SMP30 promueve la activación de vías para proteger las células HepG2 de la apoptosis inducida, aunque sería recomendable que más estudios confirmaran estos hallazgos. Sin embargo, la disminución de la expresión SMP30 con el envejecimiento puede llevar a una mejor comprensión de lo susceptible que pueden ser las lesiones hepáticas en personas mayores.
Estos hallazgos apoyan que la expresión de SMP30 puede ser una herramienta útil como biomarcador de enfermedades específicas en el hígado, por lo tanto, se espera que se realicen más investigaciones sobre aspectos clínicos de patologías humanas.
Declaración de autoría
Respecto a la contribución de los diferentes autores para la elaboración del presente trabajo se afirma que todas las personas incluidas como autores cumplen los criterios de autoría, y que no se excluye a nadie que también los cumpla.
Financiación
Sin financiación.
Conflicto de interés
Sin conflicto de intereses.
Referencias
1. Yamaguchi M, Yamamoto T. Purification of Calcium Binding Substance from Soluble Fraction of Normal Rat Liver. Chem Pharm Bull (Tokyo). 1978;26(6):1915-8.
2. Yamaguchi M. A novel Ca^<2+>-binding protein regucalcin and calcium inhibition: regulatory role in liver cell function. Calcium Inhib. 1992;19-41.
3. Yamaguchi M. Role of calcium-binding protein regucalcin in regenerating rat liver. J Gastroenterol Hepatol. 1998;13(S1):S106-12.
4. Yamaguchi M. Role of regucalcin in calcium signaling. Life Sci. 31 de marzo de 2000;66(19):1769-80.
5. Yamaguchi M. The Role of Regucalcin in Nuclear Regulation of Regenerating Liver. Biochem Biophys Res Commun. 16 de septiembre de 2000;276(1):1-6.
6. Shimokawa N, Yamaguchi M. Calcium administration stimulates the expression of calcium-binding protein regucalcin mRNA in rat liver. FEBS Lett. 1992;305(2):151-4.
7. Yamaguchi M, Nakajima R. Role of regucalcin as an activator of sarcoplasmic reticulum Ca2+-ATPase activity in rat heart muscle. J Cell Biochem. 2002;86(1):184-93.
8. Yamaguchi M, Isogai M, Kato S, Mori S. Immunohistochemical Demonstration of Calcium-Binding Protein Regucalcin in the Tissues of Rats : The protein Localizes in Liver and Brain. Chem Pharm Bull (Tokyo). 1991;39(6):1601-3.
9. Yamaguchi M. Suppressive role of regucalcin in liver cell proliferation: involvement in carcinogenesis. Cell Prolif. 22 de mayo de 2013;46(3):243-53.
10. Thiselton DL, McDowall J, Brandau O, Ramser J, d’Esposito F, Bhattacharya SS, et al. An Integrated, Functionally Annotated Gene Map of the DXS8026–ELK1 Interval on Human Xp11.3–Xp11.23: Potential Hotspot for Neurogenetic Disorders. Genomics. 1 de abril de 2002;79(4):560-72.
11. Yamaguchi M. Involvement of regucalcin as a suppressor protein in human carcinogenesis: insight into the gene therapy. J Cancer Res Clin Oncol. 1 de agosto de 2015;141(8):1333-41.
12. Yamaguchi M, Osuka S, Shoji M, Weitzmann MN, Murata T. Survival of lung cancer patients is prolonged with higher regucalcin gene expression: suppressed proliferation of lung adenocarcinoma A549 cells in vitro. Mol Cell Biochem. 1 de junio de 2017;430(1):37-46.
13. Yamaguchi M, Osuka S, Weitzmann MN, Shoji M, Murata T. Increased regucalcin gene expression extends survival in breast cancer patients: Overexpression of regucalcin suppresses the proliferation and metastatic bone activity in MDA-MB-231 human breast cancer cells in vitro. Int J Oncol. agosto de 2016;49(2):812-22.
14. Yamaguchi M, Osuka S, Weitzmann MN, El-Rayes BF, Shoji M, Murata T. Prolonged survival in pancreatic cancer patients with increased regucalcin gene expression: Overexpression of regucalcin suppresses the proliferation in human pancreatic cancer MIA PaCa-2 cells in vitro. Int J Oncol. 1 de mayo de 2016;48(5):1955-64.
15. Zheng S-X, Xiang B-D, Long J-M, Qu C, Mo Z-J, Li K, et al. Diagnostic Value of Serum SMP30 and Anti-SMP30 Antibody in Hepatocellular Carcinoma. Lab Med. 5 de julio de 2018;49(3):203-10.
16. Mo Z, Zheng S, Lv Z, Zhuang Y, Lan X, Wang F, et al. Senescence marker protein 30 (SMP30) serves as a potential prognostic indicator in hepatocellular carcinoma. Sci Rep. diciembre de 2016;6(1):39376.
17. Zhou S-F, Xie X-X, Bin Y-H, Lan L, Chen F, Luo G-R. Identification of HCC-22-5 tumor-associated antigen and antibody response in patients. Clin Chim Acta. abril de 2006;366(1-2):274-80.
18. Kondo Y, Ishigami A. Involvement of senescence marker protein-30 in glucose metabolism disorder and non-alcoholic fatty liver disease. Geriatr Gerontol Int. 2016;16(S1):4-16.
19. Handa S, Maruyama N, Ishigami A. Over-expression of Senescence Marker Protein-30 Decreases Reactive Oxygen Species in Human Hepatic Carcinoma Hep G2 Cells. Biol Pharm Bull. 2009;32(10):1645-8.
20. Yamaguchi M, Osuka S, Weitzmann MN, El-Rayes BF, Shoji M, Murata T. Prolonged survival in hepatocarcinoma patients with increased regucalcin gene expression: HepG2 cell proliferation is suppressed by overexpression of regucalcin in vitro. Int J Oncol. 1 de octubre de 2016;49(4):1686-94.
21. Zhou S-F, Mo F-R, Bin Y-H, Hou G-Q, Xie X-X, Luo G-R. Serum immunoreactivity of SMP30 and its tissues expression in hepatocellular carcinoma. Clin Biochem. 1 de marzo de 2011;44(4):331-6.
22. Fujita T, Uchida K, Maruyama N. Purification of senescence marker protein-30 (SMP30) and tis androgen-independent decrease with age in the rat liver. Biochim Biophys Acta BBA - Gen Subj. 22 de abril de 1992;1116(2):122-8.
23. Matsuyama S, Kitamura T, Enomoto N, Fujita T, Ishigami A, Handa S, et al. Senescence marker protein-30 regulates Akt activity and contributes to cell survival in Hep G2 cells. Biochem Biophys Res Commun. 20 de agosto de 2004;321(2):386-90.
24. Yamaguchi M. Regucalcin as a potential biomarker for metabolic and neuronal diseases. Mol Cell Biochem. 1 de junio de 2014;391(1):157-66.
25. Yamaguchi M, Isogai M. Tissue concentration of calcium-binding protein regucalcin in rats by enzyme-linked immunoadsorbent assay. Mol Cell Biochem. 1 de mayo de 1993;122(1):65-8.
26. Wei X, Yu H, Zhao P, Xie L, Li L, Zhang J. Serum regucalcin is a useful indicator of liver injury severity in patients with hepatitis B virus-related liver diseases. Braz J Med Biol Res [Internet]. 30 de septiembre de 2019 [citado 7 de agosto de 2020];52(10). Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6774222/
27. Tsurusaki Y, Yamaguchi M. Role of regucalcin in liver nuclear function: Binding of regucalcin to nuclear protein or DNA and modulation of tumor-related gene expression. Int J Mol Med [Internet]. 1 de agosto de 2004 [citado 20 de octubre de 2020]; Disponible en: http://www.spandidos-publications.com/10.3892/ijmm.14.2.277
28. Yamaguchi M, Sakurai T. Inhibitory effect of calcium-binding protein regucalcin on Ca2+-activated DNA fragmentation in rat liver nuclei. FEBS Lett. 1991;279(2):281-4.
29. Izumi T, Yamaguchi M. Overexpression of regucalcin suppresses cell death in cloned rat hepatoma H4-II-E cells induced by tumor necrosis factor-? or thapsigargin. J Cell Biochem. 15 de mayo de 2004;92(2):296-306.
