ARTÍCULO ESPECIAL
Las actuales guías en el manejo de las dislipidemias europeas y estadounidenses no están de acuerdo en sus objetivos y recomendaciones
Current guidelines on the management of European and American dyslipidemias do not agree on their objectives and recommendations
Eva Paloma Carbayo-Herencia1, Julio Antonio Carbayo-Herencia2
1 Sección de Epidemiología. Delegación de Sanidad. Albacete. España
2 Departamento de Medicina Clínica. Universidad Miguel Hernández. San Juan de Alicante. Alicante. España
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Resumen
La prevención de la enfermedad cardiovascular (ECV) constituye una prioridad fundamental en la práctica clínica diaria, tanto en Enfermería como en Medicina. Para conseguirla, el control de la dislipidemia es fundamental y la elaboración de guías por expertos, basadas en la evidencia disponible, el modo más racional de su abordaje. Pero en ocasiones, la producción científica llega a ser tan abundante que seleccionar la calidad de los estudios puede generar controversias. Este es el caso que se presenta en este estudio, donde las guías estadounidenses, basadas en ensayos clínicos aleatorizados y controlados, han establecido un nuevo paradigma frente a las guías europeas que además han considerado los diseños de estudios observacionales. Se exponen los puntos fundamentales de ambos casos, la controversia generada y el posterior acercamiento entre ambas guías, valorando la importancia que aporta la evidencia científica.
Palabras clave
Colesterol; triglicéridos; dislipidemia; factores de riesgo cardiovascular; enfermedad cardiovascular; prevención; tratamiento
Abstract
Prevention of cardiovascular disease (CVD) constitutes a critical priority of daily clinical practice, for both nurses and doctors. In order to achieve this, it’s essential to control dyslipidemia by using guides created by experts, based on available research. Occasionally, however, the amount of scientific research can be so abundant that choosing which studies to include can generate controversy. This study analyzes cases in which guides created in the United States, using evidence from randomized controlled clinical trials, have established a new paradigm compared to European guides, which have considered the designs of the American guides to be observational studies. The fundamental arguments of both sides will be discussed, as well as the resulting controversy and the subsequent reconciliation between both guides, which now place more value on scientific evidence.
Keywords
Cholesterol; triglycerides; dyslipidemia; cardiovascular risk factors; cardiovascular disease; prevention; treatment
Introducción
Enfermedad cardiovascular
La enfermedad cardiovascular (ECV) que tiene como base la aterosclerosis y sus consecuencias clínicas, como el infarto agudo de miocardio (IAM) o accidente cerebral vascular (ACV), constituye la principal causa de morbilidad y mortalidad en el conjunto de los países del mundo(1). Aunque la tendencia de la mortalidad por esta causa ha disminuido desde la pasada década de 1980(2), fundamentalmente debido a acciones como el éxito logrado en conseguir el abandono del consumo de tabaco, otros factores de riesgo cardiovascular (FRCV) como la obesidad y la diabetes mellitus tipo 2 (DM2) aumentan sin cesar(3,4). En España, la mortalidad debida a la ECV ajustada por edad también se encuentra en descenso desde los últimos 40 años, especialmente la mortalidad debida a ACV, aunque supone la principal causa de muerte en población española, constituyendo aproximadamente el 30% (28,3%) de todas las defunciones; en cambio, las tasas de morbilidad hospitalaria han aumentado en el mismo período(5), si bien tienden a estabilizarse, lo cual es atribuido a cambios en la evolución de los FRCV, ya que al lado de una disminución del consumo de tabaco, de los niveles de colesterol plasmático y del tratamiento y control de la presión arterial, ha ocurrido lo contrario con la obesidad y la DM2, como se ha comentado anteriormente(6).
Aun considerando el descenso de dicha mortalidad, las enfermedades del sistema circulatorio continúan siendo en su conjunto la principal causa de mortalidad en España, como puede apreciarse en la Figura 1. De un total de 427721 defunciones registradas en el año 2018, las debidas al aparato circulatorio son las más frecuentes, especialmente en mujeres, seguidas de cerca por los tumores, siendo en este caso los varones los más afectados.
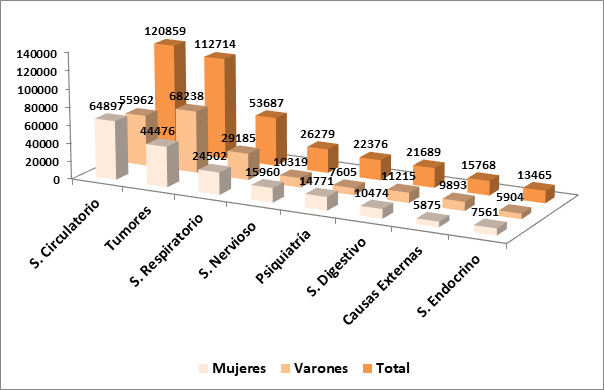
Figura 1. Causas más frecuentes de defunciones en al año 2018 (Números absolutos. Total de defunciones: 427721; mujeres: 211279; varones: 216442). Instituto Nacional de Estadística. Disponible en Instituto Nacional de Estadística (INE): http://www.ine.es/jaxi/menu.do?type=pcaxis&path=%2Ft15%2Fp417&file=inebase&L=0 (última visita el 29 de septiembre de 2020). S: Sistema. Elaboración propia.
Aterosclerosis
La aterosclerosis, cuya larga evolución lleva a la trombosis asociada a la rotura de las placas vulnerables (aterotrombosis), es la principal causa de las ECV, es decir, la enfermedad isquémica del corazón, el ACV y las arteriopatías periféricas. Se trata por tanto de una enfermedad sistémica, ya que abarca a todos los territorios arteriales, de modo que la aparición de una complicación aterotrombótica aguda en uno de ellos, aumenta el riesgo en otro(7). El proceso aterosclerótico es un proceso lento, que comienza en edades muy tempranas con alteraciones mínimas del endotelio arterial (el cual es considerado un órgano endocrino), originándose ya una reacción de defensa de la pared arterial a la agresión. Esta reacción, de carácter inflamatorio, implica que se adhieran al endotelio leucocitos (monocitos y linfocitos T) y plaquetas y se produzcan moléculas vasoactivas, citoquinas y factores de crecimiento. Si no cesa la causa del daño endotelial, este proceso continúa indefinidamente, aumentando el número de monocitos y linfocitos que se internan desde la sangre, liberando factores de crecimiento y estimulando la proliferación y migración de células musculares lisas que se internan en el área inflamada, originando una lesión intermedia. Al tiempo que la pared arterial aumenta su grosor, aparece un remodelado del vaso preservando la luz arterial. Si continúa la agresión a la placa, sucesivos ciclos de acumulación de leucocitos, migración de células musculares lisas y formación de tejido fibroso producen un aumento del tamaño de la lesión aterosclerótica apareciendo una cubierta fibrosa sobre un núcleo lipídico y necrótico. El resultado final es un estrechamiento de la luz arterial alterando el flujo sanguíneo, constituyendo ya una lesión avanzada y originando placas ateroscleróticas vulnerables, susceptibles de ruptura, lo cual constituye el origen de los episodios cardiovasculares agudos(8). En la Figura 2, modificada de Lorenzo O et al(9) y Choudhury et al(10) puede observarse la evolución de la placa en cada estadio.
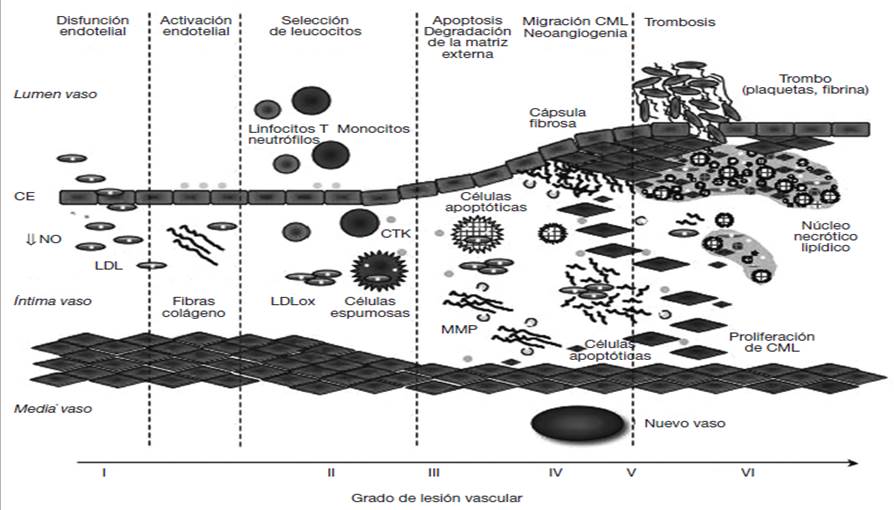
Figura 2. Evolución de la aterosclerosis. Desde la disfunción endotelial a la aterotrombosis. CML: células musculares lisas; CE: capa endotelial; NO: óxido nítrico; LDL: lipoproteínas de baja densidad; LDLox: LDL oxidadas; CTK: Citoquinas; MMP: metaloproteinasas. Modificada de Lorenzo O et al9 y Choudhury et al10.
Lípidos, placa de ateroma y enfermedad aterosclerótica
Para comprender la génesis y desarrollo de la placa de ateroma hay que remontarse a 1910 cuando Adolf Windaus encontró que las placas caseosas de la aorta contenían 25 veces más colesterol que las aortas normales(11). Desde entonces el interés por esta molécula no ha hecho sino aumentar. En el año 1913 Anitschkow observó la presencia de lípidos en la íntima arterial y la relación del colesterol con la producción de las lesiones ateroscleróticas(12). La elevada prevalencia de las ECV en EEUU originó que en 1948 se iniciara el estudio de Framingham(13), estudio de referencia mundial, en el cual quedó acuñado el concepto de FRCV y puso de manifiesto la importancia de los principales FRCV, entre ellos el colesterol elevado, como predictores de la ECV. Puede observarse en la Figura 3, modificada de O’Donnell et al(13) los principales FRCV, ampliamente conocidos, detectados hasta 2008.
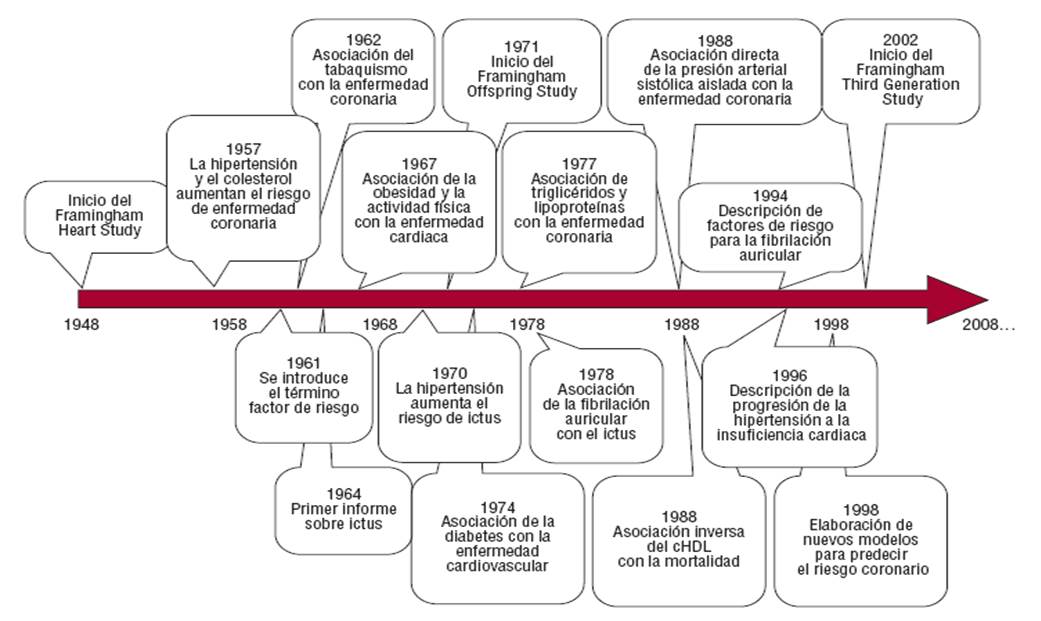
Figura 3. Principales aportaciones realizadas por el estudio Framingham hasta el año 2008. Modificada de O’Donnel et al13. cHDL: colesterol vehiculizado por las lipoproteínas de alta densidad.
Estudios posteriores de cohortes prospectivas, ensayos clínicos y metaanálisis han sido consistentes con el estudio de Framingham y han corroborado que el aumento del CT, el aumento del colesterol transportado por las lipoproteínas de baja densidad (cLDL) y el descenso del colesterol de las lipoproteínas de alta densidad (cHDL) constituyen importantes FR para la aparición de la ECV, de modo que ya no ofrece ninguna duda en considerar a las lipoproteínas de baja densidad (LDL), las cuales son las que más colesterol transportan de todas las lipoproteínas (47%)(14), como un factor clave en el desarrollo de la aterosclerosis. Inducen una alteración de las propiedades antitrombóticas del endotelio vascular y una activación de vías de señalización proinflamatorias. Las LDL atraviesan el endotelio (más, cuanto más pequeñas y densas sean, como sucede en la DM2) y allí, en la íntima arterial, son retenidas (proceso clave en la evolución de la aterosclerosis) por la matriz extracelular (proteoglucanos, colágeno y elastina) sufriendo modificaciones (oxidación, glucosilación, etc) que potencian su actividad aterogénica. Una vez modificadas, son internalizadas indefinidamente en los macrófagos, los cuales proceden de su adhesión previa como monocitos a la superficie endotelial, atravesándola y llegando a la íntima a través de la pared del endotelio desde la luz vascular, transformándose en células espumosas, en cuya génesis también intervienen las células musculares lisas. Además de contribuir de este modo al aumento del volumen de la placa, aumentan la trombogenicidad de la misma por aumentar los niveles de factor tisular circulante y la reactividad de las plaquetas, contribuyendo con ello a la mayor vulnerabilidad de las placas y por tanto, a la aparición de la aterotrombosis en el lecho vascular en que tiene lugar el desarrollo de la misma(15). Es decir, las LDL y el colesterol transportado en ellas son tan claves en el desarrollo de la placa ateromatosa, que valores fisiológicos de 20-40 mg/dL de cLDL, como sucede en los recién nacidos, tendrían mínimas probabilidades de retención de las LDL en el espacio subendotelial, y por tanto, de intervenir en el desarrollo de la aterosclerosis. Cifras cada vez mayores de cLDL parecen intervenir en el inicio y progresión del desarrollo del proceso ateroclerótico de modo que ante cifras más elevadas de cLDL se produce un incremento de la placa, siendo esta respuesta dosis-dependiente, hasta el punto que ya no ofrece duda que niveles plasmáticos elevados de cLDL constituyen un factor no ya de riesgo, sino causal en la aparición de la ECV(16). Numerosos estudios, especialmente cohortes prospectivas y ensayos clínicos realizados con estatinas, mostraban que una reducción del cLDL cada vez más intensa se asociaba a una menor morbimortalidad de origen cardiovascular, dando origen a una conocida frase referida al mismo, “cuanto más bajo, mejor”, para prevenir la ECV. En este sentido O’Keefe et al se preguntaban si el rango de 50-70 mg/dL de cLDL sería el óptimo para personas fisiológicamente normales como sucede en humanos cazadores recolectores y en otras especies animales(17). Estudios posteriores han demostrado que descensos cada vez mayores del cLDL, efectivamente, han corroborado la frase “cuanto más bajo, mejor”. Así, la Figura 4, modificada de Raymond C et al(18), muestra en diferentes estudios clásicos como se reduce el número de eventos CV cuanto más bajo es el cLDL conseguido, llegando a cifras, como el estudio JUPITER(19), en el que la administración de 20 mg de rosuvastatina en el brazo experimental, alcanzó concentraciones plasmáticas de cLDL de 55 mg/dL.

Figura 4. Principales estudios tanto en prevención primaria como secundaria que han demostrado menos episodios cardiovasculares cuanto más bajos han sido los niveles de cLDL logrados. LDL-C: colesterol de las lipoproteínas de baja densidad; CHD: Enfermedad cardíaca coronaria. Modificada de Raymond C et al18.
Posteriormente, la adición a estos estudios de los resultados del estudio IMPROVE-IT(20), mostró que una combinación de fármacos hipolipemiantes (simvastatina 40 mg + ezetimibe 10 mg) logró una reducción del cLDL algo menor en el grupo de intervención (media de 53,7 mg/dL) acompañada asimismo de menores episodios de ECV.
Pero no solo se consiguió disminuir la ECV, sino que niveles muy bajos de cLDL permitieron reducir la placa de ateroma como expusieron Ference et al(16).
Manejo de la hipercolesterolemia
Conocida la importancia del cLDL como factor causal de la aterosclerosis y por tanto de las ECV, había que regular los objetivos a conseguir en sus cifras con el tratamiento disponible según la evidencia científica del momento. Desde el año 2001, dichos objetivos estaban basados en el National Cholesterol Education Program and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) (NCEP-ATP III)(21), en cuyo informe se incidía en la importancia de establecer los niveles a conseguir en el cLDL según el riesgo global del paciente, teniendo en cuenta otras variables como la edad, el colesterol total, estado de fumador, niveles de cHDL y presión arterial sistólica (PAS). Según las cifras de estas variables y basado en el estudio de Framingham(13,22), se obtenía una suma de puntos que configuraban un riesgo a ese paciente en concreto, clasificado en 3 niveles. Según este riesgo, los objetivos a lograr en el cLDL eran <100 mg/dL en el grupo de alto riesgo, <130 mg/dL en el de riesgo moderado y <160 mg/dL en el nivel de bajo riesgo. Pero los resultados de 5 grandes ensayos clínicos con estatinas (HPS(23), PROSPER(24), ALLHAT-LLT(25), ASCOT-LLA(26) y PROVE IT-TIMI22(27)) modificaron en 2004 estos objetivos. Scott Grundy et al(28) a la luz de estas nuevas aportaciones aconsejaron incrementar la reducción del cLDL en pacientes de muy alto riesgo a <70 mg/dL quedando sin modificar los individuos con bajo riesgo. Es decir, a los pacientes clasificados según el riesgo global que presentaban había que conseguir unos valores determinados en el cLDL, estableciéndose que una reducción del cLDL de 30 mg/dL implicaba una reducción del 30% de la aparición de cardiopatía isquémica.
Por tanto, el objetivo del cLDL a conseguir en la población general dependía del RCV de cada paciente. Durante mucho tiempo se ha debatido (y se sigue debatiendo) qué tablas de riesgo utilizar en la predicción del RCV y cuales las cifras de cLDL a conseguir. Así en 2011 aparecieron unas guías elaboradas por la Sociedad Europea de Cardiología y la Sociedad Europea de Aterosclerosis para el manejo de las dislipidemias(29) y en 2012, el “Fifth Joint Task Force” dedicado a la prevención de la ECV(30). Ambas guías ponían de manifiesto calcular el riesgo de cada paciente utilizando las funciones de riesgo SCORE, las cuales valoraban el riesgo de sufrir un episodio mortal de causa cardiovascular en 10 años, presentando dos tipos de tablas que correspondían a países con alto o bajo riesgo de sufrir el episodio CV. A España le corresponde la predicción con la función de bajo riesgo. Dicha tabla es de acceso libre.
Los individuos eran clasificados teniendo en cuenta las siguientes variables: edad, género, hábito de fumar, PAS y valores de CT, en 4 grupos: muy alto riesgo, alto riesgo, moderado riesgo y bajo riesgo de fallecer por ECV. Las condiciones para ser etiquetados de muy alto riesgo o alto riesgo (clasificación que más beneficios obtendría tras una intervención) estaban condicionadas fundamentalmente por haber sufrido una ECV, padecer diabetes mellitus, estar diagnosticado de insuficiencia renal y la clasificación obtenida por el sistema SCORE a los 10 años (muy alto riesgo: puntuación ≥10%; alto riesgo: puntuación ≥5% y <10%; moderado riesgo: puntuación ≥1 y <5% y bajo riesgo: <1%). Además se tendrían en cuenta los siguientes modificadores del riesgo cardiovascular que permitirían reclasificar el riesgo obtenido con la puntuación SCORE: Historia familiar de cardiopatía isquémica prematura (<55 años en varones y <65 años en mujeres), edad (≥45 años en varones y ≥55 años en mujeres), hábito de fumar, padecer hipertensión arterial o estar en tratamiento antihipertensivo y tener unas cifras del cHDL <40 mg/dL en varones y <45 mg/dL en mujeres.
De este modo, según la clasificación del RCV y el valor del cLDL en un paciente determinado, la estrategia a seguir en el control de la dislipidemia estaría condicionada por los objetivos a conseguir en el cLDL en los tramos siguientes: <70 mg/dL; entre 70 y <100 mg/dL; entre 100 y <155 mg/dL; entre 155 y <190 mg/dL y >190 mg/dL. En pacientes de muy alto riesgo el objetivo de cLDL a conseguir sería <70 mg/dL ó reducción del 50% de su nivel inicial de cLDL; en pacientes de alto riesgo el objetivo sería un cLDL <100 mg/dL en pacientes de alto riesgo y <115 mg/dL en pacientes de moderado riesgo(29).
Sin embargo, desde el ATP III no se habían actualizado las guías para el tratamiento de la hipercolesterolemia en adultos a pesar de la numerosa bibliografía generada, hasta que en 2013 (12 años más tarde), Stone et al(31) avalado por la American College of Cardiology y la American Heart Association (ACC/AHA), de EEUU, actualizaron el ATP III y dieron a conocer el que sería el ATP IV, una guía de práctica clínica para el tratamiento de la hipercolesterolemia en adultos, empleando en su elaboración un proceso de selección constituido exclusivamente por ensayos clínicos aleatorizados y controlados (ECAs) y/o metaanálisis de los mismos. Los resultados obtenidos de estos estudios, fundamentados en una reducción del cLDL y del colesterol no HDL (colesterol total menos el colesterol de las HDL) sirvieron de base para aconsejar las recomendaciones en la prevención de la ECV, tanto en prevención primaria como secundaria, así como la valoración del efecto de los fármacos hipolipemiantes, especialmente las estatinas, con escasa mención a otros fármacos en la prevención de la ECV. El aspecto más destacable de esta guía ha sido el no considerar los puntos de corte del cLDL como objetivos a conseguir, tal como recomendaban las guías europeas, originando un gran impacto por el cambio de paradigma que el nuevo enfoque suponía. Por ello, el principal objetivo de este estudio ha sido valorar en ambas guías aquellos aspectos diferentes y a la luz de los conocimientos actuales, evaluar en el tiempo los puntos de consenso o diferenciales detectados entre ambas recomendaciones.
Desarrollo del tema
Justificación del presente estudio
Creemos que es conveniente no solo recordar el camino andado hasta abordar las dislipidemias en el momento actual, sino que al aparecer recientemente dos guías, dos formas de abordar el mismo problema (control del cLDL, factor causal de las ECV que tienen como base la aterosclerosis), nos ha parecido oportuno exponer sus similitudes y diferencias. Dado que se trata de un estudio que no se ajusta a ninguno de los diseños clásicos de investigación (metaanálisis, estudios de intervención, estudios de cohortes, estudios de casos y controles ó estudios trasversales), podría encuadrarse como artículo especial. Se irá exponiendo el desarrollo del tema en diferentes subapartados con el fin de que pueda ser más comprensible para el lector.
Principales características del ATP IV
En la Tabla 1 se resume las recomendaciones mayores realizadas por el equipo de expertos del ATP IV.
Tabla 1. Recomendaciones mayores para el tratamiento de la hipercolesterolemia con el fin de reducir la enfermedad cardiovascular aterosclerótica (modificada de Stone et al, cita 31).
|
Facilitar y potenciar los hábitos de vida saludables en todas las personas. |
|
Iniciar o continuar tratamiento con estatinas a la intensidad adecuada: |
|
1. Enfermedad cardiovascular clínica (ECV) a. Personas ≤75 años y que toleren estatinas: estatinas de alta intensidad (clase I, nivel A) b. Personas >75 años o con intolerancia a estatinas: estatinas de moderada intensidad (clase I, nivel A) |
|
2. Prevención primaria: cLDL ≥190 mg/dL a. Descartar causas secundarias de hipercolesterolemia. b. Personas ≥21 años: estatinas de alta intensidad (clase I, nivel B) c. Alcanzar una reducción ≥50% en el cLDL (clase IIa, nivel B) d. Considerar terapia sin estatinas para reducir aún más el cLDL (clase IIb, nivel C) |
|
3. Prevención primaria: personas con DM entre 40 y 75 años y con un cLDL entre 70 y 189 mg/dL: a. Estatinas de moderada intensidad (clase I, nivel A) b. Considerar estatinas de alta intensidad cuando el riesgo de ECV sea ≥7,5% (clase IIa, nivel B) |
|
4. Prevención primaria: personas entre 40 y 75 años sin DM y con un nivel de cLDL entre 70 y 189 mg/dL: a. Valorar el riesgo a 10 años de padecer una ECV (se recomienda utilizar una calculadora del riesgo basada en las ecuaciones de cohortes conjuntas) en aquellas personas que no están en tratamiento con estatinas; valorar el riesgo en las mismas cada 4-6 años (clase I, nivel B) b. El tomar una estatina inicialmente debe consensuarse con el paciente informando de la disminución del riesgo de ECV, los efectos adversos de las estatinas, las interacciones medicamentosas de las mismas y las preferencias del paciente (clase IIa, nivel C). Insistir en practicar los hábitos de vida saludables y valorara otros factores de riesgo. Si se ha elegido el tratamiento con estatinas: i. Personas con riesgo de padecer una ECV ≥7.5% a los 10 años: estatinas de moderada o alta intensidad (clase I, nivel A) ii. Personas con riesgo de padecer una ECV entre el 5 y el 7.5% a los 10 años: estatinas de moderada o alta intensidad (clase IIa, level B) iii. Considerar otros factores de riesgo: cLDL ≥160 mg/dL, antecedentes familiares de haber padecido ECV prematura, riesgo de ECV de por vida, PCR de alta sensibilidad ≥2.0 mg/L, puntuación de calcio coronario ≥300 unidades Agatston o ITB <0,9 (clase IIb, nivel C). |
|
5. Prevención primaria cuando el cLDL <190 mg/dL y la persona tiene <40 años o >75 y riesgo de ECV a los 10 años <5%: a. El tratamiento con estatinas puede considerarse en personas seleccionadas que pueden aumentar el riesgo (clase IIb, nivel C). |
|
6. El tratamiento inicial con estatinas no está recomendada de forma rutinaria en pacientes con insuficiencia cardíaca de clase II-IV de la NYHA o que estén en tratamiento con hemodiálisis. |
ECV: Enfermedad cardiovascular; cLDL: colesterol de las lipoproteínas de baja densidad; DM: diabetes mellitus; PCR: proteína C reactiva; ITB: índice tobillo-brazo; NYHA: New York Heart Association.
El principal mensaje era que las ECV que tienen como base la aterosclerosis podían prevenirse con la práctica de estilos de vida saludables y un efectivo tratamiento de la hipercolesterolemia y la HTA.
Las estatinas y las dosis consideradas en la Tabla 2 para ser clasificadas de alta o moderada intensidad eran las siguientes:
Tabla 2. Dosis de las diferentes estatinas para ser consideradas de alta, moderada y baja intensidad (modificada de Stone et al, cita 31).
|
Tipo de estatina |
Dosis diaria |
||
|
|
Alta intensidad(*) |
Moderada intensidad(**) |
Baja intensidad (***) |
|
Atorvastatina |
40-80 mg |
10 (20) mg |
- |
|
Rosuvastatina |
20 (40) mg |
(5) 10 mg |
- |
|
Simvastatina |
- |
20-40 mg |
10 mg |
|
Pravastatina |
- |
40 (80) mg |
10-20 mg |
|
Lovastatina |
- |
40 mg |
20 mg |
|
Fluvastatina |
- |
80 mg (XL) |
20-40 mg |
|
Fluvastatina |
- |
40 mg |
- |
|
Pitavastatina |
- |
2-4 mg |
1 mg |
*: Una dosis diaria disminuye el cLDL ≥50%. **: Una dosis diaria disminuye el cLDL entre el 30 y el 50%. ***: Una dosis diaria disminuye el cLDL <30%. cLDL: colesterol de las lipoproteínas de baja densidad.
A modo de resumen, las principales aportaciones del ATP IV, fundamentadas en metaanálisis y ECAs, se centraban en los siguientes puntos:
1.- Cambios en el estilo de vida.- Adquiriendo modos de vida saludables. Se hace un especial énfasis en la aplicación de este apartado.
2.- Definición de grupos que se beneficiarán del tratamiento con estatinas (especial importancia otorgada a consensuar con el paciente el tratamiento).
3.- Seguridad de las estatinas.
4.- Cuando empezar a tomar estatinas.
5.- Estimación del RCV mediante una calculadora de riesgo con predicción a 10 años de sufrir un IM o ACV, procedente de población de EEUU, no validado en España.
6.- Intensidad del tratamiento con estatinas.
7.- Objetivos de tratamiento y
8.- Monitorización del tratamiento con estatinas (Tabla 2)(31).
En las nuevas guías se abandonó como objetivo fijar cifras de cLDL o colesterol no HDL, como ocurría en el ATP III, porque dichos puntos de corte “no están basadas en la evidencia”(32).
El documento suscitó una inmediata controversia en Europa. En España los Profesores Civeira, Ascaso y Masana, en nombre de la Sociedad Española de Arteriosclerosis (SEA), enviaron una carta al editor de J Am Coll Cardiol (33) en la que señalaban que lo que el documento resaltaba como más importante era prescribir estatinas y la disminución del cLDL sería una consecuencia, en vez de fijar unas cifras de cLDL como objetivo, que era lo que se había seguido hasta ese momento. Por otro lado, al estar basado en ECAs dejaría fuera otros diseños de estudios distintos a los ECAs. Acababan la carta posicionándose en nombre de la SEA en no apoyar este documento y sí en cambio las guías de la Sociedad Europea de Cardiología y la Sociedad Europea de Aterosclerosis(29).
Posicionamiento que también adoptó el Comité Español Interdisciplinario de Prevención Cardiovascular (CEIPC) y la Sociedad Española de Cardiología (SEC)(34) después de la revisión del ATP IV en el que se destacaba el abandono de las cifras del cLDL como objetivo de tratamiento, mostrando como ambas guias coinciden en la estrategia a seguir en prevención secundaria, es decir, pacientes que ya han sufrido una ECV. En cambio, en prevención primaria se llegaría a sobretratar un número más grande de personas, especialmente de la tercera edad. Por otro lado, las tablas europeas para clasificar el riesgo de las personas estaban obtenidas de población autóctona y prevendrían del sobretratamiento con estatinas en prevención primaria en caso de que se aplicaran las guias estadounidenses. La Tabla 3 muestra las características de ambas guías.
Tabla 3. Características y clasificación del riesgo en las guías europea y estadounidense (modificada de Lobos JM et al, cita 34).
|
Guía ESC/EAS 2011 (cita 29) (a) |
Guía AHA/ACC 2013 (cita 31) (b) |
|
Muy alto riesgo:
ECV documentada. DM1 o DM2 con ≥1 FRCV y/o daño de órgano diana. ERC grave (FGe <30 ml/min/1,73 m2). Riesgo SCORE ≥10%. |
Riesgo alto (estatinas de alta intensidad):
ECV documentada. cLDL >190 mg/dL y edad ≤75 años. DM con valores de cLDL de 70-189 mg/dL, edad entre 40 y 74 años y riesgo PCEF ≥7,5%. |
|
Alto riesgo:
Un solo FR muy elevado (dislipidemia familiar, HTA grave). DM1 o DM2 sin otros FRCV ni lesión de órgano diana. ERC moderada (FGe 30-60 ml/min/1,73 m2). Riesgo SCORE ≥5% y <10%. |
Riesgo moderado (estatinas de moderada intensidad):
cLDL >190 mg/dL y edad >75 años. DM valores de cLDL de 70-189 mg/dL, edad entre 40 y 74 años y riesgo PCEF <7,5%. |
|
Riesgo moderado:
Riesgo SCORE ≥1% y <5%. |
Bajo riesgo:
Resto de la población. |
|
Bajo riesgo:
Riesgo SCORE <1%. |
|
ESC/EAS: European Society of Cardiology/European Atherosclerosis Society; AHA/ACC: American Heart Association/American College of Cardiology; ECV: Enfermedad cardiovascular; DM1: Diabetes mellitus tipo 1; DM2: Diabetes mellitus tipo 2; FRCV: Factor de riesgo cardiovascular; cLDL: colesterol de las lipoproteínas de baja densidad; ERC: Enfermedad renal crónica; FGe: Filtrado glomerular estimado; PCEF: Pooled Cohort Equations Function; SCORE: Systematic Coronary Risk Evaluation; HTA: hipertensión arterial. (a): Definidos claramente en la guía europea. (b): Niveles de riesgo basados en los cuatro grupos mostrados en la Tabla 2 y que obtendrían mayor beneficio tratados con estatinas.
Discusión
¿Qué ha sucedido para que la discrepancia entre ambas guías surgiera nada más publicarse el ATP IV en el año 2013, persiguiendo tanto la americana como la europea el mismo fin, que no es otro que la prevención de la ECV tanto primaria como secundaria?
Posiblemente, el aspecto diferencial más marcado sería que las guías americanas solo incluyeron datos procedentes de ECAs y metaanálisis, excluyendo otros diseños que pudieran contribuir a la evidencia como los estudios observacionales (cohortes y casos y controles). También que las guías americanas usaron una calculadora de riesgo basada en cohortes de EEUU de razas blanca y afroamericana, criticada porque sobreestimaba el RCV. En este punto la guía europea recomendó el uso de las tablas SCORE, basadas en población autóctona. Aun así, hay puntos de consenso entre ambas guías como bien indican Lobos et al(34), señalando que las diferencias más importantes residían en la definición de la categoría del riesgo y los objetivos terapéuticos; las guías europeas definían 4 categorías de riesgo con objetivos terapéuticos acorde a la clasificación realizada y la guía americana 4 grupos de pacientes en los que estaba indicado el tratamiento con estatinas, así como las dosis a utilizar en cada caso. En cuanto al tratamiento, las guías americanas centran el tratamiento en las estatinas, grupo de fármacos en los que más ECAs se han realizado, en detrimento de otros fármacos hipolipemiantes como fibratos, resinas de intercambio iónico, inhibidores de la absorción de colesterol o ácidos grasos omega-3, ya que no presentaban la evidencia que las estatinas, aunque se consideraba su opción ante intolerancia a las mismas. Sin embargo, las guías europeas sí contemplaban estos grupos de fármacos. Si las guías de EEUU se aplicaran en España, multiplicaría por más de 2 el número de individuos que precisarían tratamiento hipolipemiante, diferencia más acusada entre los 50 y 60 años(34).
Este cambio de paradigma, al no estar basado en controles analíticos, podría llevar a tener un impacto negativo en los pacientes y en los responsables de la salud, con poca costumbre de indicar un tratamiento y no comprobar sus resultados, contribuyendo con ello a una percepción de menos control y seguimiento, y por tanto, pérdida de adherencia. Quizá sea este uno de los puntos fuertes de las guías europeas, el marcar objetivos claros en el cLDL en función del RCV, ya que este control lipídico puede servir como indicador de respuesta al tratamiento y con ello mejorar la adherencia al mismo.
Aunque se trataba de buscar que ambas modalidades fueran complementarias(34), el CEIPC y la SEC concluyeron que las guías europeas son más apropiadas al entorno español. Hecho que quedó corroborado con unas nuevas guías aparecidas en 2016 tanto para la prevención de la ECV(1), como para el manejo de las dislipidemias(35), manteniendo como objetivos niveles de cLDL en función del RCV según valoración del RCV total utilizando el sistema SCORE. De hecho, también en 2016, vieron la luz unas nuevas guías americanas(36) en las que se mantenían los grupos que se beneficiarían del tratamiento con estatinas (cuatro), pero contemplaban otros tratamientos como ezetimibe, secuestradores de ácidos biliares, inhibidores de la proproteína convertasa subtilixina/kexina tipo 9 (iPCSK9) y otros utilizados en la hipercolesterolemia familiar como lomitapide o LDL-aféresis. También se admitieron como objetivos de control puntos de corte del cLDL en 100 mg/dL o 70 mg/dL según su indicación. Sin embargo, el calculador para establecer el RCV estaba basado en población de EEUU, no validado en España.
Situación actual
Parecería que desde el año 2016, fecha de publicación de las últimas guías comentadas, transcurriría un tiempo mayor que el acontecido para establecer similitudes y diferencias entre ambas, y por tanto originar algún acuerdo o actitud entre los profesionales de la salud para aplicar a sus pacientes. No ha pasado mucho tiempo, hasta que recientemente, publicadas en 2019, han surgido dos nuevas guias(37,38) relacionadas con el manejo y control de las dislipidemias, motivadas por la aparición de nuevas evidencias en este corto período de tiempo y cuyo contenido se comentará seguidamente.
En el caso de las guías europeas, las circunstancias más notables acaecidas para ser modificadas en 3 años (de 2016 a 2019) han sido las siguientes:
1.- Recomendación de la determinación de la apo B, especialmente en pacientes que cursan con hipertrigliceridemia, DM2, obesidad, síndrome metabólico o muy bajos niveles de cLDL, preferible a la del colesterol no HDL.
2.- Cuando el control de la hipercolesterolemia no se logra con las dosis máximas toleradas de estatinas añadir ezetimibe.
3.- En prevención secundaria, pacientes de muy alto RCV o diagnosticados de Hipercolesterolemia Familiar (HF) con muy alto RCV, si no logran sus objetivos en los niveles de cLDL con las dosis máximas de estatinas toleradas combinadas con ezetimibe, añadir iPCSK9.
4.- En pacientes con hipertrigliceridemia (>200 mg/dL) se recomiendan las estatinas como principal fármaco de elección.
5.- En pacientes con HF heterozigota que han sufrido ECV, los objetivos a conseguir en reducir el cLDL son disminuir los niveles un 50% basal y alcanzar valores <55 mg/dL. Si no se lograra con las máximas dosis toleradas de estatinas y ezetimibe, añadir iPCSK9.
En la clasificación del RCV se aconseja utilizar el sistema SCORE para países de bajo riesgo en Europa, como es el caso de España. La figura 5 muestra las características de cada uno de los niveles de riesgo y el valor de las cifras del cLDL a conseguir.
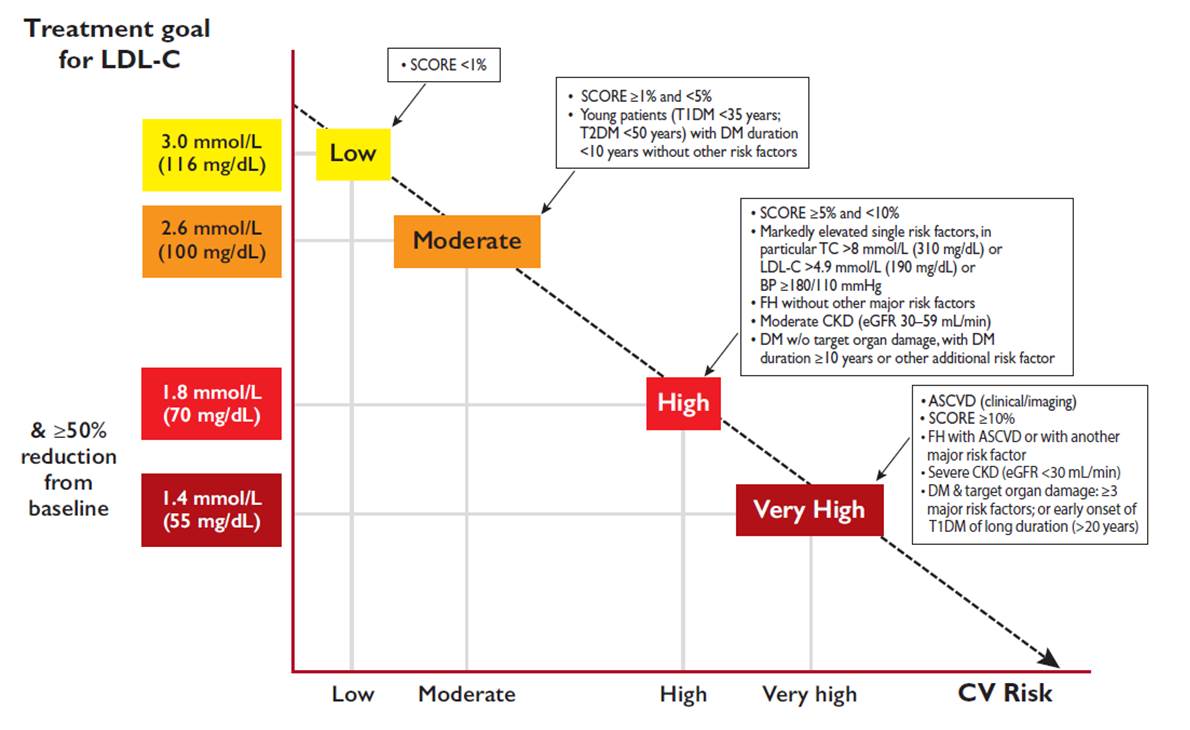
Figura 5. Clasificación del riesgo cardiovascular según características clínicas asociadas y objetivos de tratamiento a conseguir en el colesterol de las lipoproteínas de baja densidad (LDL). LDL-C: colesterol de las LDL; T1DM: diabetes mellitus tipo 1; T2DM: diabetes mellitus tipo 2; DM: diabetes mellitus; TC: colesterol total; BP: presión arterial; FH: hipercolesterolemia familiar; CKD: enfermedad renal crónica; eGFR: filtrado glomerular; ASCVD: enfermedad cardiovascular aterosclerótica; CV: cardiovascular. Modificada de Mach F et al37.
En cuanto a las nuevas guías americanas(38), las principales novedades incorporadas pueden resumirse en que en prevención primaria incluye la determinación del calcio en las arterias coronarias con el fin de clasificar mejor el riesgo del paciente y reduce el tratamiento de la hipercolesterolemia al uso exclusivo de estatinas (excepto en el caso de la HF) y en prevención secundaria amplía el tratamiento, además del uso de las estatinas, a la utilización de ezetimibe y de iPCSK9, introduciendo un punto de corte del cLDL en 70 mg/dL en pacientes considerados de muy alto riesgo. En la Tabla 4, se expone de modo resumido las características de ambas guías.
Tabla 4. Principales características, clasificación del riesgo y objetivos terapéuticos en las guías estadounidense y europea.
|
|
AHA/ACC (cita 38) |
ESC/EAS (cita 37) |
|
Prevención primaria |
||
|
Valoración del riesgo: |
Ecuaciones de cohortes conjuntas de EEUU: -Predicción de IAM y ACV fatal y no fatal a los 10 años. |
SCORE: -Predicción de ECV aterosclerótica fatal a los 10 años. |
|
Variables incluidas en el cálculo del riesgo: |
Edad, género, etnia, CT, cHDL, PAS, DM tipo 2, tratamiento antihipertensivo, estado de fumador. |
Edad, género, CT, cHDL, PAS, estado de fumador. |
|
Grupos de riesgo: |
Alto: ≥20%. Intermedio: ≥7,5% y <20%. Límite: ≥5% y <7,5%. Bajo: <5%. |
Muy alto: ≥10%. Alto: ≥5 y <10%. Moderado: ≥1% y <10%. Bajo: <1%. |
|
Factores que aumentan el riesgo (AHA/ACC) y
Factores modificadores o clasificadores del riesgo (ESC/EAS): |
Historia familiar precoz de ECV. cLDL: 160-189 mg/dL. Síndrome metabólico. Estado inflamatorio crónico. ERC. Menopausia prematura. Preeclampsia. Etnicidad. > PCR de alta sensibilidad. > Lp(a). > apo B. ITB < 0,9.
Valoración del calcio coronario: con el fin de reclasificar el riesgo del paciente. |
Historia familiar precoz de ECV. DM tipo 1 y 2. HF. Deprivación social. Estrés psicosocial. Inactividad física. Obesidad. ERC. Estado inflamatorio crónico. Fibrilación auricular. Hipertrofia VI. Apnea obstructiva del sueño. Hígado graso no alcohólico. Enfermedades psiquiátricas mayores. Tratamiento por VIH.
Valoración del calcio coronario: con el fin de reclasificar el riesgo del paciente de bajo o moderado riesgo a uno superior. |
|
Tratamiento: |
Estatinas: cLDL > 190 mg/dL (alta intensidad) DM 2 y edad 40-75 años (moderada intensidad) Intermedio (moderada intensidad). Alto (alta intensidad).
Otros fármacos (ezetimibe y/o iPCSK9): Solo en HF. |
Objetivo del tratamiento:
Muy alto riesgo: reducción del cLDL ≥50% de la cifra basal y cLDL <55 mg/dL.. Alto riesgo: reducción del cLDL ≥50% del valor basal y cLDL <70 mg/dL.
Uso de estatinas y otros fármacos de modo escalonado hasta alcanzar objetivos. |
|
Prevención secundaria |
||
|
Grupos de riesgo: |
Riesgo de ECV muy elevado: Varios episodios de ECV ó un episodio de ECV y múltiples condiciones de alto riesgo.
El resto de situaciones no son consideradas de muy alto riesgo. |
Muy alto riesgo: Cualquier tipo de ECV padecida. HF con ECV. ERC severa. DM 2 con lesión de órgano diana. SCORE ≥10%. |
|
Objetivo cLDL: |
<70 mg/dL (muy alto riesgo) |
<55 mg/dL y reducción del cLDL basal ≥50% <40 mg/dL si recurrencia ECV <2 años.. |
|
Tratamiento: |
Escalonado hasta alcanzar objetivo: Estatinas + Ezetimibe + iPCSK9. |
Escalonado hasta alcanzar objetivo: Estatinas + Ezetimibe + iPCSK9.
En pacientes de alto o muy alto riesgo añadir etilo de icosapento si los triglicéridos: 135-499 mg/dL. |
AHA: American Heart Association; ACC: American College of Cardiology; ESC: European Society of Cardiology; EAS: European Atherosclerosis Society; SCORE: Systematic Coronary Risk Estimation; IAM: infarto agudo de miocardio; ACV: accidente cerebral vascular; ECV: enfermedad cardiovascular; CT: colesterol total; cHDL: colesterol de las lipoproteínas de alta densidad; PAS: presión arterial sistólica; DM: diabetes mellitus; cLDL: colesterol de las lipoproteínas de baja densidad; ERC: enfermedad renal crónica; PCR: proteína C reactiva; Lp(a): lipoproteína a; apo B: apolipoproteína B; ITB: índice tobillo brazo; HF: hipercolesterolemia familiar; VI: ventrículo izquierdo; VIH: virus de la inmunodeficiencia humana; iPCSK9: inhibidores de la proproteína convertasa subtilixina/kesina tipo 9. Elaboración propia. Basada en la cita 39.
La potencia de las diferentes estatinas referenciadas en las guías AHA/ACC para reducir el cLDL se expone en la Tabla 5.
Tabla 5. Potencia de las diferentes estatinas en la reducción del cLDL.
|
|
Alta intensidad |
Moderada intensidad |
Baja intensidad |
|
Descenso del cLDL |
≥50% |
30%-49% |
<30% |
|
Estatinas |
Atorvastatina: 40-80 mg. Rosuvastatina: 20-40 mg. |
Atorvastatina 10 mg. (20 mg.) Rosuvastatina (5 mg.) 10 mg. Simvastatina 20-40 mg. |
Simvastatina 10 mg. |
|
|
… |
Pravastatina 40 mg. (80 mg.) Lovastatina 40 mg. (80 mg.) Fluvastatina XL 80 mg. Fluvastatina 40 mg. BID Pitavastatina 1-4 mg. |
Pravastatina 10-20 mg.
Lovastatina 20 mg.
Fluvastatina 20-40 mg. |
cLDL: colesterol de las lipoproteínas de baja densidad. Elaboración propia. Basada en la cita 38.
Por tanto, puede observarse que, aunque los principios rectores de ambas guías son similares (evitar la ECV considerando al cLDL como objetivo principal del tratamiento en las dislipidemias), hay diferencias en otras situaciones como en la clasificación del riesgo, el cual está basado en poblaciones propias de cada lugar de origen, en las variables a considerar o en los objetivos del tratamiento. Como situación especial, y mostrada en ambas guias, se aprecia la influencia que la HF tiene en la aparición de la ECV, que en el caso de la guía ESC/EAS es la primera vez que queda incluida en las categorías de muy alto riesgo y alto riesgo. Es una buena ocasión para recordar esta alteración genética, la enfermedad monogénica más frecuente en el ser humano, cuya prevalencia se estima en 1 caso por cada 250 personas en la forma heterozigota (HFhe) y 1 caso cada 300.000 en la forma homozigota (HFho). Su importancia radica en que no detectada ni tratada adelanta la aparición de la ECV entre 10 y 40 años. Aún permanece infradiagnosticada e infratratada(40), constituyendo uno de los principales retos de la Fundación Hipercolesterolemia Familiar (www.colesterolfamiliar.org), especialmente sensibilizada con esta entidad patológica y que desde sus orígenes ha conseguido logros importantes, como la aportación reducida del tratamiento en estos pacientes o iniciar y continuar una numerosa cohorte (SAFEHEART) de pacientes y familiares con esta afección, siendo pionera en el mundo. Una publicación reciente ha valorado la incidencia de la ECV en estos pacientes después de una mediana de seguimiento de 6,6 años(41). Entre sus hallazgos destaca la importancia del valor de la lipoproteína a [Lp(a)] como valor pronóstico(42) y el desarrollar una ecuación de predicción en estos pacientes, puesto que no todos tienen la misma probabilidad de padecer una ECV(43). Es decir, nuestro propósito al realizar estos últimos comentarios ha sido tener en cuenta esta frecuente enfermedad monogénica, sobre todo en hipercolesterolemias muy elevadas en personas jóvenes y tratar de diagnosticarla cuanto más precozmente, mejor(44). Incluso se ha comentado recientemente (V Simposium virtual de Hipercolesterolemia Familiar, celebrado los días 7 y 8 de este mes de octubre de 2020) la posibilidad de determinar el colesterol en todo recién nacido aprovechando los análisis que se les realiza en el talón.
Por tanto, el solo hecho de proceder de poblaciones diferentes, con objetivos diferentes derivados del estudio de las mismas, hace que debamos adaptarnos a las guías europeas. En este sentido, puede observarse con más detalle los comentarios realizados muy recientemente por la Sociedad Española de Cardiología y un grupo de expertos(45) respecto a las mismas. Destaca un interés en promover los estilos de vida saludables, mantener el sistema SCORE como el método para valorar el RCV de una persona en concreto o la incorporación de las pruebas de imagen para reclasificar el riesgo de sufrir una ECV en pacientes situados en bajo o mediano riesgo a una categoría del riesgo superior. La HF aparece incluida por primera vez en la categoría de muy algo riesgo (si se acompaña de ECV u otro FRCV mayor), así como la importancia de la DM en la clasificación del RCV (muy alto si presenta lesiones en órganos diana o se acompaña al menos de 3 FRCV mayores o si es el caso de la DM1 una duración mayor de 20 años). Como novedad se introduce la importancia de la medición de la Lp(a) al menos una vez en la vida. Aunque el cLDL continua siendo el objetivo terapéutico, en determinadas condiciones sería deseable valorar el conjunto de las lipoproteínas aterogénicas mediante la medición de la apo B (preferible) o el cálculo del col-no-HDL(46). En cuanto al estado de ayuno se indica que si el paciente no estuviera en ayunas, se debe tener en cuenta que en este estado los TG presentan por término medio unos valores superiores de 27 mg/dL al que le correspondería si estuviera en ayunas(47). Como recomendación, creemos que si se trata de evaluar un paciente en concreto y se precisa definir el riesgo teniendo como meta el cLDL, el paciente debiera estar al menos entre 8 y 10 horas en ayunas, pero si se sabe que padece hipertrigliceridemia, alcanzar 12 horas de ayuno, con especial cuidado de prevenir hipoglucemias en pacientes diabéticos, en cuyo caso se utilizaría el col no HDL o la apo B como objetivo terapéutico. Por tanto, si el objetivo del tratamiento está basado en los valores de la apo B o el col no HDL, el paciente no precisa estar en ayunas(48).
Una de las principales innovaciones con respecto a la guía 2016 son las metas terapéuticas. La Tabla 6 presenta estos cambios.
Tabla 6. Diferencias en los objetivos terapéuticos entre las guías de 2016 y 2019 en la reducción del cLDL.
|
|
Guías 2016 (cita 35) |
Guías 2019 (cita 37) |
||
|
Categoría del riesgo |
cLDL |
NR |
cLDL |
NR |
|
Muy alto |
<70 mg/dL o reducción ≥50% del cLDL si estaba entre 100 y 200 mg/dL |
1 B |
Reducción ≥50% y <55 mg/dL. |
PS: I A PP sin HF: 1 C PP con HF: IIa C |
|
Alto |
< 100 mg/dL o reducción ≥50% del cLDL si estaba entre 100 y 200 mg/dL. |
1 B |
Reducción ≥50% y <70 mg/dL. |
I A |
|
Moderado |
<115 mg/dL |
IIa C |
<100 mg/dL |
IIa A |
|
Bajo |
<115 mg/dL |
IIa C |
<116 mg/dL |
IIb A |
cLDL: colesterol de las lipoproteínas de baja densidad. NR: nivel de recomendación; PS: prevención secundaria; PP: prevención primaria. HF: hipercolesterolemia familiar. Basada en la cita 47.
Las actuales recomendaciones comparadas con las de 2016 son más exigentes, cuyos cambios están basados en que el colesterol es un factor causal de la ECV y que los estudios en los que se basa son robustos y el nivel de cLDL conseguido es seguro, de modo que se sigue afianzando la frase de que el cLDL “cuanto más bajo mejor”. Dichos cambios implica intensificar el tratamiento para conseguir los objetivos señalados, especialmente en prevención secundaria(47) y en opinión, que compartimos, del Prof. Pedro-Botet (jornada de encuentros virtuales organizada por la SEA el 22 de octubre de 2020), el tratamiento hipolipemiante, una vez indicado, debe ser realizado cuanto antes, de modo agresivo y requerirá con frecuencia terapia combinada. Para conseguirlo, la Sociedad Española de Cardiología ha elaborado recientemente unas recomendaciones para mejorar el control lipídico basadas en unos algoritmos fáciles de entender y en los que se incluye la mayoría de situaciones que se presentan en prevención secundaria(49). Sin embargo, la principal puerta de entrada de la inmensa mayoría de los problemas de salud está en la Atención Primaria. Por ello, la Sociedad Española de Medicina Familiar y Comunitaria ha elaborado unos “comentarios” a las guías europeas desde la perspectiva del médico de familia(50). Destacan los autores la importancia de asociar una categoría del RCV al paciente dislipidémico y la dificultad que entraña el que los nuevos objetivos en la disminución del cLDL sean más exigentes que las guías de 2016, lo cual podría dificultar aún más el cumplimiento terapéutico. Subrayan la importancia del cambio que debe realizarse en los estilos de vida de estos pacientes y presentan un algoritmo indicando el tratamiento farmacológico más adecuado para reducir el cLDL.
Por otro lado, no debe olvidarse que, aunque este artículo ha estado centrado en las dislipidemias, estas constituyen un aspecto, si bien importante, de la protección global de la salud cardiovascular. Es decir, es fundamental, además del control de los diferentes FRCV, cuidar los estilos de vida, especialmente no fumar, combatir la obesidad y promover la actividad física tanto a nivel poblacional como individual(51). Un amplio apartado se ha dedicado a estos temas tanto en las recientísimas guías europeas de prevención vascular en 2020(52) como en la adaptación de las mismas a España por el Comité Español Interdisciplinario para la Prevención Vascular (CEIPV)(53).
Finalmente, y a pesar de las recomendaciones publicadas tanto para el control de la dislipidemia como de otros FRCV, es conocido que el nivel de control, tanto en prevención primaria como secundaria, es bajo. Por ello, debería estandarizarse el registro de los principales síntomas y signos en aquellos pacientes cuyo RCV se precisa valorar, así como establecer recomendaciones específicas para el tratamiento de los diferentes FRCV. En este sentido Mostaza et al(54) en nombre de la Sociedad Española de Arteriosclerosis han elaborado unos estándares útiles en estos pacientes incluyendo la organización de una consulta de riesgo vascular.
Conclusiones
Para conseguir la máxima eficacia en la prevención de la ECV, el control de la dislipidemia es fundamental y la elaboración de guías por expertos, basadas en la evidencia disponible, el modo más racional de su abordaje. Después de exponer la evolución del control único de la dislipidemia durante mucho tiempo, la aparición de dos modos de afrontar este tratamiento y tras un intenso debate, la incorporación de recientes estudios, especialmente realizados con iPCSK9 hasta el año 2019, han motivado la aparición de dos actualizaciones de ambas guías, mostrando claras diferencias entre ambas. Ante estas diferencias, en nuestro medio parece más racional seguir las guías europeas para el manejo de las dislipidemias adaptadas a nuestro medio, sin olvidar algunos aspectos racionales incorporados por las guías estadounidenses.
Conflicto de interés
Los autores declaran no tener conflicto de interés
Referencias
1. Piepoli MF, Hoes AW, Agewall S, Albus C, Brotons C, Catapano AL, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice. The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts). Eur Heart J. 2016;doi:10.1093/eurheartj/ehw106.
2. Moran AE, Forouzanfar MH, Roth GA, Mensah GA, Ezzati M, Murray CJ, et al. Temporal trends in ischemic heart disease mortality in 21 world regions, 1980 to 2010: the Global Burden of Disease 2010 study. Circulation. 2011;29:1483-92.
3. Finucane MM, Stevens GA, Cowan MJ, Danaei G, Lin JK, Paciorek CJ, et al. National, regional, and global trends in body-mass index since 1980: systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9.1 million participants. Lancet. 2011;377:557-67.
4. Danaei G, Finucane MM, Lu Y, Singh GM, Cowan MJ, Paciorek CJ, et al. National, regional, and global trends in fasting plasma glucose and diabetes prevalence since 1980: systematic analysis of health examination surveys and epidemiological studies with 370 country-years and 2.7 million participants. Lancet. 2011;378:31-40.
5. Royo-Bordonada MÁ, Armario P, Lobos Bejarano JM, Pedro-Botet J, Villar Alvarez F, Elosua R, et al. Adaptación española de las guías europeas de 2016 sobre prevención de la enfermedad cardiovascular en la práctica clínica. Clin Invest Arterioscler. 2017;29:69-85.
6. Flores-Mateo G, Grau M, O’Flaherty M, Ramos R, Elosua R, Violan-Fors C, et al. Análisis de la disminución de la mortalidad por enfermedad coronaria en una población mediterránea: España 1998-2005. Rev Esp Cardiol. 2011;64:988-96.
7. Lahoz C, Mostaza JM. La aterosclerosis como enfermedad sistémica. Rev Esp Cardiol. 2007;60:184-95.
8. Martínez-González J, Berrozpe M, Badimon L. Historia natural de la arteriosclerosis. Manifestaciones clínicas. Complicaciones agudas y crónicas. Valoración diagnóstica. Medicine. 2001;8:2230-9.
9. Lorenzo O, Blanco-Colio LM, Martín-Ventura JL, Sánchez-Galán E, Ares-Carrasco S, Zubiri I, et al. Nuevos mediadores implicados en la génesis de la aterosclerosis. Clin Invest Arterioscl. 2009;21:25-33.
10. Choudhury RP, Fuster V, Fayad ZA. Molecular, celular and functional imaging of atherothrombosis. Nature Reviews. 2004;3:913-25.
11. Goldstein JL, Brown MS. A Century of Cholesterol and Coronaries: From Plaques to Genes to Statins. Cell. 2015;16:161-72.
12. Finking G, Hanke H. Nikolaj Nikolajewitsch Anitschkow (1885-1964) established the cholesterol-fed rabbit as a model for atherosclerosis research. Atherosclerosis. 1997;135:1-7.
13. O’Donnell CJ, Elosua R. Factores de riesgo cardiovascular. Perspectivas derivadas del Framingham Heart Study. Rev Esp Cardiol. 2008;61:299-310.
14. González-Santos P, Valdivielso P. Diagnóstico clínico y biológico general de las dislipemias aterógenas. En: Merino J, coordinador. Lípidos, arteriosclerosis y riesgo cardiovascular. Unidad 1. Madrid:Drug-Farma;2002.p.31-43.
15. Badimón L, Vilahur G, Padró T. Lipoproteínas, plaquetas y aterotrombosis. Rev Esp Cardiol. 2009;62:1161-78.
16. Ference BA, Ginsberg HN, Graham I, Ray KK, Packard CJ, Bruckert E, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atheroclerosis Society Consensus Panel. Eur Heart J. 2017; 38:2459-72.
17. O’Keefe Jr JH, Cordain L, Harris WH, Moe RM, Vogel R. Optimal Low-Densiy Lipoprotein is 50 to 70 mg/dl. Lower is Better and Physiologically Normal. J Am Coll Cardiol. 2004;43:2142-6.
18. Raymond C, Cho L, Rocco M, Hazen SL. New guidelines for reduction of blood cholesterol: Was it worth the wait? Cleve Clin J. 2014;81:11-9.
19. Ridker PM, Danielson E, Fonseca FAH, Genest J, Gotto AM, Kastelein JJP, et al. Rosuvastatin to Prevent Vascular Events in Men and Women with Elevated C-Reactive Protein. N Engl J Med. 2008;359:2195-207.
20. Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, et al. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med. 2015; DOI:10.1056/NEJMoa1410489.
21. Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA. 2001;285:2486-97.
22. Balcells M. El estudio Framingham. Neurosciences and History. 2016;4:43-6.
23. Heart Protection Study (HPS). Lancet. 2002;360:7-22.
24. Prospective Study of Pravastatin in the Elderly at Risk (PROSPER). Lancet. 2002;360:1623-30.
25. Antihypertesive and Lipid-Lowering Treatment to Prevent Heart Attack Trial-Lipid Lowering Trial (ALLHAT-LLT). JAMA. 2002;288:2998-3007.
26. Anglo Scandinavian Cardiac Outcomes Trial-Lipid-Lowering Arm (ASCOT-LLA). Lancet. 2003;361:1149-58.
27. Pravastatin or Atorvastatin Evaluation and Infection-Thrombolysis in Myocardial Infarction 22 (PROVE IT-TIMI22). N Engl J Med. 2004;350:1495-504.
28. Grundy SM, Cleeman JI, Merz CNB, Brewer Jr HB, Clark LT, Hunninghake DB, et al. Implications of Recent Clinical Trials for the National Cholesterol Education Program Adult Treatment Panel III Guidelines. Circulation. 2004;110:227-39.
29. ESC/EAS Guidelines for the management of dyslipidaemias. The Task Force for the management of dyslipidaemias of the European Society of Cardiologý (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J. 2011;32:1769-818.
30. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Eur Heart J. 2012;33:1635-701.
31. Stone NJ, Robinson JG, Lichstenstein AH, Bairey Merz CN, Blum CB, Eckel RH, et al. 2013 ACC/AHA Guideline on the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk in Adults. J Am Coll Cardiol. 2014;63:2889-934.
32. Martin SS, Blumenthal RS. Conceps and controversies: the 2013 American College of Cardiology/American Heart Association risk assessment and cholesterol treatment guidelines. Ann Intern Med. 2014;160:356-8.
33. Civeira F, Ascaso J, Masana L. Should we forget about low-density lipoprotein cholesterol? J Am Coll Cardiol. 2014;63:1228-9.
34. Lobos JM, Galve E, Royo-Bordonada MA, Alegría E, Armario P, Brotons C, et al. Posicionamiento del Comité Español Interdisciplinario de Prevención Cardiovascular y la Sociedad Española de Cardiología en el tratamiento de las dislipemias. Divergencia entre las guías europea y estadounidense. Rev Esp Cardiol. 2014;67:913-9.
35. Catapano AL, Graham I, De Backer G, Wiklund O, Chapman MJ, Drexel H, et al. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias. Eur Heart J. 2016;37:2999-3058.
36. Lloyd-Jones DM, Morris PB, Ballantyne CM, Birtcher KK, Daly Jr DD, DePalma SM, et al. 2016 ACC Expert Consensus Decision Pathway on the Role of Non-Statin Therapies for LDL-Cholesterol Lowering in the Management of Atherosclerotic Cardiovascular Disease Risk. A Report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents Endorsed by the National Lipid Association. J Am Coll Cardiol. 2016;68:92-125.
37. Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020;41:111-88.
38. Grundy SM, Stone NJ, Bailey AL, Beam C, Birtcher KK, Blumenthal RS, et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2019;139:e1046-e1081.
39. Raygor V, Khera A. New Recommendations and Revised Concepts in Recent Guidelines on the Management of Dyslipidemias to Prevent Cardiovascular Disease: the 2018 ACC/AHA and 2019 ESC/EAS Guidelines. Curr Cardiol Rep. 2020;22:87. doi: 10.1007/s11886-020-01331-z.
40. Watts GF, Gidding SS, Mata P, Pang J, Sullivan DR, Yamashita S, et al. Familial hypercholesterolaemia: evolving knowledge for designing adaptive models of care. Nat Rev Cardiol. 2020;17:360-77.
41. Pérez de Isla L, Arroyo-Olivares R, Alonso R, Muñiz-Grijalvo O, Díaz-Díaz JL, Zambón D, et al. SAFEHEART researchers. Incidence of cardiovascular events and changes in the estimated risk and treatment of familial hypercholesterolemia: the SAFEHEART registry. Rev Esp Cardiol (Engl Ed). 2020;73:828-34.
42. Ellis KL, Pérez de Isla L, Alonso R, Fuentes F, Watts GF, Mata P. Value of Measuring Lipoprotein(a) During Cascade Testing for Familial Hypercholesterolemia. J Am Coll Cardiol. 2019;73:1029-39.
43. Pérez de Isla L, Alonso R, Mata N, Fernández-Pérez C, Muñiz O, Díaz-Díaz JL, et al. Predicting Cardiovascular Events in Familial Hypercholesterolemia: The SAFEHEART Registry (Spanish Familial Hypercholesterolemia Cohort Study). Circulation. 2017;135:2133-44.
44. Reducing the Clinical and Public Health Burden of Familial Hypercholesterolemia. A Global Call to Action. Representatives of the Global Familial Hypercholesterolemia Community JAMA Cardiol. 2020;5:217-29.
45. Comments on the 2019 ESC/EAS guidelines for the management of dyslipidemias. SEC Working Group for the 2019 ESC/EAS guidelines for the management of dyslipidaemias, Expert Reviewers for the 2019 ESC guidelines for the management of dyslipidaemias, SEC Guidelines Committe. Rev Esp Cardiol. 2020;73:348–53.
46. Carbayo Herencia JA, Simarro Rueda M, Palazón Bru A, Molina Escribano F, Ponce García I, Artigao Ródenas LM, et al; Todos en nombre del Grupo de Enfermedades Vasculares de Albacete (GEVA). Evaluation of non-HDL cholesterol as a predictor of non-fatal cardiovascular events in a prospective population cohort. Clin Investig Arterioscler. 2018;30:64-71.
47. SEC Working Group for the 2019 ESC/EAS guidelines for the management of dyslipidaemias, Expert Reviewers for the 2019 ESC guidelines for the management of dyslipidaemias, SEC Guidelines Committe. Comments on the 2019 ESC/EAS guidelines for the management of dyslipidemias. Rev Esp Cardiol (Engl Ed). 2020;73:348-353.
48. Brotons C, Esteban M, García Lerín A, Lekuona I, Pintó X, Rodríguez Padial L, et al. Homogeneización de los valores del perfil lipídico. Documento de consenso. Barcelona: Sociedad Española de Medicina del Laboratorio; 2017.
49. Escobar C, Anguita M, Arrarte V, Barrios V, Cequier Á, Cosín-Sales J, et al. Expert reviewers. Recommendations to improve lipid control. Consensus document of the Spanish Society of Cardiology. Rev Esp Cardiol (Engl Ed). 2020;73:161-167.
50. Lago Deibe F, Escribano D, Párraga I. Guía de dislipemias SEC_SEA 2019. Comentarios desde la perspectiva del médico de familia. Barcelona: Sociedad Española de Medicina de Familia y Comunitaria; 2020.
51. Pérez-Jiménez F, Pascual V, Meco JF, Pérez Martínez P, Delgado Lista J, Domenech M, et al. Document of recommendations of the SEA 2018. Lifestyle in cardiovascular prevention. Clin Investig Arterioscler. 2018;30:280-310.
52. Piepoli MF, Abreu A, Albus C, Ambrosetti M, Brotons C, Catapano AL, et al. Update on cardiovascular prevention in clinical practice: A position paper of the European Association of Preventive Cardiology of the European Society of Cardiology. Eur J Prev Cardiol. 2020;27:181–205.
53. Armario P, Brotons C, Elosua R, Alonso de Leciñana M, Castro A, Clarà A, et al. Comentario del CEIPV a la actualización de las Guías Europeas de Prevención Vascular en la Práctica Clínica. Rev Esp Salud Pública. 2020;94:e1-38.
54. Mostaza JM, Pintó X, Armario P, Masana L, Ascaso JF, Valdivielso P; en nombre de la Sociedad Española de Arteriosclerosis; Miembros de la Sociedad Española de Arteriosclerosis. Standards for global cardiovascular risk management arteriosclerosis. Clin Investig Arterioscler. 2019;31 Suppl 1:1-43.
