ORIGINAL
Cuantificación de la actividad específica de lectina en teosinte Zea diploperennis
Quantification of specific lectin activity in teosinte Zea diploperennis
Gabriel Matías-Luis1, Alma Dolores Pérez-Santiago1, María del Socorro Pina-Canseco2, Carlos Jonnathan Castro-Juárez3, Marco Antonio Sánchez-Medina4, Iván Antonio García Montalvo1, Eduardo Pérez-Campos5
1 Unidad de Bioquímica e Inmunología, Tecnológico Nacional de México/Instituto Tecnológico de Oaxaca, Oaxaca de Juárez, Oaxaca, México.
2 Centro de Investigación Facultad de Medicina UNAM-UABJO, Facultad de Medicina y Cirugía, Universidad Autónoma “Benito Juárez” de Oaxaca, Oaxaca de Juárez, Oaxaca, México.
3 Instituto de Nutrición, Universidad de la Sierra Sur, Miahuatlán de Porfirio Díaz, Oaxaca, México.
4 Laboratorio de Alimentos, Departamento de Ingeniería Química y Bioquímica, Instituto Tecnológico de Oaxaca, Oaxaca de Juárez, Oaxaca, México.
5 Laboratorio de Patología Clínica “Dr. Eduardo Pérez Ortega”, Oaxaca de Juárez, Oaxaca, México.
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Resumen
Objetivo. Evaluar la actividad específica de lectina en teosinte Zea diploperennis sano e infectado con Ustilago maydis.
Materiales y métodos-. Plántulas de Zea diploperennis de 6 días de crecimiento fueron inoculadas con Ustilago maydis. Se evaluó la concentración de proteínas totales y la actividad hemaglutinante de extractos crudos de teosinte sano e infectado en placas de microtitulación con eritrocitos tipo O al 3% siguiendo la técnica de diluciones dobles seriadas durante 6 días.
Resultados. La concentración de proteínas totales se incrementa en coleoptilo sano durante cada día de su crecimiento. No así en teosinte infectado donde la curva presenta una tendencia a la baja desde el momento de la inoculación. La actividad específica de lectina disminuye en ambos casos desde el primer día de cuantificación.
Conclusiones. La evidente reducción en la actividad de lectina en teosinte infectado en comparación con teosinte sano podría explicar la susceptibilidad de este teosinte a dicho fitopatógeno. Si bien, la participación de las lectinas de teosinte y maíz en el mecanismo de defensa a Ustilago maydis todavía no ha sido esclarecida, los resultados obtenidos contribuyen a la comprensión del efecto que puede tener la concentración de lectina y proteína sobre la resistencia en teosinte.
Palabras clave
Actividad de lectina; proteína total; Zea diploperennis; Ustilago maydis
Abstract
Objective. To evaluate the specific activity of lectin in healthy and infected teosinte Zea diploperennis with Ustilago maydis.
Materials and methods. Zea diploperennis seedlings of 6 days of growth were inoculated with Ustilago maydis. Total protein concentration and hemagglutinating activity of crude extracts of healthy and infected teosinte were evaluated in microtiter plates with 3% type O red cells following the technique of serial double dilutions for 6 days.
Results. The concentration of total proteins increases in healthy coleoptile during each day of its growth. Not so in infected teosinte where the curve shows a downward trend from the moment of inoculation. The specific lectin activity decreases in both cases from the first day of quantification.
Conclusions. The evident reduction in lectin activity in infected teosinte compared to healthy teosinte could explain the susceptibility of this teosinte to said phytopathogen. Although the participation of the teosinte and corn lectins in the defense mechanism against Ustilago maydis has not yet been clarified, the results obtained contribute to the understanding of the effect that the concentration of lectin and protein can have on resistance in teosinte.
Keywords
Lectin activity; total protein; Zea diploperennis; Ustilago maydis
Contribución a la literatura científica
La evaluación de la actividad específica de lectina en teosinte Zea diploperennis es reportada por primera vez por medio de este trabajo. Siguiendo la metodología de Pérez et al. (2017) verificamos la infección por Ustilago maydis en este teosinte; la evaluación de la actividad de lectina muestra la ausencia de lectinas en plántulas infectadas, lo que implica la inhibición de estas proteínas en estas condiciones: una ruta para conocer el por qué este teosinte, y su descendiente actual, el maíz, son susceptibles a la infección por este fitopatógeno.
El estudio de la presencia de lectinas en teosinte es importante ya que podría aportar información para conocer los mecanismos de resistencia a patógenos en otras variedades de teosinte y en maíz.
Introducción
Las lectinas son proteínas o glicoproteínas de origen no inmune capaces de unirse a carbohidratos de manera específica, las cuales aglutinan células y precipitan glicoconjugados. La especificidad de una lectina se define en términos de monosacáridos u oligosacáridos simples que inhiben reacciones de aglutinación(1).
En la actualidad, muchas actividades biológicas se han evidenciado en lectinas, entre ellas se ha sugerido que las lectinas de algunas especies de plantas participan en mecanismos de defensa debido a su capacidad para inhibir la síntesis de proteínas(2). Algunas lectinas vegetales poseen actividad antiviral y bactericida contra patógenos de plantas(3).
En maíz (Zea mays) se ha identificado una lectina específica de galactosa de 88.7 kDa exclusiva de coleoptilo emergente(4). En teosinte (Zea diploperennis) se reporta la presencia de una glicoproteína (TCL) de 92 kDa(5). Con el hallazgo de que las lectinas de ambas plantas muestran similitudes se respalda la hipótesis de que el maíz es el producto de translocaciones sexuales homeostáticas de teosinte(6).
Los signos característicos de la infección por Ustilago maydis en teosinte Zea diploperennis no difieren de los reportados para el maíz. U. maydis presenta su ciclo de vida completo dentro de la planta confirmando que la variedad diploperennis es susceptible. Aunque Zea diploperennis no es una especie tan cercana filogenéticamente como lo es Zea parviglumis, el reconocimiento con el fitopatógeno se presenta igual que en el maíz(7).
Pero, aunque el maíz muestra un alto solapamiento genético con su antepasado directo y otros teosintes anuales, varios estudios establecen que el maíz y sus antepasados difieren en sus fenotipos de resistencia con los teosintes al ser más susceptible a daños(8).
El objetivo del presente trabajo se fundamenta en una importante actividad biológica de las lectinas vegetales, la cual tiene relación con el mecanismo de defensa a patógenos mediante la capacidad de inhibir la síntesis de proteínas. La concentración de proteínas totales y la cuantificación de la actividad específica de lectina son indicadores indirectos de la biomasa y también de la producción de metabolitos primarios y secundarios sintetizados por la planta ante ciertas condiciones de estrés, tales como la infección por patógenos.
Materiales y métodos
Obtención de plántulas de teosinte Zea diploperennis
Se utilizaron semillas de teosinte Zea diploperennis recolectadas en el rancho “Texas” ubicado en el distrito de Ixtlán de Juárez, Oaxaca, México; se seleccionaron las semillas más oscuras de teosinte Zea diploperennis de acuerdo a una prueba de flotamiento(9) en agua destilada y se eligieron las semillas sedimentadas. Se desinfectaron por 10 minutos con una solución de hipoclorito de sodio al 5% y fueron sembradas en charolas de plástico de 15 x 60 cm, en donde se humedecieron cada 24 h manteniéndose a 27 ± 3 °C durante 30 días.
Obtención de la cepa de Ustilago maydis
Se utilizaron levaduras de Ustilago maydis de la cepa diploide FBD12, donada por el Dr. Carlos Leal Morales (Universidad de Guanajuato, México). Se realizaron resiembras continuas en medio de cultivo Caldo Papa, Elote y Sacarosa (CPES) pH 7.0 utilizando como antibiótico bencilpenicilina procaínica con bencilpenicilina cristalina (PiSA) a una concentración de 50 U/250 ml de medio, el cual se conservó a 25 ºC con agitación de 65 rpm.
Inducción de la infección de plántulas de teosinte Zea diploperennis con Ustilago maydis
Se usó la metodología descrita por Pérez et al (2017)(7) para inducir la infección de coleoptilos de teosinte Zea diploperennis con Ustilago maydis, que consiste en utilizar células de Ustilago maydis viables y sin alteraciones morfológicas obtenidas de resiembras en medio CPES. Se empleó una suspensión de 200 μl de una dilución 2 x 106 cel/ml, mediante conteo en cámara de Neubauer. La inoculación se realizó por punción en la base de cada plántula de 6 días de crecimiento con ayuda de una jeringa para insulina con aguja número 27Gx1/2”.
Extracción de proteínas totales
Se preparó un extracto de coleoptilo de teosinte Zea diploperennis de 3-6 días de crecimiento con solución salina de fosfatos (PBS) pH 7 relación 1:1 (p/v) a 4 ºC. Se incubó el extracto a 0 ºC por 10 min en tubo Eppendorf. Se centrifugó a 9 000 rpm por 3 min. Se eliminó el precipitado y se utilizó el sobrenadante al cual se le cuantificó el contenido proteico.
Cuantificación de proteínas totales
La concentración proteica de la muestra se determinó siguiendo el método de Bradford (1976)(10), el cual se basa en la observación del cambio máximo de absorbancia, de 465 a 595 nm, de una solución ácida de azul de Coomassie R-250 al unirse a proteínas. Se cuantificó la unión del azul de Coomassie a la proteína y se comparó esta unión con la de cantidades diferentes de una proteína de referencia (albúmina sérica bovina, BSA) a dicho colorante.
Ensayos de actividad hemaglutinante
La actividad hemaglutinante se evaluó en placas de microtitulación (NUNC, Roskilde, Dinamarca). Se utilizaron eritrocitos humanos tipo O previamente lavados y llevados a una concentración de 3% con PBS. Se colocaron 50 µL del diluyente en cada pozo de la placa de aglutinación y se colocó una muestra de 50 µL del extracto de coleoptilo de teosinte en el primer pozo de la placa. Se realizaron diluciones dobles seriadas con un volumen final de 50 µL. Se agregaron 25 µL de la solución final de eritrocitos en todos los pozos y se observó la hemaglutinación 1 h después.
Verificación de la infección por Ustilago maydis en plántulas de Zea diploperennis
Los coleoptilos infectados mostraron un desarrollo anormal, pues presentaron deformaciones y clorosis en el área de la punción, donde se aprecian cicatrices, pero continúan con un crecimiento hasta el sexto día, cuando empiezan a marchitarse de acuerdo con el reporte de Cruz y col. (2015)(11).
Los coleoptilos de teosinte Z. diploperennis inoculados se inspeccionaron en un microscopio óptico para verificar la infección. Las levaduras de Ustilago maydis inoculadas persistieron durante las primeras 72 horas posteriores a la inyección, a partir de las cuales pueden apreciarse los primeros micelios, los cuales cambian a esporas al término del sexto día de la inoculación de la misma manera como lo reportó Pérez et al (2017)(7).
Cuantificación de proteínas totales
La medición de la concentración proteica se realizó tanto en coleoptilos de teosinte Zea diploperennis sano como en infectado con Ustilago maydis con igual tiempo de crecimiento. Es evidente la disminución en las concentraciones de proteínas en coleoptilo infectado con Ustilago maydis desde el primer día de la infección. Se observa una disminución bien pronunciada del primer al segundo día de la infección, a partir del cual, el decremento es más lento hasta el día seis. Esta disminución es acorde con el desarrollo del hongo dentro del tejido vegetal, el fitopatógeno requiere de los nutrientes del hospedante y las proteínas representan un componente nutrimental esencial.
Las concentraciones de proteínas en coleoptilo sano mostraron un incremento paulatino a partir del primer día paralelo al día de la infección alcanzando hasta 8.5 mg/ml.
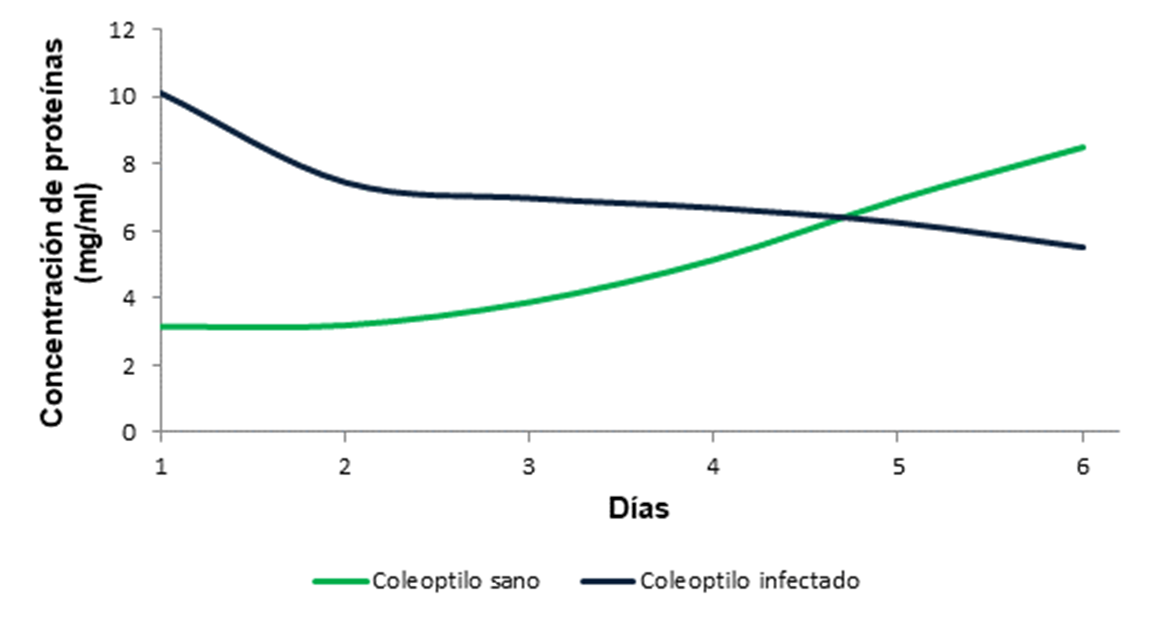
Figura 1. Comparación de la concentración de proteínas totales en coleoptilo de teosinte Zea diploperennis sano e infectado con Ustilago maydis.
Actividad específica de lectina
En coleoptilo sano la actividad específica de lectina muestra una disminución a partir del día paralelo a la infección. En coleoptilo infectado se observa también un decremento conforme al crecimiento de los coleoptilos, sin embargo, es importante resaltar que a partir del día 4 de la infección ésta desaparece y el coleoptilo tiene una actividad específica nula de lectina (Figura 2). Se identificó mayor actividad en coleoptilo sano pero el comportamiento es similar en ambos coleoptilos.
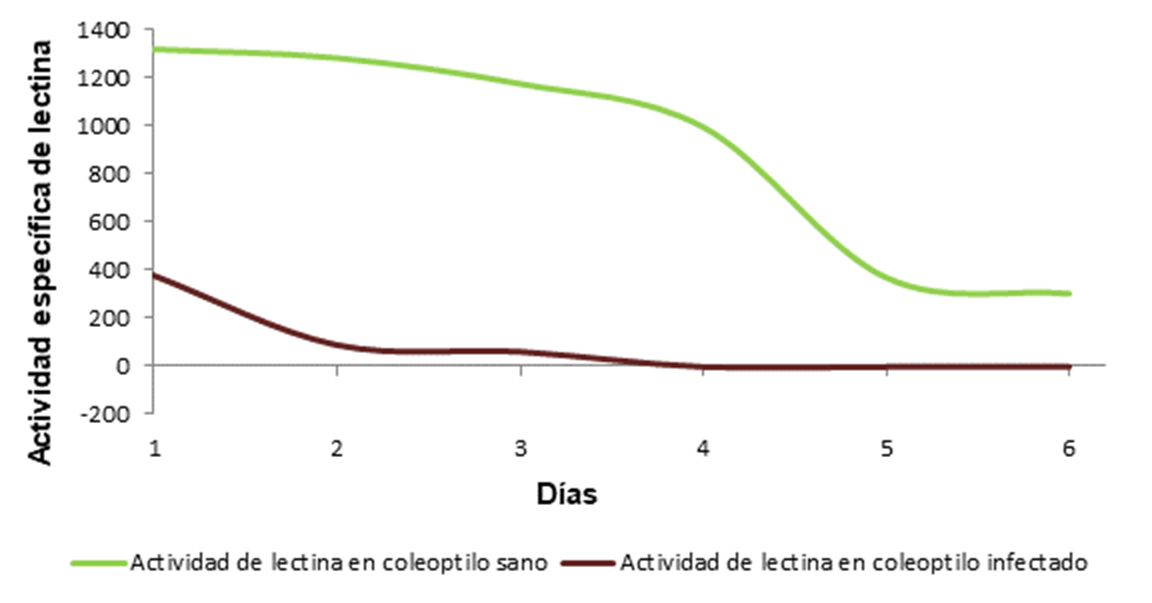
Figura 2. Comparación de la actividad específica de lectina en coleoptilo de teosinte Zea diploperennis sano e infectado con Ustilago maydis.
Discusión
El comportamiento de la actividad de lectina en coleoptilo de teosinte Zea diploperennis sano indica que esta glicoproteína tiene una relación inversamente proporcional con la concentración de proteínas: cuando la concentración de proteínas se incrementa, la actividad de lectina disminuye; un resultado que podría sugerir que, en el caso de este teosinte, la presencia de lectinas no inhibe la síntesis de proteínas dentro de la misma planta como lo reporta Chrispeels et al (1991)(2).
En coleoptilo de Zea diploperennis infectado con Ustilago maydis, la actividad de lectina desaparece al cuarto día de la infección, este comportamiento demuestra que la lectina tiene una participación no primordial en el mecanismo de defensa hacia el patógeno ya que en estas condiciones tampoco inhibe la síntesis de proteínas y, por tanto, la planta presenta alta susceptibilidad a la infección con este fitopatógeno, además de que la presencia de lectinas en ambas condiciones presenta el mismo comportamiento que la concentración de clorofila como lo establece Pérez et al (2017)(7).
Conclusiones
En Zea diploperennis infectado con Ustilago maydis la concentración de proteínas y la actividad de lectina disminuyen siempre. La concentración de proteínas totales presenta una disminución muy ligera durante los últimos cuatro días del experimento, una relación bastante lógica puesto que con la infección in vitro las plántulas tienen un tiempo de vida limitado. A partir del cuarto día de la inoculación, la producción de proteínas es nula y, por tanto, el patógeno es el responsable de las condiciones de marchitamiento, clorosis y muerte de las plántulas.
En Zea diploperennis sano, la presencia de lectinas disminuye con respecto al crecimiento de la plántula, las lectinas en este teosinte guardan una relación más estrecha con la germinación de la semilla que con la inhibición de proteínas dentro de la misma planta y, en cambio, las proteínas se incrementan naturalmente, sin mediar una condición que induzca su producción.
Estos resultados vienen a respaldar nuestra hipótesis de que la lectina de coleoptilo de teosinte al ser muy similar a la lectina de coleoptilo de maíz, si tiene alguna contribución en el mecanismo de defensa, debería tener una participación muy similar en las dos plantas y, por ello, Zea diploperennis al igual que el maíz, es susceptible a la infección con Ustilago maydis.
Conflicto de interés
Los autores declaran que no existe conflicto de interés alguno para la publicación del presente manuscrito.
Referencias
1. Goldstein I. J., Hughes R. C., Monsiony M., Osawa T., Sharon N. What should be called a lectin? Nature. 1980; 285;66.
2. Chrispeels, M. J.; Raihhel, N. V. Lectins, lectin genes, and their role in plant defense. Plant Cell. 1991; 3 (1); 1-9.
3. Pérez-Santiago, A.; Saavedra, E.; Pérez-Campos, E.; Córdoba, F. Effect of plant lectins on Ustilago maydis in Vitro. Cell Mol. Life Sci. 2000; 57; 1986-99.
4. Martínez-Cruz, M, Zenteno, E, Córdoba F. Purification and characterization of a galactose-specific lectin from corn (Zea mays) coleoptile. Biochim. Byophys. Acta. 2001; 1568; 37-44.
5. Martinez-Cruz, M.; Cordoba, F. Isolation of fully active and stable teosinte coleoptile lectins. Prep. Biochem. Biotechnol. 2000; 30; 199-208.
6. Iltis, H. H. Homeotic sexual translocations and the origin of maize (Zea mays, Poaceae): A new look at an old problem. Econ. Bot. 2000; 54; 7-42.
7. Pérez Díaz MC, Sánchez Medina MA, Pina Canseco MS, Pérez Campos E, García-Montalvo IA, Pérez Santiago AD. Inducción de infección en Teosinte (Zea diploperennis) con el fitopatógeno Ustilago maydis. JONNPR. 2017; 1(1):17-22. DOI: 10.19230/jonnpr.1154
8. Iltis H. H. and J. F Doebley. Taxonomic of Zea (Gramineae) II. Subspecifics categories in the Zea mays complex and a generic synopsis. Amer. J. Bot. 1980; 67; 994-1004.
9. Matías L. G. Inducción de la infección en coleoptilos de teosinte Zea diploperennis con Ustilago maydis. Tesis de licenciatura. Instituto Tecnológico de Oaxaca. 2013.
10. Bradford M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 1976; 72; 248-54.
11. Cruz M. M. C, Pérez, D. M. C., Matías L. G., Santiago O. G., Aragón, C. F., Sánchez M. M. A., Pina C. S. y Pérez S. A. D. Gene expression per1 in teocintle (Zea mays ssp parviglumis) infected with Ustilago maydis. Unidad de Bioquímica e Inmunología, Instituto Tecnológico de Oaxaca; XVI Congreso Internacional y XLI Congreso Nacional; Sociedad Mexicana de Fitopatología. 2013.
