ORIGINAL
Evaluación del crecimiento radial de Lactarius volemus en medio semisólido
Evaluation of radial growth of Lactarius volemus in semisolid medium
Gabriel Matías-Luis1, Marco Antonio Sánchez-Medina2, María del Socorro Pina-Canseco3, Yadira Gochi-Ponce4, Margarito Martínez-Cruz1, Eduardo Pérez-Campos5, Alma Dolores Pérez-Santiago1
1 Unidad de Bioquímica e Inmunología, Tecnológico Nacional de México/Instituto Tecnológico de Oaxaca, Oaxaca de Juárez, Oaxaca, México.
2 Laboratorio de Alimentos, Departamento de Ingeniería Química y Bioquímica, Instituto Tecnológico de Oaxaca, Oaxaca de Juárez, Oaxaca, México.
3 Centro de Investigación Facultad de Medicina UNAM-UABJO, Facultad de Medicina y Cirugía, Universidad Autónoma “Benito Juárez” de Oaxaca, Oaxaca de Juárez, Oaxaca, México.
4 División de Estudios de Posgrado e Investigación, Instituto Tecnológico de Tijuana, Tijuana, Baja California Norte, México.
5 Laboratorio de Patología Clínica “Dr. Eduardo Pérez Ortega”, Oaxaca de Juárez, Oaxaca, México.
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Resumen
Objetivo. Evaluar el crecimiento radial de Lactarius volemus en cinco medios de cultivo semisólidos in vitro.
Materiales y métodos. Cuerpos fructíferos de L. volemus provenientes de la Sierra Norte del estado de Oaxaca, México, se cultivaron en laboratorio en medios Agar Papa Dextrosa, Agar Czapek-Dox, Agar Extracto de Malta, Agar Papa Sacarosa y Agar Dextrosa Saboraud; mediante dos técnicas de sembrado. Se evaluaron las características morfológicas de colonias obtenidas de distintas muestras del cuerpo fructífero, así como el crecimiento radial de cada una.
Resultados. El crecimiento colonial evaluado permitió seleccionar un medio que reúne las condiciones óptimas para el cultivo de Lactarius volemus in vitro. No todas las muestras utilizadas desarrollan un crecimiento abundante: la muestra proveniente del látex presenta un crecimiento escaso.
Conclusiones. Con la evaluación del crecimiento radial de Lactarius volemus se obtiene una referencia directa del ciclo de crecimiento de esta especie; es posible identificar las fases exponencial y estacionaria pero las condiciones del medio no permiten evaluar la fase de muerte debido a la deshidratación y reducción del agar.
Palabras clave
Lactarius volemus; hongo silvestre; macromiceto; basidiomiceto; basidiocarpo
Abstract
Objective. To evaluate the radial growth of Lactarius volemus in five semi-solid culture media in vitro.
Materials and methods. Fruitful bodies of L. volemus from the Sierra Norte of the state of Oaxaca, Mexico, were cultured in the laboratory in Potato Dextrose Agar Papa, Czapek-Dox Agar, Malt Extract Agar, Potato Sucrose Agar and Dextrose Saboraud Agar; using two seeding techniques. The morphological characteristics of colonies obtained from different samples of the fruiting body were evaluated, as well as the radial growth of each one.
Results. The evaluated colonial growth allowed to select a culture medium that meets the optimal conditions for the cultivation of Lactarius volemus in vitro. Not all samples used develop abundant growth: the sample from latex shows little growth.
Conclusions. With the evaluation of the radial growth of Lactarius volemus a direct reference to the growth cycle of this species is obtained; it is possible to identify the exponential and stationary phases but the conditions of the medium do not allow evaluating the phase of death due to dehydration and reduction of the agar.
Keywords
Lactarius deliciosus; wild mushroom; macromycete; basidiomycete; basidiocarp
Aportación a la literatura científica
La curva de crecimiento colonial de Lactarius volemus en medio semisólido es relevante desde el punto de vista microbiológico ya que permite observar el comportamiento celular del basidiocarpo identificando sus fases exponencial y estacionaria del ciclo de vida de esta especie. Su cultivo a partir de una muestra proveniente de látex, aunque no fue el objetivo inicial de este trabajo, es novedoso ya que, al ser éste una sustancia que el hongo segrega ante ataques físicos, implica la participación de células viables en este mecanismo de defensa.
Es importante continuar la investigación para conocer el ciclo de vida completo de Lactarius volemus. Otro aspecto importante es la integridad celular del hongo cultivado: el uso de técnicas microscópicas más sofisticadas permitirá conocer a detalle si el hongo sembrado conserva sus características celulares originales o se modifica con las condiciones de laboratorio.
Introducción
Los hongos macromicetos son un alimento para los seres humanos, también han permitido la elaboración de pan, vino, licores, cerveza, bebidas fermentadas y una inmensa variedad de platillos culinarios. El estudio de los hongos ha permitido demostrar el mecanismo de degradación de las fuentes de carbono y el metabolismo intermediario(1). Actualmente tienen una gran cantidad de aplicaciones y producen una amplia variedad de productos útiles en medicina y la industria(2).
Los hongos silvestres constituyen una fuente importante de nutrientes para el consumo humano(3) y desde hace muchos años han estado presentes en la cultura religiosa y médica de los pueblos indígenas de México. Su hábitat y el clima son los principales factores que indican su diversidad(4) y, sobre todo, son las principales limitantes para la obtención de cuerpos fructíferos.
Uno de los mejor valorados en la gastronomía local donde se recolectan hongos silvestres para consumo humano es el género Lactarius, que comprende más de 540 especies, todas ellas con la característica de segregar un látex de color y sabor particular(5). Lactarius volemus es un macromiceto, ectomicorrícico, comestible y silvestre que crece durante los primeros meses de lluvias en bosques frondosos y de coníferas con climas templados(6).
El objetivo del presente trabajo es cultivar en laboratorio una cepa silvestre de Lactarius volemus y evaluar su crecimiento en cinco medios de cultivo semisólidos. El interés de su cultivo en laboratorio radica en obtener un inóculo primario disponible para cualquier época del año, con la finalidad de identificar, en un futuro, compuestos que lo hacen atractivo para el paladar y la nutrición humana.
Descripción macroscópica de Lactarius volemus
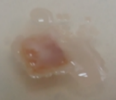
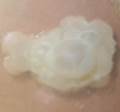
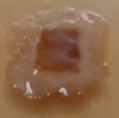
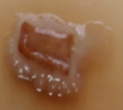
Lactarius volemus presenta un color anaranjado a rojizo. Secreta un látex blanco que cambia a pardo tras ser expuesto al aire(1). Su sombreo es convexo o plano y deprimido en el centro, de 7 a 15 cm de diámetro, con superficie seca ocrácea pubescente o aterciopelada y finamente rugosa que en los ejemplares adultos se cuartea sin mantener líneas radiales (Figura 1 A). Sus láminas son finas y apretadas, adnatas, ligeramente decurrentes y apretadas entre sí, de color crema a matiz amarillento, se manchan de marrón al tocarlas y al romperse desprenden látex blanco. Su pie es corto y grueso, macizo, lleno, cilíndrico, de 6 a 12 cm por 1,5 a 2,5 cm, de amarillo a anaranjado con superficie finamente rugosa y aterciopelada. Su carne es espesa, compacta y maciza de textura quebradiza color pálido crema, granulosa, blanca y amarillenta en el pie, de sabor ligeramente amarescente y olor fuerte a marisco, gambas cocidas o pescado. Su himenio finamente ciliado está formado por láminas y lamélulas amarillentas con arista(7).
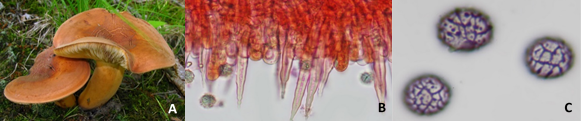
Figura 1. Lactarius volemus: A) Cuerpos fructíferos adultos, B) Cistidios, queilocistidios y basidiolos teñidos con rojo Congo (40X) y C) Esporas teñidas con reactivo de Melzer (100X). (García 2015).
Descripción microscópica de Lactarius volemus
Presenta una cutícula formada por una capa de células esféricas o piriformes de las que salen pelos erguidos, tabicados y ensanchados en la base. La arista de las láminas es tapizada de largos cistidios o queilocistidios largos y salientes, con forma de agujas, de 7,5 a 9 micras de diámetro y en las caras presenta basidios de 9 a 11 micras que producen esporas (Figura 1 B). Los cistidios presentan paredes gruesas y terminan en una punta fina y con pequeños estrangulamientos finales. Los basidiolos apenas son visibles, al madurar se alargan, se ensanchan en la extremidad y producen esporas por gemación sobre cuatro esterigmatos. Entre toda la superficie himenial se produce gran cantidad de esporas esféricas de 7 a 10 micras con una superficie decorada con una red de crestas finas y algunas verrugas amiloides (7) (Figura 1 C).
Obtención y conservación de cuerpos fructíferos de Lactarius volemus
Se obtuvieron cuerpos fructíferos de L. volemus en el Mercado de Abastos de la ciudad de Oaxaca de Juárez, Oaxaca, México provenientes de la Sierra Norte del estado de Oaxaca, México (17°19′50″N, 96°29′14″O, 2030 msnm), recolectados durante el mes de agosto en la temporada de lluvias y previamente identificados por el M.C José Armando Sandoval Porras de la Unidad de Bioquímica e Inmunología del Instituto Tecnológico de Oaxaca, México. Los hongos se lavaron con agua destilada, se secaron por 24 horas y se guardaron en congelación a -20 ºC en bolsas de cartón cubiertas de papel celulosa.
Obtención y caracterización microscópica de la muestra de Lactarius volemus
Las muestras se tomaron de un hongo conservado en congelación, el cual se lavó con H2O2 al 3 % (v/v). Se obtuvieron muestras de distintas partes del cuerpo fructífero: estípite, píleo, látex, lámina y suspensión de esporas. Cada una se observó en un microscopio óptico Carl Zeiss HBO50 para verificar las características celulares del hongo.
Cultivo de Lactarius volemus en medio semisólido
Se probaron cinco medios de cultivo: Agar Papa Dextrosa (PDA), Agar CZapek Dox, Agar Extracto de Malta (AEM), Agar Papa Sacarosa (APS) y Agar Dextrosa Saboraud (ADS) y dos técnicas de sembrado: punción y vaciado. La punción consistió en introducir en el centro de la placa una sección cortada del hongo; se sembró por punción láminas, píleo y estípite. El vaciado consistió en colocar en el centro de la placa un volumen de 5 µl de muestra y dejarlo sin extender; por vaciado se sembraron muestras provenientes de la suspensión de esporas y del látex secretado. Las placas se incubaron a 27+ 2°C y se observó el crecimiento de las colonias después de 24 h. Se sembró cada muestra distinta en caja Petri con diferente medio de cultivo y utilizando una técnica de sembrado. Se seleccionó el medio, la muestra y el tipo de sembrado que proporcionó el mejor crecimiento del hongo de acuerdo con las características morfológicas evaluadas y la medición del crecimiento radial de la cepa.
Evaluación del crecimiento radial de Lactarius volemus en medio semisólido
Para evaluar el crecimiento radial de L. volemus se colocó 1 mm2 o 5 µl de muestra en el centro de la caja Petri y se midió con Vernier el crecimiento de la colonia durante seis días.
Resultados
Caracterización microscópica de la muestra de Lactarius volemus
La observación microscópica de las muestras obtenidas de distintas partes del cuerpo fructífero de L. volemus permitió apreciar las estructuras celulares descritas para esta especie (esporas y cistidios), lo cual es indicativo directo de la integridad celular del hongo.
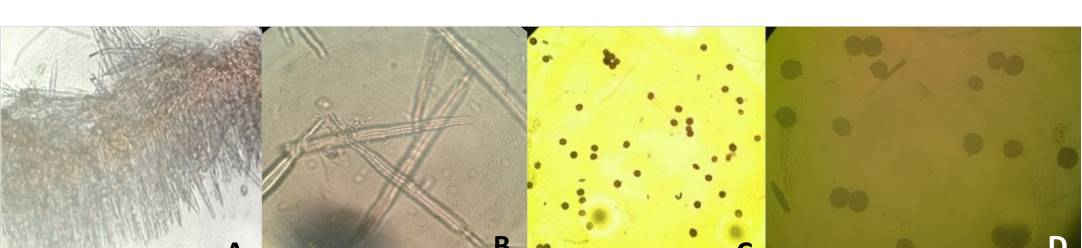
Figura 2. A) y B) Cistidios y queilocistidios de Lactarius volemus (10 y 40X, respectivamente), C) y D) Esporas (10 y 40X, respectivamente) teñidos con reactivo de Melzer.
Los cistidios y queilocistidios se observaron principalmente en cortes delgados provenientes de las láminas y laminillas (Figura 2 A y B), presentan pequeños estrangulamientos finales para terminar en forma de aguja, entre ellos los basidiolos se observan transparentes en agua al microscopio. Las esporas (Figura 2 C y D) fueron teñidas con reactivo de Melzer y se observaron en las láminas, laminillas y en la muestra proveniente de la suspensión de éstas.
Siembra y caracterización morfológica de Lactarius volemus en medio semisólido
El crecimiento y desarrollo de las colonias de L. volemus en medios semisólidos se evaluó de acuerdo con las características que se describen en las Tablas 1-5. Se seleccionaron los medios y las muestras que proporcionaron el mejor crecimiento de acuerdo a las características morfológicas evaluadas.
Tabla 1. Evaluación de las características morfológicas L. volemus en Agar de Czapek-Dox.
|
Czapek-Dox |
|||||
|
Características |
Suspensión de esporas |
Látex |
Lámina |
Píleo |
Estípite |
|
|
|
|
|
|
|
|
Tamaño |
Grande |
Grande |
Mediano |
Mediano |
Pequeño |
|
Desarrollo |
Abundante |
Abundante |
Regular |
Abundante |
Escaso |
|
Forma |
Puntiforme |
Puntiforme |
Puntiforme |
Circular |
Puntiforme |
|
Elevación |
Crateriforme |
Crateriforme |
Plana |
Crateriforme |
Plana |
|
Superficie |
Rugosa |
Rugosa |
Lisa |
Rugosa |
Lisa |
|
Margen |
Rizoide |
Entero |
Entero |
Rizoide |
Entero |
|
Luz reflejada |
Opaca |
Brillante |
Transparente |
Opaca |
Transparente |
|
Luz transmitida |
Opaca |
Brillante |
Transparente |
Opaca |
Transparente |
|
Color |
Transparente |
Transparente |
Transparente |
Blanco |
Transparente |
|
Aspecto |
Húmedo |
Húmedo |
Húmedo |
Húmedo |
Húmedo |
|
Consistencia |
Suave |
Suave |
Suave |
Rasposa |
Suave |
Tabla 2. Evaluación de las características morfológicas L. volemus en Agar Extracto de Malta.
|
AEM |
|||||
|
Características |
Suspensión de esporas |
Látex |
Lámina |
Píleo |
Estípite |
|
|
|
|
|
|
|
|
Tamaño |
Grande |
Mediano |
Mediano |
Mediano |
Mediano |
|
Desarrollo |
Regular |
Abundante |
Regular |
Regular |
Abundante |
|
Forma |
Puntiforme |
Amiboidea |
Puntiforme |
Puntiforme |
Puntiforme |
|
Elevación |
Crateriforme |
Plana |
Plana |
Plana |
Plana |
|
Superficie |
Rugosa |
Lisa |
Lisa |
Lisa |
Lisa |
|
Margen |
Entero |
Rizoide |
Entero |
Entero |
Entero |
|
Luz reflejada |
Transparente |
Mate |
Opaca |
Opaca |
Brillante |
|
Luz transmitida |
Brillante |
Opaca |
Opaca |
Opaca |
Brillante |
|
Color |
Transparente |
blanco |
Blanco |
Blanco |
Blanco |
|
Aspecto |
Húmedo |
Seco |
Húmedo |
Húmedo |
Húmedo |
|
Consistencia |
Suave |
Suave |
Suave |
Suave |
Suave |
Tabla 3. Evaluación de las características morfológicas L. volemus en Agar Papa Dextrosa.
|
PDA |
|||||
|
Características |
Suspensión de esporas |
Látex |
Lámina |
Píleo |
Estípite |
|
|
|
|
|
|
|
|
Tamaño |
Pequeño |
Pequeño |
Pequeño |
Mediano |
Pequeño |
|
Desarrollo |
Escaso |
Regular |
Escaso |
Regular |
Escaso |
|
Forma |
Circular |
Circular |
Circular |
Puntiforme |
Puntiforme |
|
Elevación |
Crateriforme |
Crateriforme |
Plana |
Plana |
Plana |
|
Superficie |
Plana |
Rugosa |
Lisa |
Lisa |
Lisa |
|
Margen |
Entero |
Rizoide |
Entero |
Entero |
Entero |
|
Luz reflejada |
Opaca |
Opaca |
Opaca |
Opaca |
Opaca |
|
Luz transmitida |
Opaca |
Opaca |
Opaca |
Opaca |
Opaca |
|
Color |
Transparente |
Amarillo |
Blanco |
Blanco |
Blanco |
|
Aspecto |
Seco |
Seco |
Húmedo |
Húmedo |
Húmedo |
|
Consistencia |
Blando |
Rasposo |
Suave |
Suave |
Suave |
Tabla 4. Evaluación de las características morfológicas L. volemus en Agar Dextrosa Saboraud.
|
ADS |
|||||
|
Características |
Suspensión de esporas |
Látex |
Lámina |
Píleo |
Estípite |
|
|
|
|
|
|
|
|
Tamaño |
Pequeño |
Pequeño |
Mediano |
Pequeño |
Grande |
|
Desarrollo |
Escaso |
Escaso |
Regular |
Escaso |
Abundante |
|
Forma |
Circular |
Circular |
Circular |
Circular |
Puntiforme |
|
Elevación |
Cóncava |
Plana |
Plana |
Crateriforme |
Crateriforme |
|
Superficie |
Lisa |
Lisa |
Lisa |
Rugosa |
Rugosa |
|
Margen |
Entero |
Entero |
Entero |
Rizoide |
Rizoide |
|
Luz reflejada |
Opaca |
Opaca |
Opaca |
Opaca |
Opaca |
|
Luz transmitida |
Tenue |
Opaca |
Opaca |
Brillante |
Opaca |
|
Color |
Transparente |
Pigmentado |
Pigmentado |
Transparente |
Pigmentado |
|
Aspecto |
Húmedo |
Seco |
Húmedo |
Húmedo |
Húmedo |
|
Consistencia |
Suave |
Suave |
Suave |
Rasposo |
Rasposo |
Tabla 5. Evaluación de las características morfológicas L. volemus en Agar Papa Sacarosa.
|
APS |
|||||
|
Características |
Suspensión de esporas |
Látex |
Lamina |
Píleo |
Estípite |
|
|
|
|
|
|
|
|
Tamaño |
Grande |
Grande |
Mediano |
Mediano |
Pequeño |
|
Desarrollo |
Regular |
Regular |
Regular |
Abundante |
Regular |
|
Forma |
Puntiforme |
Puntiforme |
Puntiforme |
Circular |
Puntiforme |
|
Elevación |
Crateriforme |
Crateriforme |
Plana |
Crateriforme |
Plana |
|
Superficie |
Rugosa |
Rugosa |
Lisa |
Rugosa |
Lisa |
|
Margen |
Rizoide |
Entero |
Entero |
Rizoide |
Entero |
|
Luz reflejada |
Opaca |
Brillante |
Transparente |
Opaca |
Transparente |
|
Luz transmitida |
Opaca |
Brillante |
Trasparente |
Opaca |
Transparente |
|
Color |
Transparente |
Transparente |
Transparente |
Blanco |
Transparente |
|
Aspecto |
Húmedo |
Húmedo |
Húmedo |
Húmedo |
Húmedo |
|
Consistencia |
Suave |
Suave |
Suave |
Rasposa |
Suave |
En todas las características evaluadas existe una similitud en las muestras provenientes de áreas de cuerpo fructífero de L. volemus (lámina, píleo y estípite), con una marcada diferencia con las provenientes de suspensiones (de esporas y látex). Cabe resaltar que todas las muestras sembradas presentaron un tamaño de mediano a grande y la mayoría un desarrollo abundante, características que demuestran la factibilidad del cultivo del hongo en las condiciones de laboratorio propuestas.
Una vez analizado el crecimiento de las muestras en los medios de cultivo con las técnicas de siembra utilizadas, se seleccionaron dos medios semisólidos que proporcionaron cultivos con las mejores características morfológicas: AEM y APS; en ellos se evaluó el crecimiento radial de tres muestras provenientes del cuerpo fructífero: lámina, píleo y estípite que fueron las que presentaron el mejor desarrollo colonial.
Crecimiento radial de Lactarius volemus en medio semisólido
El crecimiento radial del cultivo de Lactarius volemus es un indicador directo del ciclo de crecimiento que presenta en medio semisólido. La Figura 3 presenta el crecimiento radial de las muestras sólidas de L. volemus durante los primeros 6 días de desarrollo en medio AEM. En este medio, la fase exponencial se muestra claramente en el periodo de 0 a 3 días, la fase de aceleración se observa muy corta, casi imperceptible, desde la siembra en medio semisólido hasta las 12 horas aproximadamente, lo mismo sucede con la fase de desaceleración, la cual puede apreciarse tenuemente + seis horas alrededor del tercer día. La fase estacionaria se observa bien definida a partir del tercer día del desarrollo fúngico.
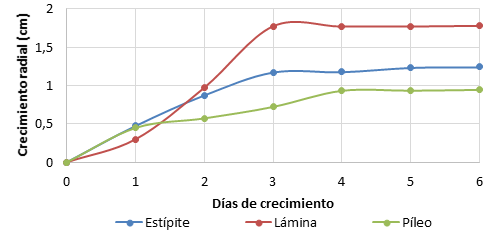
Figura 3. Crecimiento radial de Lactarius volemus en medio AEM.
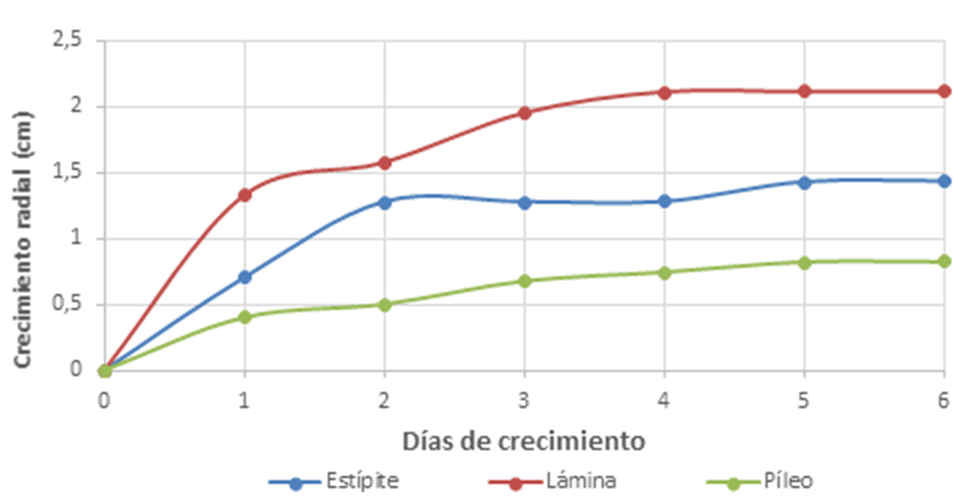
Figura 4. Crecimiento radial de Lactarius volemus en medio APS.
En medio APS la fase exponencial se extiende hasta el cuarto día para la muestra de lámina, hasta el quinto día para la suspensión de esporas y no es muy clara para el píleo, donde la fase estacionaria aparece a partir del segundo día. Cabe destacar que la información más importante viene dada por la muestra que proporciona el mayor crecimiento radial, el cual corresponde a la muestra de láminas en ambos medios.
Discusión
Las muestras obtenidas del carpóforo de Lactarius volemus presentan características macroscópicas y microscópicas idénticas a las observadas por García (2015)(7) para el cuerpo fructífero, esporas y estructuras no fértiles como cistidios y queilocistidios. Las esporas observadas se tiñen perfectamente con Melzer y, sin embargo, no así con rosa de bengala. Su cultivo a partir del látex presentó un desarrollo en medio semisólido nunca antes reportado.
El cultivo de muestras procedentes del cuerpo fructífero de Lactarius volemus en medios semisólidos permite observar y describir características morfológicas similares a las observadas por Giollant et al. (1993)(8) en colonias de Lactarius deterrimus cultivadas en medio Pachlewski y a las reportadas por Pereira et al. (2014)(9) en colonias de Lactarius deliciosus cultivadas en medio Agar de Aneurina y Ácido Fólico (BAF).
Con la evaluación del crecimiento radial colonial de Lactarius volemus se obtiene una referencia directa del ciclo de crecimiento de esta especie; es posible identificar las fases exponencial y estacionaria pero las condiciones del medio no permiten evaluar la fase de muerte debido a la deshidratación y reducción del agar.
Conclusiones
Lactarius volemus es una especie que puede aislarse y cultivarse en laboratorio a partir de muestras provenientes del cuerpo fructífero recolectado en campo, este cultivo garantiza la disponibilidad de células viables que pueden conservarse para estudios posteriores, pero sólo por un periodo de tiempo muy corto. Las características morfológicas descritas para las colonias de Lactarius volemus en cada medio de cultivo nos permiten conocer y establecer que este basidiomiceto crece en todos los medios semisólidos probados, pero presenta un desarrollo sano, abundante y óptimo en el medio AEM. La evaluación del crecimiento radial permite identificar a APS como el medio que ofrece el mayor crecimiento en el mismo periodo evaluado, sin embargo, es una fórmula que no presenta las mejores características morfológicas del cultivo: presenta una oxidación rápida del medio, lo que provoca un halo de opacidad alrededor de la colonia. Si bien AEM proporciona un crecimiento ligeramente inferior que APS, nos ofrece excelentes características morfológicas y una curva de crecimiento en la cual es posible observar una fase exponencial más lineal y mejor definida.
Estos resultados, aunque muy simples, son relevantes ya que no se habían reportado estudios microbiológicos de Lactarius volemus en laboratorio. Sin embargo, sería conveniente probar y formular otros medios de composición conocida para lograr un crecimiento más rápido; un cultivo en medio líquido podría aportar información valiosa sobre una curva de crecimiento más completa.
Conflicto de interés
Los autores declaramos no tener conflicto de interés alguno para la publicación del presente manuscrito.
Referencias
1. Ceroni A. Detección y evaluación de germoplasma celulítico en 136 cepas de hongos de suelo. Lima, Perú. Facultad de Ciencias. Universidad Nacional Agraria. 1988.
2. Garza F, García J & Castillo J. Macromicetos asociados al bosque de Quercus rysophylla en algunas localidades del centro del estado de Nuevo León. Revista Mexicana de Micología. 1985. 1: 423-37.
3. Guzmán G. Diversity and use of traditional Mexican medicinal fungi. A review. International Journal of Medicinal Mushrooms. 2008. 10:209-17.
4. Khan F & Islam M. Fungal Lectins: Current Molecular and Biochemical Perspectives. International Journal of Biological Chemistry. 2011. 5:1-20.
5. Cuesta J & Jiménez J. Ficha Micológica del género Lactarius. Asociación Micológica El Royo. El Royo, Soria, España [monografía en internet]. 2016. [Consultado el 29 de noviembre de 2019] Disponible en: http://www.amanitacesarea.com/lactarius.html
6. Sandoval JA. Aislamiento y caracterización de lectina de Lactarius volemus. Oaxaca de Juárez, Oaxaca, México. Unidad de Bioquímica e Inmunología, Instituto Tecnológico de Oaxaca. 2016.
7. García BLM.. Guía de Setas y Hongos de Navarra. Navarra, España. 2015 [Consultado el 17 de octubre de 2016]. Disponible en: http://guiahongosnavarra1garciabona.blogspot.mx/2015/02/lactarius-volemus-fr.html
8. Giollant M, Guillot J, Damez M, Dusser M, Didier P & Didier E. Research on the possible lnvolvement of the funga1 lectin in recognition between mushroom and spruce during the early stages of mycorrhizae formation. Plant Physiology. 1993. 101: 513-22.
9. Pereira G, Campos JL, Chávez D, Anabalón L & Arriagada C. Caracterización del crecimiento miceliar del hongo ectomicorrícico Lactarius aff. deliciosus y su simbiosis con plántulas de Pinus radiata. Quebracho. 2014. 22 (1-2):30-9.