REVISIÓN
Análisis de la relación entre aspectos de la nutrición y el cáncer
Analysis of the relationship between aspects of nutrition and cancer
Ana Martínez Martínez1, Mª Loreto Tárraga Marcos2, Pedro J. Tárraga López3
1 Grado Universidad Castilla la Mancha. España
2 Enfermería Hospital Clinico de Zaragoza. España
3 Profesor de Medicina Universidad de Castilla la Mancha. España
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Resumen
El cáncer es una enfermedad multifactorial influida por factores externos y genéticos. Se estima que más del 30% de los cánceres hubieran sido prevenidos con modificaciones en el estilo de vida, fundamentalmente con los hábitos dietéticos. Se trata de una enfermedad cuyo número está en aumento, estimándose una incidencia de 29.5 millones de casos para el año 2040. Con esta revisión, se pretende esclarecer la relación entre los alimentos y el riesgo de padecer ciertos tumores, así como analizar las causas y componentes que influyen en su aparición y el patrón de dieta más recomendable. Asimismo, se espera recoger una serie de recomendaciones tras el análisis de los resultados que puedan servir de ayuda a la población para una modificación de su hábito alimenticio. Las medidas de prevención primaria resultan ser las más costoefectivas. Entre los alimentos que más se han asociado a un efecto protector está la fruta, verdura y la fibra, mientras que la carne roja y dietas ricas en grasas animales pueden ejercer un factor promotor del cáncer. La dieta occidental es considerada una dieta proinflamatoria, asociándose cada vez más a un riesgo aumentado de neoplasias, mientras que las dietas que incluyen abundantes productos vegetales, como la mediterránea o la vegana ofrecen beneficios a los que las consumen, como efectos antiinflamatorios y anticancerígenos. Por tanto, los beneficios deben valorarse en el conjunto de la dieta y no por alimentos separados, ya que las personas realizan comidas, y la totalidad de los efectos de los alimentos ingeridos será lo que determine hacia donde dirige la persona la balanza en la modulación de la carcinogénesis.
Palabras clave
prevención primaria; nutrición; cáncer
Abstract
Cancer is a multifactorial disease influenced by external and genetic factors. It’s estimated that more than 30% of cancers would have been prevented with changes in lifestyle, mainly with dietary habits. It’s a disease whose number is increasing, estimating an incidence of 29.5 million cases by 2040. With this review, we aim to clarify the relationship between food and the risk of suffering certain tumors, as well as to analyze the causes and components that influence its appearance and the most recommended diet pattern. Likewise, it is expected to collect a series of recommendations after analyzing the results that may help the population to change their eating habits. Primary prevention measures turn out to be the most cost-effective. Among the foods that have been most associated with a protective effect are fruit, vegetables and fiber, while red meat and diets rich in animal fats can exert a cancer-promoting factor. The western diet is considered a proinflammatory diet, increasingly being associated with an increased risk of malignancies, while diets that include abundant plant products, such as the Mediterranean or vegan ones, offer benefits to those who consume them, such as anti-inflammatory and anticancer effects. Therefore, the benefits must be valued in the diet as a whole and not by separate foods, since people make meals, and the total effects of the food eaten will determine what the person is directing the balance in the modulation of carcinogenesis.
Keywords
nutrition; primary prevention and cancer
Importancia del problema
El cáncer es un conjunto de enfermedades conocidas por tener en común un crecimiento desmesurado de células debido a fallos genéticos y epigenéticos(1), asimismo, se le ha relacionado con factores externos, tanto ambientales como relacionados con el estilo de vida(2), por ello, se trata de una enfermedad multifactorial. Por otro lado, cada uno de ellos tiene unos factores de riesgo que influyen en la incidencia, pudiendo ser la nutrición una causa de la alteración del ciclo celular llegando a desencadenar una neoplasia o a frenar su aparición(1,3).
De entre los factores causales del cáncer, la gran mayoría están relacionados con el estilo de vida cuya exposición es modificable(1). Además, aunque las neoplasias evolucionan mayoritariamente con acumulación de mutaciones sólo una minoría están asociada a factores genéticos hereditarios(1,4), siendo por tanto en su mayoría adquiridas durante la vida del individuo(4). A pesar de ello, existe una relación entre los factores nutricionales y los genéticos de baja penetrancia, lo que se denomina susceptibilidad genética, la cual puede modificar el efecto de los alimentos en el proceso neoplásico dando lugar a diferentes respuestas para un mismo compuesto(1).
Esta enfermedad sigue constituyendo una de las principales causas de morbi-mortalidad del mundo, con aproximadamente 18,1 millones de casos nuevos en el mundo en el año 2018(5). Casi una de cada seis defunciones en el mundo son por esta enfermedad(6), siendo los más frecuentemente diagnosticados los de pulmón, mama, colon y recto, próstata y estómago(5).
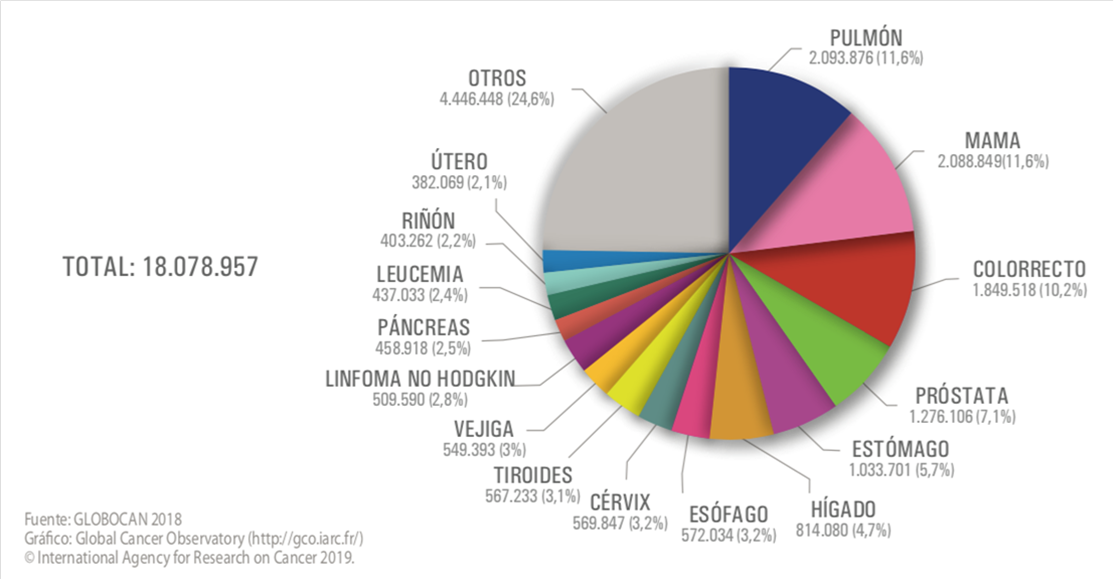
Figura 1. Tumores más frecuentemente diagnosticados en el mundo en el año 2018, ambos sexos(7).
Las estimaciones poblacionales indican que el número de casos nuevos aumentará en las dos próximas décadas de 14 millones en 2012(6) hasta 29,5 millones al año en 2040(5), y que para el año 2030 13’2 millones de personas morirán por esta causa(1). Esta situación resalta la necesidad de medidas de prevención urgentes para frenar el apogeo del cáncer(8).
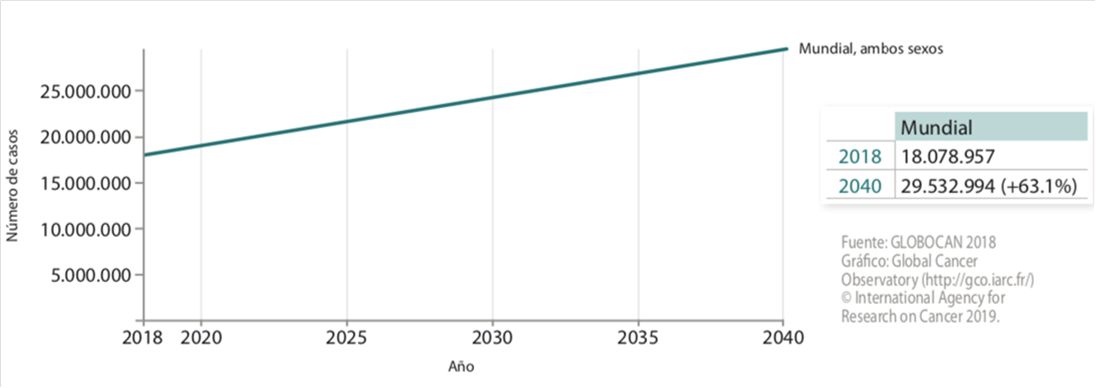
Figura 2. Incidencia estimada de tumores en la población mundial para el periodo2018-2040, ambos sexos(5).
En España las previsiones no son diferentes. Se estima que en el 2020 el número de nuevos casos alcance los 277.394(5). El número absoluto de cánceres diagnosticados en España ha continuado en aumento desde hace décadas en probable relación con el aumento poblacional, el envejecimiento y la exposición a factores de riesgo(5). Los cánceres más frecuentemente diagnosticados serán los de colon y recto (44.231 nuevos casos), próstata (35.126), mama (32.953), pulmón (29.638) y vejiga urinaria (22.350)(5). En mujeres serán los de mama (32.953) y colon y recto (18.187)(5), mientras que en varones serán los de próstata (35126), colon y recto (26044), pulmón (21847) y vejiga (18071)(5).
Por tanto, el cáncer puede ser prevenible(1,6). Según la OMS, del 30 al 50% de los cánceres se pueden prevenir con un modo de vida sano(6). El concepto de estilo de vida saludable, de forma abreviada, englobaría aspectos como un adecuado peso corporal (IMC:18,5-24,9 Kg/m2) y evitar los alimentos que fomenten su aumento como bebidas azucaradas, no fumar, 30 minutos de actividad física al día, fomentar la lactancia materna, limitar el consumo de carnes rojas, procesadas y alcohol y aumentar los alimentos vegetales (1,9).
Prevención
La prevención persigue modificar factores biológicos, ambientales y genéticos en la medida de lo posible para evitar la aparición de una neoplasia(4). La mayor comprensión de la carcinogénesis y de los factores de riesgo que intervienen en ella ha provocado un mejor conocimiento en este campo(8). Se trata de la estrategia más costoefectiva para el control del cáncer desde el punto de vista de la salud pública, por lo que las medidas de prevención primaria deberían ser consideradas prioritarias(6,9).
Entendemos como prevención primaria evitar la exposición a factores relacionados con la aparición y promoción de las neoplasias(9,10). La prevención secundaria actúa durante las etapas preclínicas de la tumorogénesis mediante la inhibición de la progresión tumoral(10). La prevención terciaria se logra mediante la inhibición de la invasión y la metástasis en pacientes con cáncer después de la terapia(10). Los efectos de los agentes dietéticos deben verse como un conjunto de varios efectos en lugar de una sola respuesta biológica y, por esta razón, podrían actuar sobre todo el proceso de transformación maligna(10).
Por tanto, es posible modificar la iniciación, promoción o progresión de las neoplasias malignas(1,3). Cuanto estos procesos se modifican con sustancias químicas se le denomina quimioprevención(3). Los compuestos de los alimentos pueden ser quimiopreventivos, pudiendo actuar a nivel de prevención primaria, secundaria o terciaria(1).
Si bien es conocido que el cáncer puede ser causado por cambios en nuestro ADN(1,4), también es posible la regulación de una función genética sin alterar su estructura. Existen evidencias de que la nutrición también modifica la epigenética de las células y por tanto la expresión de ciertos tipos de genes. Por tanto, los alimentos que ingerimos en nuestra dieta pueden intervenir en procesos fundamentales para la viabilidad y el funcionamiento de nuestras células, como es la metilación del ADN. De esta forma, la epigenética puede actuar como medida de prevención primaria. Tanto la hipermetilación como la hipometilación pueden ser utilizadas por un tumor para desarrollarse, y también pueden ser modificadas por los alimentos para impedir el desarrollo neoplásico, todo dependerá de que región silencien o activen. Entre los compuestos nutricionales que se han obtenido evidencias tenemos el dialil-disulfuro del ajo que interviene en la inhibición de la metilación, o la genisteína de la soja o el ácido folínico como inductores de la metilación. Por tanto, incrementando nuestro conocimiento sobre las alteraciones que la nutrición puede hacer sobre el epigenoma podemos modificar la expresión de ciertos genes fomentando un factor de protección frente a futuras neoplasias(1,3,11).
Asimismo, numerosos estudios han demostrado que la dieta y los componentes bioactivos de los alimentos juegan un papel fundamental para ayudar a contrarrestar los efectos de procesos celulares dañinos como es el daño oxidativo relacionado con el medio ambiente(12). El estrés oxidativo está fuertemente implicado en el envejecimiento y la fisiopatología de numerosas enfermedades, incluida el cáncer(12).
Por último, dependiendo de los alimentos que se consuma y su patrón de alimentación, podrá favorecer el desarrollo de un cáncer o por el contrario disminuir su probabilidad de padecerlo(1). La razón por la que se puede favorecer la carcinogénesis es debido principalmente a que en la dieta se pueden incluir sustancias, llamadas cancerígenos. No obstante, siguiendo una dieta equilibrada y saludable podemos convertir a los alimentos en potentes aliados contra el cáncer. Concretamente, uno de los efectos más importantes de estas dietas equilibradas es debido a los componentes que nos aportan los alimentos de origen vegetal (frutas y verduras)(1). Dentro de los patrones de dieta saludable, la mediterránea es la que mayor nivel de evidencia ha demostrado, reduciendo la morbimortalidad por enfermedades no transmisibles y es una de las que debería recomendarse(13).
A pesar de lo expuesto anteriormente, ha de resaltarse la dificultad que supone encontrar evidencia en este campo de la medicina, ya que existen numerosos compuestos en cada alimento, e ingerimos diversos alimentos, por lo que atribuir cierto efecto a un solo factor es complicado. Aun así, existen algunos alimentos o compuestos nutricionales fuertemente relacionados con algunos tipos de cánceres(9), como por ejemplo las dietas ricas en grasa, que se han asociado con un mayor riesgo de cáncer mamario, de colon o pancreático(1,3).
Tipos de cánceres influenciados por la nutrición
Según lo expuesto, la alimentación desempeña un relevante papel en el largo y complejo proceso que lleva a la aparición clínica de cáncer. La influencia de la dieta y la nutrición puede ser especifica en cada sitio o tipo de tumor, siendo el cáncer de colon y recto uno de los más fuertemente asociados. En esta revisión analizaremos la relación entre los diferentes alimentos y el desarrollo de cáncer. Además, los alimentos que se consumen contienen cientos de constituyentes(1), por tanto, trataremos de identificar los principales compuestos aportados por estos alimentos que influyen en la carcinogénesis y analizar el modo en que lo hacen.
Influencia de los patrones de dieta
Algunos alimentos poseen potenciales cancerígenos frecuentemente consumidos en las dietas occidentales, como por ejemplo las nitrosaminas, encontradas en diversos alimentos como carnes o alimentos fritos. No obstante, actualmente se sostiene que el aumento de cáncer está más asociado a condiciones más complejas como la obesidad y una alimentación habitual desequilibrada y pobre en verduras y frutas, más que a la ingesta de potenciales carcinógenos en los alimentos(1). Por tanto, no solo tiene importancia la exposición a alimentos individuales, sino también la exposición a patrones alimentarios(1). Dichos patrones alimentarios están influenciados por diversos factores y circunstancias complejas y dinámicas(1).
Debido a lo expuesto, se considera además necesario una revisión de los distintos patrones de dieta y sus ventajas y limitaciones. Se estima que las modificaciones en las exposiciones a factores nutricionales podrían ayudar a reducir la carga de los tumores en los países desarrollados(14).
Objetivos
Según lo expuesto anteriormente, en este trabajo se plantean los siguientes objetivos:
- Analizar la relación entre los alimentos que comemos y la aparición de ciertos tumores.
- Analizar los principales cancerígenos aportados a nuestro organismo a través de la dieta.
- Exponer los patrones alimenticios que han demostrado mayor evidencia de reducción de cáncer en la población que la sigue.
- Presentar recomendaciones alimentarias para disminuir la incidencia de cáncer.
Materiales y Métodos
Para la realización de este TFG se realizaron búsquedas en la base de datos Web of Science para artículos publicados en los últimos 5 años (desde 2015 hasta marzo de 2020). Se utilizó una estrategia de búsqueda sin restricciones con respecto al tipo de estudio realizado, tipo de participantes (por ejemplo, características de edad o sexo), tipo de intervenciones, base de datos a la que pertenecían o tipo de medidas de resultado. Además de la búsqueda en la base de datos, se utilizaron datos epidemiológicos obtenidos de organizaciones oficiales y de referencia como la OMS, la SEOM o el PAPPS, y se consultaron a libros de referencia en la medicina (Harrison(3)) y a libros de referencia en la materia de nutrición y cáncer (de la editorial Panamericana(1)), así como el libro de referencia en digestivo de la UCLM(15). No se obtuvieron publicaciones duplicadas. Se buscaron las palabras clave ‘nutrition’, ‘cancer’ y ‘primary prevention’ y se seleccionó cada título y resumen de los artículos que cumplieron con los criterios de inclusión y exclusión para determinar si eran potencialmente relevante para el tema de revisión. El siguiente paso fue revisar el texto completo de los artículos potencialmente relevantes.
1. Criterios de inclusión y exclusión
Los criterios de inclusión de nuestra búsqueda con las palabras clave fueron la fecha de publicación (2015-2020), poder disponer de ellos mediante acceso abierto, con idioma de publicación inglés o español y cuya región de publicación fuera un país perteneciente a la unión europea.
Como criterio de exclusión tenemos el pertenecer al dominio de investigación ‘Artes y humanidades’.
La búsqueda inicial arrojó 80 resultados. Después de excluir los artículos que no eran relevantes para el tema de acuerdo con su título y resumen, se seleccionaron 42 artículos para la revisión del texto completo. De estos, 34 fueron relevantes.
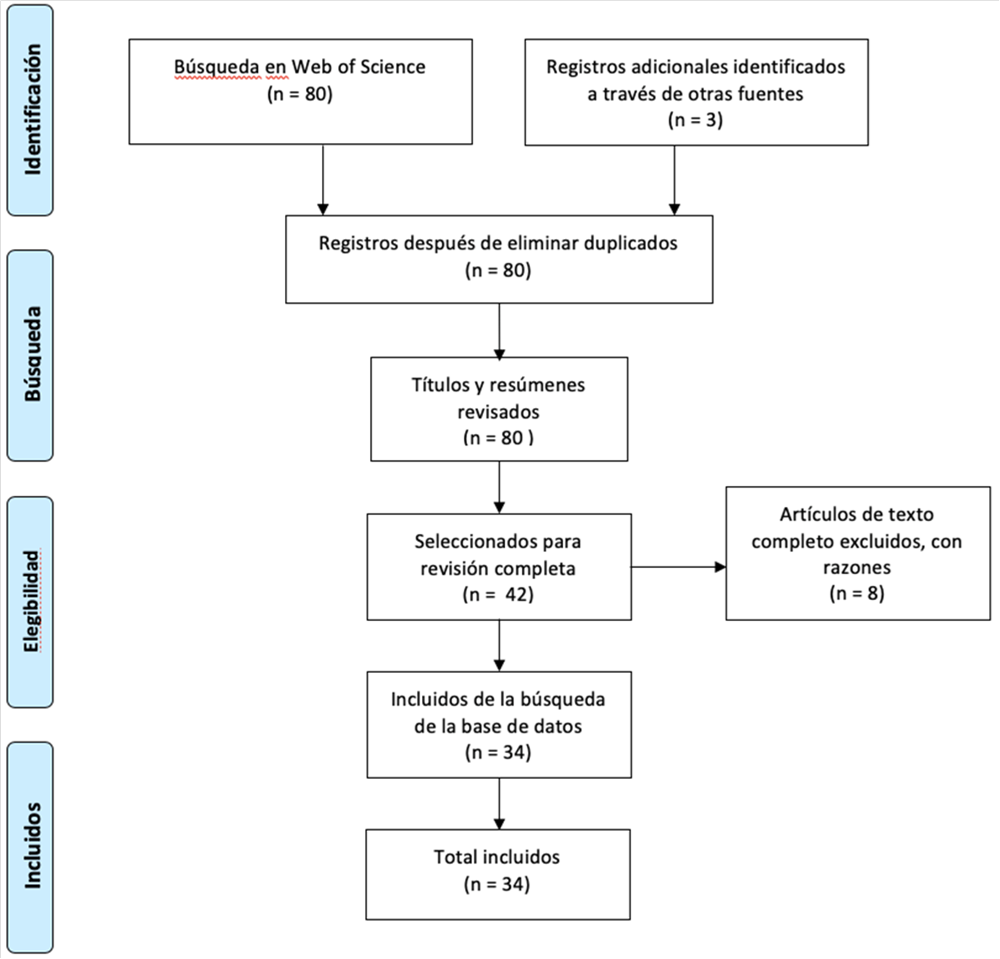
Figura 3. Diagrama de flujo del proceso de búsqueda de literatura.
Resultados
El CCR es el cáncer más frecuentemente diagnosticado en España(5) y el riesgo de desarrollar un CCR depende de factores genéticos y medioambientales(1,3,15). Definitivamente, el factor de riesgo de mayor peso es la edad para el conjunto de las neoplasias(3), siendo destacable dicha asociación en el CCR ya que aproximadamente el 90% de los CCR no hereditarios se observan en pacientes por encima de 50 años(15). Con todo, cabe destacar que las medidas de prevención primaria nutricional deben de establecerse, a ser posible, precozmente, ya que a pesar de su gran efectividad solo se obtienen resultados significativos a largo plazo(9). Asimismo, es más frecuente en personas de clase social alta que viven en zonas urbanas(3) y en los países industrializados prósperos(1). No obstante, dentro de los factores modificables, podemos apreciar una relación entre la alimentación habitual y el desarrollo de gran parte de los CCR esporádicos(1,3). Curiosamente, dicha relación con la alimentación se puede observar en personas que provienen de una zona con incidencia baja de CC y al pasar a otra tiende a igualarse al lugar donde ha migrado(3).
Hay una relación directa entre la mortalidad por CCR y el consumo per cápita de calorías, proteínas de la carne y grasa, y aceite alimentarios(3). En cuanto a la fibra dietética, numerosos metaanálisis y estudios relacionan un aumento de su consumo con una menor incidencia(1,15,16). A pesar de ello, estos datos no se han podido relacionar de manera significativa con los estudios clínicos prospectivos(3,4), por lo que hoy en día existe controversia en afirmar que la fibra reduce el CCR. Por otra parte, se ha relacionado la dieta rica en grasas animales con mayor riesgo de neoplasias, entre ellas el CCR. Se ha relacionado con un aumento de la producción de ácidos biliares y con una mayor proporción de anaerobios en la microflora intestinal, con posible transformación de los ácidos biliares en cancerígenos (activando la proliferación celular, alterando la composición de mucina e induciendo la producción de prostaciclinas)(3,15).
Tabla 1. Resultados de la búsqueda sobre cáncer de colon y recto.
|
Nombre del estudio |
Tipo de estudio |
Población a estudio |
Medidas de prevención |
Principales resultados |
|
Calidad de CH y salud humana(17) |
Revisión sistemática y metaanálisis |
Población general |
Fibra, granos integrales e índice glucémico |
Incidencia relacionada inversamente con el consumo de fibra dietética, granos integrales (calidad moderada) y dietas con índice glucémico más bajo (calidad muy baja). |
|
Suplementos y riesgo de muerte por cáncer(18) |
Revisión sistemática y metaanálisis |
Población general, media 59a |
Suplementos de vitaminas |
No se respalda su ingesta en prevención primaria. |
|
Atributos nutricionales y efectos de los pistachos (19) |
Revisión |
Población general |
Pistachos |
Efectos protectores frente al cáncer, debido entre otros a su alto contenido en fibra y propiedades antioxidantes. |
|
Quimioprevención en cáncer colorrectal(20) |
Revisión |
Pacientes con EII, PAF y síndrome de Lynch.
|
Aceite de pescado, AcF, vit C, calcio, fibra de grano, almidón resistente, curcumina/ quercetina |
Asociación inversa entre ingesta de pescado y el riesgo de CCR. PAF: la ingesta de EPA, vitamina C, calcio, fibra, curcumina y quercetina demostró ser efectivo para la quimioprevención de adenoma /CCR. El AcF fue eficaz en CU. |
|
AF y nutrición en la prevención primaria y terciaria del CCR(21) |
Artículo de revisión |
Población general |
Dieta y actividad física |
Evitar el alcohol, un peso saludable, una AF regular y moderada, y seguir una dieta mediterránea pueden reducir el riesgo de CCR y mejora la calidad de vida. |
|
Nutrición de precisión para apuntar al metabolismo de los lípidos en el cáncer colorrectal(22)
|
Revisión |
Población general |
Dieta, metabolismo lipídico, obesidad |
El colesterol, grasas y AGS, obesidad, carne roja, procesada y a la parrilla está fuertemente asociado con la tumorogénesis colorrectal. Los AGPI y el ω3 tuvieron un papel protector. Disbiosis: es un FR. Fibra: datos no concluyentes, aunque la mayor evidencia apunta a un papel protector. AcF: reducción del 30% en el riesgo. |
|
Vitamina D: enfoque en la suplementación y el cáncer(23) |
Revisión |
Ensayos pre-clínicos y población general |
Suplementos de vitamina D |
Disminución del riesgo con el consumo de 25 (OH) D, sobretodo en las mujeres. |
|
Asociación entre una puntuación dietética basada en plantas pro y el riesgo de cáncer(24) |
Cohorte prospectiva (2009-2016) |
Población > o = a 45 años |
Consumo de vegetales |
Una dieta basada en plantas se asoció con una disminución de los riesgos generales (HRt3vs.t1 = 0,85; IC del 95%: 0,76, 0,97) y digestivo, principalmente CCR (HR t3vs.t1 = 0.68; IC 95% 0.47; 0.99), |
|
Nutrición como factor epigenético regulador del cáncer(11) |
Revisión bibliográfica |
Población general |
Dieta |
La fibra, el selenio, el consumo de alimentos ricos en polifenoles, la fruta y verdura, y una dieta rica en vitaminas / antioxidantes se asoció a un efecto protector. La carne roja y procesada, la obesidad y el alcohol se asociaron como factores causantes. |
|
CR: reducción del riesgo del 20% gracias a la ingesta de fibra dietética(25) |
Revisión sistemática y metaanálisis |
Población general |
Fibra |
La ingesta de fibra en la dieta podría ser protectora contra el cáncer rectal, [ES = 0,77 (IC del 95% = 0,66 a 0,89)]. El análisis de subgrupos por género muestra un mayor efecto protector para los hombres. |
|
Revisando el impacto del estilo de vida en el riesgo de cáncer colorrectal desde una perspectiva de género(26) |
Revisión |
Población general, dividida por sexo |
Dieta, ejercicio, obesidad. |
Patrón dietético: la dieta occidental y una dieta proinflamatoria se asoció con la incidencia general de CCR, más alta entre hombres. En mujeres los hábitos alimenticios occidentales, con un alto consumo de carne pueden tener un aumento en el riesgo de CCR. Las dietas vegetarianas y pescovegetarianas se asociaron con una incidencia general más baja. AF: asociada con un menor riesgo. Obesidad: El IMC se asocia con un mayor riesgo de CC en hombres (RR 1.30) en lugar de en mujeres (RR 1.12) y de CR solo en hombres (RR 1.12). La circunferencia de la cintura tiene un impacto negativo solo en CC, y más fuerte en hombres (RR 1.33 vs 1.16 en mujeres). La obesidad temprana y CCR mostró una asociación más alta para hombres que para mujeres (RR 1.39 vs 1.19). |
|
Medicina del estilo de vida: una breve revisión de su dramático impacto en la salud y la supervivencia(27) |
Revisión |
Población occidental |
DM, dieta, obesidad, AF |
FR asociados a CCR: EII, sedentarismo, obesidad, dieta estadounidense, bajo consumo de fibra, DM (26% más de riesgo de desarrollar CC con DM), consumo de azúcares, productos animales. |
|
Bebidas alcohólicas, obesidad, AF y otros factores nutricionales y riesgo de cáncer(8) |
Revisión sistemática |
Población general |
Alcohol, obesidad, AF, sal, carne, ßcaroteno, frutas y verduras, fibra, leche y lactancia materna |
FR: bebidas alcohólicas, el sobrepeso y la obesidad, la carne roja y la carne procesada, la sal y los alimentos salados y los suplementos de betacaroteno. F. Protectores: AF, las frutas y verduras, la fibra dietética, los productos lácteos y la lactancia. |
|
Nombre del estudio |
Tipo de estudio |
Población a estudio |
Medidas de prevención |
Principales resultados |
|
Calidad de CH y salud humana(17) |
Revisión sistemática y metaanálisis |
Población general |
Fibra, granos integrales e índice glucémico |
Incidencia relacionada inversamente con el consumo de fibra dietética, granos integrales (calidad moderada) y dietas con índice glucémico más bajo (calidad muy baja). |
|
Suplementos y riesgo de muerte por cáncer(18) |
Revisión sistemática y metaanálisis |
Población general, media 59a |
Suplementos de vitaminas |
No se respalda su ingesta en prevención primaria. |
|
Atributos nutricionales y efectos de los pistachos (19) |
Revisión |
Población general |
Pistachos |
Efectos protectores frente al cáncer, debido entre otros a su alto contenido en fibra y propiedades antioxidantes. |
|
Quimioprevención en cáncer colorrectal(20) |
Revisión |
Pacientes con EII, PAF y síndrome de Lynch.
|
Aceite de pescado, AcF, vit C, calcio, fibra de grano, almidón resistente, curcumina/ quercetina |
Asociación inversa entre ingesta de pescado y el riesgo de CCR. PAF: la ingesta de EPA, vitamina C, calcio, fibra, curcumina y quercetina demostró ser efectivo para la quimioprevención de adenoma /CCR. El AcF fue eficaz en CU. |
|
AF y nutrición en la prevención primaria y terciaria del CCR(21) |
Artículo de revisión |
Población general |
Dieta y actividad física |
Evitar el alcohol, un peso saludable, una AF regular y moderada, y seguir una dieta mediterránea pueden reducir el riesgo de CCR y mejora la calidad de vida. |
|
Nutrición de precisión para apuntar al metabolismo de los lípidos en el cáncer colorrectal(22)
|
Revisión |
Población general |
Dieta, metabolismo lipídico, obesidad |
El colesterol, grasas y AGS, obesidad, carne roja, procesada y a la parrilla está fuertemente asociado con la tumorogénesis colorrectal. Los AGPI y el ω3 tuvieron un papel protector. Disbiosis: es un FR. Fibra: datos no concluyentes, aunque la mayor evidencia apunta a un papel protector. AcF: reducción del 30% en el riesgo. |
|
Vitamina D: enfoque en la suplementación y el cáncer(23) |
Revisión |
Ensayos pre-clínicos y población general |
Suplementos de vitamina D |
Disminución del riesgo con el consumo de 25 (OH) D, sobretodo en las mujeres. |
|
Asociación entre una puntuación dietética basada en plantas pro y el riesgo de cáncer(24) |
Cohorte prospectiva (2009-2016) |
Población > o = a 45 años |
Consumo de vegetales |
Una dieta basada en plantas se asoció con una disminución de los riesgos generales (HRt3vs.t1 = 0,85; IC del 95%: 0,76, 0,97) y digestivo, principalmente CCR (HR t3vs.t1 = 0.68; IC 95% 0.47; 0.99), |
|
Nutrición como factor epigenético regulador del cáncer(11) |
Revisión bibliográfica |
Población general |
Dieta |
La fibra, el selenio, el consumo de alimentos ricos en polifenoles, la fruta y verdura, y una dieta rica en vitaminas / antioxidantes se asoció a un efecto protector. La carne roja y procesada, la obesidad y el alcohol se asociaron como factores causantes. |
|
CR: reducción del riesgo del 20% gracias a la ingesta de fibra dietética(25) |
Revisión sistemática y metaanálisis |
Población general |
Fibra |
La ingesta de fibra en la dieta podría ser protectora contra el cáncer rectal, [ES = 0,77 (IC del 95% = 0,66 a 0,89)]. El análisis de subgrupos por género muestra un mayor efecto protector para los hombres. |
|
Revisando el impacto del estilo de vida en el riesgo de cáncer colorrectal desde una perspectiva de género(26) |
Revisión |
Población general, dividida por sexo |
Dieta, ejercicio, obesidad. |
Patrón dietético: la dieta occidental y una dieta proinflamatoria se asoció con la incidencia general de CCR, más alta entre hombres. En mujeres los hábitos alimenticios occidentales, con un alto consumo de carne pueden tener un aumento en el riesgo de CCR. Las dietas vegetarianas y pescovegetarianas se asociaron con una incidencia general más baja. AF: asociada con un menor riesgo. Obesidad: El IMC se asocia con un mayor riesgo de CC en hombres (RR 1.30) en lugar de en mujeres (RR 1.12) y de CR solo en hombres (RR 1.12). La circunferencia de la cintura tiene un impacto negativo solo en CC, y más fuerte en hombres (RR 1.33 vs 1.16 en mujeres). La obesidad temprana y CCR mostró una asociación más alta para hombres que para mujeres (RR 1.39 vs 1.19). |
|
Medicina del estilo de vida: una breve revisión de su dramático impacto en la salud y la supervivencia(27) |
Revisión |
Población occidental |
DM, dieta, obesidad, AF |
FR asociados a CCR: EII, sedentarismo, obesidad, dieta estadounidense, bajo consumo de fibra, DM (26% más de riesgo de desarrollar CC con DM), consumo de azúcares, productos animales. |
|
Bebidas alcohólicas, obesidad, AF y otros factores nutricionales y riesgo de cáncer(8) |
Revisión sistemática |
Población general |
Alcohol, obesidad, AF, sal, carne, ßcaroteno, frutas y verduras, fibra, leche y lactancia materna |
FR: bebidas alcohólicas, el sobrepeso y la obesidad, la carne roja y la carne procesada, la sal y los alimentos salados y los suplementos de betacaroteno. F. Protectores: AF, las frutas y verduras, la fibra dietética, los productos lácteos y la lactancia. |
Analizando los resultados de esta revisión bibliográfica, observamos que las medidas de prevención primaria que más se analizan y se relacionan con el CCR son el consumo de grasas, carnes, fibra, frutas y vegetales, y lácteos.
La fibra dietética resulta beneficiosa en términos de prevención primaria de CCR por varios mecanismos: aumenta el volumen de las heces, previene la resistencia a la insulina y disminuye la actividad de IGF-I, evita el estreñimiento disminuyendo el tiempo del tránsito intestinal, diluye los cancerígenos debido a su retención de agua y los secuestra, posee efecto prebiótico protegiendo a la microbiota intestinal y esta produce con ella ácidos grasos de cadena corta que disminuyen la inflamación sistémica y poseen propiedades anti-proliferativas y pro-apoptótocas en la mucosa local, se une a los ácidos biliares y reduce el colesterol en sangre en ayunas(8,25). La mayoría de los datos epidemiológicos y diversos metaanálisis defienden el papel protector de la fibra en el CCR(11,8,26,19,27,24), aunque también existen datos no concluyentes al respecto(22). También encontramos un metaanálisis(25) donde solo se analiza el efecto protector de la fibra en el CR, mostrando resultados significativos [ES = 0,77 (IC del 95% = 0,66 a 0,89)]. Asimismo, este mismo metaanálisis(25) fue analizado por subgrupos, mostrando un efecto protector mayor en hombres. En otro metaanálisis(17), se llega a enfatizar que los beneficios de la toma de fibra dietética podrían ser mayor cuando esta se obtiene de granos enteros, vegetales y frutas que han sido procesados mínimamente, obteniéndose en el análisis de datos un efecto protector de la ingesta de fibra dietética (RR 0’84 IC 95% 0’78-0’89) con un grado de calidad moderado, manteniéndose dicho efecto protector cuando se analizaba una ingesta de granos enteros con un RR de 0’87 para el CCR, y un grado de evidencia moderado (IC 95% 0’79 – 0’96). Además, recomiendan una ingesta diaria entre 25 y 29 gramos según los datos analizados, aunque cantidades mayores a 30 gramos conferirían beneficios adicionales(17).
La microbiota intestinal desempeña muchas funciones, incluida la protección contra los patógenos, el desarrollo del sistema inmunitario intestinal, la síntesis de vitaminas y el metabolismo de los xenobióticos(17). Su función principal es la digestión de la fibra, la cual escapa a la digestión intestinal(17). La disbiosis, es decir, cuando se altera la homeostasis de la microbiota intestinal (22), también se ha implicado con el desarrollo de los CCR(27). Esta microbiota desequilibrada no puede proteger de los organismos patógenos que podrían establecerse con éxito y desencadenar la inflamación, además de producir genotoxinas y metabolitos microbianos cancerígenos(22). Esta puede ser alterada por las dietas altas en grasas, bajas en fibra y carbohidratos(22). Un cambio extremo de una dieta basada en vegetales a una dieta animal también favorecería la disbiosis. Por tanto, dado que la eubiosis es necesaria para una correcta funcionalidad en el intestino, se ha investigado el papel de los probióticos en la prevención del CCR, con obtención de datos epidemiológicos y experimentales consistentes que respaldan dicha asociación positiva(22). Por tanto los probióticos podrían actuar como anticancerígenos debido a mecanismos como la disminución del pH intestinal, inactivación de carcinógenos, modulación de poblaciones de células inmunes, modulación de la barrera intestinal y la apoptosis y la proliferación celular (22).
La mayoría de los casos de CCR se han relacionado con exposiciones ambientales (p.e, mutágenos transmitidos por alimentos) y la inflamación intestinal crónica(27). Es clara la relación entre la inflamación crónica y el riesgo de CCR, por ello, en pacientes con EII, el riesgo de padecer un CCR es mayor cuanto más dure la enfermedad y cuando mayor territorio tenga afectado(20,27). En este grupo poblacional de riesgo existen estudios que relacionan el consumo de ciertos tipos de alimentos con la quimioprevención de CCR. De ese modo, en una revisión sistemática(20) se pudo relacionar inversamente la ingesta de ácido fólico con una quimioprevención en pacientes con CU. Además, en la PAF (otro grupo poblacional de riesgo) se relacionó el consumo de EPA, vitamina C, fibra, curcumina y quercetina con el riesgo de padecer adenomas y CCR en pacientes con PAF(20). Además, en la población general, los pacientes calificados con puntuaciones más altas de dieta inflamatoria obtenían mayores riesgos de CCR, sobretodo si eran hombres(26).
La carne es otro de los grandes grupos alimentarios asociados al desarrollo del CCR(22, 27,8,11,24,26). Hay que tener en cuanta que si separamos los tipos de carne, vemos que la literatura científica hace distinciones en cuando al peligro de su consumo. Las carnes de ave, incluidas en una dieta mediterránea, no parece asociarse a un aumento del riesgo(21,24), mientras que la carne roja y procesada ha sido indentificada como probables cancerígenos para los seres humanos(24). Su efecto dañino puede ser debido a múltiples compuestos mutagénicos entre ellos los compuestos nitrosos o compuestos genotóxicos como las aminas aromáticas heterocíclicas e hidrocarburos aromáticos policíclicos presentes en la carne cocida a alta temperatura y en la carne ahumada o a la parrilla, respectivamente(8,22,24). Además de su aportación de cancerígenos, a las carnes rojas y procesadas se les atribuyen otros mecanismos por los que se asocian a un aumento del riesgo de CCR, como el aumento del estrés oxidativo así como la inducción de mutaciones del gen APC y su metilación del promotor(22). Por otro lado, se investiga si un posible papel central lo tenga el hierro hemo(8). Asimismo, en las carnes procesadas se encuentran abundantes cancerígenos debido a su adición, como los nitritos y nitratos, los cuales fomentan la formación de los ya mencionados compuestos nitrosos(8). Esto puede ser plausible con los datos recogidos de una cohorte seguida durante 8 años con una dieta basada en alto consumo de vegetales, donde se observó dicha dieta se asoció con una disminución de los riesgos generales de padecer cáncer en comparación con otras personas que no comían tantos vegetales de un 15% (HR t3vst1=0,85; IC del 95%: 0,76, 0,97), y de cánceres digestivos, principalmente CCR (HR t3vs.t1 = 0.68; IC 95% 0.47; 0.99). Igualmente, esta asociación inversa entre una puntuación más alta en la dieta basada en plantas y el riesgo de cáncer está respaldada por datos de estudios experimentales(24).
A pesar de la creciente evidencia del riesgo aumentado en consumidores de dietas ricas en carne, parece ser que el pescado no sigue los mismos resultados, ya que se han encontrado evidencias de un papel protector(20,26,21). En un estudio donde se analizó una dieta pescovegetariana, se encontró una reducción del 43% del riesgo de CCR(21). En otra revisión se obtuvieron resultados similares de la dieta pescovegetariana, obteniéndose una incidencia general de CCR mejor, aunque solo estadísticamente significativa en mujeres(26).
Además, las dietas altas en azúcares refinados y también en productos animales, favorecen la aparición de DM(27). La DM se ha considerado como una condición inflamatoria y parece intervenir en el CC, ya que los pacientes con DM tienen un 26% más de riesgo de desarrollar cáncer de colon y un 30% más de riesgo de morir debido a esto en comparación con los pacientes sin diabetes(27). Se vio un aumento gradual en la prevalencia de diabetes con el aumento del consumo de productos animales, por lo que este sería otro método de los productos animales de favorecer la carcinogénesis indirectamente(27).
Por otro lado, la ingesta de dietas con alto índice glucémico se ha asociado independientemente de la DM al CCR. Aunque con un grado de evidencia muy bajo y sin llegar a la significación estadística, en un metaanálisis(17) relacionaban el índice glucémico más bajo con un efecto protector en el CCR (RR 0’91 IC 95% 0’82-1’01).
En contraposición, el consumo de fruta y verdura se asoció a un efecto protector(11,8,21,24). Este grupo está compuesto por una amplia variedad, encontrando en ellos micronutrientes como los ponifenoles, antioxidantes como el azufre, el cual también es antiproliferativo, vitaminas, alta cantidad de fibra y folatos(11,8,24). Los folatos intervienen en la síntesis de ADN y la expresión de genes cancerígenos por medio de la metilación(8,22), como por ejemplo su influencia en el gen MTHFR(22). Otros compuesto alimenticios también se demostraron capaces de inhibir la formación de tumores gracias a su modulación genética, a saber, el romero (aumento de la expresión del gen GCNT3, asociado con un mejor pronóstico en CCR y reguló negativamente el gen miR-15b, aumentado en CCR), la curcumina (aumentó la expresión de ABCA1), y la hesperetina, el aceite de oliva, el eucaliptol, la piperina, la silimarina y los compuestos derivados del ajo que también estimularon ABCA1(22,28). Por otro lado, se observaron reducciondes del riesgo atribuidos a alimentos específicos como el ajo(8). Los frutos secos como los pistachos también poseen efectos protectores en enfermedades con sobreproducción de radicales libres como el cáncer, por su alto contenido en fibra (lo cual relacionan con un efecto protector(19)), antioxidantes como el zinc y el selenio y compuestos fenólicos como los flavonoides, entre otros componentes(19).
Los componentes nutritivos pueden modular la progresión del cáncer o incluso el riesgo de desarrollar esta enfermedad al regular, directa o indirectamente, la expresión génica(22). Las alteraciones en los genes relacionados con el metabolismo de los lípidos pueden promover la migración y la invasión, a saber, el TGFβ promueve la transición epitelial a mesenquimal junto con una supresión de la lipogénesis, favoreciendo la producción de energía(22). Por lo tanto, el metabolismo de los lípidos puede influir en una amplia gama de etapas tumogénicas(22,24). La modulación de estos genes puede ser debida al consumo de dietas ricas en grasa(22). Pero existen diversos tipos de grasas y no todas actúan de la misma manera por lo que habría que hacer distinciones(22). Los AGS se asociaron con la tumorogénesis mientras que la ingesta de AG insaturados puede ser beneficiosa para la salud(22). Los ω3 están asociados con un papel protector en el CCR, mientras que los ω6 presentan efectos opuestos(22). El VLDL se correlaciona positivamente con la frecuencia de adenomas en el colon(22). El colesterol, presente en las dietas ricas en grasas, junto con la carne roja, procesada, a la parrilla y la grasa total, están fuertemente asociados con la tumorogénesis colorrectal(22). Además, es destacable como algunos AGPI como EPA, fueron capaces de alterar la expresión de genes del metabolismo de los AG, incluidos SCD y FA desaturasa-1 y -2 ( FASDS1 y -2), implicadas en la tumorogénesis del CCR(22).
Además, una dieta rica en grasas favorece la obesidad, la cual interviene como factor independiente en la carcinogénesis(22,11,8,21). Esta suele medirse con el IMC, el cual para ser obeso se encontraría en ≥30. El exceso de grasa visceral provoca alteraciones en la composición celular del tejido adiposo y promueve el aumento de la malignidad de los tumores que se desarrollan en un microambiente rico en adipocitos como los tumores de colon(22). Según una revisión(26) estratificada por género, la obesidad no afecta por igual al riesgo en hombres y en mujeres, ya que tienen distinta distribución de la grasa corporal. Analizando los datos se vio que, aunque con un IMC elevado el riesgo de CC era mayor en ambos, existía una elevación mayor en los hombres (RR 1,30 vs RR 1’12). Asimismo, en CR el riesgo solo era mayor en hombres (R1,12). La circunferencia de la cintura tuvo un impacto negativo solo en CC, y más fuerte en hombres (RR 1.33 vs 1.16 en mujeres). Por último, la relación entre la obesidad temprana y el riesgo de CCR en la edad adulta mostró una asociación más alta para hombres que para mujeres (RR 1.39 vs 1.19)(26).
Por lo tanto, podemos llegar a la conclusión de que la actividad física adecuada y la normalización del peso disminuyen la reacción inflamatoria del cuerpo y pueden ayudar a mitigar la respuesta inmune masiva a los agentes infecciosos que sirven como estímulo para la carcinogénesis(22,26,27,21). Además, el efecto protector fue muy similar en CC proximal y distal, siendo la evidencia ‘convincente’, sin embargo, cuando se analizó el CR por separado, en esta localización el beneficio fue ‘no concluyente’(8,26). Existen otros mecanismos por los que la actividad física puede intervenir en el freno de la mutagénesis. Por un lado, mejora la sensibilidad a la insulina, lo cual hemos comentado que puede tener un papel en el proceso, además de disminuir los niveles de IGF-I que interviene en la proliferación celular(8). Además, realizando actividad física regular y siguiendo una dieta equilibrada, necesariamente aumentará la masa magra y disminuirá la grasa corporal, y por tanto, neutralizando los efectos dañinos del sobrepeso(8). Por otro lado, centrándonos a nivel local, la AF favorece el tránsito intestinal, por lo que el tiempo de contacto con los mutagénicos disminuye(8).
Aunque el papel de los lácteos en el cáncer no está muy claro(24), entendiéndose por ellos al conjunto de leche, queso y yogurt, su asociación con el CCR se asoció a una ‘probable’ reducción del riesgo. Cuando se analizó por subgrupos, se encontró esta misma reducción con la leche, pero el efecto del queso fue no concluyente(8). Este efecto protector podría ser debido a que su contenido en calcio, vitamina D, ácido linoleico, esfingolípido y antioxidantes, ‘pesan’ más que su efecto negativo por su contenido en colesterol y AGS(8).
Otros factores que se asociaron al riesgo de CCR fue el consumo de selenio de manera inversa (11). En cuanto a las bebidas alcohólicas, numerosos estudios la asocian con la carcinogénesis, estando implicado por tanto un aumento del riesgo de CCR con su consumo(11,8,21).
Por último, la ingesta de suplementos dietéticos no se respalda en prevención primaria(18), aunque se apreció con una potencia limitada una reducción con la suplementación a dosis altas de calcio (>1200mg/día) con un RR 0’37 (IC 95% 0’22 – 0’63) (18). Asimismo, los niveles bajos de vitamina D se han asociado a un aumento de desarrollar cáncer de colon(21), y dicho riesgo fue disminuido de manera constante y estadísticamente significativa con el aumento de la circulación pre-diagnóstico 25 (OH) D hasta 40 ng / ml(23). En este sentido, ocurre de manera similar a la controversia con la fibra dietética, ya que todavía no hay asociaciones sólidas en investigaciones clínicas por lo que los resultados aun no pueden extrapolarse a recomendaciones a la población hasta que no hayan más estudios(23).
Por el contrario, la suplementación con vitamina A se asoció con un aumento significativo del riesgo un 16%(18).
Cáncer de mama
El cáncer de mama es el más frecuente en la mujer(1,5). Además, se trata del cáncer más prevalente en España en la población general (129928 casos, 16.8%), por encima del cáncer de próstata (13.8%) y colorrectal (13.7%)(5). En la mujer su prevalencia es del 36.2%. Por el contrario, en la mortalidad supuso el 6.6% de todas las neoplasia, muy por detrás de pulmón, CCR, estómago e hígado(5). Está relacionado fundamentalmente con factores hormonales y reproductivos, como los niveles de estrógenos, la edad de la menarquia, la menopausia y el primer parto, el número de hijos o si se dio o no lactancia materna(1,3). La edad es otro factor fundamental, estimándose que el 75% de los casos son en mujeres por encima de los 50 años(2,3). También se ha relacionado con factores externos. Como factores de riesgo nutricionales, el cáncer de mama ha sido asociado a consumo de alcohol y obesidad(1,5,3).
Tabla 2. Resultados de la búsqueda sobre cáncer de mama.
|
Nombre del estudio |
Tipo de estudio |
Población a estudio |
Medidas de prevención |
Principales resultados |
|
Calidad de carbohidratos y salud humana(17) |
Revisión sistemática y metaanálisis |
Población general |
Ingesta fibra dietética
|
La fibra obtuvo una disminución de la incidencia. |
|
Quimioprevención de cáncer de mama por polifenoles dietéticos(10). |
Revisión |
Población femenina |
Alimentos ricos en polifenoles |
Menor riesgo: dietas asiáticas y mediterránea, verduras y frutas y altos niveles plasmáticos de genisteína circulante. Mayor riesgo: alcohol y grasas. Datos contradictorios: soja. |
|
Prevención primaria y secundaria del cáncer de mama(29) |
Revisión |
Población general |
Dieta, ejercicio físico, obesidad, alcohol. |
Aumento del riesgo: AG trans, alto índice glucémico, carne roja, sal, obesidad, alcohol. Disminuyen el riesgo: frutas, verduras, legumbres, peso adecuado, fibra, actividad física. |
|
La dieta alta en ácido fólico mejora el crecimiento tumoral en el cáncer de mama inducido por PyMT(30). |
Ensayo clínico aleatorizado |
Ratones transgénicos modelo PyMT |
Ácido fólico |
El número de tumores totales fue mayor en la dieta alta en ácido fólico.
|
|
Comportamientos nutricionales circadianos y riesgo de cáncer(31) |
Cohorte prospectiva |
Población general |
Momentos de la ingesta a lo largo del día |
Un momento tardío del último episodio de alimentación se asoció con cáncer de mama y con un aumento de las concentraciones de leptina. |
|
Nutrición de precisión para apuntar al metabolismo de los lípidos en el CCR (22) |
Revisión |
Población general |
Dieta, metabolismo lipídico, obesidad |
La obesidad se asoció como factor de riesgo. |
|
Vitamina D: suplementación y cáncer(23) |
Revisión |
Pre-clínicos y población general |
Suplemento de vitamina D |
Vitamina D se relacionó con la prevención del cáncer mamario. |
|
Asociación entre una dieta basada en plantas y el riesgo de cáncer(24) |
Cohorte prospectiva (2009-2016) |
Población > o = a 45 años |
Consumo de vegetales |
No se observó asociación para los cánceres de mama y próstata. |
|
Viabilidad del entrenamiento de resistencia estructurado y la dieta mediterránea en portadores de mutaciones BRCA1 y BRCA2 (LIBRE-1)(32) |
Ensayo multicéntrico, prospectivo, aleatorizado y controlado JADAD: 3 |
Mujeres de 18 a 69 años con mutaciones patógenas de la línea germinal en BRCA1 y BRCA2 |
Estilo de vida y educación nutricional y sobre los beneficios de la actividad física. |
Efecto favorable sobre el IMC, los niveles de estrés crónico y en los hábitos nutricionales hacia un patrón de alimentación mediterráneo. |
|
Nutrición como factor epigenético regulador del cáncer(11) |
Revisión bibliográfica |
Población general |
Dieta |
Efecto protector: soja, fruta y verdura. Efecto perjudicial: obesidad y el alcohol. |
|
Medicina del estilo de vida: dramático impacto en la salud y la supervivencia(27) |
Revisión |
Población occidental |
DM, dieta, obesidad, AF |
Factores de riesgo: Obesidad, DM, Disbiosis. Factores protectores: AF, fibra. |
|
Adipocinas y VEGF en tejido mamario y atenuación por semillas de linaza(33) |
Estudio clínico |
Post- y pre-menopausicas |
Linaza |
El microambiente mamario puede verse afectado por modificaciones dietéticas y la linaza puede inducir un microambiente antitumoral. |
|
Grasas totales, AG y relación ω-3 /ω-6 como factores de riesgo de cáncer de mama(34) |
Casos y controles |
201 casos de cáncer de mama (Edad media 58a) y 201 controles |
Grasa, ácidos grasos e ingesta de pescado |
Beneficioso: AGPI Perjudicial: Cociente ω3/ω6 <0.2, no comer pescado. |
|
Bebidas alcohólicas, obesidad, actividad física y otros factores nutricionales y riesgo de cáncer(8) |
Revisión sistemática |
Población general |
Alcohol, obesidad, AF, sal, carne, beta caroteno, frutas y verduras, fibra, leche y lactancia materna |
Mayor riesgo: alcohol, obesidad, leche. Menor riesgo: AF, frutas y verduras (ER-), fibra (especialmente ≥25g/d), lácteos. No concluyente: carne, suplementos de Bcaroteno, frutas y verduras en cáncer de mama ER +. |
|
Biología de sistemas para comprender los efectos de la nutrición y promover la salud(12) |
Revisión sobre un tema temático |
Población general e in vitro |
Alimentos y biología |
Los extractos de granada poseen efectos de inhibición del crecimiento y la apoptosis. |
En el cáncer de mama, las bebidas alcohólicas también se han asociado a un factor adverso(8,10,11,29). Además de su mecanismo procancerígeno principal, la formación de su metabolito acetaldehído, se han identificado otros por los que puede llegar a favorecer la aparición de tumores, a saber, la elevación de los niveles de hormonas sexuales y la deficiencia de folato(8). Este aumento de riesgo es proporcional a la dosis consumida, notificándose un incremento con cifras de 5-14.9gr diarios de alcohol(29).
Las grasas tuvieron relación con el cáncer de mama de manera significativa(10,29,34). Una vez más, es necesario su distinción para analizar los resultados. Por un lado, el consumo de AGPI en más del 10% de la ingesta total de energía se asoció con un riesgo significativamente menor de cáncer de mama en comparación con la baja ingesta de AGPI (OR = 0.4, IC 95% = 0.19-0.85) (34). Por otro lado, un cociente ω-3 /ω-6 <0.2 se asoció a un aumento del riesgo (OR = 2.04, IC 95% = 0.996-4.17) (34). Así mismo, los AG trans ejercieron un efecto perjudicador(29).
En cuanto a la obesidad, tanto en premenopáusicas como en postmenopáusicas se asoció a un aumento de la incidencia(8,11,22,27,29,34). En un estudio de casos y controles (34), se obtuvo un OR de 2.07 (IC 95% = 1.3-3.3). Entre los mecanismos comunes para favorecer las neoplasias que tiene la obesidad abdominal encontramos un aumento de la resistencia a la insulina (con aumento de IGF-I), la producción de estrógenos a través de una actividad aromatasa, inflamación crónica de bajo grado y estrés oxidativo(8,27). Un mecanismo específico de la obesidad en el cáncer de mama fue el aumento de estrógenos debido a la expresión de receptores de estrógenos en postmenopáusicas (8). Una ingesta tardía del último episodio de alimentación también se ha relacionado con una modulación del nivel de estrógeno debido a un aumento de las concentraciones de leptina, y por lo tanto se asoció con un aumento de la incidencia de cáncer mamario(31).
Respecto a las pacientes que padecían de DM, se les asoció un 23% más de riesgo de padecer cáncer de mama que las pacientes no DM(27). Además, se observó cierta asociación con los productos de alto índice glucémico(29).
Al igual que en CCR, la disbiosis está implicada en un aumento del riesgo, además, en este caso, por mecanismos de reciclado del estrógeno a través de la circulación enterohepática, aumentando su potencia y favoreciendo el desarrollo de este tumor(27).
Por otro lado, la actividad física obtuvo una relación de beneficio para ambas poblaciones femeninas, pre y posmenopáusicas(8,27,29). Se estimó una reducción del 10-25% en comparación con la población de mujeres inactivas(29).
A diferencia de en el CCR, las carnes rojas y procesadas no alcanzaron significación estadística, por lo que su asociación con el cáncer de mama parece ser ‘no concluyente’(8), a pesar de ello, algunos estudios sugieren su asociación(29), más probable aún cuando se habla de carne procesada(29). Al igual que en cáncer de colon, el pescado no obtuvo el mismo resultado, en este caso, se asoció su falta de consumo (menos de una vez cada seis meses) con un riesgo aumentado (OR = 3.37, IC 95% = 1.57-7.23)(34)
En cuanto a los suplementos, los resultados con betacaroteno fueron no concluyentes(8). La ingesta de vitamina D se ha relacionado, aunque inconsistentemente, con la prevención del cáncer mamario(23). Las concentraciones más altas de 25 (OH) D se asociaron con una disminución de la dosis-respuesta en el riesgo de cáncer de mama, siendo las concentraciones ≥60 ng / ml las más protectoras(23). Asimismo, se demostró una reducción significativa en el riesgo de cáncer de mama entre las mujeres que no toman vitamina D o suplemento de calcio antes de la inscripción, lo que enfatiza los efectos protectores(23). No obstante, otras revisiones muestran resultados no concluyentes, por lo que los resultados positivos hay que tomarlos con precaución hasta nuevas evidencias(11).
En cuanto a la fruta y verdura, se encontró una relación entre la disminución del riesgo y el consumo de vegetales sin almidón en cánceres receptores de estrógenos negativos(8). El consumo de crucíferos también supuso una reducción de la incidencia. Por tanto, de manera global, se aprecia una disminución del cáncer de mama con el consumo de vegetales(8,10,11,29), aunque no fue evidente esta relación en todos los resultados(24). En cuanto a los mecanismos, además de los ya expuestos, el cáncer de mama RE parece poder modularse debido a una reducción de factores proliferativos como IGF-I, ciclina E y el factor de transcripción nuclear NF-kappa B(8). Por otro lado, este beneficio también se ha demostrado a nivel molecular, ya que el extracto de granada regula negativamente genes importantes involucrados en la reparación de roturas de doble cadena de ADN, y por tanto, jugando un papel beneficioso en la inhibición del crecimiento y la apoptosis(12). Se relaciona esta actividad moduladora con su alto contenido en polifenoles(12). Otro compuesto de las frutas con asociación demostrada es el reveratrol que se encuentra en la uva (no se pudo demostrar ese beneficio en el presente en el vino) (10).
En los resultados referentes a la fibra, se observó una disminución del riesgo(8,17,27), especialmente observado para la ingesta de fibra soluble y para la ingesta total de fibra dietética ≥25g/día(8,17). Además de los mecanismos comentados por los que favorecen la sensibilización a la insulina y disminuyen la inflamación sistémica, este componente de la dieta puede ejercer mecanismos beneficiosos específicos para los tumores de mama mediante la reducción de la concentración hormonas esteroideas circulantes(8,27), inhibiendo la absorción de estrógeno a nivel gastrointestinal.
Por otra parte, se vieron resultados contradictorios entre ingesta de soja y cáncer de mama: la correlación inversa de estas está respaldada por las líneas más sólidas de evidencia científica(10,11). La soja es un alimento rico en polifenoles y folatos(11). Su alto consumo se asoció con una ligera reducción en el riesgo de cáncer de mama con mejores resultados en mujeres premenopáusicas en comparación con postmenopáusicas(10). Además, también se apreció un efecto protector adicional cuando esta era consumida en la infancia y adolescencia(11).
Además, las semillas como la linaza pueden producir un microambiente antitumoral gracias a la inhibición de la angiogénesis y disminución de la inflamación(33). Asimismo, se asoció con una disminución de niveles de leptina y la adiponectina(33).
En cuanto al ácido fólico, su papel en la modulación de la carcinogénesis es curiosa. Parece ser, según investigaciones en modelos de ratones, que la suplementación con ácido fólico antes del establecimiento de focos neoplásicos previene el tumor, mientras que la suplementación con ácido fólico después del establecimiento de focos neoplásicos promueve el tumor. Esto puede ser explicado debido a que el ácido fólico repara el ADN en los tejidos sanos, lo que evita la aparición del cáncer, pero una vez aparecido los altos niveles de replicación del ADN en el cáncer requieren altos niveles de ácido fólico para el crecimiento continuo del tumor(30).
Por último, los datos respecto a los lácteos en relación con el cáncer de mama los resultados son interesantes. Por un lado, la ingesta total de lácteos se ha asociado a una reducción del riesgo de padecer esta neoplasia(8). No obstante, la leche consumida en grandes cantidades aumenta los niveles de IGF-I, asociándose a un aumento del riesgo(8).
Cáncer de próstata
El cáncer de próstata es el más frecuente en los varones en España(2,5), al igual que otros muchos tipos de cánceres, la edad es un factor de riesgo importante, sobretodo por encima de los 50 años(2), similar a lo que ya ocurría en el cáncer de mama, a pesar de ser el tumor más frecuente de la población masculina, en la escala de mortalidad supuso el octavo puesto de la población general en 2018(5), su relación con factores ambientales, como el sedentarismo y ciertos hábitos alimenticios(2), se pueden relacionar por su incremento de incidencia cuando una población migra desde una zona de baja incidencia a otra con alta(35).
|
Nombre del estudio |
Tipo de estudio |
Población a estudio |
Medidas de prevención |
Principales resultados |
|
Suplementos dietéticos y riesgo de muerte cáncer(18) |
Revisión sistemática y metaanálisis |
Población general (edad media 59 años) |
Suplementos dietéticos |
Un aumento de 400g/d de calcio en la dieta se asoció positivamente con el cáncer de próstata. |
|
El impacto de la nutrición en los cánceres urogenitales(35) |
Artículo |
Población masculina |
Obesidad, dieta |
Obesidad: IMC >30 disminuyó un 18% en el riesgo de desarrollar un cáncer de bajo grado (Gleason <7) pero aumento un 29% los de alto grado. Obesos con Gleason de 8 a 10 tenían un riesgo 78% mayor de transformación maligna. Grasas y lípidos: un aumento de grasas animales aumenta la incidencia. Los AG omega-6 poseen efectos estimulantes de la carcinogénesis frente a inhibitorios del omega-3. Diabetes: Tienen una menor incidencia de cáncer de próstata. |
|
Comportamientos nutricionales circadianos y riesgo de cáncer(31) |
Cohorte prospectiva |
Población general |
Momentos de la ingesta a lo largo del día |
Un momento tardío del último episodio de alimentación se asoció con aumento del riesgo. |
|
Nutrición de precisión para apuntar al metabolismo de los lípidos en CCR(22)
|
Revisión |
Población general |
Dieta, metabolismo lipídico, obesidad |
La obesidad se asoció con cáncer de próstata. |
|
Asociación entre una puntuación dietética basada en plantas pro y el riesgo de cáncer(24) |
Cohorte prospectiva (2009-2016) |
Población > o = a 45 años |
Consumo de vegetales |
No se observó asociación. |
|
Nutrición como factor epigenético regulador del cáncer(11) |
Revisión bibliográfica |
Población general |
Dieta |
Polifenoles (té verde, soja…) se asoció a una disminución del riesgo. Vitamina D: resultados no concluyentes. |
|
La posibilidad de marcadores de estilo de vida y riesgo biológico para predecir la morbilidad y mortalidad en una cohorte de hombres jóvenes después de 26 años de seguimiento(36) |
Cohorte prospectiva |
Hombres entre 33 y 42 años |
Estilo de vida y marcadores de riesgo biológico |
El grupo con los puntos de riesgo total resumidos más bajos tenía un riesgo significativamente menor de cáncer en comparación con el grupo con los puntos de riesgo resumidos más altos (OR 0.34 IC 95% 0’17 a 0’70 vs OR 0’78 IC 95% 0.48 a 1.28). En cuanto a marcadores de riesgo biológico tuvo un riesgo significativamente menor (OR 0.37 IC95% 0.18 a 0.79). |
|
Medicina del estilo de vida: una breve revisión de su dramático impacto en la salud y la supervivencia(27) |
Revisión |
Población occidental |
Dieta vegana, proteína de soja, vitaminas E y C, ejercicio (30min/d), manejo del estrés. |
El cambio de estilo de vida y nutrición del grupo experimental se asoció a menores niveles de PSA, mayor inhibición del crecimiento celular del cáncer y una regulación negativa del gen de cáncer de próstata. |
|
Bebidas alcohólicas, obesidad, actividad física y otros factores nutricionales y riesgo de cáncer: una revisión de la evidencia(8) |
Revisión sistemática |
Población general |
Alcohol, obesidad, AF, sal, carne, Bcaroteno, frutas y verduras, fibra, leche y lactancia materna |
Asociación entre la grasa corporal / abdominal y el riesgo avanzado de cáncer de próstata. Mayor riesgo de cáncer de próstata asociado con la ingesta total de productos lácteos. |
|
Enfoques de biología de sistemas para comprender los efectos de la nutrición y promover la salud(12) |
Revisión sobre un tema temático |
Población general e in vitro. |
Alimentos |
El licopeno se ha asociado a una posible quimioprevención en el cáncer de próstata. La granada (altos niveles de polifenoles) posee efectos antiproliferativos y proapoptóticos. |
Por un lado, la fruta y verdura no obtuvieron asociaciones que nos hicieran pensar en una reducción del riesgo con su consumo (8,24). No obstante, la alta ingesta de polifenoles (en este caso del té verde y la soja) se asoció inversamente al riesgo de neoplasia prostática(11,12). También hubo estudios que encontraron un beneficio potencial de componentes concretos de los alimentos, como el licopeno de los tomates, el cual se trata de un antioxidante soluble en lípidos que actúa protegiendo las membranas celulares de la peroxidación lipídica y se piensa que puede tener un papel en la quimioprevención del cáncer de próstata(12). La fibra por su parte, obtuvo datos no concluyentes(8).
La carne roja y procesada en el cáncer de próstata tuvo datos no concluyentes(8). A pesar de ello, un aumento de grasas animales sí se asoció con un aumento de la incidencia(35). Se sugieren efectos estimulantes de los ácidos grasos omega-6 y efectos inhibitorios de los ácidos grasos omega-3 en la carcinogénesis de próstata(35).
En cuanto a los lácteos, se confirma el nivel de evidencia previamente considerado como "sugestivo" para un mayor riesgo de cáncer de próstata asociado con la ingesta total de productos lácteos(8). Independientemente de su composición en carbohidratos y lípidos, la leche consumida en grandes cantidades aumenta los niveles sanguíneos de IGF-1, lo que se ha asociado con un mayor riesgo de cáncer de próstata. A pesar de ello, el nivel de evidencia continua siendo ‘no concluyente’ para la leche(8).
La obesidad tiene un efecto negativo para el cáncer de próstata(22,35). Aunque un IMC mayor o igual a 30 se asoció con una disminución de cánceres de bajo grado (Gleason <7), se observó un aumento del 29% del riesgo de adenocarcinomas de alto grado(35). Esta relación también se observó por la reducción del riesgo de cáncer de próstata de alto grado que tuvieron los hombres que perdieron >5kg durante 10 años seguimiento(35). Además, como ocurría en la mama, una ingesta a horas tardías del día se asoció con un aumento del riesgo de cáncer de próstata(31). La asociación de tumor de próstata con actividad física fue no concluyente(8). Se vieron mecanismos específicos para este cáncer que podría sugerir su efecto dañino, a saber, una producción reducida de testosterona, factor importante en la diferenciación del epitelio prostático(8).
Al contrario de lo que ocurría en CCR, los pacientes con DM tienen una menor incidencia de cáncer de próstata, aunque una vez diagnosticado tiene una mortalidad 4 veces mayor que la de un no DM con IMC <25(35).
No se respaldan los suplementos para la prevención primaria, es más, se observó que un aumento de 400g/d de calcio en la dieta se asoció positivamente con el cáncer de próstata(18). Los datos sobre vitamina D no fueron concluyentes(11). Las bebidas alcohólicas fueron no concluyentes(8).
El cáncer de próstata fue el más frecuentemente diagnosticado en una cohorte prospectiva en la que se valoraba el estilo de vida (tabaquismo, actividad física, consumo de alcohol) y marcadores de riesgo biológico (IMC, presión arterial, colesterol en suero) (36). En sus resultados se observó que el riesgo de dicho cáncer era significativamente menor en el grupo de bajo riesgo (OR 0.34 IC 95% 0’17 a 0’70 vs OR 0’78 IC 95% 0.48 a 1.28) lo que nos recuerda la importancia de una valoración de nuestro paciente en su conjunto para nuestras recomendaciones de prevención primaria(36). Otro grupo experimental sometido a una intervención de cambios en el estilo de vida también adquirió un beneficio frente a la carcinogénesis durante su seguimiento(27). Se observó un nivel de PSA que disminuyó un 4% en comparación con el grupo control el cual aumentó un 6%(27). Además, la sangre extraída demostró que el suero del grupo experimental inhibió el crecimiento de las células de cáncer de próstata casi 8 veces más intensamente que el suero del control(27).
Cáncer de pulmón
El cáncer de pulmón es el más diagnosticado en el mundo(1,5) y en España, a pesar de ello ocupa el quinto puesto en prevalencia puesto que se trata del tumor más mortífero del país(5). Su relación con el tabaco está ampliamente demostrada, aumentando hasta 10 veces el riesgo de padecer esta enfermedad(3), siendo su principal causa, responsable del 80-90% de los casos(1). No obstante, otras causas ambientales se han asociado con el aumento de su incidencia, como la exposición a radón o la contaminación atmosférica(1).
Tabla 3. Resultados de la búsqueda sobre cáncer de pulmón.
|
Nombre del estudio |
Tipo de estudio |
Población a estudio |
Medidas de prevención |
Principales resultados |
|
Suplementos dietéticos y riesgo de muerte por causa específica, cáncer(18) |
Revisión sistemática y metaanálisis |
Población general (edad media 59 años) |
Suplementos dietéticos |
La suplementación con β-caroteno se asoció con un aumento en la incidencia de cáncer entre los fumadores y trabajadores expuestos a asbesto. |
|
Asociación entre una puntuación dietética basada en plantas pro y el riesgo de cáncer (24) |
Cohorte prospectiva (2009-2016) |
Población > o = a 45 años |
Consumo de vegetales |
Una puntuación más alta en la dieta basada en plantas se asoció con una disminución de cáncer de pulmón (HR t3vs.t1 = 0.47; IC 95% 0.25, 0.90) |
|
Nutrición, factor epigenético regulador del cáncer(11) |
Revisión bibliográfica |
Población general |
Dieta |
Una dieta rica en frutas y verduras se asoció como factor protector. |
|
Bebidas alcohólicas, obesidad, actividad física y otros factores nutricionales y riesgo de cáncer: una revisión de la evidencia(8) |
Revisión sistemática |
Población general |
Alcohol, obesidad, AF, sal, carne, Bcaroteno, frutas y verduras, fibra, leche y lactancia materna |
Mayor riesgo: carne roja y suplementos de ßcaroteno en fumadores y sujetos expuestos al asbesto. Menor riesgo: AF, frutas y vegetales crucíferos. |
Existen pocos estudios que relacionen el cáncer de pulmón con la prevención primaria nutricional, por lo que muchas de las posibles asociaciones siguen estando hoy día en no concluyentes.
El consumo de vegetales y fruta obtuvo un efecto protector (11,8,24). En una cohorte prospectiva cuando se consumía en abundantes cantidades en comparación con el grupo que menos consumía, con una reducción de la incidencia de cáncer de pulmón (HR t3vs.t1 = 0.47; IC 95% 0.25, 0.90)(24).
Existe un aumento del riesgo de padecer la enfermedad en los consumidores de carne roja y procesada, con un nivel de evidencia ‘sugestivo’(8).
La actividad física obtuvo un efecto beneficioso para la disminución del riesgo, siendo aún mayor la disminución para los niveles más altos de actividad física en lugar de las personas que practicaban la actividad física en un nivel moderado(8).
En el cáncer de pulmón tampoco se respalda la suplementación dietética(18). Existe una fuerte evidencia a asociar un aumento de la incidencia y una aceleración de la progresión de cáncer de pulmón en pacientes fumadores y expuestos a asbesto con la suplementación de ß-caroteno(8,18) sobre todo cuando esta suplementación se hacía a dosis altas ≥20 mg(8,18).
Las asociaciones con el cáncer de pulmón que no obtuvieron una significación estadística y por lo tanto fueron no concluyentes fueron las bebidas alcohólicas, el sobrepeso, la fibra y los lácteos.
Cáncer de estómago
La SEOM estima que para el año 2020 habrá una incidencia de 7577 casos de cáncer gástrico (CG) en España(35). Es el noveno en términos de incidencia en España(5). No obstante, se trata de la cuarta causa de neoplasia más frecuente en el mundo y de la segunda causa de muerte de todas las neoplasias malignas en todo el mundo.(37).
Se han observado disminuciones
constantes en las tasas de incidencia de cáncer gástrico en todo el mundo en
las últimas décadas(37). Esta
disminución general de la incidencia de CG puede explicarse por estándares más
altos de higiene, una mejor conservación de los alimentos, un alto consumo de
frutas y verduras frescas y por la erradicación de Helicobacter
pylori (H. pylori)(37).
Tabla 4. Resultados de la búsqueda sobre cáncer de estómago.
|
Nombre del estudio |
Tipo de estudio |
Población a estudio |
Medidas de prevención |
Principales resultados |
|
Cáncer gástrico: epidemiología, prevención, clasificación y tratamiento(37) |
Revisión |
Población general |
Dieta, peso. |
Disminución de la incidencia con: Alta ingesta de frutas y verduras, dieta mediterránea, peso adecuado y clase social alta. Aumento de la incidencia: alcohol, tabaco, sal, carne roja y procesadas. |
|
Carga mundial de cáncer gástrico en 2010 y carga atribuible prevista para 2030(38)
|
Revisión sistemática y metaanalisis |
Población general |
Consumo de sal |
El consumo de sal >2g/día se asoció a un aumento de la incidencia. Se estima un aumento de consumo de sal para el año 2030, y por tanto un aumento del número de casos.
|
|
La posibilidad de marcadores de estilo de vida y riesgo biológico para predecir la morbilidad y mortalidad(36) |
Cohorte prospectiva |
Hombres entre 33 y 42 años |
Estilo de vida y marcadores de riesgo biológico |
Las formas más frecuentes fueron cáncer de próstata, piel y canal gastrointestinal con 33, 13 y 11 casos, respectivamente. |
|
Estrategias para la prevención de cánceres gastrointestinales en países en desarrollo: una revisión sistemática(39) |
Revisión sistemática |
Población en países en desarrollo |
Suplementos de vitaminas y minerales |
Los estudios sobre la suplementación con vitaminas y minerales (p. Ej., Vitaminas A, B, selenio, etc.) consideraron la reducción de la incidencia y mortalidad por cáncer gástrico. |
|
Bebidas alcohólicas, obesidad, actividad física y otros factores nutricionales y riesgo de cáncer (8) |
Revisión sistemática |
Población general |
Alcohol, obesidad, AF, sal, carne, ßcaroteno, frutas y verduras, fibra |
Aumentan la incidencia: sal, carne roja y procesada, obesidad, suplementos de Bcaroteno, Disminuyen la incidencia: frutas y verduras. No concluyentes: bebidas alcohólicas, fibra. |
El cáncer de estómago es otro de los tumores que se puede beneficiar de una dieta saludable como es la dieta mediterránea(37). Existe evidencia de una disminución de este con el incremento de verduras y frutas(8, 37), sobre todo verduras frescas de color verde oscuro, verde claro y amarillo ricas en betacaroteno, vitamina C, E y fólico(37). Por otro lado, se observó una disminución del riesgo de CG asociado con la ingesta de fibra en la dieta (insoluble y soluble de frutas, verduras o cereales) aunque el nivel de evidencia no llegó a la significación.
Un peso adecuado también posee beneficios potenciales en la reducción de su incidencia(8,37). No obstante, hay que distinguir entre cáncer gástrico proximal y distal, ya que solo en el proximal se obtuvo un nivel de evidencia adecuado para afirmar su asociación con la obesidad.
Por otro lado, las bebidas alcohólicas se asociaron a un aumento del riesgo de padecer esta patología(37) en una revisión, aunque también se aportaron datos de su evidencia ‘no concluyente’ en otra(8).
La carne roja y procesada, como en otros tumores, tiene una relación estrecha con el riesgo(8,37).
Aunque en una revisión los estudios sobre la suplementación con vitaminas y minerales (p. Ej., Vitaminas A, B, selenio, etc.) consideraron la reducción de la incidencia y mortalidad por cáncer gástrico, estos datos no parecen ser extrapolables a países desarrollados(39).
Un pilar fundamental en el cáncer de estómago en lo que respecta a la prevención primaria es la concienciación de su asociación con el consumo de sal (37,38). A pesar de su relación con la incidencia de cáncer gástrico, se estima un aumento de la mediana de su consumo para la mayoría de los países(38). Debido a que las altas ingestas de sal (>2g/d) representa una gran proporción de los casos de este tumor y a su estimado aumento de consumo, se espera por tanto un aumento en su incidencia en los próximos años(38). Esta asociación se refuerza al obtener como resultado una estabilidad en la estimación del cáncer de estomago para 2030 en los territorios donde poseen una ingesta de sal cercana a la recomendada(38).
Discusión
Una vez analizados los resultados, parece clara la necesidad de hacer recomendaciones a la población sobre modificaciones en el estilo de vida e intentar de este modo aumentar la concienciación social sobre los efectos que tiene lo que comemos en nuestra salud. El lugar óptimo para realizar esta intervención es la atención primaria, ya que es aquí donde se dispone de un mayor contacto con los pacientes.
Por tanto, a nivel general, parece ser que ciertos alimentos como los vegetales y granos integrales, poseen un efecto protector. Por otro lado, las grasas animales, saturadas y carnes rojas y procesadas parecen aportar considerables cancerígenos. Aunque especulativo en este punto ya que no hay acuerdo en la evidencia, según los resultados de esta revisión, parece que la mayoría de la evidencia apunta a que la fibra sí puede jugar un papel protector en el cáncer debido a múltiples mecanismos. Además, parece razonable aconsejas a la población que su aporte de grasas diarias sea de frutos secos, semillas y aceites vegetales.
No obstante, no consumimos alimentos aislados, sino que en cada comida ingerimos diferentes tipos de alimentos. Estos alimentos pueden interactuar entre ellos, por lo que es necesario analizar no solo cada componente individualmente, sino una acción conjunta en el organismo(1,40).
A nivel de la dieta, existen varios tipos, la dieta occidental parece tener una relación con la incidencia de neoplasias. En cambio, la dieta mediterránea, asiática o vegana/pescovegetariana parecen demostrar mayores beneficios.
La adherencia a la dieta occidental se asoció directamente con la incidencia general de diversos cánceres, como el CCR, mientras que las dietas vegetarianas/pescovegetarianas se asociaron a un efecto protector(26).
En nuestro país sería adecuado recomendar la dieta mediterránea, ya que tiene una fácil adherencia y es la que dispone de una mayor evidencia científica. Se trata de una dieta basada en plantas que usa verduras, frutas, cereales y legumbres, con un uso moderado de pescado, mariscos o lácteos, e ingesta limitada de carne y alcohol (principalmente vino tinto)(40,41). Además, la carne y los dulces procesados son casi inexistentes. Está reconocida por la comunidad científica como una potente herramienta contra ECV, DM tipo 2, obesidad o el cáncer(12,32,40,41). Esto supone un aporte reducido de ácidos grasos saturados y grasas trans (8% diario)(40), siendo el aceite de oliva su principal fuente de grasas. La dieta mediterránea supone uno de los ejemplos de sinergia alimentaria, donde los efectos de sus componentes son más beneficiosos que ellos mismos por separado(1,40). Entre las consecuencias de seguir una dieta mediterránea están los efectos antiinflamatorios, antioxidantes, reducción de lípidos, modulación de hormonas y otras vías involucradas en el desarrollo del cáncer, reducción del estrés oxidativo y protección de la microflora (12,40). Además, posee altos aportes de polifenoles y fitoquímicos, aportados por alimentos como el aceite de oliva, las verduras o los frutos secos, los cuales evitan la oxidación de los AG insaturados(40). Los flavonoides, compuestos polifenólicos más consumidos(42), disminuyen la inflamación, eliminan radicales libres y mejoran la función endotelial(43). Asimismo, el alto aporte de fibra vegetal produce una disminución de la resistencia a la insulina, disminución de la absorción de colesterol entre otros mecanismos que se suman a su efecto protector(40). Adicionalmente, los derivados fenólicos como tirosol, encontrados en el aceite de oliva, parecen influir en el ciclo celular(40). Además, el aporte de los carotenoides parecen tener beneficios en tumores no comentados como el melanoma(44). Su consumo óptimo aumenta las defensas dérmicas contras los rayos UV y una mayor protección a largo plazo(44).
Es importante entender un alimentos como tal y no como un conjunto de componentes(41). Un ejemplo de esto sería el beneficio de frutas y verduras que no se pudo obtener aportando mediante suplementos de dichos componentes o fibra equivalente en ensayos clínicos aleatorizados(41). Esto puede explicarse por la interacción de los distintos componentes, su biodisponibilidad cuando se altera el formato de consumo o su reemplazo por alimentos menos beneficiosos cuando consumes los suplementos(41).
En la dieta asiática poseen una costumbre cultural como es la toma de té e infusiones. Estas bebidas se han relacionado con un efecto beneficioso para la salud como ECV, DM2 o ciertos cánceres(45). En una revisión se describió una asociación con la reducción de riesgo de tumores como CCR, mama, ovario o próstata. Además, el té es una bebida hipocalórica, cuyo beneficio va más allá de su toma, ya que, al consumir este producto, evitas la consumición indirecta de otros como bebidas azucaradas o alcohólicas. Por tanto, de esa forma se le podría añadir un efecto positivo indirecto(45). Por otro lado, su dieta obtiene el aporte de proteínas del pescado y de la soja, con efectos beneficiosos para la salud, y por tanto, se trata de una dieta con bajo aporte de carne.
La dieta vegetariana se caracteriza por un abundante consumo de vegetales, frutas y legumbres, característica esencial de la alta calidad de la dieta, relacionados con la modulación de la carcinogénesis(24,43). Las frutas son la principal fuente de flavonoides en España(43), siendo el té es otra fuente principal en las dietas occidentales(42) . Dichos flavonoides se han relacionado con una disminución del riesgo de enfermedades crónicas y mortalidad(24,43). En una cohorte se observó una disminución de la reducción de riesgo general de cáncer en un 15% en las dietas donde incluían más vegetales(24). Las dietas flexivegetarianas y pescovegetarianas también se relacionaron con una disminución del riesgo(24). Por ello, se trata de una dieta antiinflamatoria y anticancerígena, al igual que la dieta mediterránea. Uno de sus beneficios es el cese del aporte de cancerígenos como los productos nitrosos de origen animal(8,24). Se describen mecanismos por los que los flexivegetarianos obtendrían beneficios al consumirlos vegetales, como por ejemplo el freno de la peroxidación lipídica o productos nitrosos gracias a los antioxidantes(24). Además, estas dietas suelen ir ligadas a una reducción del aporte calórico, fomentando el normopeso. La restricción calórica es el principal factor ambiental capaz de influir en la longevidad en modelos experimentales no humanos(12). Una reducción del 20-40% se asoció con una modulación de vías relacionadas con la longevidad, como la sirtuina o rapamicina, con menor daño oxidativo y modulación de funciones energéticas. En humanos todavía no se ha implementado, aunque sí se ha demostrado los beneficios en el estrés oxidativo y la sensibilidad a la insulina del ayuno intermitente(12).
Aunque con los datos que tenemos hoy día no podríamos decantarnos entre unas u otras, parece que la dieta que se consuma debe de respaldarse por una mayor ingesta de productos vegetales junto con una disminución de los productos animales.
Matizar que una adherencia a una dieta equilibrada, junto con actividad física fomentará el normopeso y evitemos el impacto de la obesidad, reconocida como factor de riesgo para padecer cáncer, atribuyéndose a esta patología más de 450000 casos de cánceres anuales(5), incluidos mama, colon y recto.
Esta revisión posee ciertas limitaciones que deben tenerse en cuenta. Como motivo de obtener los datos más actualizados sobre la materia, se seleccionó un periodo de 5 años, por lo que artículos probablemente relevantes no quedaran incluidos. No obstante, en los resultados se obtuvieron numerosos metaanálisis y revisiones sistemáticas que abarcaban periodos posteriores a esta revisión, por lo que la evidencia más sólida posiblemente quedara recogida. De igual modo, los idiomas seleccionados fueron inglés y español, por tanto, no abarcando la evidencia publicada en otro idioma. Otra limitación pudo ser el criterio de inclusión de pertenecer a la Unión Europea, teniendo también sus ventajas. Por un lado, esto excluye evidencias científicas obtenidas o publicadas en otro lugar del mundo, pudiendo perderse información valiosa para esta búsqueda sistemática, pero, por otro lado, obtenemos unos datos que discrepan lo menos posible en cuando a criterios de valoración y aumenta la extrapolación de estos resultados a nuestra población. Además, esta revisión ofrece un estudio descriptivo de los estudios, por lo que la realización de un metaanálisis hubiera aportado una evidencia más sólida. Por último, como en cualquier revisión, no fue posible controlar el sesgo de publicación, por lo que no podemos descartar su presencia y en caso de existir, que este haya sobreestimado los efectos preventivos a estudio. Como ventajas, gracias a la selección de artículos con libre acceso, evitamos la limitación de interpretabilidad de resultados. Por otro lado, nuestros datos no contradicen los proporcionados por organismos de referencia como la OMS o el código de cáncer europeo, proporcionando de esta forma coherencia a la revisión. Además, los resultados parecen contar con una plausibilidad biológica, ya que muchos de estos fueron acompañados con su explicación fisiopatológica. Por otro lado, además de revisiones y metaanálisis, nuestra búsqueda también incluyó ensayos de animales y humanos, otorgándoles evidencia experimental.
Las medidas de prevención primaria son prioritarias y urgentes para frenar el crecimiento del cáncer en los países desarrollados. La adherencia a dietas como la mediterránea o la vegana pueden ser buenas opciones por sus resultados en la disminución de la carcinogénesis. Sea cual sea la dieta, esta debe contener abundantes vegetales y frutas, a ser posibles frescas, legumbres y granos integrales, frutos secos, semillas, y con una reducción del aporte de calorías basadas en carne roja, alimentos y bebidas con azúcar añadido, y a ser posible eliminando las carnes procesadas, el alcohol y los alimentos procesados.
Referencias
1. SVATEZT G. NUTRICIÓN Y CÁNCER. Lo que la ciencia nos enseña. Edición: 1. Madrid: Editorial Médica Panamericana S.A.; 2015.
2. Marzo-Castillejo M, Vela-Vallespín C, Bellas-Beceiro B, et al. Recomendaciones de prevención del cáncer. Actualización PAPPS 2018. Aten Primaria 2018;50:41–65.
3. Jameson JL, Fauci A, Kasper D, Hauser S, Longo D, Loscalzo J. HARRISON PRINCIPIOS DE MEDICINA INTERNA VOLS 1 Y 2. Edición: 20. McGraw-Hill Interamericana de España S.L.; 2019.
4. López PJT, Montes JAR, Albero JS, Marcos AT. El Cáncer en datos: ¿Se aplican las medidas de prevención para el Cáncer Colorrectal? J Negat No Posit Results JONNPR 2017;2(10):537–59.
5. Cifras del cáncer en España | SEOM - Día Mundial del Cáncer 2020 [Internet]. SEOM Día Mund. Cáncer 2020. [cited 2020 Apr 8];Available from: https://seom.org/dmcancer/cifras-del-cancer/
6. OMS | Cáncer [Internet]. WHO. [cited 2020 Apr 8];Available from: http://www.who.int/cancer/es/
7. Global Cancer Observatory [Internet]. [cited 2020 May 4];Available from: https://gco.iarc.fr/
8. Latino-Martel P, Cottet V, Druesne-Pecollo N, et al. Alcoholic beverages, obesity, physical activity and other nutritional factors, and cancer risk: A review of the evidence. Crit Rev Oncol Hematol 2016;99:308–23.
9. Prevención del cáncer - SEOM: Sociedad Española de Oncología Médica © 2019 [Internet]. [cited 2020 Apr 8];Available from: https://seom.org/informacion-sobre-el-cancer/prevencion-cancer?start=1
10. Mocanu M-M, Nagy P, Szöllősi J. Chemoprevention of Breast Cancer by Dietary Polyphenols. Molecules 2015;20(12):22578–620.
11. Hernando-Requejo O, Garcia de Quinto H, Rubio Rodriguez MC. Nutrition as an epigenetic factor in develops of cancer. Nutr Hosp 2019;36:53–7.
12. Badimon L, Vilahur G, Padro T. Systems biology approaches to understand the effects of nutrition and promote health. Br J Clin Pharmacol 2017;83(1):38–45.
13. Córdoba García R, Camarelles Guillem F, Muñoz Seco E, et al. Recomendaciones sobre el estilo de vida. Actualizacón PAPPS 2018. Aten Primaria 2018;50:29–40.
14. About our Cancer Prevention Recommendations [Internet]. World Cancer Res. Fund. 2018 [cited 2020 May 5];Available from: https://www.wcrf.org/dietandcancer/recommendations-about
15. ACTUALIZACION EN GASTROENTEROLOGIA Y HEPATOLOGIA [Internet]. [cited 2020 May 27];Available from: https://www.popularlibros.com/libro/actualizacion-en-gastroenterologia-y-hepatologia_960014
16. Diet and Cancer [Internet]. World Cancer Res. Fund. 2018 [cited 2020 May 27];Available from: https://www.wcrf.org/dietandcancer
17. Reynolds A, Mann J, Cummings J, Winter N, Mete E, Te Morenga L. Carbohydrate quality and human health: a series of systematic reviews and meta-analyses. The Lancet 2019;393(10170):434–45.
18. Schwingshackl L, Boeing H, Stelmach-Mardas M, et al. Dietary Supplements and Risk of Cause-Specific Death, Cardiovascular Disease, and Cancer: A Systematic Review and Meta-Analysis of Primary Prevention Trials. Adv Nutr 2017;8(1):27–39.
19. Bullo M, Juanola-Falgarona M, Hernandez-Alonso P, Salas-Salvado J. Nutrition attributes and health effects of pistachio nuts. Br J Nutr 2015;113:S79–93.
20. Lang M, Gasche C. Chemoprevention of Colorectal Cancer. Dig Dis 2015;33(1):58–67.
21. Schoenberg MH. Physical Activity and Nutrition in Primary and Tertiary Prevention of Colorectal Cancer. Visc Med 2016;32(3):199–204.
22. Aguirre-Portoles C, Fernandez LP, Ramirez de Molina A. Precision Nutrition for Targeting Lipid Metabolism in Colorectal Cancer. Nutrients 2017;9(10):1076.
23. Minisola S, Ferrone F, Danese V, et al. Controversies Surrounding Vitamin D: Focus on Supplementation and Cancer. Int J Environ Res Public Health 2019;16(2):189.
24. Kane‐Diallo A, Srour B, Sellem L, et al. Association between a pro plant-based dietary score and cancer risk in the prospective NutriNet-santé cohort. Int J Cancer 2018;143(9):2168–76.
25. Gianfredi V, Nucci D, Salvatori T, et al. Rectal Cancer: 20% Risk Reduction Thanks to Dietary Fibre Intake. Systematic Review and Meta-Analysis. Nutrients 2019;11(7):1579.
26. Conti L, Del Cornò M, Gessani S. Revisiting the impact of lifestyle on colorectal cancer risk in a gender perspective. Crit Rev Oncol Hematol 2020;145:102834.
27. Bodai BI, Nakata TE, Wong WT, et al. Lifestyle Medicine: A Brief Review of Its Dramatic Impact on Health and Survival. Perm J 2018;22:17–025.
28. Komal K, Chaudhary S, Yadav P, Parmanik R, Singh M. The Therapeutic and Preventive Efficacy of Curcumin and Its Derivatives in Esophageal Cancer. Asian Pac J Cancer Prev APJCP 2019;20(5):1329–37.
29. Kolak A, Kaminska M, Sygit K, et al. Primary and secondary prevention of breast cancer. Ann Agric Environ Med 2017;24(4):549–53.
30. Hansen MF, Jensen SO, Fuchtbauer E-M, Martensen PM. High folic acid diet enhances tumour growth in PyMT-induced breast cancer. Br J Cancer 2017;116(6):752–61.
31. Srour B, Plancoulaine S, Andreeva VA, et al. Circadian nutritional behaviours and cancer risk: New insights from the NutriNet-santé prospective cohort study: Disclaimers. Int J Cancer 2018;143(10):2369–79.
32. Kiechle M, Dukatz R, Yahiaoui-Doktor M, et al. Feasibility of structured endurance training and Mediterranean diet in BRCA1 and BRCA2 mutation carriers - an interventional randomized controlled multicenter trial (LIBRE-1). Bmc Cancer 2017;17:752.
33. Morad V, Abrahamsson A, Kjölhede P, Dabrosin C. Adipokines and Vascular Endothelial Growth Factor in Normal Human Breast Tissue in Vivo – Correlations and Attenuation by Dietary Flaxseed. J Mammary Gland Biol Neoplasia 2016;21(1):69–76.
34. Dydjow-Bendek D, Zagozdzon P. Total Dietary Fats, Fatty Acids, and Omega-3/Omega-6 Ratio as Risk Factors of Breast Cancer in the Polish Population - a Case-Control Study. In Vivo 2020;34(1):423–31.
35. Golabek T, Powroznik J, Chlosta P, Dobruch J, Borowka A. The impact of nutrition in urogenital cancers. Arch Med Sci 2015;11(2):411–8.
36. Persson L-G, Lingfors H, Nilsson M, Molstad S. The possibility of lifestyle and biological risk markers to predict morbidity and mortality in a cohort of young men after 26 years follow-up. Bmj Open 2015;5(5):e006798.
37. Sitarz R, Skierucha M, Mielko J, Offerhaus GJA, Maciejewski R, Polkowski WP. Gastric cancer: epidemiology, prevention, classification, and treatment. Cancer Manag Res 2018;10:239–48.
38. Peleteiro B, Barros S, Castro C, Ferro A, Morais S, Lunet N. Worldwide burden of gastric cancer in 2010 attributable to high sodium intake in 1990 and predicted attributable burden for 2030 based on exposures in 2010. Br J Nutr 2016;116(4):728–33.
39. Shams AZ, Haug U. Strategies for prevention of gastrointestinal cancers in developing countries: a systematic review. J Glob Health 2017;7(2):020405.
40. Lăcătușu C-M, Grigorescu E-D, Floria M, Onofriescu A, Mihai B-M. The Mediterranean Diet: From an Environment-Driven Food Culture to an Emerging Medical Prescription. Int J Environ Res Public Health 2019;16(6):942.
41. Sofi F, Dinu MR. Nutrition and prevention of chronic-degenerative diseases. In: Menghini S, Pfoestl E, Marinelli A, editors. Florence “Sustainability of Well-Being International Forum”, 2015: Food for Sustainability and Not Just Food, Florenceswif2015. Amsterdam: Elsevier Science Bv; 2016. p. 713–7.
42. Julia C, Touvier M, Lassale C, et al. Cluster analysis of polyphenol intake in a French middle-aged population (aged 35-64 years). J Nutr Sci 2016;5:UNSP e28.
43. Ahmed Bawaked R, Schroder H, Ribas Barba L, et al. Dietary flavonoids of Spanish youth: intakes, sources, and association with the Mediterranean diet. Peerj 2017;5:UNSP e3304.
44. Balić A, Mokos M. Do We Utilize Our Knowledge of the Skin Protective Effects of Carotenoids Enough? Antioxidants 2019;8(8):259.
45. Habs M, Binder K, Krauss S, et al. A Balanced Risk-Benefit Analysis to Determine Human Risks Associated with Pyrrolizidine Alkaloids (PA)-The Case of Tea and Herbal Infusions. Nutrients 2017;9(7):717.
