REVISIÓN
Efecto de los probióticos como tratamiento alternativo para la mastitis humana
Effect of probiotics as an alternative treatment for human mastitis
María José Aguilar-Cordero1, Ximena Alejandra Leon-Rios1, Alvaro Luque-Ortega2, Iñigo Perez-Castillo1, Tania Rivero-Blanco1, Norma Mur-Villar3
1 Facultad de Ciencias de la Salud, Universidad de Granada, España. Grupo de Investigación CTS 367. Plan Andaluz de Investigación. Junta de Andalucía. España.
2 Facultad de Ciencias de la Salud, Universidad de Granada, España
3 Facultad de Ciencias Médicas de Cienfuegos. Cuba. Grupo de Investigación CTS 367. Plan Andaluz de Investigación. Junta de Andalucía. España.
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Resumen
El objetivo de este estudio es determinar el efecto del uso de los probióticos en relación a la mastitis, así como conocer la dosis adecuada de los probióticos y la semana ideal de gestación para que surja el efecto deseado. Para ello se ha realizado una revisión sistemática, con una cadena de búsqueda y unos filtros de acuerdo a cada una de las distintas bases. También, se realizó una búsqueda inversa a raíz de los resultados obtenidos. Se han aplicado criterios de inclusión y exclusión en la selección de los artículos. En cuanto a los resultados y según la evidencia actual se puede decir que el uso de probióticos como tratamiento alternativo a la mastitis humana podría resultar eficaz ya que existe diferencia estadísticamente significativa en la reducción de la carga bacteriana. En lo referente a la dosis y semana ideal de gestación para la administración de probióticos, se ha podido comprobar distintas dosis y semanas que han surtido efecto; pero sin poder concretar cuáles son las más efectivas e ideales.
Palabras clave
Mastitis; probióticos; lactancia materna; estafilococos; leche humana; respuesta inmune
Abstract
The aim of this study is to determine the effect of the use of probiotics in relation to mastitis, as well as to know the adequate dose of probiotic and the ideal week of gestation so that the desired effect appears. For this, a systematic review has been carried out, with a search string and filters according to each of the different bases. Also, an inverse search was performed to the root of the results obtained. Inclusion and exclusion criteria have been applied in the selection of articles. Regarding the results and according to current evidence, it can be said that the use of probiotics as an alternative treatment to human mastitis could be effective since there is a statistically significant difference in the reduction of bacterial load. Regarding the dose and the ideal week of gestation for the administration of probiotics, different doses and weeks have been determined that have taken effect; but without being able to specify problems they are the most effective and ideal.
Keywords
Mastitis; probiotics; breastfeeding; Staphylococcus; human milk; immune response
Introducción
La OMS define la mastitis como una afección inflamatoria de la glándula mamaria cuyas dos causas principales son la estasis de la leche y la infección, siendo esta primera normalmente la causa principal, pudiendo estar o no seguido o progresando en una infección(1,2)
La mastitis, normalmente ligada a la lactancia, es una inflamación de cualquier parte de la glándula mamaria, incluyendo, además de tejido intramamario, las areolas mamarias y los pezones, frecuentemente originada por bacterias(3,4).
Esta patología puede estar determinada por una disbiosis bacteriana de la mama, en la cual se produce un aumento de los agentes de la microbiota mamaria normal, realizando así un cambio en el equilibrio de la microbiota, pudiendo llegar a ser algo perjudicial en la salud del huésped, provocando así el incremento de la susceptibilidad a enfermedades infecciosas, inflamatorias y alérgicas(5,6).
La mastitis es considerada una enfermedad de origen multifactorial causada por una diversidad de diferentes patógenos, donde el estafilococo es el agente etiológico más frecuente, y más concretamente, el Staphylococcus aureus es el más común(7,8,9).
Además, la mastitis y el dolor que conlleva este proceso, son la principal causa del destete no deseado y por consiguiente el cese de la lactancia(8,9).
En cuanto a la incidencia establecida en la mastitis existe una variación entre el 2 y el 33% pudiendo estar o no ligada a infección(5,6), con tasas de incidencia en torno al 20% en países desarrollados pero con una gran variabilidad entre los diferentes estudios(8). Casi todos los episodios de mastitis suelen ocurrir entre las primeras 6-8 semanas tras el parto, aunque pueden llegar a ocurrir en cualquier momento durante toda la lactancia(10,11,12). Además casi un tercio de las mujeres llegan a padecer un episodio recurrente, sufriendo un 3% el desarrollo de un absceso mamario con su consecuente periodo de hospitalización(3).
Los factores de riesgo a la hora de desarrollar mastitis son la edad, donde se encuentran madres menores de 21 años y mayores de 35 años, pezones agrietados o doloridos, estasis de la leche, mastitis de un niño anterior, fatiga materna, aplicación de ungüentos, prácticas incorrectas de la lactancia, extractores de leche manuales y antibioterapia periparto(13,14).
La mastitis se puede clasificar en distintas categorías según su curso (agudo, subagudo y granulomatoso) o manifestaciones clínicas (clínicas o subclínicas)(15).
La mastitis aguda se determina por enrojecimiento de las mamas, dolor, fiebre y malestar. A causa de la intensidad que originan estos síntomas, suele ser el único tipo de mastitis diagnosticado con precisión(15,16).
La mastitis subaguda se caracteriza por unos síntomas más sutiles que agudos, lo que conlleva una baja tasa en el diagnóstico debido a diagnósticos erróneos o falta de comprensión por parte de las mujeres que sufren estos síntomas. Una vez existe un diagnóstico oficial, los síntomas son dolor agudo y punzante con sensación de ardor en la mama(17,18).
La mastitis granulomatosa idiopática (IGM) se presenta como un bulto o masa dolorosa y sensible en el seno, siendo relativamente rara su existencia. La presencia de una masa o bulto y los síntomas secundarios de IGM como grosor de la piel, retracción del pezón y formación de abscesos, normalmente conllevan un diagnóstico erróneo de neoplasia mamaria. La IGM se origina predominantemente en mujeres con edad reproductiva, en un tiempo aproximado de 2-6 años tras un embarazo, aunque también existen casos en niñas prepubescentes o en mujeres de edad avanzada y en hombres(15).
Para tratar la infección que se produce en la mastitis, generalmente se usan antibióticos como tratamiento convencional, aunque ahora se ha establecido que generan varios problemas críticos, ya que cuando se usan en ausencia de indicaciones claras en vez de producir el beneficio deseado lo que se puede llegar a causar son daños, como es la creación de resistencia a los antibióticos por parte de las bacterias que residen en las glándulas mamarias y el desarrollo de trastornos gastrointestinales en el huésped(18,19).
Se ha documentado que existe un 25% de madres que interrumpen la lactancia materna a causa de la mastitis habiendo ya recibido antibioterapia como la cloxacilina, amoxicilina-ácido clavulánico, clindamicina y/o eritromicina durante 2-4 semanas sin tener mucho éxito(15,17).
El uso de antibióticos conlleva una pérdida de lactobacilos y bifidobacterias en la leche materna, lo que puede acarrear consecuencias para la salud de las mamas al favorecer el crecimiento excesivo de los agentes que producen la mastitis(7).
Como la resistencia a los antibióticos causa un gran desafío para el éxito de esta terapia, existe la necesidad de crear estrategias para poder reemplazar los antibióticos mediante terapias alternativas que se basen en la restauración de la microbiota mamaria, como el uso de distintas cepas de probióticos que pueden proporcionar una solución viable para la infección de la mastitis(17).
Se piensa que la administración oral de probióticos en mujeres mientras se encuentra en el período postnatal temprano para regular la composición de la microbiota de la glándula mamaria y así reducir el riesgo de infección y enfermedad. Los probioicos tienen unas propiedades antiinflamatorias representativas siendo comparables a las de un agente farmacéutico terapéutico apoyándolos así como agentes inmunomoduladores(3).
La presencia de diferentes cepas de lactobacilos en la leche humana de mujeres con mastitis tras la ingesta oral de probióticos y la respuesta antiinflamatoria junto con la disminución significativa en el recuento de bacterias en la leche y la mejoría de los síntomas característicos que se ha observado en estas mujeres avalan el efecto probiótico para estos lactobacilos(8).
La evidencia hasta ahora sugiere que los probióticos pueden ofrecer una medida eficaz y alternativa al tratamiento convencional con antibióticos en la mastitis y que, además, los estudios realizados no han informado de ningún efecto secundario de importancia ni para la madre ni para el bebé. Sin embargo, la evidencia es limitada y esto genera la necesidad de realizar investigaciones más exhaustivas sobre el uso de probióticos orales para prevenir la mastitis(3).
Para ello, hemos planteado la siguiente pregunta de investigación: ¿Es eficaz el uso de probióticos como tratamiento alternativo a los antibióticos para la mastitis en mujeres embarazadas?
Metodología
Se ha realizado una revisión sistemática según el modelo PRISMA(20) sobre los probióticos como alternativa de tratamiento para la mastitis en mujeres embarazadas para comprobar su efecto.
La revisión se ha realizado en las bases de datos bibliográficas más relevantes de ciencias de la salud, siendo estas las mencionadas a continuación: Web of Science, Scopus y Cochrane.
Criterios de búsqueda
La búsqueda bibliográfica se ha elaborado desde mediados de noviembre de 2018 hasta mediados de octubre de 2019. Para ello se han utilizado las siguientes cadenas de búsqueda y filtros correspondientes en cada base de datos, reflejados a continuación (Tabla 1):
Tabla 1. Resumen búsqueda bibliográfica (bases de datos, cadenas de búsqueda, filtros y periodo).
|
Bases de datos |
Cadena de búsqueda |
Filtros |
Periodo |
|
WEB OF SCIENCE |
(mastitis AND probiotic*) (breastfeed AND probiotic*) |
Tema principal |
2013-2019 |
|
|
|
|
|
|
COCHRANE |
(mastitis AND probiotic) |
|
2013-2019 |
|
SCOPUS |
TITLE-ABS-KEY ( mastitis AND probiotic* ) |
Título, resumen y palabras clave |
2013-2019 |
Fuente: Elaboración propia.
También se ha desarrollado una búsqueda inversa, tras analizar los resultados obtenidos, durante el mes de octubre de 2019 mediante los artículos seleccionados.
Criterios de inclusión y exclusión
Los criterios de inclusión empleados para seleccionar los distintos estudios de esta revisión han sido:
- C1: Artículos originales (ensayos clínicos o estudios observacionales) que relacionen el efecto, la dosis y/o la semana de gestación para los probióticos sobre el tratamiento de la mastitis humana.
- C2: Estudios realizados en humanos.
- C3: Artículos publicados en inglés o castellano.
En cuanto a los criterios de exclusión:
- Ci: Literatura gris (cartas al director, tesis, congresos, conferencias u otros).
Criterios de calidad metodológica
Ha sido evaluada la calidad metodológica de cada uno de los artículos seleccionados, mediante la herramienta de lectura crítica Critical Appraisal Skill Programme (CASPe) en su versión castellana(21), para cada tipo de estudio, incluyéndose los que obtuvieron una puntuación de 5 o más en un total de 11 preguntas para los ensayos clínicos. La puntuación de cada uno de los artículos se encuentra en el anexo I.
Además, se ha medido el factor de impacto de los artículos seleccionados según los cuartiles publicados en la Journal Citation Reports(22), incluyéndose los estudios que se encontraban entre el Q1-Q3.
Resultados
Con las cadenas de búsqueda determinadas en la metodología se ha desarrollado la búsqueda lográndose los resultados reflejados de modo sintético en el siguiente diagrama de flujo (Figura 1) y cuya ampliación se encuentra en ANEXOS
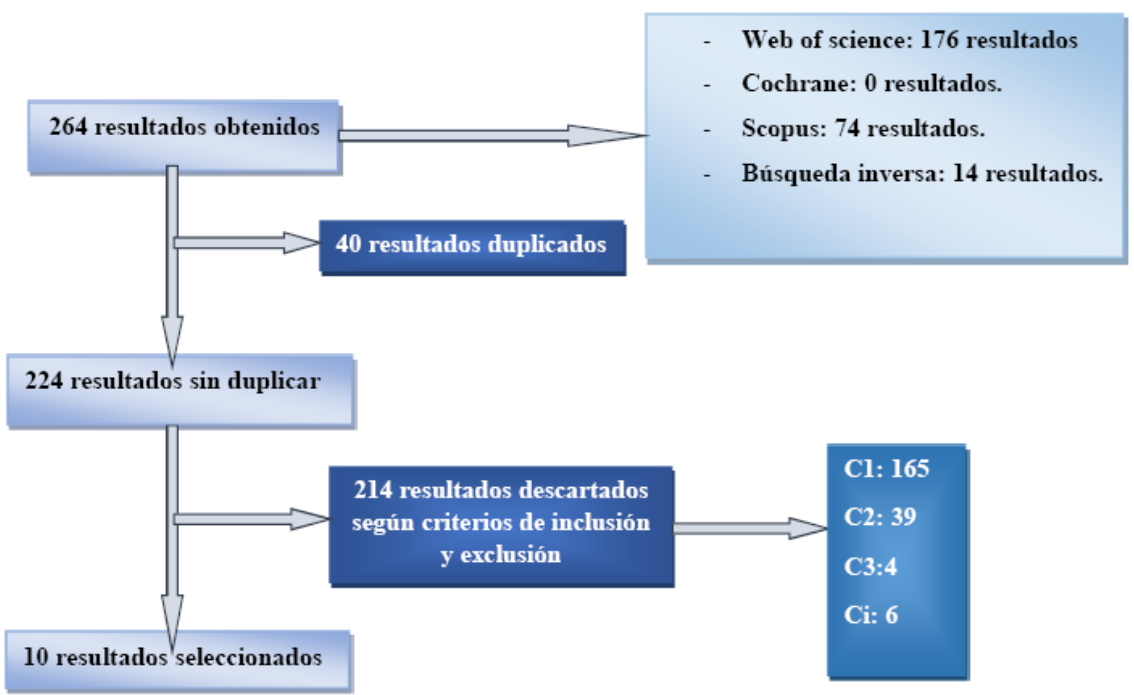 Fuente:
Elaboración propia.
Fuente:
Elaboración propia.
Figura 1. Diagrama de flujo
Se han obtenido finalmente 10 estudios, de los que se han recogido datos con relación a la eficacia de probióticos en mastitis humana, en cuanto a la dosis de probiótico adecuada y en relación a la semana ideal de gestación para administración de probióticos.
Los estudios seleccionados abarcan una serie de países englobando gran parte de los continentes, exceptuando el continente americano y asiático. Los estudios encontrados en Europa, siendo estos la mayoría, engloban países como España, casi en su totalidad, Italia y Noruega, respecto al continente africano cabe destacar Irán y, por último, de Oceanía se encuentra un estudio realizado en Australia.
En cuanto al tamaño de la muestra de los distintos estudios se abarca un rango que comprende desde 23 pacientes para un estudio con el menor tamaño de muestra, hasta 57.134 pacientes en el estudio de mayor muestra publicado, y 600 pacientes en el estudio piloto que todavía está por desarrollar, con una media de 90 pacientes aproximadamente en los estudios publicados y una media de 147 pacientes aproximadamente si contamos el estudio piloto. (Tabla 2)
Tabla 2. Características principales de los estudios seleccionados.
|
Autor y año |
Título |
Tipo de estudio |
País/ ciudad |
Resultados valorados |
|
Vázquez-Fresno, R et al. 2014(6) |
Urinary metabolomic fingerprinting after consumption of a probiotic strain in women with mastitis. |
Ensayo clínico. |
España. |
- Eficacia de probióticos en mastitis humana. - Dosis de probiótico adecuada. |
|
Maldonado-Lobón, JA et al. 2015(23) |
Lactobacillus fermentum CECT 5716 Reduces Staphylococcus Load in the Breastmilk of Lactating Mothers Suffering Breast Pain: A Randomized Controlled Trial |
Estudio controlado aleatorio doble ciego con cuatro grupos de estudio. |
España/ Granada. |
- Eficacia de probióticos en mastitis humana. - Dosis de probiótico adecuada. |
|
Mastromarino, P et al. 2015(24) |
Administration of a multistrain probiotic product (VSL#3) to women in the perinatal period differentially affects breast milk beneficial microbiota in relation to mode of delivery. |
Ensayo aleatorizado, doble ciego, controlado con placebo. |
Italia/ Bari. |
- Eficacia de probióticos en mastitis humana. - Semana ideal de gestación para administración de probióticos. |
|
Fernández, L et al. 2016(25) |
Prevention of Infectious Mastitis by Oral Administration of Lactobacillus salivarius PS2 During Late Pregnancy. |
Ensayo aleatorizado, controlado con placebo, doble ciego. |
España/ Madrid. |
- Eficacia de probióticos en mastitis humana. - Dosis de probiótico adecuada. - Semana ideal de gestación para administración de probióticos. |
|
Espinosa-Martos, I et al. 2016(10) |
Milk and blood biomarkers associated to the clinical efficacy of a probiotic for the treatment of infectious mastitis. |
Ensayo clínico. |
España/ Madrid. |
- Eficacia de probióticos en mastitis humana. - Dosis de probiótico adecuada. |
|
Jamilian, M et al. 2016(26) |
Effects of Probiotic Supplementation on Metabolic Status in Pregnant Women: a Randomized, Double-blind, Placebo-Controlled Trial. |
Ensayo clínico aleatorizado, doble ciego, controlado con placebo. |
Irán. |
- Eficacia de probióticos en mastitis humana. - Dosis de probiótico adecuada. - Semana ideal de gestación para administración de probióticos. |
|
Bond, DM et al. 2017(27) |
Study protocol: evaluation of the probiotic Lactobacillus Fermentum CECT5716 for the prevention of mastitis in breastfeeding women: a randomised controlled trial. |
Ensayo controlado aleatorio, doble ciego: protocolo de estudio. |
Australia. |
- Eficacia de probióticos en mastitis humana. - Dosis de probiótico adecuada. |
|
Hurtado, JA et al. 2017(28) |
Oral Administration to Nursing Women of Lactobacillus fermentum CECT5716 Prevents Lactational Mastitis Development: A Randomized Controlled Trial |
Ensayo controlado aleatorizado doble ciego. |
España/ Granada. |
- Eficacia de probióticos en mastitis humana. - Dosis de probiótico adecuada. |
|
De Andrés, J et al. 2018(29) |
An Exploratory Search for Potential Molecular Targets Responsive to the Probiotic Lactobacillus salivarius PS2 in Women With Mastitis: Gene Expression Profiling vs. Interindividual Variability. |
Ensayo clínico. |
España/ Madrid. |
- Eficacia de probióticos en mastitis humana. - Dosis de probiótico adecuada. |
|
Karlosson S et al. 2019(39) |
Maternal probiotic milk intake during pregnancy and breastfeeding complications in the Norwegian Mother and Child Cohort Study. |
Estudio de cohorte de madres e hijos. |
Oslo/ Noruega |
-Mayor duración de la lactancia materna
|
Fuente: Elaboración propia.
En la revisión de los distintos artículos se han reflejado que existen una serie de diferencias en cuanto a las semanas de gestación a la que se deben administran los probióticos para que estos sean efectivos, contemplándose dichos datos en la siguiente tabla (Tabla 3):
Tabla 3. Semana ideal de gestación para administración de probióticos.
|
Autor y año |
Semana gestación para administrar probióticos |
|
Mastromarino, P et al. 2015(24) |
Desde la semana 36 del embarazo hasta 4 semanas después del parto. |
|
Desde aproximadamente 30 semanas de embarazo hasta el nacimiento. |
|
|
Jamilian, M et al. 2016(26) |
Primera mitad del embarazo. |
Discusión/Conclusión
A pesar de los avances que tenemos hoy en día en el ámbito de la medicina y la investigación, aún se sigue considerando la mastitis como la primera causa del destete y cese de la lactancia materna, siendo esta el alimento primordial del recién nacido.
Cuando los tratamientos convencionales como los antibióticos no logran conseguir el efecto deseado para la mejora de la mastitis, se plantean otros tratamientos alternativos, de los cuales destacamos el uso de probióticos.
La administración de probióticos como tratamiento alternativo para la mastitis origina un debate en torno a la eficacia de estos, la dosis adecuada de administración y la semana ideal para administrarlos.
Una fortaleza de los estudios de Maldonado-Lobón, JA et al.(23), Hurtado, JA et al.(28) y Fernández, L et al.(25) es que además de medir la carga bacteriana evalúan el dolor de las glándulas mamarias en la mastitis, reforzando así la eficacia de los probióticos.
Una limitación del estudio de Hurtado, JA et al.(6) es la población, puesto que, para observar un mayor nivel de incidencia, solo se incluyeron mujeres que recibieron antibióticos de forma preventiva.
En cuanto al estudio de Fernández, L et al.(25) la limitación que presenta el estudio es que las mujeres incluidas no representan a la población embarazada en su conjunto, porque todas eran mujeres que habían tenido mastitis en un embarazo previo, condicionando así la aplicabilidad de los hallazgos a otras cohortes.
En lo referente a los estudios de De Andrés, J et al.(29) y Espinosa-Martos, I et al.(10) se mide la eficacia de los probióticos en un grupo con mastitis y en un grupo sano, sin existir ningún grupo que tome placebo. No se puede comparar la eficacia del probióticos frente a un placebo y además el tamaño muestral de estos estudios es pequeña, siendo esta otra limitación.
Por último, el estudio de Vázquez-Fresno, R et al.(6) cuenta con un único grupo al que se le aplica el probiótico sin existir un grupo de control, siendo esto una limitación, junto con el tamaño de muestra reducida de pacientes.
Por este motivo consideramos que sería oportuno realizar estudios en los que se compare el uso de probióticos y placebos en muestras de un tamaño superior para poder demostrar una mayor eficacia y que también sería interesante que se realicen estudios donde se compare la eficacia del uso de probióticos y antibióticos o estudios donde se apliquen los probióticos a nivel preventivo, ya que la mayoría de los estudios se basan en una mastitis ya instaurada.
En lo que respecta a la dosis adecuada de probiótico hemos podido comprobar que se administran diferentes cepas de probióticos en los estudios analizados y que dentro de los estudios que analizan la misma cepa cada uno de ellos cuenta con una dosis diferente, por lo que, aunque todas las dosis resultan efectivas, no podemos saber con claridad cuál es la dosis adecuada para administrar la cantidad ideal de probiótico para que surja el efecto deseado sin que haya un mayor o menor consumo del necesario.
Por último, en cuanto a la semana ideal de gestación para la administración de probióticos nos hemos encontrado con el mismo problema que con la dosis adecuada, y es que, cada uno de los 3 estudios en los que se refleja tienen distintas semanas de gestación, por lo que, aunque hayan resultado eficaces para esos estudios, seguimos sin saber a ciencia cierta cuál es la semana ideal de gestación para dicha administración, por lo que sería necesario el desarrollo de nuevos estudios que clarifiquen esta cuestión.
Con las evidencias actuales se puede decir que el uso de probióticos como tratamiento alternativo para la mastitis humana podría resultar eficaz. Se refleja la necesidad de seguir realizando investigaciones en torno a la eficacia de las distintas cepas de probióticos, dosis adecuada y semana de gestación ideal.
Agradecimientos
Esta revisión bibliográfica se realizó dentro del marco del proyecto de investigación “Análisis del comportamiento de los marcadores biológico/nutricionales durante el embarazo y su influencia en el parto y la lactancia materna. Modelo predictivo BECOME.” Código del Proyecto: PI17/02305 financiado por el Fondo Europeo de Desarrollo Regional (FEDER).
Anexos
Puntuación CASPe de los artículos estudiados.
|
Estudio |
Puntuación CASPe |
|
Vázquez-Fresno, R et al. 2014 |
5/11 |
|
Maldonado-Lobón, JA et al. 2015 |
8/11 |
|
Mastromarino, P et al. 2015 |
7/11 |
|
Fernández, L et al. 2016 |
7/11 |
|
5/11 |
|
|
7/11 |
|
|
Bond, DM et al. 2017 |
5/11 |
|
Hurtado, JA et al. 2017 |
7/11 |
|
De Andrés, J et al. 2018 |
5/11 |
Fuente: Elaboración propia.
Factor de impacto JCR de los artículos estudiados.
|
Estudio |
Factor de impacto JCR |
|
Vázquez-Fresno, R et al. 2014 |
Q1 |
|
Maldonado-Lobón, JA et al. 2015 |
Q1 |
|
Mastromarino, P et al. 2015 |
Q2-Q3 |
|
Fernández, L et al. 2016 |
Q1 |
|
Espinosa-Martos, I et al. 2016 |
Q3 |
|
Jamilian, M et al. 2016 |
Q3 |
|
Bond, DM et al. 2017 |
Q2 |
|
Hurtado, JA et al. 2017 |
Q2-Q3 |
|
De Andrés, J et al. 2018 |
Q2 |
Fuente: Elaboración propia.
Referencias
1. World Health Organization. Mastitis: causes and management. Geneva: World Health Organization. 2000. Disponible en: https://www.who.int/maternal_child_adolescent/documents/fch_cah_00_13/es/
2. Turck D, Bresson J, Burlingame B, Dean T, Fairweather-tait S, Heinonen M, et al. Lactobacillus fermentum CECT 5716 and a reduction of the Staphylococcus load in breast milk which reduces the risk of infectious mastitis : evaluation of a health claim pursuant to Article 14 of Regulation ( EC ) No 1924 / 2006. EFSA J. 2017;15(7):4917.
3. Bond DM, Morris JM, Nassar N. Study protocol: Evaluation of the probiotic Lactobacillus Fermentum CECT5716 for the prevention of mastitis in breastfeeding women: A randomised controlled trial. BMC Pregnancy Childbirth [Internet]. 2017;17:148. Disponible en: https://www.scopus.com/inward/record.uri?eid=2-s2.0-85019364086&doi=10.1186%2Fs12884-017-1330-8&partnerID=40&md5=cc73c81a035c9cbcf210784dbd3c61df
4. Hurtado JA, Maldonado-Lobón JA, Díaz-Ropero MP, Flores-Rojas K, Uberos J, Leante JL, et al. Oral Administration to Nursing Women of Lactobacillus fermentum CECT5716 Prevents Lactational Mastitis Development: A Randomized Controlled Trial. Breastfeed Med [Internet]. 2017;12(4):202–9. Disponible en: https://www.scopus.com/inward/record.uri?eid=2-s2.0-85019403288&doi=10.1089%2Fbfm.2016.0173&partnerID=40&md5=2c17e39e4b5eb21dabfe2410fb3969d4
5. de Andrés J, Jiménez E, Espinosa-Martos I, Rodríguez JM, Garcia-Conesa MT. An Exploratory Search for Potential Molecular Targets Responsive to the Probiotic Lactobacillus salivarius PS2 in Women With Mastitis: Gene Expression Profiling vs. Interindividual Variability. Front Microbiol. 2018;9.
6. Vázquez-Fresno R, Llorach R, Marinic J, Tulipani S, Garcia-Aloy M, Espinosa-Martos I, et al. Urinary metabolomic fingerprinting after consumption of a probiotic strain in women with mastitis. Pharmacol Res [Internet]. 2014;87:1605. Disponible en: https://www.scopus.com/inward/record.uri?eid=2-s2.0-84907597628&doi=10.1016%2Fj.phrs.2014.05.010&partnerID=40&md5=6c953640e7203cc9a5b9728f9077312d
7. Arroyo R, Martín V, Maldonado A, Jiménez E, Rodríguez JM. Treatment of Infectious Mastitis during Lactation : Antibiotics versus Oral Administration of Lactobacilli Isolated from Breast Milk. Clin Infect Dis. 2010;50(12):1551–8.
8. Fernández L, Langa S, Martín V, Maldonado A, Jiménez E, Martín R, et al. The human milk microbiota : Origin and potential roles in health and disease. Pharmacol Res [Internet]. 2013;69(1):1–10. Disponible en: http://dx.doi.org/10.1016/j.phrs.2012.09.001
9. Jiménez E, Fernández L, Maldonado A, Martín R, Olivares M, Xaus J, et al. Oral Administration of Lactobacillus Strains Isolated from Breast Milk as an Alternative for the Treatment of Infectious Mastitis during Lactation. 2008;74(15):4650–5.
10. Espinosa-Martos I, Jiménez E, de Andrés J, Rodríguez-Alcala LM, Tavárez S, Manzano S, et al. Milk and blood biomarkers associated to the clinical efficacy of a probiotic for the treatment of infectious mastitis. Benef Microbes. 2016;7(3):305–18.
11. Marín M, Arroyo R, Espinosa-Martos I, Fernández L, Rodríguez JM. Identification of Emerging Human Mastitis Pathogens by MALDI-TOF and Assessment of Their Antibiotic Resistance Patterns. 2017;8:1258.
12. Angelopoulou A, Field D, Ryan CA, Stanton C, Hill C, Ross RP. The microbiology and treatment of human mastitis. Med Microbiol Immunol [Internet]. 2018;207(2):83–94. Disponible en: https://www.scopus.com/inward/record.uri?eid=2-s2.0-85040689037&doi=10.1007%2Fs00430-017-0532-z&partnerID=40&md5=16d715c2ec35b4c5e20fd157aedec269
13. Castro A, González M, Tarín JJ, Cano A. Role of probiotics in obstetrics and gynecology [Papel de los probióticos en Obstetricia y Ginecología]. Nutr Hosp [Internet]. 2015;31:26–9. Disponible en: https://www.scopus.com/inward/record.uri?eid=2-s2.0-84923847889%7B&%7Ddoi=10.3305%7B%25%7D2Fnh.2015.31.sup1.8704%7B&%7DpartnerID=40%7B&%7Dmd5=f1462fae4b763b756a125f6ada50e87f
14. Beltrán DA, Crespo AE, Rodriguez TC, Garcia Á. Infectious mastitis: A new solution for an old problem [Mastitis infecciosa: Nueva solución para un viejo problema]. Nutr Hosp [Internet]. 2015;31:89–95. Disponible en: https://www.scopus.com/inward/record.uri?eid=2-s2.0-84923852152%7B&%7Ddoi=10.3305%7B%25%7D2Fnh.2015.31.sup1.8714%7B&%7DpartnerID=40%7B&%7Dmd5=65b9de872dabaa6a56e84717369749cc
15. Vayas R, Carrera L. Actualización en el manejo de las mastitis infecciosas durante la lactancia. 2012;5(1):25–9.
16. Fernández L, Cárdenas N, Arroyo R, Manzano S, Jiménez E, Martín V, et al. Prevention of Infectious Mastitis by Oral Administration of Lactobacillus salivarius PS2 during Late Pregnancy. Clin Infect Dis [Internet]. 2016;62(5):568–73. Disponible en: https://www.scopus.com/inward/record.uri?eid=2-s2.0-84960121427&doi=10.1093%2Fcid%2Fciv974&partnerID=40&md5=042286a05823e99eecac7c4d16bd8a34
17. Carrera M, Arroyo R, Mediano P, Fernández L, Marín M, Rodríguez J. Lactancia materna y mastitis. Tratamiento empírico basado en la sintomatología y los agentes etiológicos. Acta Pediatr Esp. 2012;70(6):255–61.
18. Fernández L, García C, Carrera M, Mediano P, Rodríguez J, Marín M. Factores de riesgo de la mastitis infecciosa durante la lactancia. 2016;74(11):243–50.
19. Mediano P, Fernández L, Rodríguez JM, Marín M. Case – control study of risk factors for infectious mastitis in Spanish breastfeeding women. 2014;14:195.
20. Urrútia G, Bonfill X. Declaración PRISMA: una propuesta para mejorar la publicación de revisiones sistemáticas y metaanálisis. Med Clin. 2010;135(11):507–11.
21. Cabello JB por CASPe. Plantilla para ayudarte a entender un Ensayo Clínico. En: CASPe. Guías CASPe Lectura Crítica de la Literatura Médica. Alicante: CASPe; 2005.
22. Jcr.clarivate.com [Internet]. United Kingdom: Clarivate analytics; 2018 [actualizado 20 Sep 2018; consultado 7 mar 2019]. Disponible en: https://jcr.clarivate.com/JCRJournalHomeAction.action
23. Maldonado-Lobón JA, Díaz-López MA, Carputo R, Duarte P, Díaz-Ropero MP, Valero AD, et al. Lactobacillus fermentum CECT 5716 Reduces Staphylococcus Load in the Breastmilk of Lactating Mothers Suffering Breast Pain: A Randomized Controlled Trial. Breastfeed Med [Internet]. 2015;10(9):425–32. Disponible en: https://www.scopus.com/inward/record.uri?eid=2-s2.0-84946080205&doi=10.1089%2Fbfm.2015.0070&partnerID=40&md5=9f4699aee7dc64d1dad589315e208211
24. Mastromarino P, Capobianco D, Miccheli A, Praticò G, Campagna G, Laforgia N, Capursi T, Baldassarre ME. Administration of a multistrain probiotic product (VSL#3) to women in the perinatal period differentially affects breast milk beneficial microbiota in relation to mode of delivery. Pharmacol Res. 2015 May-Jun;95-96:63-70. doi: 10.1016/j.phrs.2015.03.013. Epub 2015 Mar 31.
25. Fernández L, Cárdenas N, Arroyo R, Manzano S, Jiménez E, Martín V, et al. Prevention of Infectious Mastitis by Oral Administration of Lactobacillus salivarius PS2 during Late Pregnancy. Clin Infect Dis [Internet]. 2016;62(5):568–73. Disponible en: https://www.scopus.com/inward/record.uri?eid=2-s2.0-84960121427&doi=10.1093%2Fcid%2Fciv974&partnerID=40&md5=042286a05823e99eecac7c4d16bd8a34
26. Jamilian M, Bahmani F, Vahedpoor Z, Salmani A, Tajabadi M, Jafari P, et al. Effects of Probiotic Supplementation on Metabolic Status in Pregnant Women: a Randomized, Double-blind, Placebo-Controlled Trial. Arch Iran Med. 2016;19(10):687–92.
27. Bond DM, Morris JM, Nassar N. Study protocol: Evaluation of the probiotic Lactobacillus Fermentum CECT5716 for the prevention of mastitis in breastfeeding women: A randomised controlled trial. BMC Pregnancy Childbirth [Internet]. 2017;17:148. Disponible en: https://www.scopus.com/inward/record.uri?eid=2-s2.0-85019364086&doi=10.1186%2Fs12884-017-1330-8&partnerID=40&md5=cc73c81a035c9cbcf210784dbd3c61df
28. Hurtado JA, Maldonado-Lobón JA, Díaz-Ropero MP, Flores-Rojas K, Uberos J, Leante JL, et al. Oral Administration to Nursing Women of Lactobacillus fermentum CECT5716 Prevents Lactational Mastitis Development: A Randomized Controlled Trial. Breastfeed Med [Internet]. 2017;12(4):202–9. Disponible en: https://www.scopus.com/inward/record.uri?eid=2-s2.0-85019403288&doi=10.1089%2Fbfm.2016.0173&partnerID=40&md5=2c17e39e4b5eb21dabfe2410fb3969d4
29. De Andrés J, Jiménez E, Espinosa-Martos I, Rodríguez JM, Garcia-Conesa MT. An Exploratory Search for Potential Molecular Targets Responsive to the Probiotic Lactobacillus salivarius PS2 in Women With Mastitis: Gene Expression Profiling vs. Interindividual Variability. Front Microbiol. 2018;9.
30. Karlsson S, Brantsæter AL, Meltzer HM, Jacobsson B, Barman M, Sengpiel V.Maternal probiotic milk intake during pregnancy and breastfeeding complications in the Norwegian Mother and Child Cohort Study. Eur J Nutr. 2019 Sep 10. doi: 10.1007/s00394-019-02072-8. [Epub ahead of print]