
ORIGINAL
Fístula
aorto-entérica y ley de Murphy
Aorto-enteric fistula and Murphy's law
Francisco S. Lozano1, Felipe Parreño2,
María Parra3, José I. González4, Rubén Peña5,
Elisa Diego6, Carola Rubio1
1 MD, PhD,
FACS, FACA. Jefe servicio y catedrático de cirugía. Servicio de Angiología y
Cirugía Vascular. Complejo Asistencial
Universitario de Salamanca (CAUSA). Instituto de Investigación Biomédica de
Salamanca (IBSAL). Universidad de Salamanca (USAL). España
2 MD, PhD.
Médico adjunto y profesor asociado de cirugía. Servicio de Cirugía General y
del Aparato Digestivo. Complejo Asistencial
Universitario de Salamanca (CAUSA). Instituto de Investigación Biomédica de
Salamanca (IBSAL). Universidad de Salamanca (USAL). España
3 MD. Médico
adjunto. Servicio de Angiología y Cirugía Vascular. Complejo
Asistencial Universitario de Salamanca (CAUSA). Instituto de Investigación
Biomédica de Salamanca (IBSAL). Universidad de Salamanca (USAL). España
4 MD. Médico
adjunto y profesor asociado de cirugía. Servicio de Cirugía General y del
Aparato Digestivo. Complejo Asistencial
Universitario de Salamanca (CAUSA). Instituto de Investigación Biomédica de
Salamanca (IBSAL). Universidad de Salamanca (USAL). España
5 MD. Médico
adjunto y profesor asociado de cirugía. Servicio de Angiología y Cirugía
Vascular. Complejo Asistencial Universitario de Salamanca (CAUSA).
Instituto de Investigación Biomédica de Salamanca (IBSAL). Universidad de
Salamanca (USAL). España
6 MD.
Residente de cirugía. Servicio de Cirugía General y del Aparato Digestivo. Complejo
Asistencial Universitario de Salamanca (CAUSA). Instituto de Investigación
Biomédica de Salamanca (IBSAL). Universidad de Salamanca (USAL). España
7 MD, PhD. Médico
adjunto y profesor asociado de cirugía. Servicio de Angiología y Cirugía
Vascular. Complejo Asistencial Universitario de Salamanca (CAUSA).
Instituto de Investigación Biomédica de Salamanca (IBSAL). Universidad de
Salamanca (USAL). España
*
Autor para correspondencia.

This work is licensed
under a Creative
Commons
Attribution-NonCommercial-ShareAlike 4.0
International License
La revista no cobra tasas por el envío de trabajos,
Resumen
Objetivo. Reflejar
nuestra frustración al perder un paciente, no porque su infrecuente patología
sea de por sí muy grave, sino por el acumulo sobreañadido de otros motivos
diagnósticos, y terapéuticos en un entorno hospitalario de epidemia Covid-19.
Método. Primero
describimos el proceso diagnóstico, terapéutico y evolutivo (27 febrero al 25
marzo 2020) de un varón de 73 años portador de una fístula aorto-entérica
secundaria a un bypass aorto-bifemoral, implantado doce años antes en otro
hospital. Después presentamos nuestra experiencia (1978-2020) en este tipo de
situaciones, y finalmente realizamos una revisión de la literatura (1953-2020)
al respecto.
Resultados. A) Caso
clínico: ausencia de diagnóstico precoz, fracaso de la técnica operatoria
elegida, importantes complicaciones postoperatorias (hemorragia, infarto
cerebral y neumonía bilateral por coronavirus) que finalizo en exitus. B)
Experiencia personal: cuatro casos (incluido el referido). C) Revisión de la
literatura: tres revisiones sistemáticas: 564 casos (1953-1993); 386 casos en
58 publicaciones (1991-2006), 823 pacientes en 216 publicaciones (1995-2015) y
20 casos en 14 publicaciones (2016-2020).
Conclusión. Si en
situaciones normales una fístula aorto-entérica es una condición que amenaza
seriamente la vida del paciente (hemorragia y/o infección), no debe extrañar
que en situaciones excepcionales esa situación de gravedad se incremente. No
obstante, de estas malas experiencias estamos obligados a sacar enseñanzas que
beneficien a otros en el futuro.
Palabras clave
Fistula aortoentérica; fistula aortoduodenal;
fistual aortoentérica secundaria; fistula aortoduodenal secundaria; fístula
protésico-entérica; fistula paraprotésica; erosión protésico-entérica
Abstract
Objective. To reflect
our frustration when losing a patient, not because their infrequent pathology
is in itself very serious, but because of the accumulation of other diagnostic
and therapeutic reasons in a hospital environment of the Covid-19 epidemic.
Method. First we
describe the diagnostic, therapeutic and evolutionary process (February 27 to
March 25, 2020) of a 73-year-old male with an aorto-enteric fistula secondary
to an aorto-bifemoral bypass, implanted twelve years earlier in another
hospital. Then we present our experience (1978-2020) in this type of situation,
and finally we carried out a review of the literature (1953-2020) in this
regard.
Results. A)
Clinical case: absence of early diagnosis, failure of the chosen operative
technique, significant postoperative complications (hemorrhage, cerebral
infarction and bilateral coronavirus pneumonia) that ended in death. B)
Personal experience: four cases (including the referred one). C) Literature
review: three systematic reviews: 564 cases (1953-1993); 386 cases in 58
publications (1991-2006), 823 patients in 216 publications (1995-2015) and 20
cases in 14 publications (2016-2020).
Conclusion. If in
normal situations an aorto-enteric fistula is a condition that seriously
threatens the patient's life (hemorrhage and / or infection), it should not be
surprising that in exceptional situations this serious situation increases.
However, from these bad experiences we are obliged to draw lessons that will
benefit others in the future.
Keywords
Aortoenteric fistula; aortoduodenal fistula; secondary
aortoenteric fistula; secondary aortoduodenal fistula; graft-enteric fistulas;
paraprosthetic fistula; graft-enteric erosions
Aportación a la literatura científica
A)
Qué aporta el estudio realizado al
conocimiento ya existente.
Presenta un paciente portador de una fistula aorto-entérica
secundaria a un bypass aorto-bifemoral. Esta patología habitualmente de difícil
diagnóstico y complejo tratamiento se complicó y finalizó con el fallecimiento
del paciente, todo ello en un entorno hospitalario del Covid-19.
No es habitual presentar resultados negativos de la práctica
clínica vascular y no hemos encontrado referencias similares en la literatura
revisada. Parafraseando a la ley de Murphy y algunos de sus corolarios: “Una
crisis consiste en no poder decir: olvidemos ese tema (precepto de Ferguson) o
“El buen juicio proviene de las malas experiencias” (ley de Higdon). Por tanto,
1) no debemos olvidar esta pesadilla que supuso el caso presentado, y 2)
debemos sacar de ella conclusiones positivas para el futuro.
B)
Implicaciones de los resultados obtenidos,
para la práctica, y la investigación en general
Aporta varios puntos
para el aprendizaje:
-
Todo
paciente con el antecedente de una cirugía aórtica (con prótesis o incluso
endoprótesis) y que presente una hemorragia digestiva alta tiene una fistula
aorto-entérica hasta que se demuestre lo contrario.
-
Tener
un alto índice de sospecha es crucial para un diagnóstico precoz.
-
Reconocer
el "sangrado precoz" como señal de alarma.
-
La
asociación TAC y endoscopia permiten confirmar el diagnóstico.
-
La
fistula aorto-entérica es una urgencia quirúrgica.
-
Sin
cirugía las fístulas aorto-entéricas secundarias son una condición letal; con
cirugía pueden superar el 50%.
-
El
tratamiento ideal, siempre que sea posible, sería un planteamiento quirúrgico
en dos tiempos: primero endovascular y posterior cirugía abierta.
Introducción
Una fistula aorto-entérica (FAE) es una comunicación anormal
entre la aorta y el intestino. Sus características más significativas son: baja
frecuencia, complejo tratamiento y elevada mortalidad.
Las FAE se clasifican en primarias (aneurismas, infecciones,
traumatismos, o radioterapia), y secundarias a cirugía aórtica previa. Entre
las últimas, existe una variante denominada fístulas paraprotésicas o erosiones
(entre el cuerpo o ramas de la prótesis con el intestino), bien diferente a una
verdadera FAE (que comunica la línea de sutura prótesis-aorta con el intestino)
(1). La primera descripción, lógicamente de una FAE primaria la
realizo Astley Cooper (1829); el primer caso de FAE secundario, fue reportado
por Block (1953). Para otros hechos históricos ver Tabla 1. (1-2)
Tabla
1.
Fistulas aorto-entéricas. Hechos históricos
______________________________________________________________________
Autor
Año Hecho histórico
______________________________________________________________________
Cooper 1829 Primera
descripción de una FAE (primaria)
Block 1953 Primer
caso reportado
Claytor 1956 Primera
caso con una prótesis
MacKenzie 1958 Primera
operación con éxito (operación in situ)
Gryka
1959 Primera descripción de erosión
aorto-entérica
Crawford 1960 Propone
cirugía urgente ante hemorragia centinela
Donovan 1967 Diferencia
FAE con/sin infección
Youmans 1967 Describe
el termino fístula entero-protésica
Mirmadjelassi 1967 Primer
diagnóstico endoscópico
Ehrenfeld 1968 Propone
la exéresis total + bypass axilo-bifemoral
Szylagvi 1972 Primero
en proponer los términos FAE y FPP
Prinkerton
1972 propone el control intra-aórtico con balón
Elliott 1973 Primera
descripción de rotura del muñón aórtico
Klenmann 1979 Propone
un algoritmo de tratamiento
Martin
1980 Propone la cirugía en varios tiempos
Parodi 1992 Introduce
las endoprótesis aorticas
_____________________________________________________________________
Modificada
de Blunt (1994) (1)
FAE,
fistula aorto-enterica; FPP, fístula paraprotesica
Son poco frecuentes
(incidencia anual de 0,007/millón de habitantes), siendo las primarias
excepcionales (incidencia del 0,04-0,07%). Más frecuentes son las secundarias,
con una incidencia del 0,5-2% después de cirugía aortica (1-5). La
mayoría (50-80%) afectan al duodeno, en su tercera o cuarta porción (3-6).
Aunque la exacta patogenia es especulativa, las fístulas
primarias surgen en pacientes con aneurismas de la aorta que al crecer perforan
la luz digestiva, comportándose como una excepcional complicación evolutiva de
los aneurismas. En las fístulas secundarias a cirugía aortica se menciona la
presión mecánica de la prótesis implantada contra el intestino adyacente o por
infecciones periprotésicas de baja virulencia (Biofilm) (1-3,7).
Conjuntamente, Bergqvist y cols (8) han recogido 16 FAE secundarias
a endoprótesis; la incidencia es más baja que por cirugía abierta, pero la
clínica es similar.
En este contexto, el objetivo de la presente publicación es
presentar: 1) un resultado negativo, a propósito de un caso; 2) nuestra
experiencia en los últimos 40 años; y 3) una revisión de la literatura.
Material y Método
1) Presentamos un paciente portador de una FAE secundaria,
diagnosticada y tratada en el Hospital Universitario de Salamanca. El caso se
desarrolló durante la actual pandemia Covid-19 (marzo 2020).
2) Presentar la experiencia personal sobre FAE, en los
servicios de Cirugía General (1978-1990) y Angiología y Cirugía Vascular
(1991-2020) del Hospital Universitario de Salamanca.
3) Realizar una revisión de la literatura sobre FAE
secundarias, entre 1953-2020. Se ha realizado una búsqueda en Pubmed/Medline y
dos revistas españolas (Cirugía Española y Angiología). Se utilizaron las
siguientes palabras clave: Fistula
aortoentérica, fistula aortoduodenal, fistula aortoentérica secundaria, fistula
aortoduodenal secundaria, fístula protésico-entérica, fistula paraprotésica,
erosión protésico-entérica.
Resultados
a) Caso clínico
Varón de 73 años que acude a urgencias (27/2/2020) por
hematemesis y melenas (caída al suelo sin pérdida de conciencia). Antecedentes
de EPOC, apnea del sueño, esteatosis hepática, pielonefritis litiásica, herpes
zoster, osteoporosis, claudicación intermitente, e insomnio. Factores de riesgo
cardiovascular: HTA, dislipemia, fumador (20 cig./día), no diabetes mellitus.
Antecedentes quirúrgicos: bypass aorto-bifemoral hace 12 años en Bilbao y
menicectomía. Alergia a buscapina. Medicación: Adiro® 100 mg,
Simvastatina 20 mg, Esidrex® 25 mg, Deprax® 100, Spiriva®
10 mg, y Paracetamol 1 gr. El paciente no presenta repercusión hemodinámica
(PA, 168/71 mmHg; FC, 62 lpm; SaO2, 98%; temperatura, 35,6º C) ni hematimétrica
(3.77 hematíes/uL; hemoglobina 11,6 g/dL; hematocrito 34,1%); resto del
hemograma y analítica normal (coagulación, bioquímica, gasometría y PCR). Es
dado de alta, con una cita para el servicio del aparato digestivo.
Al día siguiente, en la referida consulta, se solicita
endoscopia (28/2/2020): Esofagitis grado A de Los Angeles. Alteraciones
inflamatorias de la mucosa gástrica (se toman biopsias para estudio de H.
pylori). Duodenitis erosiva con ulcera péptica Forrest IIc. No sangrado
activo. El 4/3/2020, se recibe el informe de anatomía patológica: Gastritis
crónica leve, atrofia leve con metaplasia intestinal que afecta al 30% del
tejido estudiado y actividad inflamatoria aguda leve; no H. pylori. Un
informe microbiológico del mismo día (28/2/2020) informa de bacteriemia por E.
coli y Str. mitis, sensibles a amoxicilina-ácido clavulanico.
Tres días después ingresa en el servicio del aparato
digestivo (2/3/2020): Paciente estable; hemograma (3,13 hematíes/uL;
hemoglobina 9,8 g/dL; hematocrito 27,5%). Ante su mejoría y el informe
endoscópico referido, se decide el alta con el diagnóstico de hemorragia digestiva
alta secundaria a ulcera duodenal Forrest IIc, en paciente en tratamiento
antiagregante. Se propone revisión al mes y se pauta Esomeprazol® 40
mg/d y Ferrosanol® 100 mg/d.
Diez días después, reingresa en el mismo servicio (12/3/2020)
por persistencia de las melenas. Constantes: PA, 97/59 mmHg; FC, 73 lpm; SaO2
98%; temperatura 36,5ºC. Analítica: 3.19 hematíes/uL; hemoglobina 9,8 g/dL;
hematocrito 28,5%; leucocitos 12.60 x 103; PCR 37 mg/dL. Exploración abdominal
normal (blando, depresible, no doloroso a la palpación, no se palpan masas, no
signos de irritación peritoneal y auscultación normal). Tacto rectal: dedo
manchado de heces negras. Se realiza de urgencia TAC abdomino-pélvico con
contraste y esofágo-gastro-duodenoscopia, cuyos hallazgos son: a) TAC: No aire
extraluminal, liquido libre ni colecciones definidas. Bypass permeable. No
extravasaciones de contraste. Sin signos de patología abdominal urgente (Figura
1). b) Endoscopia: Anillo de Schatzki, en tercio inferior de esófago. En
segunda porción duodenal úlcera de 10 mm descrita previamente, con fondo
necrótico, bordes regulares sobreelevados que se biopsian por posibilidad de
malignidad. Bulbo sin alteraciones. No se visualizan restos hemáticos.
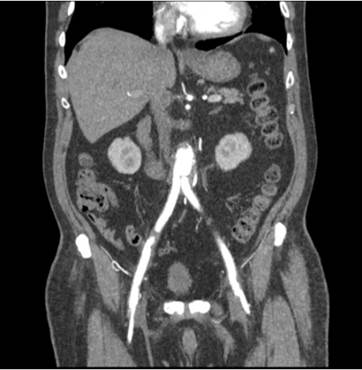
Figura
1. TAC abdominal con contraste intravenoso. Prótesis
aorto-bifemoral permeable, sin signos de complicación.
Con estos hallazgos se diagnóstica de hemorragia digestiva
alta (HDA) por úlcera duodenal refractaria al tratamiento médico. Las melenas
persisten y el 16/3/2020 presenta una nueva hematemesis, que obliga a varias
trasfusiones. Se solicita nueva endoscopia (17/3/2020): En segunda porción
duodenal por debajo de la papila se visualiza prótesis asomando en duodeno con
un orificio de unos 10 x 10 mm, sin sangrado activo en estos momentos.
Sugerente de fístula aorto-entérica (Figura 2).
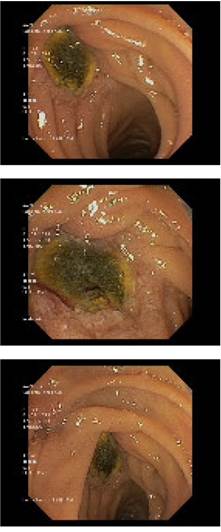
Figura
2. Esófago-gastro-duodenoscopia. Erosión del duodeno con
prótesis vascular visible.
Conocido el informe endoscopico se contacta con el servicio
de cirugía vascular. Se propone cirugía urgente cuanto sea posible (paciente
estable y en fase de transfusiones: hemoglobina 7,9 gr/dL). La cirugía da
comienzo a las 13.00 h del 18/3/2020, por problemas de disponibilidad de quirófano;
el paciente continuaba estable, sin sangrado activo y hemoglobina, 10,9 gr/dL.
Técnica quirúrgica: Incisión xifo-pubiana sobre cicatriz de
laparotomía media previa. Liberación de múltiples adherencias. Cavidad
abdominal sin datos macroscópicos de sangrado e infección. Abordaje
retroperitoneal laborioso por intensa fibrosis. Control de la aorta abdominal
infrarenal. En ese momento se solicita la colaboración del servicio de cirugía
general. Ellos liberan el duodeno, apreciando una ulceración íntimamente
adherida a la prótesis aórtica pero sin existir fistulización con la misma. La
prótesis esta integra y sin sangrado. No signos de infección macroscópica. Se
realiza sutura primaria de la lesión duodenal. Lavado local con rifampicina.
Finalmente se interpone epiplón entre duodeno y prótesis vascular. Revisión de
la hemostasia y cierre habitual de la laparotomía.
A las 4 horas de finalizada la cirugía, una ecografía informa
de hemoperitoneo. El paciente es reintervenido, objetivando 2.700 cc de sangre.
Se aprecia una fuga a nivel de la prótesis aortica en su cara postero-lateral
derecha y zona de la anastomosis aorto-protésica, y un pequeño sangrado de la
vena gonadal izquierda. Sutura del duodeno intacta. Nuevamente no se aprecia
macroscopicamente infección protésica. Con estos hallazgos y dada la situación
del paciente se decide sutura con prolene 2/0 del orificio aórtico, y
ligadura-sección de la vena gonadal. Aplicación de Flosil® sobre la
zona de sutura. Comprobación de hemostasia y colgajo de epiplón sobre lecho
aorto-duodenal.
Al día siguiente (19/3/2020), un TC craneal informa de
hipodensidad cortico-subcortical en el territorio de la arteria cerebral media
derecha, compatible con lesión isquémica establecida.
El 25/3/2020, llega el diagnóstico patológico de las biopsias
duodenales (segunda endoscopia), que informan de tejido ulcerado sin evidencia
de malignidad. Ese día el paciente fallece en la unidad de reanimación afecto
de una neumonía bilateral y deteminación del Covid-19 positivo.
b) Experiencia personal (1978-2020)
En este periodo hemos tratado 4 pacientes portadores de
fistulas entre la aorta y el aparato digestivo (Tabla 2). Los tres primeros
casos ya fueron publicados (9-10); el cuatro paciente es el actual.
Tabla 2. Fistulas entre la aorta y el aparato digestivo.
Experiencia personal (1978-2020)
____________________________________________________________________________________________________________________
Nº Año Sexo/edad
Localización Tipo de fístula Etiología (patogenia) Tratamiento
Resultado
____________________________________________________________________________________________________________________
1 1983 H/35 Aorta
torácica-esófago Primaria Aneurisma aorta torácica
traumático Cirugía (1) Exitus*
2 2005 H/72 Aorta
abdominal-duodeno Primaria Aneurisma aorta abdominal Cirugía
(2) Supervivencia
3 2006 H/63 Aorta
abdominal-duodeno Primaria Aneurisma aorta abdominal Cirugía
(2) Supervivencia
4 2020 H/73 Aorta
abdominal-duodeno Secundaria Prótesis de dacrón aorto-bifemoral Cirugía Exitus*
____________________________________________________________________________________________________________________
(1) Publicado en J Thorac Cardiovasc Surg 1984;87(1):148-9.
(2) Publicados en J
Gastointest Surg 2008;12(9):1561-5.
* En el postoperatorio precoz.
c) Revisión de la literatura sobre las FAE secundarias
(1991-2020)
Hemos encontrado tres revisiones en FAE secundarias. El
primero de Blunt (1) quien entre 1953 y 1993 recopila 564 casos; el
segundo de Martínez y cols (11), entre 1991 y 2006, que seleccionan
58 publicaciones con 386 pacientes; y el tercero de Kakkos y cols (12),
realizado entre 1995-2015, que incluye los resultados de 823 casos procedentes
de 216 publicaciones.
Entre el 2016 y 2020, hemos identificado 20 publicaciones.
Una vez excluidas seis (2 FAE primarias, 2 revisiones y 1 fistula
aorto-esofágica), trece eran casos aislados y una aportaba siete casos (13).
En esta última, su abordaje era retirar la prótesis problema y una
reconstrucción “in situ” con la vena femoral superficial; supervivencia, a 30
días, del 86%.
Por tanto, en 66 años (fecha del primer caso reportado), el
número de FAE secundarias publicadas en la literatura no supera los 1.793 casos
(Tabla 3).
Tabla 3. Revisiones
sistemáticas: Métodos terapéuticos y mortalidad en pacientes con fístulas
aorto-entéricas secundarias.
___________________________________________________________________________________________________________________________________________
Método Blunt
(hasta 1993) (1) Martínez Aguilar y cols (1991-2006) (2)
Kakkos y cols (1995-2015) (3)
N (%) Mortalidad (%) N (%)
Mortalidad precoz y tardía (%) N (%)
Mortalidad hospitalaria (%)
___________________________________________________________________________________________________________________________________________
Ninguno 96
(17,0) 100 - - - -
-
Explante + bypass extraanatómico 230
(40,8) 40 188 (48,7) 18,2-44 9-14 226
(27,5) 31,2
Sustitución in situ 104
(18,4) 47 73 (18,9) 8-13,3 14-26 403
(49,0)* 34,0
- Homoinjertos -
- 115 (29,8) 12-50 10-25,9 - -
No
reparación arterial/local 96 (17,0) 80 -
- - 25
(3,0) 28,0**
Endovascular
- - 10
(2,6) - - 98
(11,3)*** 7,1
Miscelánea
38 (6,7) 63 -
- - 55
(6,7) 41,3
-
Cierre primario del defecto arterial - - -
- - 16 (1,9) 62.5
___________________________________________________________________________________________________________________________________________
Total 564
(100) 57 386 (100) 8-50 2,1-26 823
(100) 30,7
___________________________________________________________________________________________________________________________________________
(1) Vascular Graf Infections (468
casos).
(2) Cir Esp 2007 (386 casos en 58 publicaciones).
(3) Eur J Vasc Endovasc Surg 2016
(823 casos en 216 publicaciones).
*
Incluye homoinjertos (166), prótesis normal (42), e impregnadas en plata o
rifampicina (160), injerto de pericardio bovino (1), y venoso (34).
**
Fundamentalmente eran fistulas paraprotésicas (erosiones).
*** Incluye dos
tiempos: endoprótesis y posterior reparación abierta (n = 13).
Discusión
En 1949, el ingeniero estadounidense Edward A. Murphy formulo
su famosa ley: “Si algo puede salir mal, saldrá mal”. En este sentido, nuestro
caso es paradigmático. La historia natural de las FAE es la muerte por
hemorragia y/o sepsis, a menos que un rápido, correcto y exacto diagnóstico
asociado a un adecuado tratamiento quirúrgico eviten el fatal desenlace.
Nuestro caso no cumplió esta secuencia.
Los síntomas habituales de FAE son la hematemesis, melena y
dolor abdominal (10). El sangrado inicialmente suele ser escaso y a
menudo intermitente, pero con el tiempo conduce a un sangrado grave y shock
hemorrágico (4). Algunos pacientes antes de la hemorragia, presentan
fiebre, fatiga, malestar o pérdida de peso, que suelen pasar desapercibidos (1-2).
En nuestro caso, no existieron pródromos, pero si hemorragia centinela (Herald
bleed), que no fue bien interpretada.
El síndrome de HDA, está producido por muchas causas (úlcera
gástro-duodenal, síndrome de Mallory-Weiss, varices esofágicas, etc) siendo la
FAE una causa excepcional; este hecho suele retrasar el diagnóstico salvo un
alto índice de sospecha. Por ello, una primera enseñanza: “Todo paciente con
antecedente de cirugía de la aorta, que presente una HDA tiene una FAE mientras
no se demuestre lo contrario”.
Una sospecha se debe confirmar/excluir, si bien ningún método
complementario ha demostrado absoluta eficacia (11). El TAC con
contraste intravenoso está considerada la prueba de elección, con una
sensibilidad del 50-94% y especificidad del 85-100% (4); se deben
buscar signos de gas alrededor de la prótesis, engrosamiento de su pared,
hematoma periaortico o incluso contraste dentro de la luz gastrointestinal (2).
En nuestro caso, no se observo ninguno de los signos radiológicos referidos (Figura
1).
Para otros, la endoscopia es la principal prueba diagnóstica,
al poder demostrar la fístula y descartar otras causas de HDA (3).
Aunque muchas veces no identifica el lugar del sangrado (4), en
otras visualiza la prótesis (3,14-16). Ambas situaciones las hemos
vivido en nuestro caso (dos endoscopias negativas y la última visualizando la
prótesis). Otras pruebas, gammagrafías o arteriografías, ocupan un lugar
secundario.
Con los datos diagnósticos iniciales (ausencia de sospecha,
un TAC y dos endoscopias negativas) podemos decir que se retrasó el diagnóstico
de FAE. Sin embargo, ello no condiciono la cirugía (indicación y momento), dado
que esta se realizó con el paciente estable. De hecho, el paciente nunca
presento una HDA grave probablemente porque no existió una verdadera
comunicación con la aorta, siendo más bien una erosión y el sangrado
seguramente procedía de la pared duodenal ulcerada; caso contrario el paciente
no habría llegado vivo a la cirugía. Otro aspecto diagnóstico negativo, fue el
peligro que supuso realizar una biopsia “a ciegas” en la segunda endoscopia.
Las FAV son una urgencia quirúrgica. La mortalidad de las FAE
secundarias sin cirugía es prácticamente del 100% y con cirugía alrededor del
50% (1-2). Se han descrito tasas de mortalidad precoz entre el 8-50%
y tardías entre 2-26% (11), y más concretamente una mortalidad
hospitalaria global (incluyendo todas las técnicas) del 30,7% (12).
Las diferentes cifras de mortalidad dependen fundamentalmente del grado de
hemorragia (que condiciona la urgencia) y la contaminación bacteriana (que
condiciona el tipo de cirugía y su revascularización).
La laparotomía ayuda al diagnóstico y permite la toma de
decisiones. Las fases quirúrgicas se resumen en: 1) control de la aorta, 2)
eliminación de la fístula; 3) cirugía digestiva; y 4) cirugía vascular.
Sobre la fase digestiva, en una publicación sobre 21 FAE (una
primaria), la reparación intestinal fue elegida caso por caso por el cirujano
general. Esta consistió en reparación primaria simple (48%), resección con
anastomosis primaria (38%) y parches con pleura u epiplón en casos
individuales. Seis pacientes (32%) fallecieron en los 90 días; los pacientes
que requirieron resección intestinal murieron mas frecuentemente (66%) que
aquellos con reparación simple (10%) (6). Por tanto, el método de
reparación intestinal se relaciona también con la supervivencia en estos
pacientes.
Con respecto a la reparación vascular, existen más datos. El
tratamiento curativo consiste en retirar la prótesis problema y revascularizar
con un nuevo injerto/prótesis por vía extraanatómica o “in situ”, asociada a
una terapia antibiótica prolongada. Conjuntamente existen planteamientos menos
agresivos.
La cirugía clásica (estándar) consiste en la ligadura de la
aorta, retirada de la prótesis y revascularización mediante un bypass
axilo-bifemoral, en uno o dos tiempos (antes de la retirada de la prótesis
problema). Esta técnica tiene una elevada tasa de mortalidad operatoria
(25-90%) y amputación de extremidades inferiores (5-25%) (3-4).
Para mejorar esos resultados, se propuso la revascularización
“in situ” con un injerto (homoinjerto arterial o autoinjerto venoso) o prótesis
(convencional o impregnada) una vez retirada la prótesis problema. Este
proceder redujo la mortalidad operatoria (27-30%) (4)- Para Kakkos y
cols, sobre 403 casos, alcanzo el 49% (12).
Mientras la primera opción se realiza cuando el campo
operatorio está infectado, la sustitución “in situ” se reserva para situaciones
con infección circunscrita, como las erosiones enteroprotésicas, estando
contraindicada en septicemias, supuración y necrosis periaórtica difusa, así
como en infecciones por bacterias gramnegativas (11). Nuestro
paciente presento una bacteriemia (E.coli) tratada con
amoxilicilia-clavulanico, 19 días antes de la cirugía.
La revisión de Martínez y cols (11) (Tabla 3)
informan que incluso tras una intervención exitosa persiste una elevada
morbilidad (9% de amputación de miembros inferiores, 22% de reinfección
protésica y 20% de trombosis en los casos de bypass extraanatómico). Asimismo,
cuando se realiza un bypass extraanatómico, tras la retirada de la prótesis y
ligadura de la aorta, existe un riesgo de sangrado a través del muñón aórtico
(6-50%), habiendose descrito una mortalidad relacionada con esta complicación
de hasta el 89%.
Posteriormente apareció el tratamiento endovascular (que
permite recubrir la aorta con una endoprótesis y así bloquear la FAE). Este
proceder tiene menor morbilidad y mortalidad y se prefiere en situaciones de
alto riesgo, siendo de elección para pacientes con shock hemorrágico debido a
su efecto hemostático. Sin embargo, no elimina el riesgo de infección o
reinfección en pacientes con FAE secundaria, a pesar de la administración de
antibióticos a largo plazo. Por lo tanto, en los casos donde sea posible, la
endoprótesis debe considerarse un procedimiento puente a una posterior cirugía
abierta (4,14).
Antoniou y cols (17) recopilaron 41 FAE tratadas
mediante endoprótesis (33 informes) y un seguimiento medio de 13 meses. La
infección persistente/recurrente o hemorragia recurrente apareció en el 44%.
Las FAE secundarias, en comparación con las primarias, tenían un riesgo casi
tres veces mayor de infección persistente/recurrente. La sepsis preoperatoria
era un factor de mal pronóstico. La infección persistente/recurrente
post-tratamiento se asoció a peor supervivencia.
Un estudio multicéntrico que comparó la reparación abierta
frente a la endovascular mostró una morbilidad general más baja en pacientes
endovasculares (25% frente a 77%), pero la infección secundaria persistió
debido a la eliminación incompleta de la prótesis infectada (2).
La revisión de Kakkos y cols (12), al incluir un
gran número de pacientes (n = 823) les permitió realizar comparaciones entre
las técnicas abiertas y endovasculares en el tratamiento de las FAE. La cirugía
abierta tuvo una mayor mortalidad hospitalaria (33,9%), respecto los métodos
endovasculares (7,1%), pero que se reducía durante el seguimiento a largo
plazo. Complementariamente un enfoque endovascular por etapas, en candidatos
adecuados logró los mejores resultados; así la endoprótesis seguida de
reparación in situ, con injertos venosos, mejoran los resultados a largo plazo,
si bien los casos publicados superan escasamente la docena.
Así las cosas, disponemos de dos tratamientos vasculares
curativos (revascularización extraanatómica o remplazo “in situ”) y otro no
curativo (endoprótesis aórtica, sin explantar la prótesis original) que puede
terminar siendo curativo si se contempla una segunda etapa; mientras los
primeros presentan elevada morbilidad y mortalidad, el segundo no libera al
paciente de la posible recidiva y el tercero (etapas) solo es posible en casos
muy seleccionados (y con una experiencia muy limitada).
Por ello, hay autores que realizaron un planteamiento
quirúrgico similar al nuestro: sutura simple del duodeno una vez que la
prótesis es separada del duodeno. Para proteger el intestino, se inserta un
fragmento pediculado del epiplón mayor entre duodeno y prótesis. La prótesis se
mantiene en su lugar al no existir signos locales o sistémicos de infección, ni
de hemorragia. Así trataron Geraci y cols (3) un paciente cuyo
postoperatorio y seguimiento a seis meses fue normal.
Kavanagh y cols (18) sobre 21 FAE (7 primarias) y
una supervivencia global del 38%, emplearon la reparación primaria en cuatro
pacientes con una mortalidad del 25%.
Kakkos y cols (12), en la revisión varias veces
referida, encontraron 18 casos donde no se realizó reparación arterial,
principalmente eran fístulas paraprotésica o erosiones; la prótesis original no
fue eliminada y esta se trató mediante omentoplastia. Un análisis de los
resultados mostro: a) que esta reparación primaria de FAE es menos duradera que
otras técnicas de cirugía abierta, con una tasa de recurrencia del 100% a los 2
años; b) que la tasa de supervivencia a 5 años fue similar a otras técnicas
abiertas y finalmente c) que la tasa libre de mortalidad a 3 años se situó en
el 45% de los casos.
Los múltiples motivos para nuestra decisión fueron:
1)
Descartamos
el planteamiento endovascular. Un análisis preoperatorio mostró una anatomía
lesional no favorable.
2)
Nuestro
planteamiento inicial era explantar la prótesis y decidir intraoperatoriamente
el tipo de revascularización (bypass axilo-bifemoral o prótesis impregnada en
plata “in situ”), pero cambiamos a una actitud conservadora por:
- No FAE propiamente dicha, sino erosión protésica.
- No sangrado en cavidad peritoneal o retroperitoneal.
- No contaminación macroscópica. No exudado, ni pus
local.
- No infección sistémica.
- Edad y comorbilidad del paciente.
- Situación hospitalaria (Covid-19). En la fecha de la
cirugía, el registro de la Junta de Castilla y
León, informaba que en nuestro hospital había 44 pacientes ingresados en planta
y 4 en UCI.
Sin embargo, una mirada retrospectiva demuestra que muchas
decisiones fueron negativas; aunque sea anecdótico, incluso las fotos
realizadas durante la cirugía salieron desenfocadas. Existen ocasiones, como la
vivida, donde la Ley de Murphy o sus corolarios prevalecen: “Si existe la
posibilidad de que varias cosas salgan mal, la que cause más perjuicios será la
que salga mal”. Así cuando parecía que ya nada podia salir peor, las cosas
empeoraban; así la hemorragia de casi 3 litros que sufrió el paciente y que
obligo a re-operar seguramente motivó o facilitó su infarto cerebral.
Conjuntamente esa hemorragia indujo una respuesta inflamatoria sistémica que se
multiplico por el coronavirus y contribuyó al fallecimiento. Verdaderamente
parece aplicable la maldición de Marlowe: “La frustración de perder un paciente
dura más que la alegría de salvar a uno” (19).
Pero no queremos escondernos tras estas inevitables y cínicas
leyes que denotan una actitud pesimista o de resignación. Tampoco manifestar un
espíritu defensivo, sino propiciar un aprendizaje positivo; parafraseado a
otros “una crisis consiste en no poder decir que olvidemos el tema” (Feguson) y
sobre todo “que el buen juicio proviene de las malas experiencias” (Higdon) (19).
Afortunadamente en la literatura hay datos que indican que
muchas FAE secundarias podrían ser prevenibles. Aunque el exacto mecanismo
patogénico es desconocido, los factores mecánicos e infecciosos parecen ser las
causas más frecuentes de esta complicación postquirúrgica. Conjuntamente, las
FAE aparecen con mayor frecuencia después de procedimientos urgentes y
reoperaciones (14). Por ello, no debemos olvidar la importancia de
practicar una cirugía particularmente delicada y una profilaxis/terapia
antibiótica en los casos indicados (3).
Finalmente referir como desde hace años llaman nuestra
atención aquellas publicaciones que incluyen en su título la palabra
"pesadilla" (20). Cuando lees esos artículos te compadeces
o haces piña con los autores sobre su desafortunado resultado, o mejor como dice
Butman (21) “elogias a sus autores por compartir con los lectores un
día salvaje y desafortunado”. Como refiere Blunt (1): “Los cirujanos
vasculares honestos comenten errores, los cirujanos inteligentes aprenden de
ellos”; nos gustaría pertenecer a ese grupo.
Conflicto de intereses
Los autores
declaran no tener conflicto de interés
Financiación
Los autores declaran no tener financiación
Agradecimientos
A María Jesús y Elena, del servicio de bibliotecas de la
Facultad de Medicina de la Universidad de Salamanca, por su eficacia y gran
ayuda en la búsqueda de documentación para la realización de este trabajo.
Referencias
1. Blunt TJ. Vascular Graft Infections. Futura Publishing
Company, Inc. Armonk, New Yok, 1994.
2. Simó Alari F, Molina González E, Gutierrez
I, Ahamdanech-Idrissi A. Secondary aortoduodenal
fistula and the unrecognized herald bled. BMJ Case Rep 2017:bcr2017220186.
3. Geraci G, Pisello F,
Volsi FL, Facella T, Platia L, Modica G, et
al. Secondary aortoduodenal fistula. World
J Gastroenterol 2008;14(3):484-6.
4. Makimoto
S, Takami T, Shintani H, Kataoka N, Yamaguchi T, Tomita M, et al. Cases of two
patients with aortoduodenal fistula who underwent emergency operation. Int J Surg Case Rep 2020;69:87-91.
5.
Tejedor-Tejada J, Núñez Rodríguez H, Domingo
L. Secondary aortoduodenal fistula with the presentation of gastrointestinal
bleeding: a case report. Rev Esp Enferm Dig 2019;111(7):575.
6.
Cendan JC, Thomas JB 4th, Seeger
JM. Twenty-one cases of aortoenteric fistula: lessons for the general surgeon.
Am Surg 2004;70(7):583-7.
7.
Bunt TJ. Synthetic vascular graft infections. II. Graft-enteric erosions
and graft-enteric fistulas. Surgery
1983;94(1):1-9.
8.
Bergqvist D, Björck M, Nyman R. Secondary aortoenteric fistula after endovascular aortic
interventions: A systematic literature review.
J Vasc Interv Radiol 2008;19(2 Pt 1):163-5.
9. Gomez-Alonso A, Lozano F, Cuadrado F, Almazan A. Traumatic aorto-esophageal fistula. J Thorac Cardiovasc Surg 1984;87(1):148-9.
10. Lozano FS, Muñoz-Bellvis L, San Norberto E, García-Plaza A,
González-Porras JR. Primary
aorto-duodenal fistula: New case reports and a review of the literature. J
Gastrointest Surg 2008;12(9):1561-5.
11. Martínez Aguilar E, Acín F, March JR, Medina
FJ, de Haro J, Flórez A. Reparación de las fístulas
aortoentéricas secundarias. Revisión sistemática. Cir Esp 2007;82(6):321-7.
12.
Kakkos SK, Bicknell CD, Tsolakis IA, Bergqvist D; Hellenic Co-operative Group on Aortic
Surgery. Editor's Choice - Management of secondary aorto-enteric and other abdominal arterio-enteric
fistulas: A review and pooled data analysis. Eur
J Vasc Endovasc Surg 2016;52(6):770-86.
13.
Feo CF, Ginesu GC, Pinna A, Galotti F,
Paliogiannis P, Fancellu A, et al. In situ reconstruction with autologous
graft in the treatment of secondary aortoenteric fistula: A retrospective case
series. Ann Med Surg (Lond) 2019;49:53-56.
14.
Hansen BA, Amundsen S, Reikvam H, Wendelbo O,
Pedersen G. Non-curative surgery for aortoenteric fistula. J Surg Case Reports
2017;8:1-3.
15. Khan A, Ahmad E, Javaid S, Sankari MR. An Insidious gastrointestinal bleeding
from secondary aortoduodenal fistula leading to septic shock. Case Rep Gastrointest Med 2019:6261526.
16.
Riddle PJ Jr, Shetty A, Brock AS.
Confirmatory visualization of an aorto-enteric fistula with
esophagogastroduodenoscopy. Clin
Gastroenterol Hepatol 2019;17(13):e157.
17.
Antoniou GA, Koutsias S, Antoniou SA,
Georgiakakis A, Lazarides MK, Giannoukas AD. Outcome after endovascular stent graft
repair of aortoenteric fistula: A systematic review. J Vasc Surg 2009;49(3):782-9.
18.
Kavanagh DO, Dowdall JF, Younis F, Sheehan S,
Mehigan D, Barry MC. Aorto-enteric fistula: changing management strategies. Ir
J Med Sci 2006;175(1):40-4.
19. Matthews R. Tumbling toast, Murphy’s Law and
the fundamental constants. Eur J Phys 1995;16(4):172-6.
20. Hammon JW. Aortic nightmares:
can we sleep better?. J Thorac Cardiovasc Surg
2003;125(6):1200-1.
21.
Butman SM. Murphy's Law and Us. Catheter
Cardiovasc Interv 2011;78(2):244-5.
![]()


