ORIGINAL
¿Puedo diagnosticar la hipoglucemia en hurones domésticos (Mustela putorius furo) con el uso de glucómetros portátiles?
Can I diagnose hypoglycemia in domestic ferrets (Mustela putorius furo) with the use of portable glucometers?
Óscar Miñana Morant
Clínica Veterinaria Babieca. Gandía. Valencia. España
https://orcid.org/0000-0003-0227-4710
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Resumen
Objetivo. El diagnóstico de la hipoglucemia en hurones (Mustela putorius furo) se basa en la detección de un nivel de glucosa en la sangre inferior a 60- 70 mg / dl. Una concentración de glucosa en sangre por debajo de estos niveles es muy sugestiva de tumor de células beta pancreáticas (insulinoma), que comprende aproximadamente el 25% de todas las neoplasias diagnosticadas en esta especie. En este estudio se pretende comprobar si los bajos valores de glucosa en sangre obtenidos mediante el uso de glucómetros portátiles son fiables como método de diagnóstico de hipoglucemia en esta especie.
Material y métodos. En este estudio se analizan 31 muestras de sangre de hurones de distinta edad y sexo, mediante el uso de tres tipos de glucómetros portátiles, comparando dichos resultados con las medidas obtenidas mediante un analizador de bioquímica líquida que usa el método de la glucosa oxidasa, considerado como uno de los métodos estándar de medida.
Resultados. Uno de los tres glucómetros utilizado en este estudio subestima los valores de glucosa en sangre en esta especie, mientras que otro los sobreestima, lo que supone un error sistemático (predecible) de los equipos que se podría solucionar calibrándolos para esta especie. El otro glucómetro que presenta mayor concordancia con los valores de referencia presenta un error aleatorio elevado (impredecible) más difícil de corregir. Por tanto ninguno de los tres equipos sería adecuado para realizar un diagnóstico fiable de hipoglucemia en hurones.
Conclusiones. Estos resultados indican que las concentraciones de glucosa en sangre en hurones deben confirmarse con un analizador de laboratorio validado para realizar el diagnóstico de hipoglucemia de forma fiable, y los glucómetros usarse sólo para hacer un seguimiento de la enfermedad.
Palabras clave
hipoglucemia; insulinoma; glucómetro
Abstract
Aims. The diagnosis of hypoglycemia in ferrets (Mustela putorius furo) is based on the detection of a blood glucose level below 60-70 mg / dl. A blood glucose concentration below these levels is very suggestive of pancreatic beta cell tumor (insulinoma), which comprises of approximately 25% of all neoplasms diagnosed in this species. This study aims to check if the low blood glucose values obtained through the use of portable glucometers are reliable as a method of diagnosing hypoglycemia in this species.
Material and methods. In this study, 31 samples of ferrets blood of different ages and sexes are analyzed, using three types of portable glucometers, comparing these results with the measurements obtained by a liquid biochemistry analyzer using the glucose oxidase method, considered as one of the standard measurement methods.
Results. One of the three glucometers used in this study underestimates blood glucose values in this species, while another overestimates them, which is a systematic error (predictable) of the equipment that could be solved by calibrating them for this species. The other glucometer is more consistent with the reference values, but has a high random error (unpredictable), that is more difficult to correct. Therefore none of the three teams would be adequate to make a reliable diagnosis of hypoglycemia in ferrets.
Conclusions. These results indicate that blood glucose concentrations in ferrets should be confirmed with a validated laboratory analyzer to reliably diagnose hypoglycemia, and blood glucose meters used only to monitor the disease.
Keywords
hypoglycemia; insulinoma; glucometer
Introducción
El diagnóstico de la hipoglucemia en hurones (Mustela putorius furo) se basa en la detección de un nivel de glucosa en la sangre inferior a 60- 70 mg / dl(1,2).
Una concentración de glucosa en sangre por debajo de estos niveles es muy sugestiva de insulinoma, que comprende aproximadamente el 25% de todas las neoplasias diagnosticadas en esta especie(2). Otras causas de hipoglucemia mucho menos comunes incluyen: enfermedad hepática severa, sepsis, ayuno prolongado y otras neoplasias(2).
Los medidores portátiles de glucosa (glucómetros) son ampliamente utilizados en medicina de animales de compañía debido a su bajo coste y a la capacidad de proporcionar resultados inmediatos, aunque no siempre proporcionan resultados que se corresponden con los de los analizadores de laboratorio(2,3). Particularmente en esta especie se ha llegado a considerar que hasta la mitad de los hurones normoglucémicos se diagnostican como hipoglucémicos cuando se utilizan los glucómetros portátiles diseñados para su uso en humanos (50% de falsos positivos)(1).
Este trabajo compara tres glucómetros portátiles diseñados para el análisis de glucosa en humanos y en perros y gatos con un analizador de bioquímica líquida que usa el método de la glucosa oxidasa (considerado como estándar de referencia(4,5).
Material y Métodos
Se han realizado 31 extracciones de sangre a hurones de distinta edad y sexo. Todas las muestras han sido obtenidas de la vena cava craneal bajo anestesia con isofluorano (Imagen 1).
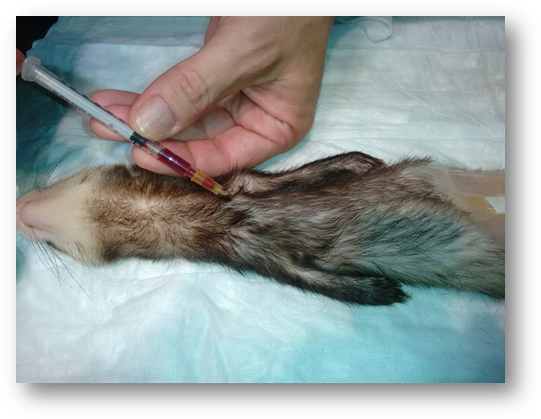 Imagen
1. Extracción de sangre de la vena cava craneal
Imagen
1. Extracción de sangre de la vena cava craneal
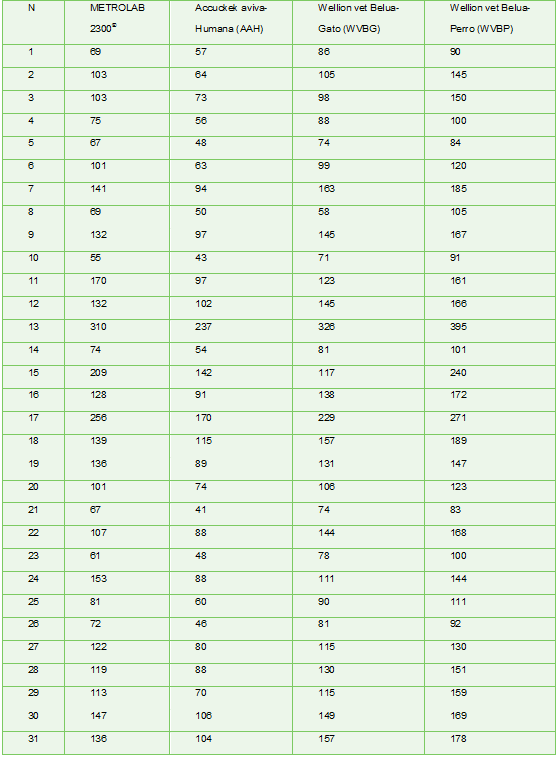
Algunos hurones estaban diagnosticados como hipoglucémicos y otros se consideraron totalmente sanos. Las muestras obtenidas han sido inmediatamente analizadas con un glucómetro portátil diseñado para humanos (Accuchek aviva®) y con un glucómetro diseñado para la especie canina y felina (Wellion vet Belua® -perro, Wellion vet Belua ® -gato). Los resultados obtenidos son comparados con un analizador de bioquímica líquida (Metrolab 2300®), que usa el método enzimático de la glucosa oxidasa y que se calibra semanalmente (Tabla 1).
Tabla 1. Valores de glucosa (mg/dl) obtenidos con los distintos equipos de medida.
La medición de los valores de glucosa con los glucómetros portátiles se realiza con sangre entera inmediatamente después de su extracción, mientras que la medición realizada con el analizador de laboratorio se realiza con plasma heparina litio para poder centrifugar las muestras rápidamente y evitar la glucólisis al no tener que esperar a que la sangre coagule.
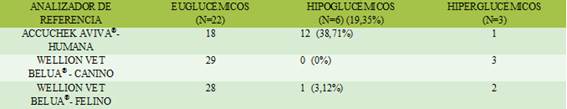
Las muestras se clasifican como hipoglucémicas (concentración plasmática de glucosa <70 mg /dl), euglucémicas (concentración de glucosa en plasma de 70 a 200 mg / dl), o hiperglucémicas (concentración de glucosa en plasma > 200 mg / dl)(2) (Tabla 2).
Tabla 2. Número de animales diagnosticados como hipoglucémicos según los distintos equipos de medida.
La norma actual en medicina humana (ISO 15197:2013) para que los glucómetros se consideren fiables es que las mediciones de glucosa obtenidas no deben diferir en más del 15% del valor de referencia
Los resultados obtenidos se analizaron y compararon utilizando el coeficiente de correlación de Pearson, el coeficiente de concordancia de Lin y el Método de Bland- Altman(6).
Resultados
Los coeficientes de correlación obtenidos para los diferentes glucómetros son: 0,9735 para el Accuchek-aviva humana® (AAH), , 0,9558 para el Welion vet Belua®- perro (WVBP) y 0,8983 para el Welion vet Belua®- gato (WVBG), mientras que los coeficientes de concordancia son: 0,7309 para AAH, 0,8432 para WVBP y 0,894 para WVBG.
Con el glucómetro AAH todos los valores difieren más del 15% del valor de referencia. Con el glucómetro WVBP el 22,58% (7/31) no difieren más de este porcentaje, mientras que con el glucómetro WVBG se obtiene el 67,74% (21/31) dentro de este porcentaje.
Considerando animales hipoglucémicos a aquellos cuyo valor obtenido de glucosa es inferior a 70 mg/dl2, con el analizador de referencia se obtienen 6 muestras positivas (19,35%). Con el glucómetro AAH los animales considerados hipoglucémicos son 12 (38,71%), con el glucómetro de WVBP no hay ninguna muestra inferior a este valor (0%) y con el WVBG se obtiene 1 muestra positiva (3,12%) (Tabla 2).
Discusión
El mejor coeficiente de correlación ha sido el obtenido con el glucómetro AAH (0,9733), lo que indica que este glucómetro es el que menor error aleatorio presenta (error impredecible), pudiendo considerarse por ello el glucómetro más exacto. Sin embargo es el que presenta el menor coeficiente de concordancia (0,7179). Observando la media de la diferencias en el gráfico de Altman (Gráfica 1), se aprecia que hay un error sistemático hacia abajo (este glucómetro tiende a subestimar los valores de glucosa). En todas las medidas los resultados difieren en más del 15% de los valores de referencia. Con este glucómetro se han considerado 12 animales como hipoglucémicos lo que supone un 50% de falsos positivos. Los resultados obtenidos con este glucómetro (diseñado para humanos) en el que se subestiman los valores de glucosa de los hurones, coincide con los resultados obtenidos en otros estudios con glucómetros también diseñados para humanos. Estos resultados se dan tanto usando sangre sin anticoagulante como usando sangre con heparina(2,3).
Con el glucómetro WVBP el coeficiente de correlación sigue siendo aceptable (0,9539), lo que indica que también presenta un error aleatorio bajo. El coeficiente de concordancia ha sido algo más elevado (0,8386) que con el anterior glucómetro. El gráfico de Altman (Gráfica 2) indica un error sistemático hacia arriba, por la que tiende a sobreestimar los valores de glucosa en esta especie. Además en el 77,42% de las muestras los resultados han diferido en más del 15%. No se ha obtenido ningún resultado como hipoglucémico, lo que supone que habría 6 animales diagnosticados como falsos negativos.
El mejor coeficiente de concordancia se ha obtenido con el glucómetro WVBG (0,894). Sin embargo el coeficiente de correlación ha sido muy inferior al de los otros dos glucómetros (0,8983), lo que indica que es el glucómetro con mayor error aleatorio (impredecible). En el gráfico de Altman (Gráfica 3), la media de las diferencias es de 2, lo que confirma que es el glucómetro con menor error sistemático de los tres, pero los límites de concordancia son 50,51 y -46,51, es decir que con un 95% de probabilidad los valores obtenidos pueden variar arriba o abajo entre estos valores, lo cual tampoco es aceptable. El número de muestras en las que los valores han diferido en más del 15% ha sido del 32,26% y se ha considerado una sola muestra como hipoglucémica, lo que supone que hay 5 animales diagnosticados como falsos negativos.
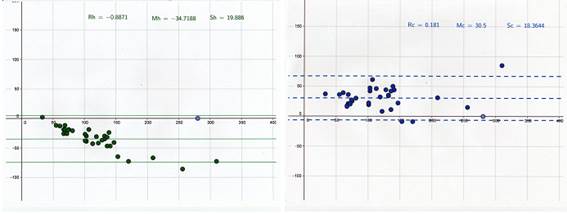
Gráfica 1 Gráfica 2
El método Bland- Altman representa gráficamente las diferencias entre dos mediciones frente a su media. La media de estas diferencias (línea horizontal central) representa el error sistemático. Los límites de concordancia del 95% (líneas horizontales superior e inferior) informan entre qué diferencias oscilan la mayor parte de las medidas tomadas con los 2 métodos.
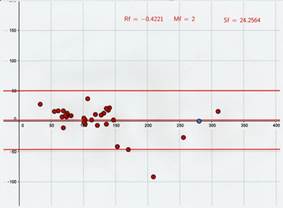
Gráfica 3
Un análisis de encuestas realizado por el College of American Pathologists (CAP) revela que el método de la hexoquinasa o glucosa oxidasa se usa en prácticamente todos los análisis que se realizan en los Estados Unidos(4). Una comparación de los resultados de aproximadamente 6000 laboratorios clínicos revela que las concentraciones medias de glucosa medidas en muestras de suero por los métodos de hexoquinasa y glucosa oxidasa son esencialmente las mismas(5). La mayoría de glucómetros portátiles y los que se presentan en este trabajo usan el método de la glucosa deshidrogenasa.
Conclusiones
Los glucómetros AAH y WVBP subestiman y sobrestiman los valores de glucosa en hurones respectivamente, lo que supone un error sistemático (predecible) de los equipos que se podría solucionar calibrándolos para esta especie. El glucómetro WVBG que presenta mayor concordancia con los valores de referencia presenta un error aleatorio elevado (impredecible) más difícil de corregir. Por tanto ninguno de los tres equipos sería adecuado para realizar un diagnóstico fiable de hipoglucemia en hurones.
La fiabilidad y concordancia de los instrumentos de medida son aspectos fundamentales en medicina tanto humana como veterinaria que no siempre se tienen en cuenta. El uso de instrumentos sujetos a error puede llegar a tener implicaciones importantes en el diagnóstico y tratamiento.
Estos resultados indican que las concentraciones de glucosa en sangre en hurones deben confirmarse con un analizador de laboratorio validado, y los glucómetros usarse sólo para hacer un seguimiento.
Referencias
1. Di Girolamo N, Selleri P. Medical and Surgical Emergencies in Ferrets. Veterinary Clinics of North America: Exotic Animal Practice. Volume 19, Issue 2, May 2016, Pages 431–464.
2. Petritz OA, Antinoff N, Chen S, Kass PH, Paul-Murphy JR. Evaluation of portable blood glucose meters for measurement of blood glucose concentration in ferrets (Mustela putorius furo). JAVMA, Vol 242, No. 3, February 1, 2013: 350- 354.
3. Gómez Pizano DA , Rodríguez Hernández A , Ducoing Watty AM , Castillo Mata DA , Maldonado Reséndiz RI. Medición de glicemia en hurones: evaluación de tres métodos portátiles de uso humano. Journal of negative and no positive results, 2019, 4 (8): 785-795. DOI: 10.19230/jonnpr.3044
4. Sacks DB. Carbohydrates. In: Burtis CA, Ashwood ER, Bruns DE, eds. Tietz textbook of clinical chemistry and molecular diagnostics. 5th ed. St. Louis: Elsevier Saunders, 2012.
5. Miller WG, Myers GL, Ashwood ER, Killeen AA, Wang E, Ehlers GW, et al. State of the art in trueness and interlaboratory harmonization for 10 analytes in general clinical chemistry. Arch Pathol Lab Med 2008; 132: 838-46.
6. Carrasco JL y Jover L. Métodos estadísticos para evaluar la concordancia. Med Clin (Barc) 2004;122(Supl 1):28-34.