EDITORIAL (Versión española)
Farmacogenética y trastornos mentales
Pharmacogenetics and mental disorders
Ignacio Jáuregui-Lobera
Instituto de Ciencias de la Conducta y Universidad Pablo de Olavide. Sevilla. España
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
La farmacogenética incluye el estudio de mutaciones de un solo gen y su efecto sobre la respuesta a los medicamentos, analizando las variaciones estructurales del ADN y el impacto en el metabolismo, la eficacia y la tolerabilidad de los medicamentos en función del hecho de que el ADN permanece estable y no cambia con el tiempo o la edad. La variación polimórfica en los genes que codifican las funciones de los transportadores, las enzimas metabolizadoras, los receptores y otras proteínas puede dar lugar a diferencias individuales en las relaciones dosis-concentración plasmática de muchos agentes terapéuticos importantes. Un término mucho más amplio se refiere a la farmacogenómica, que se centra en examinar todo el genoma para evaluar varios determinantes de las respuestas a los medicamentos. Su estudio incluye variaciones de todo el genoma y posibles interacciones complejas, así como alteraciones en la expresión génica y modificaciones post-translacionales (por ejemplo, proteómica) que se correlacionan con la respuesta al fármaco(1,2). En general, la farmacogenética se ocupa de genes individuales y su estructura, mientras que la farmacogenómica se relaciona con la función genética influenciada por el medio ambiente; ambos pueden desempeñar un papel en las enfermedades, incluido el metabolismo de los medicamentos(3).
El advenimiento de la farmacogenómica comenzó este siglo después de la finalización del estudio del genoma humano en 2003, y la disponibilidad inmediata de nuevas tecnologías de genotipado y secuenciación, que han permitido la evaluación de todo el genoma(3).
La farmacogenética utiliza la información genética del paciente para seleccionar el tratamiento farmacológico más apropiado, maximizando la eficacia terapéutica y minimizando los efectos adversos. En este sentido, la farmacogenética tiene como objetivo practicar una medicina personalizada. La farmacogenética facilita que el médico seleccione entre diferentes alternativas farmacológicas de forma personalizada, permite la recomendación de dosis específicas para cada paciente y ayuda a anticipar información sobre seguridad farmacológica. Además, permite aumentar el número de pacientes que responden a un tratamiento específico y ayuda a reducir el tiempo necesario para seleccionar el tratamiento más apropiado en cada caso, mejorando así la calidad de vida de los pacientes(4,5). La Figura 1 muestra la idea básica de este enfoque.
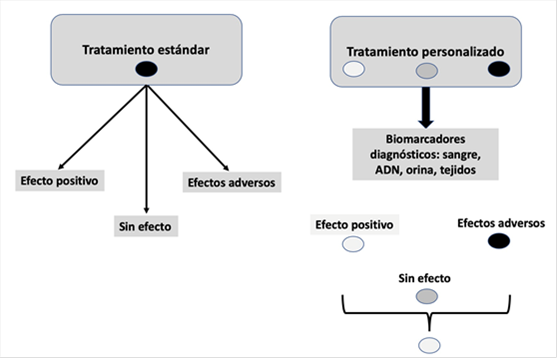
Figura 1. Tratamiento estándar versus tratamiento personalizado
La farmacogenética se basa con mayor frecuencia en el sistema enzimático citocromo P450, que se encuentra principalmente en el hígado e involucra genes que codifican la producción de enzimas citocromo P450. La respuesta a los medicamentos depende de la capacidad de cada individuo para metabolizar los medicamentos, y la mayoría de los medicamentos metabolizados por este sistema enzimático dependen de la composición genética de cada persona. Aproximadamente el 90% de todos los medicamentos son metabolizados por siete enzimas citocromo (CYP1A2, CYP3A4, CYP3A5, CYPC19, CYP2D6, CYP2C9 y CYP2B6). En el caso de CYP2D6 (el gen CYP2D7 se encuentra en el cromosoma 22ql3.1), contribuye a la metabolización-oxidación del 25% de los medicamentos prescritos con mayor frecuencia. Figura 2.
El gen CYP2D7 tiene más de 130 variantes genéticas con alteraciones que incluyen duplicaciones, polimorfismos de un solo nucleótido, defectos de empalme, deleciones y mutaciones con desplazamiento de la pauta de lectura. Como resultado de esta complejidad, se puede encontrar una actividad enzimática disminuida, aumentada o no funcional. Además, el medio ambiente puede alterar las enzimas del citocromo P450 en forma de inhibidores o inductores, así como también puede verse afectado por las interacciones farmacológicas(3).
Las pruebas de farmacogenética para optimizar los tratamientos son relevantes en salud mental, campo en el que la FDA reconoce que el 20% de los 121 marcadores de farmacogenética son informativos para la práctica clínica con uso de psicofármacos(6).
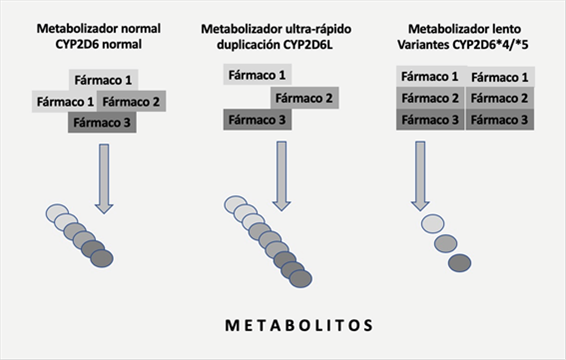
Figura 2. Metabolizadores normales, ultrarrápidos y lentos
Por lo tanto, una prescripción personalizada de medicamentos en salud mental daría como resultado:
• Una reducción de los costos financieros y personales relacionados con los efectos adversos de los medicamentos.
• Menos tiempo para seleccionar la medicación y las dosis más apropiadas.
• Menos reacciones adversas a los medicamentos.
• Menos visitas a urgencias.
• Menos medicamentos recetados.
Mediante este enfoque, es posible identificar si un individuo tiene un estado metabolizador normal, rápido o deficiente antes de recetar un medicamento específico. En este sentido, los profesionales serían más selectivos con una mayor garantía de éxito basada en el patrón genético del individuo(6).
En España, el estudio AB-GEN, que incluyó 316 pacientes con depresión mayor, fue diseñado para evaluar la eficacia de Neurofarmagen® (una plataforma médica específicamente diseñada para proporcionar un medicamento personalizado en el campo de la psiquiatría basado en los análisis farmacogenéticos) en la selección del tratamiento más adecuado. La eficacia fue del 51,3% (Neurofarmagen®) frente al 36,1% (tratamiento estándar). Con respecto a los efectos adversos después de un tratamiento de 12 semanas, los porcentajes de pacientes libres de esos efectos secundarios fueron 68.5% (Neurofarmagen®) vs 51.4% (tratamiento estándar). Neurofarmagen® incluye más de 20 antidepresivos, 12 antipsicóticos, varios ansiolíticos, estabilizadores del estado de ánimo, anticonvulsivos y otros como el metilfenidato o la atomoxetina(5).
En otro estudio (estudio GENEPSI), Espadaler et al. descubrieron que el uso de Neurofarmagen® redujo el número de pacientes no estabilizados en un 40% independientemente del trastorno mental que padecieran. Este estudio incluyó a 182 pacientes con diferentes trastornos mentales con un seguimiento de 12 semanas(7).
Hoy en día, la creciente lista de tests personalizados vinculados a los genes del citocromo P450 a menudo incluye otros genes que juegan un papel en el campo de los trastornos mentales (receptores de neurotransmisores, transportadores, enzimas metabólicas, funciones del canal iónico). Todos estos genes juegan un papel en los aspectos farmacodinámicos de los medicamentos psiquiátricos. Con este nuevo enfoque, los psiquiatras y psicólogos pueden usar su base de conocimientos y experiencia en los trastornos mentales en el contexto de la farmacogenética para ayudar a los pacientes y a los médicos a tomar mejores decisiones y elecciones con respecto a los planes de tratamiento y la selección de medicamentos(3).
Referencias
1. McCarthy AD, Kennedy JL, Middleton LT. Pharmacogenetics in drug development. Philos Trans R Soc Lond B Biol Sci. 2005;360:1579-1588.
2. Lesko LJ, Salerno RA, Spear BB, Anderson DC, Anderson T, Brazell C, et al. Pharmacogenetics and pharmacogenomics in drug development and regulatory decision making: Report of the first FDA-PWG-PhRMA-Dru Safe Workshop. J Clin Pharmacol. 2003;43:342-358.
3. Butler MG. Pharmacogenetics and psychiatric care: A review and commentary. J Ment Health Clin Psychol. 2018; 2:17-24.
4. Pirmohamed M. Pharmacogenetics: past, present and future. Drug Discov Today. 2011;16: 852-861.
5. Pérez V, Salavert A, Espadaler J, Tuson M, Saiz-Ruiz J, Sáez-Navarro C, et al. Efficacy of prospective pharmacogenetic testing in the treatment of major depression disorder: results of a randomized, double-blind clinical trial. BMC Psychiatry. 2017;17:250.
6. Hamilton SP. The promise of psychiatric pharmacogenomics. Biol Psychiatry. 2015; 77:29-35.
7. Spadaler J, Tuson M, López-Ibor JM, López-Ibor F, López-Ibor MI. Pharmacogenetic testing of the guidance of Psychiatric treatment: A multicenter retrospective analysis. CNS Spectr. 2016;21:1-10.