ORIGINAL
Capacidad antifúngica de biopelículas de quitosán conteniendo bacterias ácido lácticas
Antifungal ability of chitosan biofilms containing lactic acid bacteria
Carla María Bravo-De la Cruz, Raymundo Rosas-Quijano, Didiana Gálvez-López, Victor Albores-Flores, Alfredo Vázquez-Ovando
Instituto de Biociencias, Universidad Autónoma de Chiapas. Boulevard Príncipe Akishino sin número Colonia Solidaridad 2000, CP. 30798. Tapachula, Chiapas, México.
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Resumen
Introducción. Existen reportes del uso de biopelículas como soporte para la incorporación de microorganismos benéficos, sin embargo, son pocos los reportes donde se evalúe la capacidad antimicrobiana de las biopelículas conteniendo bacterias ácido lácticas (BAL).
Objetivo. Optimizar los componentes de una biopelícula comestible basada en quitosán para conservar la viabilidad y la capacidad antifúngica de la BAL Lactobacillus plantarum CDBB-B-1091 durante 28 días.
Métodos. Bajo un diseño de 8 tratamientos tipo Plackett-Burman se evaluaron dos niveles de 7 factores (glucosa, lactosa, glicerol, almidón, humedad relativa del ambiente, pH, concentración de BAL). De los factores (componentes) que mostraron efecto, se optimizó la concentración mediante la metodología de superficie de respuesta basada en un arreglo de Box-Benhken.
Resultados. Se encontró que la concentración de células (A), concentración de almidón (B) y concentración de glucosa (C) son los componentes de la biopelícula más determinantes para mantener la viabilidad y la capacidad antifúngica contra el hongo fitopatógeno Colletotrichum gloeosporioides. Mediante análisis de superficie de respuesta se obtuvieron los valores óptimos para mantener la viabilidad de las bacterias por 28 días, siendo los valores de 7,009164 log UFC/g película para el factor A, 1,997712% para B y 0,10750016 M para el factor C. De acuerdo al análisis de la varianza la concentración de células el factor más influyente. Sin embargo, para la capacidad antifúngica solamente fue posible obtener inhibición del 100% con películas recién elaboradas, siendo para este día los valores óptimos de 8,9004 log (UFC/g) para el factor A, 2,0% para B y 0,0850143 M para C.
Conclusión. La capacidad antifúngica de las biopelículas conteniendo BAL fue decreciendo a medida que transcurrió el almacenamiento de las biopelículas. Aún con lo anterior, se proponen los modelos de regresión para predecir los valores de viabilidad y la capacidad antifúngica de biopelículas conteniendo la bacteria Lactobacillus plantarum CDBB-B-1091.
Palabras clave
Lactobacillus plantarum; MTT; Colletotrichum gloeosporioides; diseño de superficie de respuesta
Abstract
Introduction. There are reports of the use of biofilms as a support for the incorporation of beneficial microorganisms, however, there are scarce the reports where the antimicrobial capacity of biofilms containing lactic acid bacteria (LAB) is evaluated.
Objective. Optimize the components of an edible biofilm based on chitosan to preserve the viability and antifungal capacity of the LAB Lactobacillus plantarum CDBB-B-1091 for 28 days.
Methods. Through a design Plackett-Burman of 8 treatments, two levels of 7 factors (componente) were evaluated (glucose, lactose, glycerol, starch, relative humidity, pH, BAL concentration). Of the factors that showed effect, the concentration was optimized using the response surface methodology based on a Box-Benhken arrangement.
Results. It was found that cell concentration (A), starch concentration (B) and glucose concentration (C) are the most determining biofilm components to maintain viability and antifungal ability against the phytopathogenic fungus Colletotrichum gloeosporioides. Optimal values were obtained by response surface analysis to maintain the viability of the bacteria for 28 days, the values being 7.009164 log CFU/g film for factor A, 1.997712% for B and 0.10750016 M for factor C. According to ANOVA the concentration of cells being the most influential factor. However, for the antifungal capacity it was only possible to obtain 100% inhibition with freshly made films, for this day the optimal values of 8.9004 log (CFU/g) for factor A, 2.0% for B and 0.0850143 M for C.
Conclusion. The antifungal capacity of the biofilms containing BAL was decreasing as the storage of the biofilms passed. Even with the above, regression models are proposed to predict the viability values and the antifungal capacity of biofilms containing the bacterium Lactobacillus plantarum CDBB-B-1091.
Keywords
Lactobacillus plantarum; MTT; Colletotrichum gloeosporioides; response surface design
Introducción
Para alargar la vida útil o de anaquel de frutas y hortalizas se emplean distintas técnicas como la refrigeración, el uso de atmósferas controladas, uso de absorbentes de etileno, aplicación exógena de fitorreguladores, aplicación de biopelículas o recubrimientos, etc.(1). Dentro de las estrategias que se mencionan, la aplicación de biopelículas ha experimentado un desarrollo exponencial. Las biopelículas pueden definirse como matrices continuas que se elaboran empleando principalmente combinaciones de biomoléculas. En diversos trabajos se han utilizado proteínas de varias fuentes, como las de gluten de trigo(2), gelatina(3), soja(4), caseinato de sodio(5); polisacáridos entre los que destacan el almidón y sus derivados, celulosa, alginatos(6,7) pectinas, gomas, propóleos(8) y quitosán(9,10); lípidos y otras sustancias. El quitosán ha sido uno de los materiales que más ha llamado la atentación debido a su estructura lineal, la cual le permite formar películas resistentes, flexibles y transparentes(11).
Las biopelículas han sido empleadas en distintos alimentos, incluyendo frutas frescas y alimentos mínimamente procesados(12) ya que pueden disminuir la migración de lípidos, mejorar la textura, firmeza, brillo, color y proteger la integridad estructural de los alimentos. Lo anterior es consecuencia de que regulan la velocidad de transferencia de materia (O2, CO2, agua) asociada con la respiración y transpiración en frutas y hortalizas y la transferencia de agua y solutos en otros alimentos procesados(12). Así mismo, se ha demostrado que tienen efecto positivo para controlar el desarrollo microbiano. Además de que por sí solas las biopelículas pueden ejercer un efecto benéfico sobre el alimento, también pueden servir como vehículo para la incorporación de sustancias de diversas índole tales como aditivos, saborizantes, agentes antimicrobianos, enzimas, colores e incluso microorganismos como levaduras(13), bacterias ácido lácticas(14,15) con propiedades antagonistas hacia patógenos que deterioran los alimentos o causan daño a la salud de los consumidores. Cuando los microorganismos son incorporados en las películas se espera puedan producir sustancias para la inhibición de los patógenos(16). Un ejemplo de estos microorganismos lo constituyen las bacterias ácido lácticas (BAL), las cuales, se ha reportado interfieren con el desarrollo de patógenos como Listeria monocytogenes(17,18).
Está ampliamente documentado el efecto antibacteriano de las BAL, y más recientemente se reporta sobre la capacidad de estas bacterias para inhibir hongos(19,20), sin embargo, en la mayoría de los reportes se prueba la capacidad antifúngica de la BAL en enfrentamiento directo (in vitro) contra los hongos indeseables y no hay reportes de que ocurre con su capacidad antifúngica cuando son atrapadas en matrices de biopelículas. En nuestro grupo de trabajo llevamos a cabo la optimización de los componentes de películas elaboradas con quitosán a las cuales se incorporó BAL, logrando mantener hasta un 90.75% de viabilidad después de 7 días de almacenamiento(14). En ese reporte se sugiere que los factores que mayor efecto tienen sobre la viabilidad son el tipo de quitosán (de bajo peso molecular) y la concentración de ácido láctico (1,5%). Sin embargo, en aquel estudio no se comprueba si las bacterias viables conservan la capacidad antifúngica, por lo cual el objetivo del este trabajo fue evaluar la viabilidad y actividad antifúngica de bacterias ácido lácticas incorporadas durante 28 días en biopelículas de quitosán, además de optimizar los componentes de la biopelícula para el mismo propósito.
Materiales y métodos
Reactivos
Se emplearon quitosán (85% de desacetilación y PM=50-190 KDa) marca Sigma®, ácido láctico 85% (Meyer®), almidón soluble (Hycel®), glicerol (Meyer®), lactosa (Bioxon®), glucosa anhidra (Meyer®), bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio (MTT) marca Sigma®, dimetil-sulfóxido (DMSO) marca Sigma®.
Hongos fitopatógenos
Las cepas de los hongos fitopatógenos Rhizopus stolonifer y Colletotrichum gloeosporioides fueron proporcionadas por el cepario del Instituto de Biociencias (IBC) de la Universidad Autónoma de Chiapas (UNACH). Estos hongos fueron previamente aislados de frutas enfermas de papaya Maradol y Colletotrichum gloeosporioides caracterizados previamente mediante claves dicotómicas(21). Se realizaron subcultivos en agar ADP (pH 7,0 a 30 °C) hasta obtener cultivos monospóricos, los cuales fueron inoculados en agar ADP contenido en botellas Roux (pH 7.0 a 30 °C), se esperó la germinación, crecimiento de micelio y esporulación, en promedio cuatro días para R. stolonifer y 15 d para C. gloeosporiodes. Al final, las esporas fueron recogidas en solución Ringer, cuantificadas microscópicamente en cámara de Neubauer y ajustadas a una concentración en solución de 106 esporas/mL.
Evaluación de la capacidad antifúngica in vitro de las BAL
Con el objetivo de emplear las BAL con mayor actividad antifúngica, se evaluó esta capacidad con cinco cepas almacenadas en el cepario del IBC-UNACH. Las cepas de Lactobacillus fermentum CDBB-B-1039 y Lactobacillus plantarum CDBB-B-1091 fueron adquiridas de la Colección Nacional de Cepas Microbianas y Cultivos Celulares del CINVESTAV, y las cepas BAL5, BAL10 y BAL11 fueron aisladas de productos en fermentación. Todas las cepas fueron sometidas a pruebas de catalasa, tinción de Gram y visualización de la morfología microscópica para asegurar la pureza. Posteriormente se realizaron con cada una de las cepas pruebas de inhibición in vitro del crecimiento del micelio de Rhizopus stolonifer y Colletotrichum gloeosporioides por el método de superposición(22). La cepa que presentó inhibición contra los dos fitopatógenos fue posteriormente reactivada en caldo MRS de pH 6.5 y mantenida en agitación para su crecimiento.
Optimización de la composición de las películas
Para determinar los componentes de la biopelícula compuesta basada en quitosán que mayor influencia tuvieran sobre la viabilidad y capacidad antifúngica de bacterias ácido lácticas (BAL), se condujo un diseño experimental de cribado de tipo Plackett-Burman. Mediante un arreglo prediseñado de 8 tratamientos, fueron evaluados dos niveles de 7 factores (glucosa, lactosa, glicerol, almidón, humedad relativa (HR) del ambiente, pH, concentración de BAL) con base en resultados previos(14), tal como se presenta en la Tabla 1. Los números codificados (1, -1) en la Tabla 1 representan, -1= ausencia de glucosa, ausencia de lactosa, ausencia de glicerol, ausencia de almidón, 70% de HR del ambiente, pH 4,5 y concentración celular de 6 log UFC/mL. Por el contrario, el 1= 0,1 M de glucosa, 0,1 M de lactosa, 0,1 g/mL de glicerol, 1,5% de almidón, 90% de HR del ambiente, pH 5,5 y concentración celular 8 log UFC /mL.
Tabla 1. Arreglo factorial basado en el diseño de Plackett-Burman para evaluar la interacción de siete factores sobre la viabilidad y capacidad antifúngica de Lactobacillus plantarum CDBB-B-1091
|
Tratamientos |
Factores |
|
||||||
|
Glucosa |
Lactosa |
Glicerol |
Almidón |
HR del ambiente |
pH |
Células (BAL) |
||
|
T1 |
1 |
-1 |
-1 |
1 |
-1 |
1 |
1 |
|
|
T2 |
1 |
1 |
-1 |
-1 |
1 |
-1 |
1 |
|
|
T3 |
1 |
1 |
1 |
-1 |
-1 |
1 |
-1 |
|
|
T4 |
-1 |
1 |
1 |
1 |
-1 |
-1 |
1 |
|
|
T5 |
1 |
-1 |
1 |
1 |
1 |
-1 |
-1 |
|
|
T6 |
-1 |
1 |
-1 |
1 |
1 |
1 |
-1 |
|
|
T7 |
-1 |
-1 |
1 |
-1 |
1 |
1 |
1 |
|
|
T8 |
-1 |
-1 |
-1 |
-1 |
-1 |
-1 |
-1 |
|
|
Los números 1 y -1 representan; -1=ausencia de glucosa, 1= glucosa 0,1 M,-1=ausencia de lactosa, 1= lactosa 0,1 M,-1=ausencia de glicerol,1= glicerol 100 g/L,-1=ausencia de almidón,1= almidón al 1.5%,-1= 70% humedad relativa del ambiente,1= 90% humedad relativa del ambiente; -1= pH 4,5, 1= pH 5,5, -1= concentración de células 6 log UFC/mL, 1= concentración de células 8 log UFC/mL. |
|
|||||||
Con los componentes (factores) de la biopelícula que mostraron efecto sobre la viabilidad y la capacidad antifúngica en la etapa de cribado de factores se procedió a optimizar su concentración mediante la metodología de superficie de respuesta basada en un arreglo de Box-Benhken. Los factores, las concentraciones y la codificación empleada se muestran en la Tabla 2. Producto de esta codificación se corrieron 15 tratamientos incluyendo tres repeticiones al punto central (Tabla 3).
Tabla 2. Nivel y codificación de las variables empleadas en el diseño de optimización de Box-Benhken
|
Variable |
Código |
Nivel del código |
||
|
-1 |
0 |
+1 |
||
|
Concentración de células (log UFC/mL) |
X1 |
7 |
8 |
9 |
|
Contenido de almidón (%) |
X2 |
1.0 |
1.5 |
2.0 |
|
Concentración de glucosa (M) |
X3 |
0.05 |
0.10 |
0.15 |
Tabla 3. Arreglo del diseño de Box-Benhken con los valores observados y predichos para la viabilidad y capacidad antifúngica de L. plantarum CDBB-B-1091.
|
|
|
|
|
Viabilidad (%) |
Capacidad antifúngica (%) |
||
|
Tratamientos |
X1 |
X2 |
X3 |
Observado* |
Predicho |
Observado* |
Predicho |
|
1 |
-1 |
1 |
0 |
98,14 |
93,95 |
0 |
0 |
|
2 |
0 |
-1 |
-1 |
29,28 |
27,20 |
0 |
0 |
|
3 |
0 |
1 |
1 |
41,76 |
47,08 |
0 |
2,27 |
|
4 |
1 |
0 |
1 |
0,32 |
0 |
0 |
0 |
|
5 |
0 |
0 |
0 |
26,69 |
41,71 |
0 |
9,31 |
|
6 |
0 |
-1 |
1 |
20,74 |
19,26 |
0 |
0 |
|
7 |
1 |
-1 |
0 |
3,47 |
07,98 |
0 |
2,22 |
|
8 |
-1 |
0 |
1 |
48,80 |
71,42 |
0 |
0 |
|
9 |
1 |
0 |
-1 |
3,82 |
2,07 |
0 |
0 |
|
10 |
-1 |
0 |
-1 |
60,10 |
63,67 |
0 |
0 |
|
11 |
1 |
1 |
0 |
17,38 |
10,78 |
0 |
33,62 |
|
12 |
-1 |
-1 |
0 |
56,56 |
64,49 |
0 |
7,45 |
|
13 |
0 |
1 |
-1 |
37,59 |
45,47 |
0 |
17,30 |
|
14 |
0 |
0 |
0 |
11,25 |
54,16 |
6,41 |
9,31 |
|
15 |
0 |
0 |
0 |
45,52 |
41,71 |
0 |
9,31 |
|
*Valores obtenidos con datos de viabilidad y capacidad antifúngica de todos los días de almacenamiento (0 hasta 28 días). |
|||||||
Preparación de la solución para las películas
Las soluciones para formar las películas fueron elaboradas siguiendo el método de casting(23), empleando como polímero base quitosán de bajo peso molecular al 1,5% p/v. Para los tratamientos donde se adicionó almidón, primeramente, se preparó una solución de almidón al 3% (p/v), la cual se sometió a calentamiento (85 °C) y agitación hasta la gelatinización completa del almidón. Posteriormente la solución de almidón se mezcló con la solución de quitosán en la proporción adecuada para lograr la concentración deseada de almidón. Enseguida se adicionaron los demás componentes de la solución (glucosa, lactosa o glicerol, según el tratamiento). Finalmente, y de acuerdo al tratamiento correspondiente, se ajustó el pH (4,5 o 5,5).
Incorporación de bacterias, formación y almacenamiento de películas
El volumen de caldo MRS requerido para obtener las BAL (en función del tratamiento) fue centrifugado a 2500 rpm por 20 min y el sedimento celular lavado dos veces con buffer PBS. Posteriormente, el sedimento fue incorporado a las soluciones de quitosán, las cuales se agitaron mecánicamente hasta lograr la homogenización completa. Para la elaboración de las películas, siguiendo el método de casting, se vertieron 3 mL de la solución en cajas de Petri de 60mm x 15mm. Se dejó secar de 24-48 h a 28±2 °C.
Las biopelículas fueron almacenadas en un espacio común durante 28 días en condiciones de 28±2 °C, 70% de HR, 12 h luz y 12 h oscuridad, mientras que para los tratamientos que requerían una humedad relativa de 90%, las películas se colocaron en recipientes cerrados conteniendo una solución saturada de sulfato de potasio. Por cada tratamiento se elaboraron 20 unidades experimentales (una unidad experimental fue una película proveniente de una caja de Petri).
Evaluación de la viabilidad celular por el método de MTT
A partir del día de secado de las películas (día cero), cada 7 días y durante 28 d se evaluó la viabilidad de las BAL basado en la prueba de reducción del tetrazolio(24), conocida como MTT (bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio). Para esto, se pesaron 30 mg (base húmeda) de biopelícula (por triplicado), y se colocaran en viales de 2 mL, se maceraron con ayuda de un espátula delgada y estéril; posteriormente se le agregó 1 mL de PBS estéril para lavado, posteriormente se centrifugó a 7000 rpm por 10 min, se retiró el sobrenadante y se le agregó 1 mL de buffer PBS pH 7,2, luego se agitó por 10 min. De la mezcla obtenida, se tomaron 50 µL y se colocaron en viales, se le adicionaron 50 µL de solución MTT (0.3% disuelto en buffer PBS y 0.2% de dimetilsulfóxido), se dejó incubar 4 h a 37 ºC. Transcurrido el tiempo, se centrifugó a 1500 rpm por 20 min, posteriormente se le agregaron 150 µL de DMSO para disolver los cristales formados y se agitó durante 10 min (en vortex). A esta solución, se midió la densidad óptica (DO) a una absorbancia de 630 nm en un lector de microplacas, empleando como blanco de calibración buffer PBS. El mismo procedimiento se siguió tomando el volumen necesario del cultivo de células de BAL para obtener la cantidad de células similar a las incorporadas en la cantidad de biopelícula empleada para la determinación; la densidad óptica medida se consideró como DO de las células control. La viabilidad (%) se calculó a partir de la fórmula = (DO células tratadas/DO células control) x 100.
Prueba de la capacidad antifúngica in vitro de las biopelículas
Se evaluó la capacidad antifúngica de las biopelículas mediante el enfrentamiento directo individual de cada biopelícula contra micelio de los dos hongos fitopatógenos(25). Para esto, se tomó un fragmento de micelio (3 mm de diámetro) de cada hongo previamente crecido en agar extracto de malta (24 h para Rhizopus stolonifer y 168 h para Colletotrichum gloeosporioides) y se colocó en el centro de una placa de Petri con AEM, posteriormente sobre éste, se colocó un fragmento circular de la película (diámetro de 10 mm). Las placas se almacenaron a 30±2 °C y cada 24 h se midió el tamaño del micelio. A partir de estos datos y tomando en cuenta un control (micelio en medio AEM sin biopelícula) se calculó el % de inhibición del crecimiento miceliar.
Análisis estadístico
Para definir y evaluar el diseño experimental se empleó el software Statgraphic Centurion XV v. 15.2.06. Estableciendo un límite de confianza de 5%, se probó la significancia de los diseños experimentales de Plackett Burman y de Box-Benhken, así como las interacciones entre los factores. También se obtuvo el modelo de regresión que mostró el mejor ajuste para la relación entre las variables independientes (viabilidad y capacidad antifúngica) y las independientes e interacciones que explicaron el óptimo.
Resultados y Discusión
Selección de bacterias ácido lácticas y capacidad antifúngica in vitro
De las cinco cepas obtenidas del cepario del IBC-UNACH, solamente Lactobacillus
plantarum CDBB-B-1091 demostró efecto inhibitorio del crecimiento in
vitro de los dos hongos fitopatógenos (Rhizopus stolonifer y Colletotrichum
gloeosporioides) evaluados (Figura 1). Esto concuerda con reportes previos
donde se demuestra que L. plantarum muestra actividad antibacteriana y
antifúngica(26,27). También se han descrito algunas cepas de BAL con
capacidad de inhibir el crecimiento de otros hongos fitopatógenos (Penicillium
spp. y Aspergillus spp.), dentro de las cuales reportan a una cepa Lactobacillus
plantarum(28). Recientemente, nuestro grupo de
investigación aisló tres cepas de Lactobacillus plantarum que poseen
fuerte actividad contra el hongo Colletotrichum gloeosporioides que
infecta a la papaya Maradol(29).
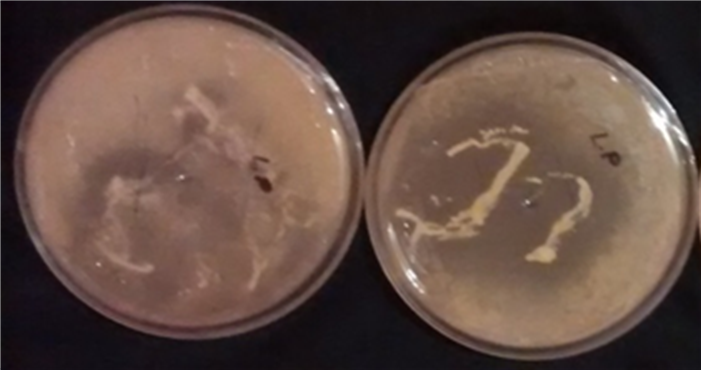
Figura 1. Antagonismo in vitro de Lactobacillus plantarum CDBB-B-1091 contra los hongos fitopatógenos Rhizopus stolonifer (izquierda) y Colletotrichum gloeosporioides (derecha).
Efecto de los componentes de la película sobre la viabilidad de Lactobacillus plantarum durante el almacenamiento
En la Figura 2 se muestra la viabilidad de L. plantarum CDBB-B-1091 (log UFC/g de película) incorporada en las diferentes películas durante 28 días de almacenamiento. Se observa que los tratamientos T1, T2 y T4 muestran menor disminución del número de células, permaneciendo viables durante un tiempo más prolongado, además que a partir del día cero la concentración de células fue mayor 7-8 log UFC/g de película, en comparación a los demás tratamientos los cuales mostraron valores menores a 7 log UFC/g de película para ese mismo tiempo. Los tratamientos que mostraron valores por arriba de 7 log UFC/g tienen en común la concentración de células adicionadas a la solución (Tabla 1), mientras que para los tratamientos T1y T4 que son los que mostraron la mayor viabilidad para el tiempo cero tienen características similares como el porcentaje de almidón (1,5%) y humedad relativa del ambiente (70%). Estas tendencias muestran un posible efecto de tales factores sobre la viabilidad, sin embargo, para obtener mayor fiabilidad se condujo un análisis estadístico de la contribución de los factores a la viabilidad para cada día de evaluación (Figura 3). Derivado de este análisis se encontró que para todos los días (0, 7, 14, 21, 28), la humedad del ambiente de 70% fue el factor que contribuye a mantener la viabilidad de L. plantarum CDBB-B-1091 incorporada en las películas de quitosán y para los días 0, 21 y 28 el porcentaje de almidón (1,5%), al igual que la concentración de células (8 log UFC /mL) tiene influencia positiva sobre la misma variable respuesta. El pH de 5,5 también tuvo efecto positivo en los días 14, 21 y 28 de evaluación.
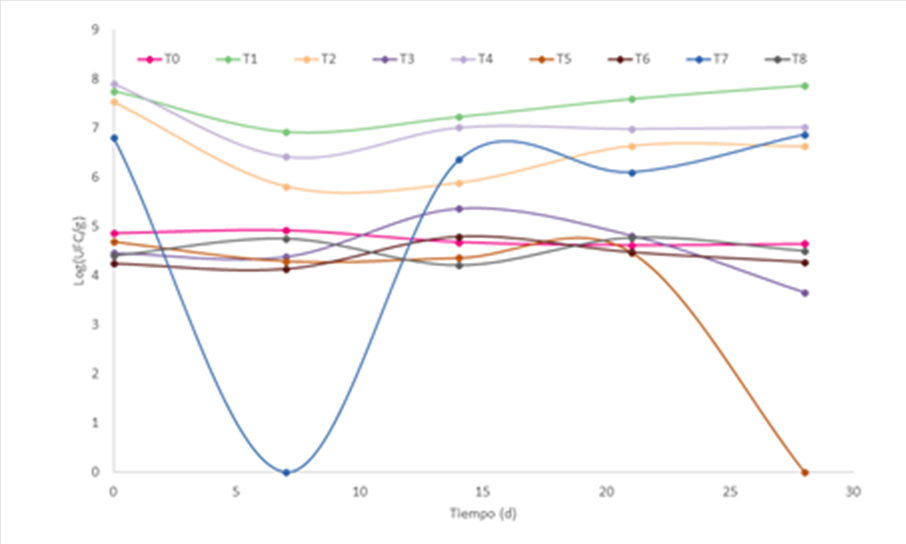
Figura 2. Viabilidad de Lactobacillus plantarum CDBB-B-1091 incorporada en biopelículas con diferente composición durante 28 días de almacenamiento. Para detalles de la composición de los tratamientos (T1-T8) véase Tabla 1. T0 es control, compuesto de quitosán (1,5 %), ácido láctico (1,5%), lactosa (0.1 M), concentración de células (8 log UFC/mL), almidón (1,5%), humedad relativa del ambiente (90%).
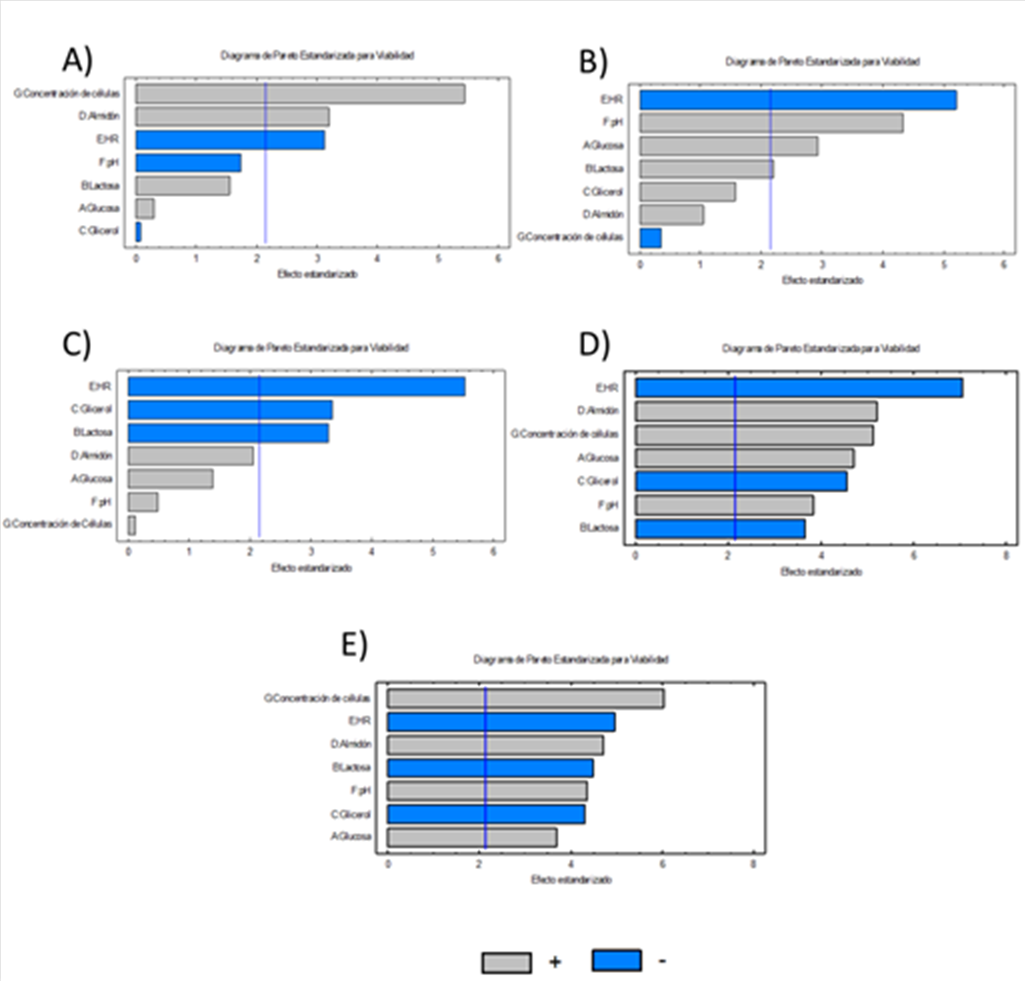
Figura 3. Diagrama de Pareto de los efectos estandarizados para la viabilidad de Lactobacillus plantarum CDBB-B-1091 incorporada en las películas de quitosán a distintos días de la evaluación; 0 (A), 7 (B), 14 (C), 21 (D) y 28 días (E).
El efecto de la humedad relativa del ambiente (70%) sobre la viabilidad para todos los días de almacenamiento evaluados es contrario con lo reportado por otros(30,31). Estos autores señalan que contenidos de humedad relativa considerados altos (>75% y 45%, respectivamente), son perjudiciales para la supervivencia de los probióticos, ya que el almacenamiento a estas condiciones puede acelerar procesos de oxidación que dañarían la membrana de las células. Esta característica que se reporta en el presente estudio, le confiere ventajas a las biopelículas de quitosán conteniendo BAL, pues puede aplicarse a productos que son almacenados a condiciones ambientales y no solo bajo condiciones controladas de humedad como las reportadas por los autores antes citados. Una de las razones de la discrepancia puede ser el tipo o variedad de cepa empleada, ya que en los trabajos citados se evalúan diferentes BAL con diferente grado de tolerancia a la humedad relativa, lo cual podría indicar que la BAL CDBB-B-1091 es más tolerante a humedades altas 70% y mantiene su viabilidad por mucho más tiempo (28 d). Se ha propuesto que la producción de exopolisacáridos (EPS) por parte de las BAL juega un papel importante en la respuesta a estrés de factores externos, pues se ha demostrado que una capa de EPS es formada en la superficie celular después de la eliminación del agua(32). Este mecanismo pudo haber sido empleado por L. plantarum CDBB-B-1091 para tolerar por un lado la desecación durante la formación de la película y posteriormente la HR del ambiente de almacenamiento, tal como se reporta que ocurre con las BAL durante el secado(32).
Cuando se analizaron los efectos de los factores mediante el diagrama de Pareto (Figura 3), también se encontró que la viabilidad aumenta cuando el glicerol no es adicionado a las biopelículas, lo cual contrasta con la mayoría de los reportes bibliográficos. Se ha reportado el uso de concentraciones de glicerol de 10%, 5% y 1%(33-35), respectivamente, y reportan que este factor ayuda a mantener la viabilidad de cepas probióticas argumentando un efecto protector de este alcohol hacia las células. La concentración empleada en el presente estudio (10%, Tabla 1) no ejerció efecto alguno sobre la viabilidad de L. plantarum CDBB-B-1091 incorporadas en biopelículas de quitosán y almacenadas durante 28 días.
Efecto de los componentes de la película sobre la capacidad antifúngica in vitro de las biopelículas conteniendo Lactobacillus plantarum
Cuando se realizó el enfrentamiento de las biopelículas conteniendo L. plantarum contra el hongo Rhizopus stolonifer en placa (prueba in vitro) se observó un crecimiento “normal” del micelio del hongo después de 48 h, tiempo en el cual el micelio alcanzó su mayor crecimiento (100 mm, placa de Petri llena). Esto ocurrió a pesar de que, al transcurrir 24 h de crecimiento del hongo, el tratamiento testigo (micelio sin biopelícula) presentó mayor crecimiento con respecto a los tratamientos. Si se considera que lo que busca el presente estudio es mantener el efecto antifúngico de las biopelículas conteniendo L. plantarum CDBB-B-1091, este resultado no es el esperado por lo que se optó por no realizar análisis estadístico para los datos obtenidos de la actividad contra este hongo fitopatógeno. A pesar de que en la prueba inicial la BAL demostró actividad inhibitoria del desarrollo de este hongo, su efecto fue menor que contra C. gloeosporioides y dicho efecto fue suprimido por la etapa de atrapamiento, pues ninguno de los tratamientos post-atrapamiento mostró indicio de actividad antifúngica.
Por el contrario, contra el hongo C. gloeosporioides si se encontró actividad antifúngica. En la Figura 4 se puede apreciar el comportamiento del hongo al exponerse con las biopelículas incorporadas con L. plantarum CDBB-B-1091. Para la mayoría de los tratamientos (T0-T8), se observaron descensos graduales en la actividad inhibitoria a medida que el hongo se desarrolló, iniciando para el día cero con valores de 100% y, encontrándose en algunos casos valores de 0% después de siete días de crecimiento del hongo. De manera general también puede observarse que el almacenamiento de las biopelículas afectó negativamente la actividad antifúngica, pues en la mayoría de los tratamientos, las biopelículas recién elaboradas (d0) mostraron mayor actividad antifúngica (Figura 4A, B, D y F). De estas biopelículas, las del tratamiento 1 (Figura 4B) mostraron una actividad inhibitoria eficiente para controlar el crecimiento de hongo (70%) y esta actividad se mantuvo durante todo el tiempo de desarrollo del hongo. Algo similar ocurrió con el tratamiento tres (Figura 4D) pero la inhibición fue de menor magnitud. Solamente las biopelículas de los tratamientos T6-T8 (Figuras 4 H-I) exhibieron actividad antifúngica moderada (<40%) aun cuando fueron almacenadas durante 21 días (líneas rojas). Esto mismo se observó, pero en menor magnitud con las biopelículas las almacenadas durante 14 días (líneas verdes) provenientes de los tratamientos T4 y T6.
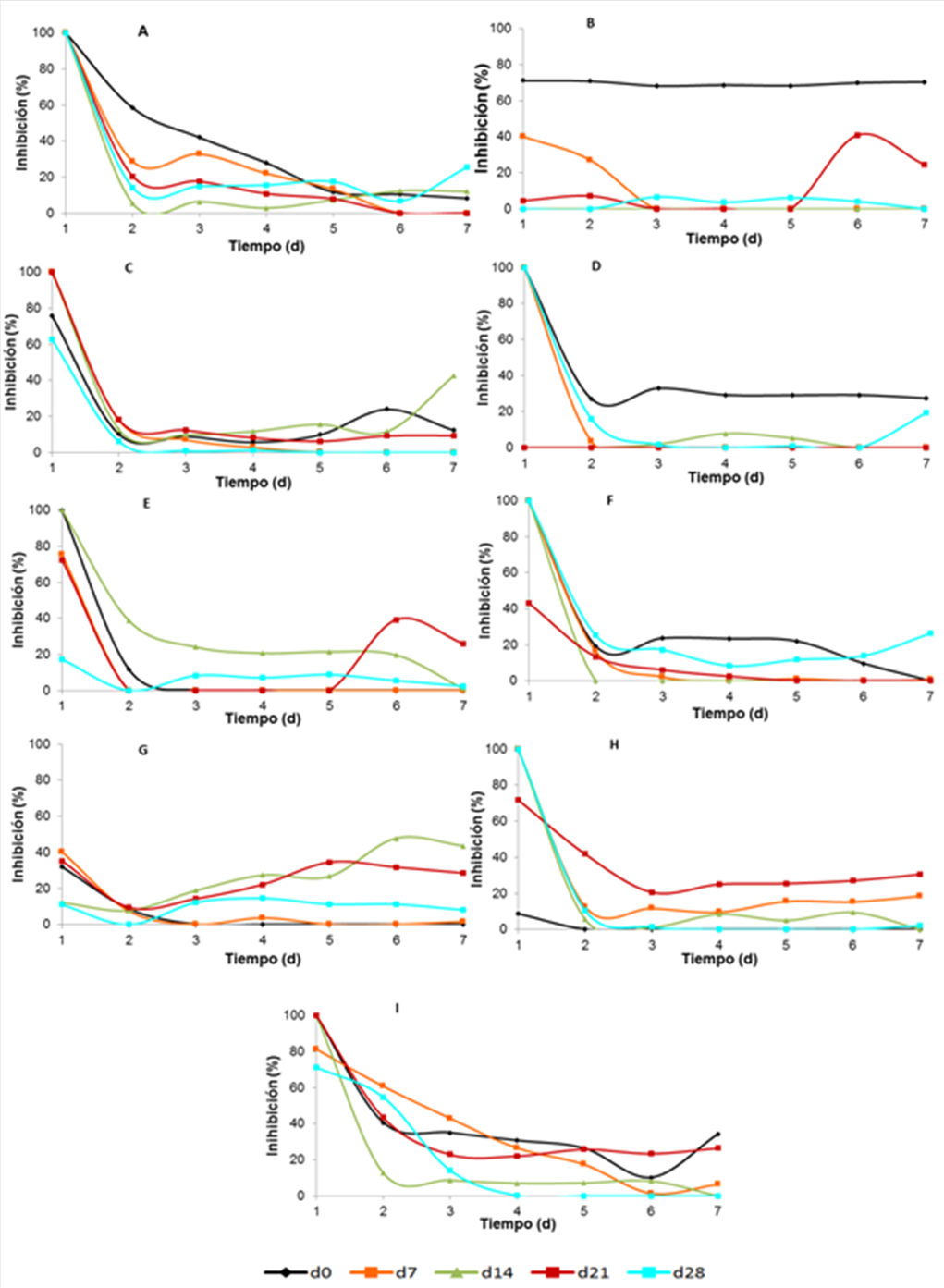
Figura 4. Inhibición (%) del hongo Colletotrichum gloeosporioides promovida por Lactobacillus plantarum atrapada en biopelículas de diferente composición (T0, A; T1, B; T2, C; T3, D; T4, E; T5, F; T6, G; T7, H; T8, I; ver Tabla 1 para detalles de la composición) y después de diferentes tiempos de almacenamiento de la biopelícula (d0, d7, d14, d21 y d28).
Cuando se analizó el efecto de los factores estandarizados sobre la actividad antifúngica contra C. gloeosporioides solamente se encontró respuestas significativas para las biopelículas provenientes de los días 0 y 14 de almacenamiento (Figura 5). Para los demás días de almacenamiento ningún factor mostró efecto estandarizado significativo. Los factores que mostraron efectos significativos (P<0.05) a esta variable fueron la humedad del ambiente de 70% (día cero) y la presencia de lactosa 0.1 M como fuente de carbono (día 14). Este comportamiento de los factores puede estar revelando la baja influencia de los mismos sobre la capacidad antifúngica, ya que factores que se ha reportado inducen la producción de sustancias antimicrobianas tal como el pH(28,36) no mostraron tener efecto significativo para la variable capacidad antifúngica en ninguno de los días de almacenamiento evaluados.
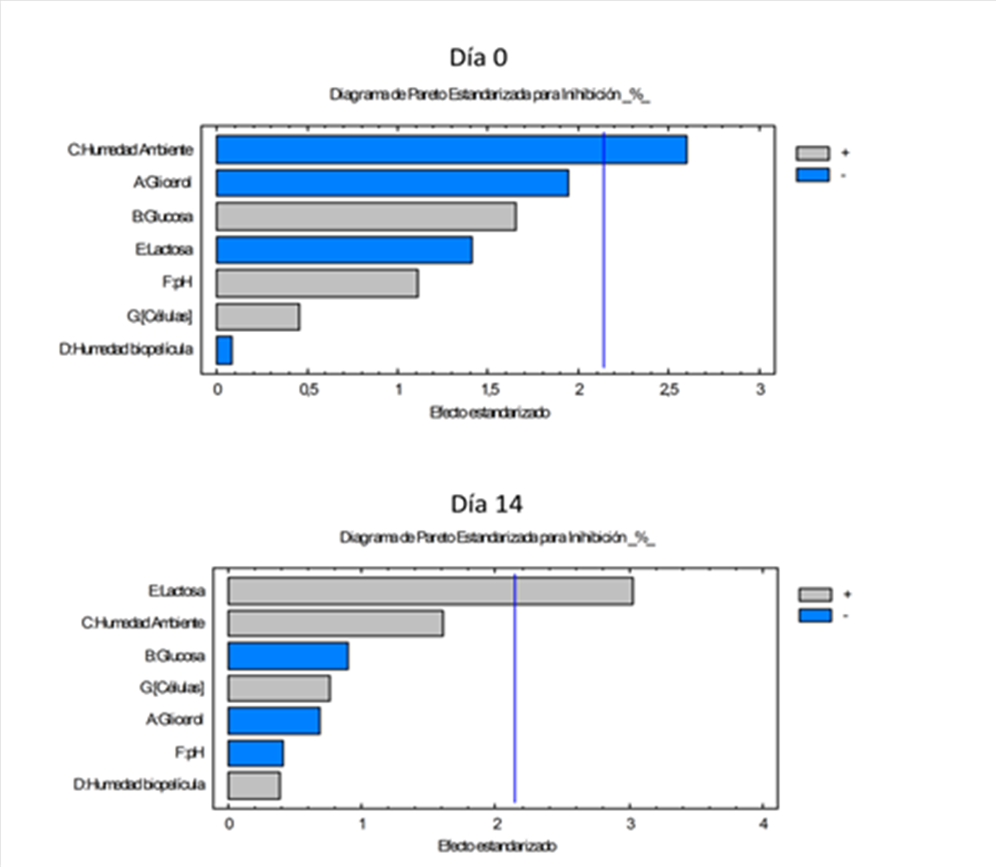
Figura 5. Diagrama de los efectos estandarizados para la inhibición del desarrollo del hongo Colletotrichum gloeosporioides por biopelículas de quitosán conteniendo Lactobacillus plantarum y almacenadas por cero días (parte superior) y 14 días (parte inferior).
A pesar de que en los distintos días de almacenamiento evaluados varios de los factores resultaron tener un efecto significativo (P<0.05) sobre la viabilidad (Figura 3) y la actividad antifúngica (Figura 5), para la etapa de optimización de la investigación se consideraron aquellos con mayor frecuencia de aparición en los distintos días de evaluación y que además tuvieron efecto positivo cuando estuvieron presente en la composición de la película (+). Con este argumento, los factores y los niveles a optimizar fueron: porcentaje de almidón a 1,5%; concentración de células de 8 log UFC/mL y concentración de glucosa 0.1M (Tabla 2). La humedad del ambiente a pesar de ser un factor con influencia en la viabilidad no fue incluida en la etapa de optimización pues el efecto positivo sobre la viabilidad se encontró con el nivel de 70%, lo que corresponde a las condiciones ambientales del lugar donde se realizó el estudio.
Optimización de la viabilidad y actividad antifúngica
El efecto de los factores en la etapa de optimización analizados como respuesta de los tratamientos sobre la viabilidad de las BAL se muestra en la Figura 6. Todos los tratamientos exhiben valores en la cantidad de células por arriba de 6 log UFC/g lo cual demuestra un efecto positivo de los factores incorporados en esta etapa, pues los valores de viabilidad son superiores a los mostrados en la Figura 2 (etapa de cribado), donde solo cuatro tratamientos están por encima de este mismo valor. Lo anterior ratifica el efecto de la concentración de glucosa, la concentración de células y el porcentaje de almidón sobre la viabilidad de las bacterias lácticas incorporadas en las biopelículas de quitosán. Los tratamientos 1, 6, 8, 10, 12 con respecto a los demás son los que menor viabilidad presentan en el día 0, mientras que los tratamientos 2, 3, 4, 5, 7, 9, 13, 14 y 15 se encuentran con valor por arriba de 7 log UFC/g y solo el tratamiento 11 muestra viabilidad por arriba de 8 log UFC/g para el mismo día. Los tratamientos 2, 3, 5, 13, 14 y 15 se caracterizan por tener una concentración inicial de células de 8 log UFC/mL de solución y solamente los tratamientos 4, 7 y 9 contenían originalmente 9 log UFC/mL de solución.
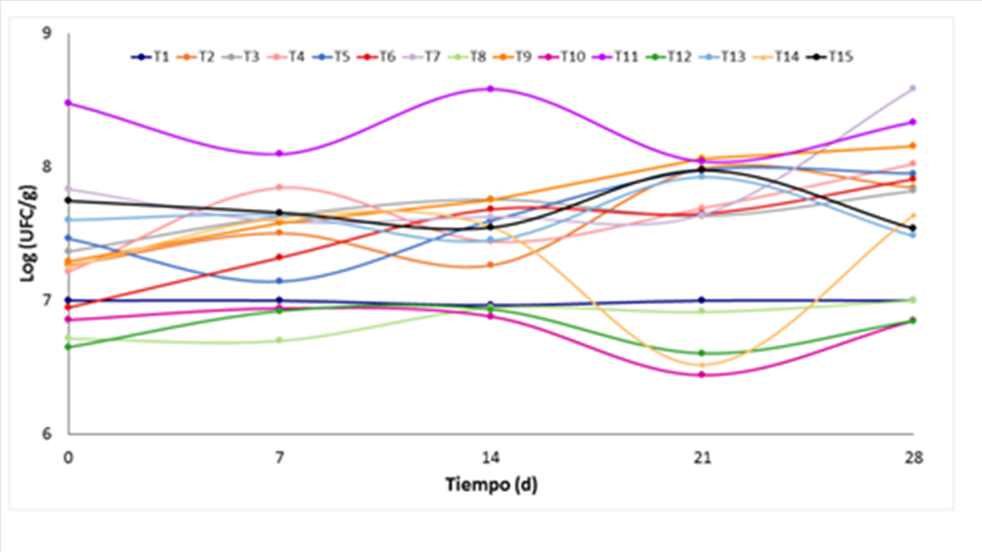
Figura 6. Viabilidad de Lactobacillus plantarum CDBB-B-1091 incorporada en biopelículas con diferente composición evaluada cada 7 días durante 28 días. Para detalles de la composición de los tratamientos (T1-T15) véase Tabla 2.
El tratamiento uno mantuvo durante todo el almacenamiento la mayor viabilidad (respecto al número total de células incorporadas originalmente) de las BAL incorporadas en las biopelículas, pues presentó durante toda la evaluación (28 días) valores mayores a 98% de viabilidad. A pesar de que todos los tratamientos lograron mantener la concentración de células por arriba de 6 log UFC/g de biopelícula (Figura 6), solamente en este tratamiento se observa una línea casi horizontal para el comportamiento de la viabilidad (línea azul, Figura 6). Este tratamiento tuvo una viabilidad observada de 98.14% siendo incluso superior a la teórica esperada de 93,95% (Tabla 3). La composición de los factores evaluados en las biopelículas del T1 fueron; una concentración de células de 7 log UFC/mL, 2% de almidón y 0.1 M de glucosa. Estos valores en la concentración de almidón y en la cantidad de células incorporados resultaron posteriormente ser los factores óptimos (Figura 7) para la mayoría de los días de almacenamiento, siendo solamente el día 14 (Figura 7C) indistinta la concentración de almidón. En un estudio similar(14) se reporta que la cantidad de células que se incorporan en las biopelículas no es un factor importante para la viabilidad contrario con lo que se encontró en el presente estudio.
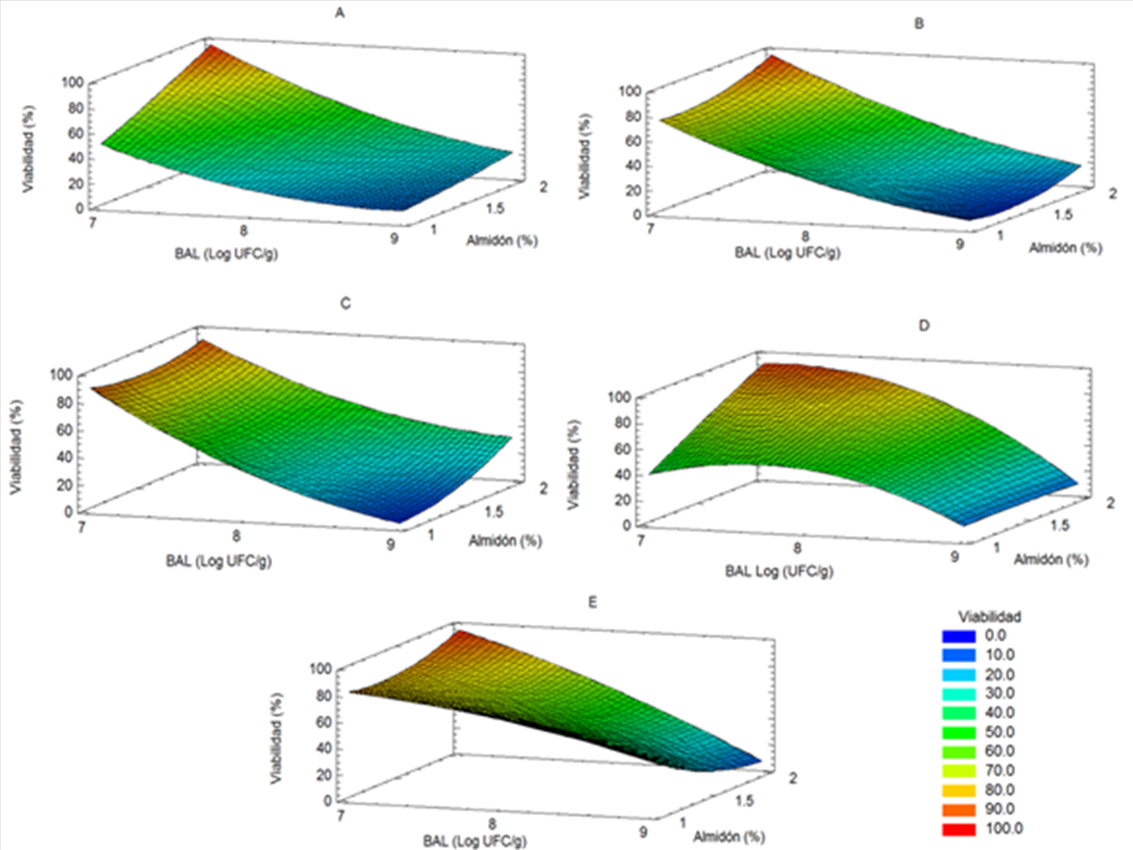
Figura 7. Contornos de superficie de respuesta optimizada para la viabilidad de Lactobacillus plantarum CDBB-B-1091 incorporada en biopelículas con diferente composición y almacenadas a temperatura ambiente durante 28 días. Días de almacenamiento, 0 días (A), 7 días (B), 14 días (C), 21 días (D) y 28 días (E).
Existe una aparente relación inversa entre la cantidad de células incorporadas en la biopelícula y los valores óptimos de viabilidad (Figura 7, Tabla 3), pues para todos los días evaluados el aumento en la cantidad de células redujo los valores de la viabilidad. Posiblemente la actividad de agua (aw) de la película se redujo durante la desecación a un nivel que no permitió la viabilidad de concentraciones mayores a 7 log de UFC/mL tal como se ha reportado ocurrió con levaduras atrapadas en diversos polímeros(37).
Aunque la significancia del efecto fue menor que la concentración de células, la concentración de 2% de almidón también influyó para obtener valores óptimos en la viabilidad (Figura 7). Se ha reportado un efecto negativo del almidón adicionado a biopelículas de pululano sobre la viabilidad de bacterias probióticas(38), posiblemente debido al aumento en la actividad metabólica celular como consecuencia del aumento en la humedad de la biopelícula, incluso los autores sugieren que concentraciones menores de 5% permiten mantener la viabilidad celular, lo cual demuestra que la cantidad encontrada en este estudio resulta altamente efectiva para Lactobacillus plantarum en biopelículas de quitosán.
Contrario con lo observado en la viabilidad, la Figura 8 muestra como los valores de la capacidad antifúngica se alejan drásticamente del óptimo o deseable a partir del día 7 de almacenamiento de la biopelícula a valores cercanos a 80% (Figura 8B) cuando la concentración de células es de 9 log UFC/mL y 2% en la concentración de almidón. Solamente las biopelículas recién elaboradas (día cero de almacenamiento) presentaron valores de inhibición del crecimiento del hongo C. gloeosporiodes del 100% (Figura 8A). Posterior al día 14, los valores de inhibición alcanzaron valores de 10% (Fig. 8C-E). Este mismo fenómeno ha sido observado previamente(35), reportando que células de L. plantarum incorporadas en biopelículas derivadas de celulosa pierden su capacidad para inhibir a Listeria innocua a medida que transcurre el tiempo de almacenamiento.
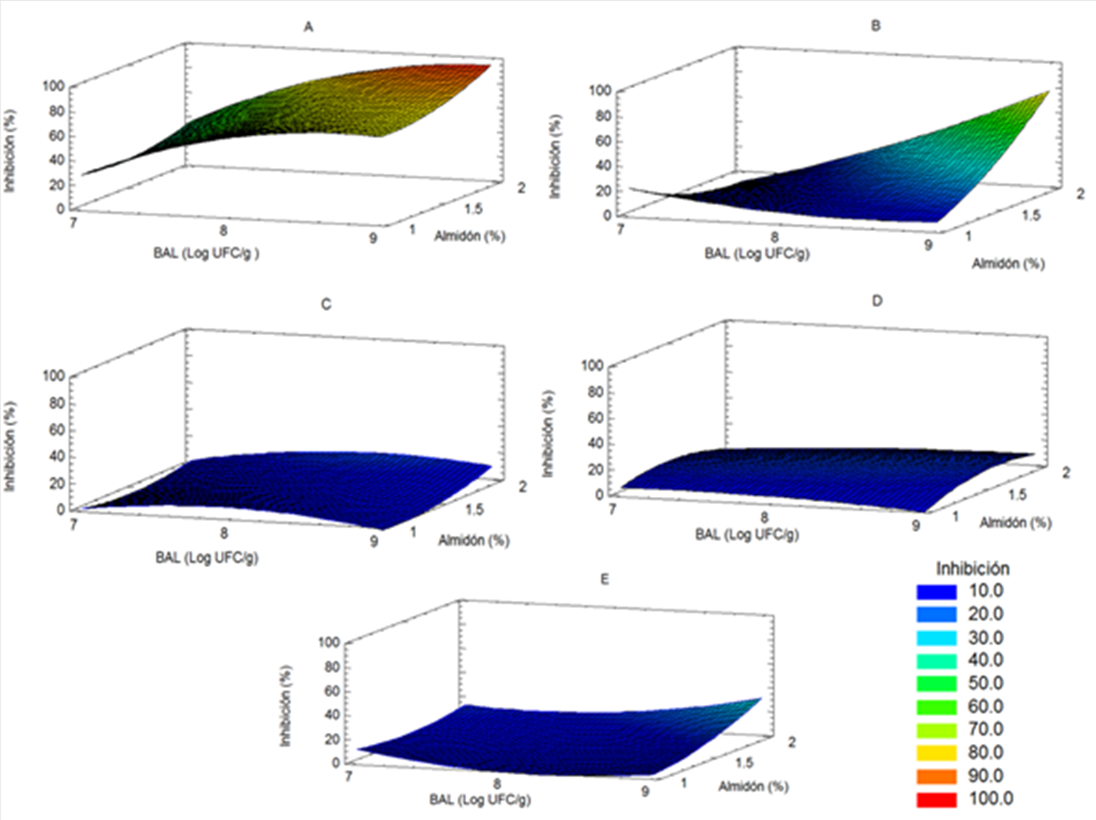
Figura 8. Contornos de superficie de respuesta optimizada para la capacidad antifúngica Lactobacillus plantarum CDBB-B-1091 incorporada en biopelículas con diferente composición y almacenadas a temperatura ambiente durante 28 días. Días de almacenamiento, 0 días (A), 7 días (B), 14 días (C), 21 días (D) y 28 días (E).
Finalmente, los datos obtenidos de la viabilidad y la capacidad antifúngica de todos los días de almacenamiento (0-28 días) se analizaron para obtener los valores predichos para cada tratamiento evaluado por el método de Box-Benken. Los resultados de este procedimiento validan lo antes descrito sobre el efecto de los tres factores evaluados. Cuando se analizó el efecto (pruebas de ANOVA) de los factores sobre la viabilidad, solamente la concentración de glucosa fue no significativa (P>0,05) en los días 0 y 21 de almacenamiento de las biopelículas y el contenido de almidón para el día 28 de almacenamiento. El tratamiento 1 resulta por tanto la composición óptima para obtener una viabilidad predicha de 93,95 para L. plantarum (Tabla 3); sin embargo, para obtener el 100% en la viabilidad los valores teóricos óptimos arrojados por el análisis son los siguientes: una concentración de células de 7,009164 log UFC/g película, concentración de almidón de 1,997712% y concentración de glucosa 0,10750016 M. La cantidad de células también es el factor más determinante en la actividad antifúngica, pero lo fue de manera inversa a lo que ocurrió con la viabilidad, pues un valor cercano a la mayor concentración de células (8,90041 log UFC/mL) promovió más actividad antifúngica. Este mismo comportamiento ha sido reportado previamente(18), donde se encontró menor actividad antibacteriana de una bacteria acido láctica cuando la concentración de células era menor.
Considerando que la viabilidad obtenida el día 28 de almacenamiento puede ser la de mayor interés práctico, se propone la relación empírica para predecir los valores de viabilidad. Para este análisis se tomaron todos los factores que fueran y no significativos en el análisis de a varianza. La ecuación cuadrática derivada del análisis de regresión con un valor R2=75.3908 quedó descrita como y = -358,437 + 107,79*A + 61,7835*B + 1256,22*C – 5,49314*A2 – 23,3231*A*B – 168,626*A*C + 29,8757*B2 + 250,587*B*C – 517,443*C2; donde “y” es igual a viabilidad (%); A es la concentración de células (log UFC/g), B es concentración de almidón (%) y C es concentración de glucosa (M).
Sin embargo, para la capacidad antifúngica no fue posible obtener valores predichos globales superiores a 33% debido a que los valores observados escasamente alcanzaron 6% (Tabla 3). Cuando se analizan exclusivamente los datos de las películas recién elaboradas (Figura 8A) es posible obtener los valores óptimos de los factores evaluados los cuales corresponden a: 8,90041 log (UFC/mL) para la concentración de células, 2,0% para la concentración de almidón y 0.0850143 M para la concentración de glucosa, y predicen una capacidad antifúngica de 99,1558%. Tal predicción está descrita por la ecuación empírica cuadrática derivada del análisis de regresión con un valor R2= 53.8661 y quedó descrita por y = -1141,8 + 232,817*A – 7,14217*B + 3466,32*C – 14,7142*A2 + 7,38095*A*B + 168,815*A*C + 24,8206*B2 – 1096,06*B*C – 16331,9*C2, donde “y” es Inhibición (%); A es concentración de células (log UFC/g), B es concentración de almidón (%) y C es concentración de glucosa (M).
Conclusión
Las concentraciones óptimas de los factores evaluados para mantener 100 % de viabilidad de la cepa L. plantarum CDBB-B-1091 durante 28 días de almacenamiento son; concentración de células de 7,009164 log UFC/mL de solución, 1,997712% (p/v) en el contenido de almidón y 0,10750016 M para la concentración de glucosa.
La capacidad antifúngica solo se presentó en las películas recién elaboradas (inhibición del 100%) y, esta disminuyó conforme transcurrió el tiempo de almacenamiento de la biopelícula. Los valores óptimos predichos para la composición de la biopelícula para ese día son: concentración de células de 8,90041 log UFC/mL, 2,0 % (p/v) para la concentración de almidón y 0,0850143 M para la concentración de glucosa.
Fue posible extender la viabilidad de L. plantarum CDBB-B-1091 hasta 28 días al modificar las concentraciones de los componentes de las biopelículas, sin embargo, no fue posible conservar la capacidad antifúngica contra C. gloeosporioides. Se sugiere evaluar el efecto de otros componentes de las matrices poliméricas donde sea posible conservar esta capacidad o evaluar la efectividad de los metabolitos antifúngicos de las bacterias incorporados en las biopelículas.
Referencias
1. Hernández A, Márquez C, Restrepo CE, Cano JA, Patiño JH. Aplicación de tratamiento térmico, recubrimiento comestible y baño químico como tratamiento poscosecha para la conservación de hortalizas mínimamente procesadas. Acta Agron. 2014; 63: 1-10.
2. Girard AL, Teferra T, Awika JM. Effects of condensed vs hydrolysable tannins on gluten film strength and stability. Food Hidrocoll. 89: 36:43.
3. Bergo P, Sobral PJA. Effects of plasticizer on physical properties of pigskin gelatin films. Food Hydrocolloid. 2007; 21: 1285-1289.
4. González A, Gastélu G, Barrera GN, Ribbota PD, Álvarez ICI. Food Hidrocoll. 2019; 89: 758-764.
5. Aloui H, Baraket K, Sendon R, Sanches SA, Khwaldia K. Development and characterization of novel composite glycerol-plasticized films based on sodium caseinate and lipid fraction of tomato pomace by-product. Int. J. Biol. Macrobiol. 2019; 139: 128-138.
6. Tavassoli-Kafrani E, Shekarchizadeh H, Masoudpour-Behabadi M. Development of edible films and coatings from alginates and carrageenans. Carbohyd. Polym. 2016; 137: 360-374.
7. Cazon P, Velázquez G, Ramírez JA, Vázquez M. Polysaccharide-based films and coatings for food packaging: A review. Food Hydrocoll. 2017; 68: 136-148.
8. Bolívar-Monsalve J, Ramírez-Toro C, Bolívar G, Ceballos-González C. Mechanisms of action of novel ingredients used in edible films to preserve microbial quality and oxidative stability in sausages - A review. Trends Food Sci. Tech. 2019; 89: 100-109.
9. Salvador-Figueroa M, Castillo-López D, Adriano-Anaya L, Gálvez-López D, Rosas-Quijano R, Vázquez-Ovando A. Chitosan composite films: physicochemical characterization and their use as coating in papaya Maradol stored at room temperature. Emir. J. Food Agric. 2017; 29: 779-791.
10. Monzón-Ortega K, Salvador-Figueroa M, Gálvez-López D, Rosas-Quijano R, Ovando-Medina I, Vázquez-Ovando A. Characterization of Aloe vera-chitosan composite films and their use for reducing the disease caused by fungi in papaya Maradol. J. Food Sci. Tech. 2018; 55: 4747-4757.
11. Mujtaba M, Morsi RE, Kerch G, Elsabee MZ, Kaya M, Labidi J, Khawar KM. Current advancements in chitosan-based film production for food technology; A review. Int. J. Biol. Macrobiol. 2019; 121: 889-904.
12. Wilson MD, Stanley RA, Eyles A, Ross T. Innovative processes and technologies for modified atmosphere packaging of fresh and fresh-cut fruits and vegetables. Crit. Rev. Food Sci. Nutr. 2019; 59: 411-422.
13. Aloui H, Licciardello F, Khwaldia K, Hamdi M, Restuccia C. Physical properties and antifungal activity of bioactive films containing Wickerhamomyces anomalus killer yeast and their application for preservation of oranges and control of postharvest green mold caused by Penicillium digitatum. Int. J. Food Microbiol. 2015; 4: 22-30.
14. Maldonado Z, Vázquez-Ovando A. Viabilidad de bacterias del ácido láctico incorporadas en películas de quitosán. Tesis de licenciatura. Instituto de Biociencias, Universidad Autónoma de Chiapas. Tapachula, Chiapas, México. 2015. 17p.
15. Pereira JO, Soares J, Sousa S, Madureira AR, Gomes A, Pintado M. Edible films as carrier for lactic acid bacteria. LWT – Food Sci. Technol. 2016, 73: 543-550.
16. Hartmann A, Wilke T, Erdmann R. Efficacy of bacteriocin-containing cell-free culture supernatants from lactic acid bacteria to control Listeria monocytogenes in food. Int. J. Food Microbiol. 2011; 146: 192-199.
17. Concha A, Schobitz R, Brito C, Fuentes R. Lactic acid bacteria in alginate film inhibit Listeria monocytogenes growth on smoked salmon. Food Control 2010; 22: 485-489.
18. Schmidt CA. Antagonismo en contra de Listeria monocytogenes de nisina y de una cepa láctica, encapsuladas en alginato. Tesis de licenciatura. Universidad Austral de Chile. 2007. 53p.
19. Cheong EYL, Sandhu A, Jayabalan J, Kieu-Le TT, Thi-Nhiep N, My-Ho HT, Zwielehner T, Bansala N, Turner MS. Isolation of lactic acid bacteria with antifungal activity against the common cheese spoilage mould Penicillium commune and their potential as biopreservatives in cheese. Food Control 2014; 46: 91-97.
20. Ndagano D, Lamoureux T, Dortu C, Vandermoten S, Thonart P. Antifungal activity of 2 lactic acid bacteria of the Weissella genus isolated from food. J. Food Sci. 2011; 76: 305-311.
21. Vázquez-Ovando A, López-Hilerio H, Salvador-Figueroa M, Adriano-Anaya L, Rosas-Quijano R, Gálvez-López D. Uso combinado de radiación UV-C y biorecubrimiento de quitosán con aceites esenciales para el control de hongos en papaya Maradol. Rev. Bras. de Frutic. 2018; 40(3): e-688.
22. Magnusson J, Ströma K, Roos S, Sjögren J, Schnürer J. Broad and complex antifungal activity among environmental isolates of lactic acid bacteria. FEMS Microbiol. Lett. 2003; 219: 129-135.
23. Binsi PK, Ravishankar CN, Srinivasa-Gopal TK. Development and characterization of an edible composite film based on chitosan and virgin coconut oil with improved moisture sorption properties. J. Food Sci. 2013; 70: 526-534.
24. Hegyi F, Zalán Z, Halasz A. Improved 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT) colorimetric assay for measuring the viability of lactic acid bacteria. Acta Aliment. 2012; 41: 506-512.
25. Egusa M, Iwamoto R, Izawa H, Morimoto M, Saimoto H, Kaminaka H, Ifuku S. Characterization of chitosan nanofiber sheets for antifungal application. Int. J. Mol. Sci. 2015; 16: 26202-26210.
26. Arasu M, Jung MW, Ilavenil S, Jane M, Kim DH, Lee KD, Park HS, Hur TY, Choi GJ, Lim YC, Al-Dhabi NA, Choi KC. Isolation and characterization of antifungal compound from Lactobacillus plantarum KCC-10 from forage silage with potential beneficial properties. J. Appl. Microbiol. 2013; 115(5): 1172-1185.
27. Ström K, Sjögren J, Broberg A, Schnürer J. Lactobacillus plantarum MiLAB 393 produces the antifungalcyclic dipeptides cyclo (L-Phe-L-Pro) and cyclo (L-Phe-trans-4-OH-L-Pro) and phenyl lactic acid. Appl. Environ. Microb. 2002; 68: 4322–4327.
28. Dalié DKD, Deschamps AM, Richard-Forget F. Lactic acid bacteria potential for control of mould growth and mycotoxins: A review. Food Control 2010; 21: 370-380.
29. Barrios-Roblero C, Rosas-Quijano R, Salvador-Figueroa M, Gálvez-López D, Vázquez-Ovando A. Antifungal lactic acid bacteria isolated from fermented beverages with activity against Colletotrichum gloeosporioides. Food Biosci. 2019; 29: 47-54.
30. Rodrigues D, Sousa S, Rocha-Santos T, Silva J, Lobo JS, Costa P. Influence of L-cysteine, oxygen and relative humidity upon survival throughout storage of probiotic bacteria in whey protein-based microcapsules. Int. Dairy J. 2011; 21: 869-876.
31. Romano N, Tavera-Quiroz M, Bertola N, Mobili P, Pinotti A, Gómez-Zavaglia A. Edible methylcellulose-based films containing fructo-oligosaccharides as vehicles for lactic acid bacteria. Food Res. Int. 2014; 64: 560-566.
32. Nguyen HT, Truong DH, Kouhoundé S, Ly S, Razafindralambo H, Delvigne F. Biochemical engineering approaches for increasing viability and functionality of probiotic bacteria. Int. J. Mol. Sci. 2016; 17: 867.
33. Piermaria J, Diosma G, Aquino C, Garrote G, Abraham A. Edible kefiran films as vehicle for probiotic microorganisms. Innov. Food Sci. Emerg. Technol. 2015; 32: 193-199.
34. Pereira JO, Soares J, Sousa S, Madureira A, Gomes A, Pintado M. Edible films as carrier for lactic acid bacteria. LWT Food Sci. Technol. 2016; 73: 543-550.
35. Sánchez-González L. Quintero-Saavedra JI, Chiralt A. Physical properties and antilisterial activity of bioactive edible films containing Lactobacillus plantarum. Food Hydrocolloid. 2014; 33: 92-98.
36. Muynck C, Leroy A, Maeseneire S, Arnaut F, Soetaert W, Vandamme EJ. Potential of selected lactic acid bacteria to produce food compatible antifungal metabolites. Microbiol. Res. 2004; 159: 339-346.
37. Marín A, Atarés L, Cháfer M, Chriralt A. Properties of biopolymer dispersions and films used as carriers of the biocontrol agent Candida sake CPA-1. LWT Food Sci. Technol. 2017; 79: 60-69.
38. Kanmani P, Lim ST. Development and characterization of novel probiotic-residing pullulan/starch edible films. Food Chem. 2013; 141: 1041-1049.