EDITORIAL
Rendimos homenaje a Alfred Nobel y a los galardonados con el Premio de Fisiología y Medicina de 2019
We pay tribute to Alfred Nobel and to the recipients of the 2019 Prize in Physiology and Medicine
Francisco J. Sánchez-Muniz1, Jesús M Culebras2, Luis Vicente-Vacas3
1 Catedrático de Nutrición. Facultad de Farmacia de la Universidad Complutense de Madrid y Académico de número de la Real Academia Nacional de Farmacia, España
2 De la Real Academia de Medicina y Cirugía de Valladolid y del IBIOMED, Universidad de León. Director de Journal of Negative & No Positive Results. España
3 Editor de Journal of Negative & No Positive Results. España
* Autor para correspondencia.
![]()
This work is licensed
under a Creative
Commons
Attribution-NonCommercial-ShareAlike 4.0 International License
La revista no cobra tasas por el envío de trabajos,

Los científicos estadounidenses William G. Kaelin
(Dans-Farber Cancer Institute) y Gregg L. Semenza (Johns Hopkins Hospital), así
como el británico Peter J. Ratcliffe (Universidad de Oxford) han ganado el Nobel
de Medicina 2019 por sus estudios sobre el sensor de oxígeno celular y su
importancia en el campo de la Medicina.
https://www.nobelprizemedicine.org/the-nobel-prize-in-physiology-or-medicine-2019/(1)
Es esta corta editorial una continuación del homenaje que JONNPR dio a Alfred Nobel y a los galardonados con el Premio Nobel de Fisiología y Medicina en previas ediciones de 2017 y 2018(2,3), cuando la revista comenzaba su segundo y tercer año de andadura, respectivamente. Esta iniciativa no tiene otra finalidad que recordar la importancia que alcanzan en el mundo científico los premios Nobel y poner de manifiesto los méritos que reúnen aquellos a los que el Instituto Karolinska reconoce año a año como merecedores de tan alto galardón. Este año ha recaído sobre los descubrimientos de un aspecto fundamental de la fisiología celular, el sensor celular de los niveles de oxígeno y la regulación fisiológica de la hipoxia(4).
La noticia salió a los medios el pasado mes de octubre, y por ello creemos que estamos aún a tiempo de dar un homenaje y hacer una breve pincelada de su importancia en el contexto de la ciencia en las últimas décadas, sin olvidar a la figura de Alfred Nobel. Al igual que en la publicación en JONNPR en 2018, sabemos que otros científicos o intelectuales, podrían fraguar mejor que nosotros este homenaje, por lo que no cejaremos en nuestra petición de colaboraciones para rescatar del olvido aquellos Premios Nobel en Fisiología y Medicina que se otorgaron entre los años 2000 y el 2016.
Esta reseña de los medios es antesala de lo que tiene lugar el diez de diciembre, fecha, que además de ser conmemorativa de la muerte de Alfred Nobel, es en la que tiene lugar la ceremonia de entrega de los premios Nobel y el reconocimiento oficial de los galardonados. Como es ya conocido por los medios de comunicación desde hace 118 años, interrumpida solamente la tradición por las dos grandes guerras mundiales, cada diez de diciembre tiene lugar la doble ceremonia de los Premios Nobel en el Ayuntamiento de Oslo (donde se entrega el Premio Nobel de la Paz) y, horas más tarde, en el Konserthus de Estocolmo donde se conceden los demás galardones en una sencilla y elegante ceremonia a la que asisten los académicos responsable de la selección final de premiados y la familia real de Suecia(4).

Figura 1. La medalla del Premio Nobel donde aparece la figura de Alfred Nobel y los años de su nacimiento y defunción.
Alfred Nobel nació el 21 octubre de 1833 en Estocolmo (Suecia) y falleció el 10 de diciembre de 1896 en San Remo (Italia) (Figura 1). Fue ingeniero e inventor, pero también escritor y soñador. De sus más de 350 inventos de los que se tienen noticia, sobresalen algunos como el de la dinamita, que desde su descubrimiento ha tenido una enorme importancia en el desarrollo de las vías de comunicación. No obstante este invento también ha jugado un papel decisivo en las guerras del pasado, originado muchas muertes. A este respecto un periódico, confundiendo a Alfred con un hermano Ludving, publicó erróneamente su muerte diciendo que el mercader de la muerte había muerto, noticia que – posiblemente - indujo a Nobel a crear el premio de la Paz, para paliar parcialmente el mal potencial que podía haber generado para la humanidad por el descubrimiento de la dinamita. Alfred Nobel, posibilitó con su fortuna, la creación de un fondo para poder premiar a aquellas personas que sobresalieran de forma determinante en los campos de la Paz, Literatura, Fisiología o Medicina, Física y Química y muy posteriormente en Ciencias Económicas(4).
Figura 2. Alfred Nobel, inventor y fundador de los Premios Nobel junto a un fragmento de su testamento, donde se hace constar la última voluntad del inventor en relación con los Premios que llevan su nombre (5) https://www.google.es/search?newwindow=1&client=firefoxb&
dcr=0&tbm=isch&sa=1&q=Fotos+de+Alfred+Nobel+&oq
Los Premios Nobel, instituidos por el químico e inventor Alfred Nobel en su testamento, y organizados y administrados desde hace más de un siglo por la Fundación Nobel(1,2), es uno de los galardones más prestigiosos del mundo y se concede tal como figura en la página oficial del Premio For the greatest benefits to humankind” (traducción libre al castellano “Para mayor beneficio de la humanidad”(1).
Existe un procedimiento de nominación y selección donde intervienen cientos de personas e instituciones de reconocido prestigio en los diferentes ámbitos de alcance de los Premios Nobel. Así, en septiembre del año previo a la concesión, el Comité Nobel de Fisiología y Medicina (compuesto por cinco miembros elegidos por un período de tres años según los Estatutos de la Fundación Nobel, además del Secretario de la Asamblea Nobel) envía invitaciones confidenciales a personas cualificadas en el ámbito de la Fisiología y la Medicina, para que propongan los nombres de candidatos para el Premio Nobel de Medicina, con la limitación de que no pueden autovotarse. Entre estas personas cualificadas se encuentran aquellas galardonadas previamente con el Premio Nobel de Medicina, los miembros del Instituto Karolinska, los miembros de la Real Academia Sueca de las Ciencias, o profesores universitarios de los países escandinavos de Fisiología y Medicina. Las propuestas de las personas cualificadas deben ser enviadas al Comité Nobel de Medicina antes del 31 de enero del año siguiente. El Comité durante el mes de febrero examina los nombres propuestos para los Premios Nobel de Medicina. Entre los meses de marzo y mayo, el Comité Nobel de Medicina consulta con diferentes expertos los nombres de estos candidatos preliminares. El Comité Nobel de Medicina realizará un informe recabando todos los antecedentes y lo remite a la Asamblea Nobel. En dicha Asamblea Nobel se debate sobre el informe del Comité en dos reuniones distintas. A principios de octubre la Asamblea Nobel designará, por mayoría simple de sus miembros, a los ganadores del Premio Nobel de Medicina. Esta decisión es inapelable y se comunica de forma inmediata a todos los medios disponible. Debido a que Noruega formaba parte del Reino de Suecia y por deseo expreso de Alfred Nobel, el premio de Medicina y fisiología es el único que se falla y entrega fuera de Suecia.
Cada octubre, la voluntad de Alfred Nobel de premiar a los que hacen verdadera ciencia (Figura 2), llega como onda expansiva a nuestras universidades y laboratorios y se hace “viral” gracias a la labor instantánea de la prensa, radio, televisión y redes sociales. El Nobel, con su reconocimiento a la excelencia contribuye a que cada día, sabiendo un poco más, recitemos las palabras del Dalai Lama “Comparte tu conocimiento. Es una forma de conseguir la inmortalidad” y empuja a leer y a animar a nuestros compañeros y discípulos a que conozcan algo más sobre la noticia y su importancia científica. Todos los premios llevan incluida una dotación económica, que este año asciende a 9 millones de coronas suecas (831.000 euros), a repartir en caso de que haya más de un galardonado. Este Premio, rodeado de anécdotas, de pequeñas o grandes errores, injusticias o anacronismos, es cada año un soplo de esperanza para algunos, y la realidad de que en el mundo no todo es malo como algunos se atreven a decir.
También recordar historias pasadas de los Premios Nobel ilumina nuestro asombro actual al recordar, como la ciencia, la propia humanidad han ido evolucionando. Así, respecto a los tres últimos años vemos que en 2016, recayó el premio Nobel en Yoshinori Ohsumi por sus investigaciones sobre la autofagia, un aspecto que hace pensar que en la naturaleza todo tiene un porqué y que el “reciclado”, no es sólo un proceso de limpieza, es un proceso complejo, controlado por genes, que permite la renovación y asegurar la vida y la calidad de la misma. El concepto “comerse así mismo” nacido en la década de los 60 del siglo XX, tuvo su reconocimiento 50 años más tarde.
Posteriormente, el dos de octubre de 2017 apareció en los medios la noticia “Tres americanos, descubridores del “reloj interno” del cuerpo, Nobel de Medicina 2017”. Estos autores señalaron que cada célula tenía un reloj interno autorregulado. La comunidad científica ha constatado desde entonces la importancia de este mecanismo en la salud humana, que hace más eficaz los procesos metabólicos y homeostáticos, permitiendo que la vida, desde lo unicelular hasta nosotros mismos, sea algo más previsible y controlable. No cabe duda de que estos genes son heredables, pero su expresión y por tanto los procesos que codifican y controlan son modulados por factores epigenéticos, entre los que destaca el ambiente y la nutrición.
En 2018, el premio Nobel recae sobre un aspecto relacionado con la capacidad inmunológica del organismo y se otorga a James P. Allison y a Tasuku Honjo por su descubrimiento de la terapia contra el cáncer mediante inhibición de la regulación inmune. La aplicación de los descubrimientos de ambos de forma sinérgica ha abierto una puerta increíble, donde se ensayan ya múltiples remedios basados en la terapia inhibitoria sobre células cancerígenas conocida como "terapia de punto de control inmunitario" ha cambiado las perspectivas y el pronóstico para ciertos grupos de pacientes con cáncer en estado avanzado, aunque en algunos casos debido a una hiperactividad en la respuesta inmune puede conducir a reacciones autoinmunes. Estudios clínicos recientes indican que la terapia conjunta, dirigida tanto a CTLA-4 como a PD-1, puede ser más segura como se ha encontrado en pacientes con melanoma.
Siguiendo la tradición, el Nobel de Fisiología y Medicina ha sido el primer premio de su categoría en hacerse público este año y los medios al unísono han anunciado a primeros de octubre de 2019 que el Instituto Karolinska hacía público el siguiente comunicado “The Nobel Assembly at Karolinska Institutet has today decided to award the 2019 Nobel Prize in Physiology or Medicine jointly to William G. Kaelin, Sir Peter Ratcliffe y Gregg L. Semenza for “discovery of how cells sense and adapt to oxygen availability” (“El comité de la Fundación Nobel en el Instituto Karolinska ha decidido hoy conceder el premio Nobel de Fisiología y Medicina conjuntamente a William G. Kaelin, Sir Peter Ratcliffe y Gregg L. Semenza for sus descubrimientos de cómo las células perciben y se adaptan a la disponibilidad de oxígeno”, libre traducción al español).
El secretario de la Fundación Nobel, señalaba en la presentación de los nominados al Premio de Medicina, que “los tres científicos han logrado con sus estudios identificar la maquinaria molecular que regula la actividad de los genes en respuesta a los niveles cambiantes de oxígeno y con ello han establecido la base para entender cómo las concentraciones de este gas tan vital afectan el metabolismo celular y a la función fisiológica, lo que "allana el camino en el desarrollo de nuevas estrategias para combatir la anemia, el cáncer y otras muchas enfermedades. La importancia fundamental del oxígeno es conocida desde hace siglos, pero durante mucho tiempo se desconocía cómo las células se adaptan a los cambios en los niveles de oxígeno; y los premiados hoy han revelado los mecanismos moleculares que subyacen en este proceso”.
“Se trata de un mecanismo biológico fundamental que, en el cuerpo humano, regula -entre otras funciones- el desarrollo embrionario, el metabolismo, la respiración, la inmunidad o la respuesta a la actividad física. Siendo un mecanismo tan básico, resulta interesante que esté involucrado además en múltiples enfermedades como el cáncer, el ictus cerebral, el infarto de miocardio o la anemia”, continuó, la Fundación Nobel. La investigación de estos premiados recuerda a una historia por entrega, cuyos capítulos se publicaron uno tras otro entre 1991 y 2001, como si de una serie por episodios se tratara y tiene como protagonistas principales a tres moléculas: la hormona eritropoyetina (EPO), el Factor inducible por hipoxia (HIF) y la proteína Von Hippel-Lindau (pVHL).
De manera muy breve y basándonos en datos bibliográficos aportados en la página del Premio Nobel(1) y en otras a las que hemos tenido acceso muy recientemente, comentaremos los principales hitos relacionados con los descubrimientos de estas molécula que han llevado a merecer el Premio Nobel de medicina y Fisiología de 2019.
La primera molécula es la hormona eritropoyetina (EPO). Se había descubierto anteriormente que la falta de oxígeno (o hipoxia) elevaba los niveles de EPO y que dicha hormona aumentaba la producción de glóbulos rojos, lo cual llevó a utilizar la hormona como dóping en algunos deportes. Gregg Semenza y Peter Radcliffe se preguntaron cómo el gen que produce la EPO puede responder a los cambios en los niveles de oxígeno. Ambos descubrieron, trabajando de manera independiente, que hay una secuencia del ADN próxima al gen de la EPO que actúa como sensor de oxígeno, y que este sensor está activo no sólo en los riñones donde se produce la EPO, sino en prácticamente todos los tejidos del cuerpo humano. Lo cual reveló que distintos tipos de células comparten un mismo mecanismo de detección del oxígeno.
La segunda molécula es conocida como HIF (por las siglas de Hipoxia Inducible Factor, en castellano Factor Inducible por Hipoxia). Gregg Semenza lo identificó, le puso el nombre y demostró que HIF es la pieza clave que responde a la falta de oxígeno. Concretamente, cuando la disponibilidad de oxígeno se reduce, la célula responde produciendo más HIF. Después HIF se une a la secuencia de ADN próxima al gen EPO, de manera que aumenta la producción de la hormona EPO. Poco más tarde se descubrió que HIF está formada en realidad por dos componentes distintos: HIF-1a (que tendrá un papel importante) y translocador nuclear del receptor de aril-hidrocarburo (ARNT) (Figura 3).
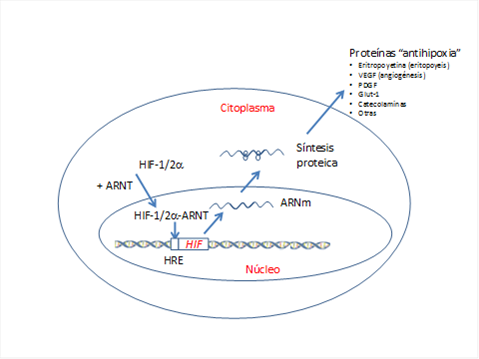
Figura 3. Situación de hipoxia. La falta de disponibilidad de oxígeno conduce a una mayor presencia del factor de transcripción inducible por hipoxia alfa (HIF1/2a), que se transloca al núcleo uniéndose al translocador nuclear del receptor de aril-hidrocarburo (ARNT). En el núcleo se une a la secuencia más próxima del gen HIF en una zona conocida como elemento del receptor del gen HIF-1/2 o HRE, poniendo en marcha la maquinaria de expresión génica con la transcripción de ARN mensajeros y su traducción posterior en los ribosomas para formar múltiples proteínas relacionadas con mecanismos protectores contra la hipoxia, promoción de la vascularización (angiogénesis), utilización metabólica, etc. (Esquema de diseño propio)
La tercera molécula protagonista fue introducida por William Kaelin, un investigador de cáncer que se había especializado en la enfermedad de Von Hippel-Lindau (de ahí el nombre VHL). Se trata de una rara enfermedad hereditaria, causada por mutaciones en el gen VHL, que aumenta dramáticamente el riesgo de algunos cánceres en las familias afectadas por dicha mutación. Kaelin descubrió que, cuando el gen VHL no tiene mutaciones y por lo tanto la proteína VHL (pVHL) tiene una estructura correcta, esta previene de la aparición de tumores. Pero, cuando la proteína es defectuosa, la célula se comporta como si estuviera en situación de hipoxia y esto favorece el desarrollo cáncer. A partir del trabajo de Kaelin, Ratcliffe descubrió que la pVHL es imprescindible para degradar HIF-1a. Por lo tanto, cuando falla VHL, se mantienen niveles anormalmente altos de HIF-1a y la célula interpreta que le falta oxígeno.
Para finalizar este informe, la Academia Nobel1) señalaba el pasado octubre de 2019 (libre traducción al castellano) “En el capítulo final de la historia, Kaelin y Ratcliffe descifraron de manera independiente la cadena de reacciones químicas que permiten a las células monitorizar sus niveles de oxígeno. En una primera fase, el oxígeno interactúa con HIF-1a añadiéndole grupos hidroxilo (Figura 4). Posteriormente, gracias a estos grupos hidroxilo, la pVHL puede unirse a HIF-1a y permitir su degradación”.
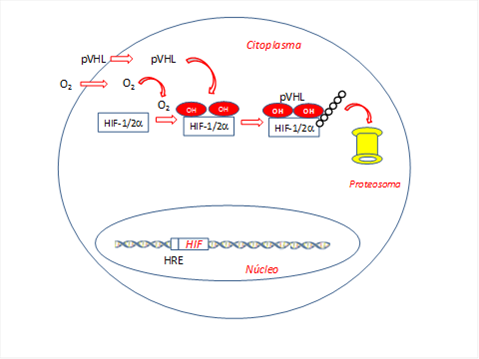
Figura 4. La presencia de oxígeno (normoxia) induce la activación del sistema prolil-hidroxilasa e incrementa la presencia de la proteína VHL (pVHL). Esta proteína tiene actividad ubiquitina ligasa y es responsable de añadir restos ubiquitina a la proteína HIF hidroxilada, permitiendo el reconocimiento por el proteosoma y su degradación posterior, evitando que HIF pueda inducir la formación de proteínas anti-hipoxia. HIF: Factor inducible por hipoxia. (Esquema de diseño propio)
También la Academia Nobel señaló “Gracias al trabajo pionero de estos premiados, sabemos mucho más sobre cómo diferentes niveles de oxígeno regulan procesos biológicos fundamentales. El control del nivel de oxígeno es esencial en nuestra vida cotidiana ya que permite a las células adaptar su metabolismo a niveles bajos: por ejemplo, en nuestros músculos durante la práctica de ejercicio intenso” o bien para generar nuevos vasos sanguíneos o producir glóbulos rojos”. Asimismo, “nuestro sistema inmunitario y muchas otras funciones fisiológicas están moduladas por la maquinaria de control del nivel de oxígeno. Fallos en este sistema de control están implicados en un gran número de enfermedades. Destaca el ejemplo de los tumores que utilizan la maquinaria regulada por el oxígeno para estimular la formación de vasos sanguíneos (angiogénesis) y para reformular el metabolismo de las células para conseguir una proliferación efectiva. Una vez descubierto este mecanismo, se han iniciado “esfuerzos intensos en laboratorios académicos y compañías farmacéuticas para desarrollar fármacos que puedan interferir con estados de enfermedad ya sea activando o bloqueando la maquinaria de control de nivel de oxígeno”.
En este mismo número de la revista se publica un artículo especial(6) que desgrana los mecanismos y aspectos centrales relacionados con tres moléculas: EPO, HIF y pVHL que han dado lugar tras múltiples investigaciones a galardonar con el Premio Nobel de Fisiología y Medicina 2019 a los científicos William G. Kaelin Gregg L. Semenza y Peter J. Ratcliffe. Se señalan los mecanismos moleculares que tiene lugar en situación de normoxia, hipoxia y pseudohipoxia. El artículo termina señalando las perspectivas farmacológicas que ha abierto la relación investigadora de estos científicos en el campo del cáncer y de muchas enfermedades degenerativas.
Referencias
1. Premio Nobel de Medicina 2019: Página Oficial. https://www.nobelprizemedicine.org/the-nobel-prize-in-physiology-or-medicine-2019/
2. Sánchez-Muniz FJ, Culebras JM, Vicente-Vacas L. In the month of the Nobel Prize Awards, we pay tribute to Alfred Nobel and to the recipients of the 2017 Prize in Physiology and Medicine. JONNPR 2017; 2(11): 577-580.
3. Sánchez-Muniz FJ, Culebras JM, Vicente-Vacas L. In the month of the Nobel Prize Awards, we pay tribute to Alfred Nobel and to the recipients of the 2018 Prize in Physiology and Medicine. JONNPR 2018; 3(11): 857-665.
4. Rincón del vago https://www.rincondelvago.com/informacion/premios-nobel/
6. Sánchez-Muniz FJ, Culebras JM, Vicente-Vacas L. JONNPR and the research carried out on the way to the Nobel Prize 2019. A personal view on the molecules and the molecular aspects and underlying control mechanisms related to hypoxia and cancer. JONNPR 2020; 5(3): 231-43 DOI: 10.19230/jonnpr.3452
