ARTICULO ESPECIAL
Atlas de imágenes Laparoscópicas del Cruce Duodenal (Parte I)
Laparoscopic Imaging Atlas of the Duodenal Switch (Part I)
Nieves Pérez, Carlos Serra, Rafael Bou, María Ortín, Aniceto Baltasar
Hospital Virgen de los Lirios. Alcoy. Alicante. España
* Autor para correspondencia.
![]()
This work is licensed
under a Creative
Commons
Attribution-NonCommercial-ShareAlike 4.0 International License
La revista no cobra tasas por el envío de trabajos,
Resumen
La Derivación Bilio-Pancreática laparoscópica (DBP) con Cruce Duodenal (CD) es una operación técnicamente desafiante que requiere una extensa disección quirúrgica, transección y restauración de la continuidad intestinal, y habilidades avanzadas de sutura laparoscópica.
Palabras clave
Cruce duodenal; Cirugía bariátrica; Derivación bilio-pancreática
Abstract
Laparoscopic Bilio-Pancreatic Diversion (BPD) with Duodenal Switch (CD) is a technically challenging operation that requires extensive surgical dissection, transection and restoration of bowel continuity, and advanced laparoscopic suturing skills.
Keywords
Duodenal Switch; Bariatric Surgery; Bilio-pancreatic Diversion
El procedimiento de Cruce Duodenal (CD) fue descrito por DeMeester (1) en 1987 como una solución quirúrgica para la gastritis por reflujo biliar primario o para disminuir los síntomas post gastrectomía observados en pacientes después de la gastrectomía distal y la gastroduodenostomía.
En 1988, Hess (2) y Marceau (3) adaptaron este procedimiento al tratamiento de la obesidad mórbida añadiendo una gastrectomía longitudinal del 75% para reducir la capacidad gástrica y la producción de ácido y extendiendo el asa de Roux a una longitud similar a la recomendada por Scopinaro (4) para inducir la malabsorción de grasa.
Gagner (5) fue el primero en realizar el CD por laparoscopia (CDL) en septiembre de 1999 y Baltasar (6) lo hizo en mayo de 2000. La derivación bilio-pancreática (DBP) con Cruce duodenal (BPD-CD) combina una gastrectomía vertical (GV) con una derivación bilio-pancreática (DBP) en forma de cruce duodenal.
Indicación
1. Como procedimiento primario de pérdida de peso en pacientes con IMC >50 y síndrome metabólico.
2. Como segundo paso en pacientes súper-obesos (SO) con IMC > 50) y SO (IMC > 60) cuando la pérdida máxima de peso ha alcanzado la meseta, 1-1.5 años tras la gastrectomía vertical (GV).
3. En caso de recuperación de peso tras la GV.
Preparación preoperatoria
El tratamiento preoperatorio de los pacientes bariátricos es realizado por un equipo multidisciplinario que incluye cirujanos, endocrinólogos, dietistas, anestesistas, fisioterapeutas y psiquiatras, quienes combinan exámenes médicos, nutricionales y endocrinos para evaluar a los posibles candidatos quirúrgicos.
La evaluación preoperatoria incluye ecografía abdominal, evaluación bioquímica del estado nutricional, fisioterapia respiratoria y en casos seleccionados polisomnografía, estudio de contraste gastrointestinal superior y endoscopia esófago-gastro-duodenal.
Todos los pacientes bariátricos siguen una preparación preoperatoria de rutina que incluye antibióticos y profilaxis de la broncoaspiración ácida en ingresan en el hospital la tarde anterior a la cirugía.
Anestesia
El CDL se realiza bajo anestesia general e intubación endotraqueal. El paciente es colocado en posición francesa con medias de compresión secuencial, y se utiliza rutinariamente una fijación especial de la mesa de operaciones.
Instrumentación
Técnica Quirúrgica
Se utilizan
1. Un trócar de trabajo de 12 mm, otro de 10 mm (para la cámara) y cuatro trocares de 5 mm
2. Retractor hepático Nathanson
3. Visor laparoscópico de 0º y 30
4. Bisturí armónico (Harmonic Ethicon ACE®) y
5. Bisturí (Harmonic Ethicon ACE® 7)
6. Tijeras laparoscópicas de 36 cm)
7. Cuatro pinzas atraumáticas
8. Portaagujas laparoscópico
9. Dispositivo de irrigación por succión
10. Endo grapadora. Echelon Flex 60 mm (cartuchos de oro y verde) o Covidien Signia 60 mm (cartuchos de oro y violeta).
11. Esponjas 10.
12. Aplicador de clip (opcional)
13. Suturas; monoplus 3/0 HR 22mm, Optilene 2/0 2xHR C 26 (agujeros mesentéricos), Optilene 1 HR40 (cierre de aponeurosis), Seda trenzada 0 aguja recta 60mm. (ligamento redondo y piel), y 2/0 Aguja redonda de 25 mm. (fijación de anastomosis)
Posición de los trocares y cirujanos
Se insertan rutinariamente seis puertos supraumbilicales. A veces se necesitan trocares largos en pacientes que tienen una pared abdominal muy gruesa. Por lo general, se inserta un trocar subcostal derecho de 12 mm bajo visión directa, cuatro puntas de dedo por debajo de las costillas, un trocar supraumbilical de 10 mm (cámara) y cuatro trocares de 5 mm en la línea axilar anterior izquierda, derecha e izquierda y posición sub xifoidea (Figura 1).
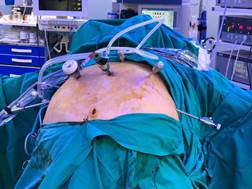
Figura 1
La posición de los cirujanos debe variar dependiendo del paso del procedimiento. En la primera parte de la cirugía, la gastrectomía vertical (GV), el paciente es colocado en posición anti-Trendelenburg y el cirujano se coloca entre las piernas del paciente. Se utilizan dos monitores, uno a cada lado de la cabeza del paciente. Por lo general, el procedimiento se realiza con dos asistentes, uno a cada lado (Figura 2). El neumoperitoneo se ajusta a una presión máxima de 15 mm Hg.
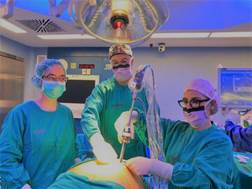
Figura 2
PROCEDIMIENTO
Paso 1 - Gastrectomía Vertical (GV)
Pasamos con una seda 0 para hacer tracción percutánea del ligamento redondo y levantar el hígado. Se introduce un retractor hepático Nathanson a través de un puerto sub xifoideo de 5 mm para separar el lóbulo izquierdo del hígado y exponer el aspecto anterior del estómago (Figuras 3-6).
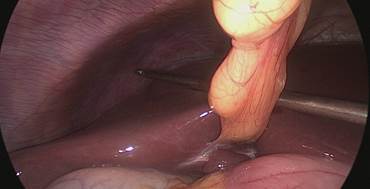
Figura 3
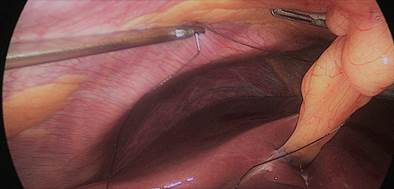
Figura 4
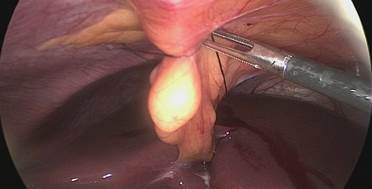
Figura 5
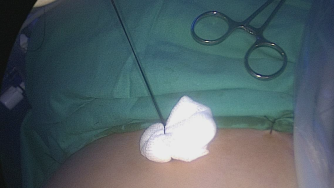
Figura 6
La resección gástrica comienza sellando los vasos de mayor curvatura mayor comenzando en la incisura angularis donde es más fácil entrar en el saco menor. Una vez en transcavidad progresamos hacia arriba con un disector ultrasónico. Para tener la mejor vista, los asistentes mantienen una tracción suave en curvatura mayor y el epiplón. Es muy importante dividir todas las adherencias entre páncreas y pared posterior gástrica. Continuamos la liberación hasta el diafragma (Figuras 7-14).
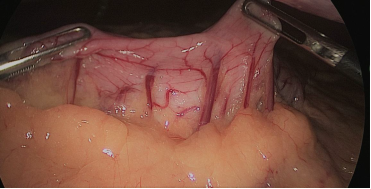
Figura 7
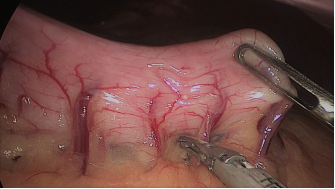
Figura 8
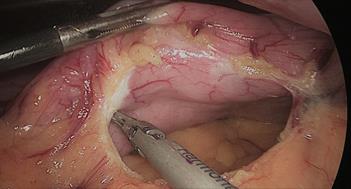
Figura 9
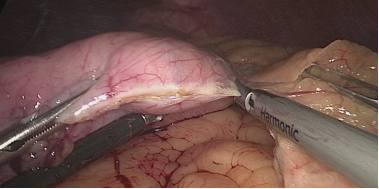
Figura 10
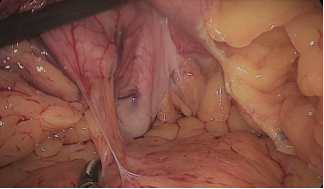
Figura 11
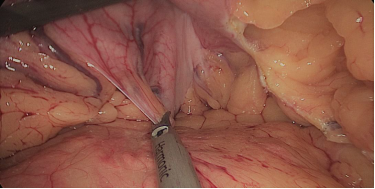
Figura 12
Figura 13
Figura 14
Ahora se pasa una sonde 12 mm nasogástrica hasta el píloro.
Figura 15
El asistente del lado izquierdo continúa la disección gástrica hacia abajo hasta el 2 - 3 cm distal al píloro. En este punto, se crea un túnel retro duodenal mediante maniobras de disección suaves a partir del margen duodenal inferior. La disección se continúa muy cerca de la pared posterior del duodeno, en un plano superior a la arteria gastroduodenal. Durante esta maniobra el cirujano y los asistentes levantan el estómago y se crea una pequeña ventana en el margen superior del duodeno (ligamento gastro hepático) (Figuras 16-23).
Figura 16
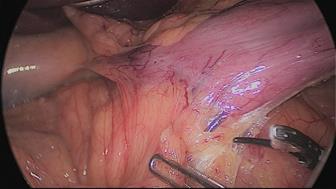
Figura 17
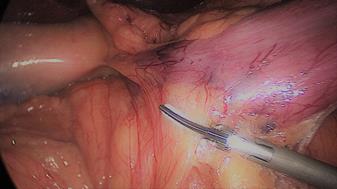
Figura 18
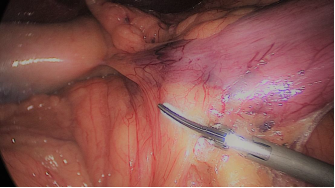
Figura 19
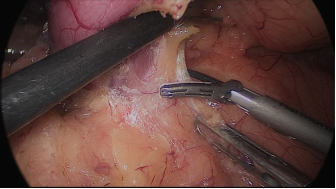
Figura 20
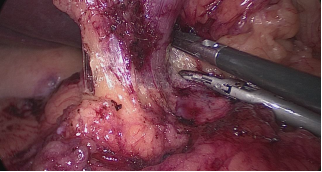
Figura 21
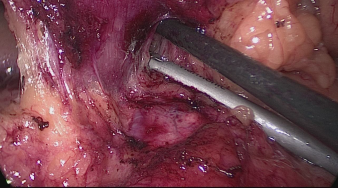
Figura 22
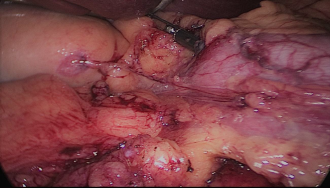
Figura 23
Una vez realizado el túnel retro duodenal, el cirujano introduce una grapadora de 60 mm por la derecha a través del trocar de 12 mm y pasa muy suavemente a lo largo del túnel y se divide el duodeno. La línea de grapadoras duodenales está reforzada con una sutura monoplus 3/0. El duodeno distal está así cerrado.
Gastrectomía. La sonda de 12 ms. se avanza hasta píloro y se apoya en la curvatura menor.
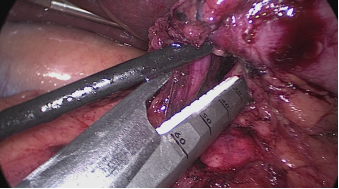
Figura 24
La división del estómago se inicia a 1 cm por encima del píloro, aplicando una grapadora de 60 mm insertada por el puerto derecho de 12 mm (los dos primeros cartuchos deben ser de color verde (Covidien) o violeta (Echelon). Antes de cada cierre de la grapadora, es obligatorio comprobar la movilidad de la bujía. Evitar la estenosis a nivel de la incisión angularis. La división gástrica progresa a lo largo de todo el proceso utilizando cartuchos de 60 ms. En este punto es crítico exponer adecuadamente el aspecto anterior y posterior del estómago usando tracción lateral del asistente a la izquierda. Esto previene la forma de un sacacorchos del tubo gástrico, evita dejar un gran fondo posterior y el riesgo de reflujo gastroesofágico postoperatorio.
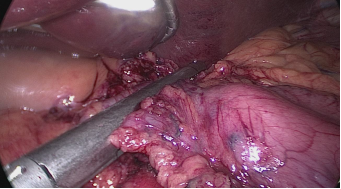
Figura 25
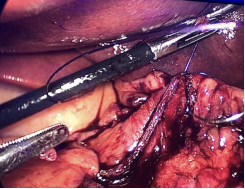
Figura 26
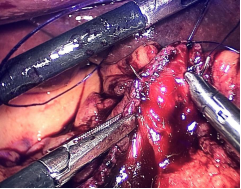
Figura 27
La división gástrica progresa a lo largo de todo el proceso utilizando cartuchos de oro de 60 ms. En este punto es crítico exponer adecuadamente el aspecto anterior y posterior del estómago usando tracción lateral del asistente a la izquierda. Esto previene la forma de un sacacorchos de la manga y evita dejar un gran fondo posterior y el riesgo de reflujo gastroesofágico postoperatorio. Siempre se realiza una prueba de tinte azul de metileno para comprobar las fugas en la unión esófago-gástrica y a lo largo de toda la línea de grapas (Figuras 28-34).
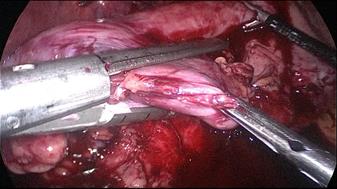
Figura 28
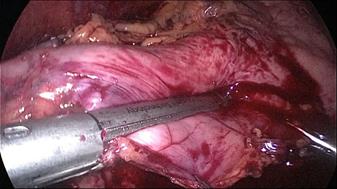
Figura 29
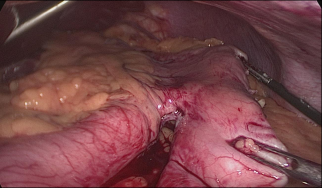
Figura 30
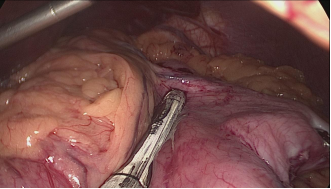
Figura 31
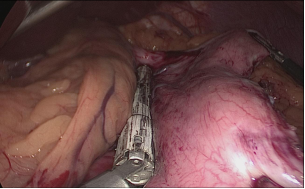
Figura 32
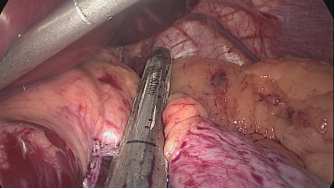
Figura 33
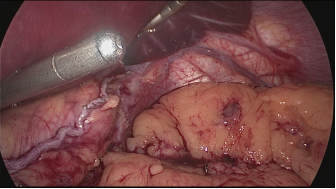
Figura 34
El cirujano entre las piernas refuerza la larga línea de la grapadora gástrica con dos suturas 3/0 monoplus (Figuras 35-38).
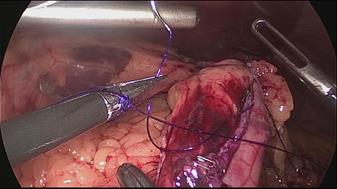
Figura 35
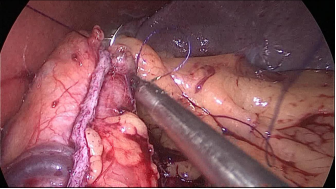
Figura 36
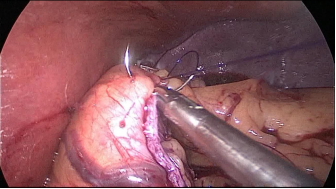
Figura 37
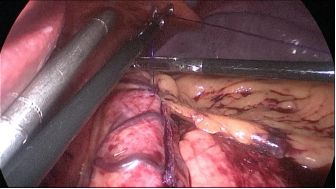
Figura 38
* Primero, creamos (7,8) un nudo deslizante y auto bloqueante al final de una rosca 3/0 Monoplus. El portaagujas pasa por el asa y agarra la sutura cerca de la aguja antes de entrar en la cavidad abdominal. Introducimos el portaagujas por el puerto de 12 mm y empezamos la puntada tomando primero el omentum y luego la serosa de la pared posterior del tubo - y luego la puntada serosa de la pared anterior en alto en el ángulo de la suya.
Sostenemos de nuevo la sutura cerca de la aguja y pasamos el hilo a través del bucle de deslizamiento. Luego, el lazo deslizante y también el nudo se deslizan sobre la sutura y esta primera puntada se auto bloquea con los principios del nudo de Aberdeen: cuanto más se tira, más se bloquea el nudo.
El resto de la sutura es una sutura sero-serosa que toma el omento en cada puntada y finalmente un nudo de Aberdeen termina la sutura. Nos preocupaba el papel de las dos grapas al final del hilo de nuestra sutura en el desarrollo de fugas gástricas después de LSG. Estos cuerpos extraños podrían ser el origen de un agujero en el ángulo de His y, potencialmente, la causa del desarrollo de una fuga a este nivel. La primera puntada deslizante y autoblocante es una maniobra fácil que evita la existencia de cuerpos extraños en una parte delicada del estómago. El objetivo de esta sutura corrida es, por un lado, estabilizar el tubo gástrico y, por otro, realizar una hemostasia.
Terminamos esta parte dividiendo el epiplón para un levantamiento más fácil y sin tensión del ansa yeyunal (Figura 39).
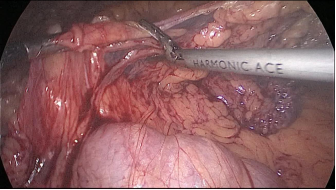
Figura 39
Siempre se realiza una prueba de azul de metileno para comprobar las fugas en la unión esófago-gástrica y a lo largo de toda la línea de grapas (Figuras 28-34).
Este artículo tiene su continuación con los dos siguientes pasos del Procedimiento en el artículo que se publicará en el siguiente número de esta revista(9)
Referencias
- DeMeester TR, Fuchs KH, Ball CS, et al.: N. Experimental and clinical results with proximal end-to-end duodeno-jejunostomy for pathological duodeno gastric reflux. Ann Surg. 1987;206(4):414-24.
- Hess DS, Hess DW. Biliopancreatic diversion with a duodenal switch. Obes Surg 1998; 8:267-82
- Marceau P, Biron S, St Georges R, et al. Biliopancreatic diversion with gastrectomy as surgical treatment of morbid obesity. Obes Surg 1991; 1:381-7. 5.
- Scopinaro N, Gianetta E, Civalleri D, et al. Two years of clinical experience with biliopancreatic bypass for obesity. Am J Clin Nutr 1980; 33:506-14.
- Ren CJ, Patterson E, Gagner M. Early results of laparoscopic biliopancreatic diversion with duodenal switch: a case series of 40 consecutive patients. Obes Surg 2000; 10:514-523.
- Baltasar A, Bou R, Miró J. et al.: Avances en técnica quirúrgica. Cruce duodenal por laparoscopia en el tratamiento de la obesidad mórbida: técnica y estudio preliminar. Cir. Esp. 2001; 70:102-104. (www.youtube.com/ watch?v=GSfzgYYxZJ8)
- Serra C, Pérez N, Bou R, et al. Sliding self-locking first stitch and Aberdeen knots in suture reinforcement with omentoplasty of the laparoscopic gastric sleeve staple line. Obes Surg 2014; 24:1739-40. DOI: 10.1007/s11695014-1352-5
8. Baltasar A, Bou R, Serra R, et al. Use of self-locking knots in running intestinal bariatric sutures. Glob Surg 2015; 2:100-1. DOI: 10.15761/GOS.1000132
9. Falta completar la cita a la Parte II
