ORIGINAL
Funcionamiento neuropsicológico en los Trastornos de la Conducta Alimentaria: Un estudio comparativo
Neuropsychological functioning in Eating Disorders: A comparative study
Rubén Maldonado-Ferrete1, María Catalán-Camacho1, Vanessa Álvarez Valbuena1, Ignacio Jáuregui-Lobera1,2
1 Instituto de Ciencias de la Conducta. Sevilla. España.
2 Universidad Pablo de Olavide. Sevilla. España.
* Autor para correspondencia.
![]()
This work is licensed
under a Creative
Commons
Attribution-NonCommercial-ShareAlike 4.0 International License
La revista no cobra tasas por el envío de trabajos,
Resumen
Introducción. Los trastornos de la conducta alimentaria (TCA) cursan con diversas alteraciones en tres principales rasgos o endofenotipos: coherencia central, tareas de cambio de criterio y control de impulsos según diferentes técnicas de evaluación neuropsicológicas y de neuroimagen. El objetivo de este trabajo es aportar evidencia empírica descriptiva sobre estas posibles alteraciones y su relación con variables emocionales, de funcionamiento diario y de conducta alimentaria
Método. Se compararon 38 mujeres: 19 con trastornos de la conducta alimentaria (TCA) y 19 participantes sin TCA. Se usaron diferentes técnicas para evaluar la velocidad de procesamiento, memoria, atención, impulsividad y el estado emocional.
Resultados. Las diferencias en el resultado de la mayoría de las pruebas neuropsicológicas empleadas fueron no significativas excepto en la Clave de Números y en el recuerdo inmediato del Test de Memoria de Rivermead. El grupo con TCA mostró síntomas depresivos moderados.
Conclusiones. El rendimiento similar del grupo TCA en las pruebas neuropsicológicas podría ser explicado por un estilo de procesamiento de la información basado en el detalle y sin cambio de criterio. Los síntomas depresivos parecen ser un factor de vulnerabilidad que correlaciona con la evolución del trastorno. La intervención neuropsicológica de los TCA aportaría nuevas técnicas de tratamiento de forma complementaria a las que ya se aplican; favorecería un abordaje más dimensional sacando a la luz nuevas dianas terapéuticas y también se trataría la comorbilidad de estos trastornos actuando sobre los factores comunes. En consecuencia, se sugieren nuevas líneas de investigación de neuropsicología aplicada.
Palabras clave
Endofenotipos; neuropsicología; trastornos de la conducta alimentaria; tratamiento
Abstract
Introduction. Patients with eating disorders (ED) show several alterations in three main features or endophenotypes: central coherence, tasks based on changing criteria and impulse control according to different neuropsychological and neuroimaging evaluation techniques. The objective of this work is to provide descriptive empirical evidence about these possible alterations and their relationship with emotional, daily functioning and eating behavior variables.
Method. A total of 38 women were compared: 19 with ED and 19 healthy participants. Different techniques were used to assess the speed of processing, memory, attention, impulsivity and emotional state.
Results. Differences in the results of the most of neuropsychological tests used were not significant except in the case of symbol search and in the immediate recall of the Rivermead Memory Test. The group with ED showed moderate depressive symptoms.
Conclusions. The similar performance of the ED group respecting the neuropsychological tests could be explained by a style of information processing based on detail and without changing criteria. Depressive symptoms appear to be a vulnerability factor that correlates with the course of the disorder. Neuropsychological intervention in ED would provide new treatment techniques in a complementary way to those already applied; it would favor a more dimensional approach by bringing new therapeutic targets to light, and the comorbidity of these disorders would also be treated by acting on common factors. Consequently, new lines of applied neuropsychology research are suggested.
Keywords
Endophenotypes; neuropsychology; eating disorders; treatment
Las personas con Trastornos de la Conducta Alimentaria (TCA) sufren una alteración en la ingesta de nutrientes asociada a otras alteraciones cognitivas, conductuales y emocionales. El Manual Diagnóstico y Estadístico de los trastornos mentales en su quinta edición (DSM-5)(1), establece varios diagnósticos. La anorexia nerviosa (AN) y bulimia nerviosa (BN) son los más importantes para este trabajo.
Según la Guía de Práctica Clínica sobre TCA del Ministerio de Sanidad y Consumo (2008)(2), en España, están afectadas entre el 4.1% y el 6.4% de mujeres de 12 a 21 años. En hombres, el valor baja hasta el 0.3% (1 hombre por cada 10 mujeres afectadas).
A continuación, se comentan brevemente, las características descriptivas tanto de AN como de BN basándonos en el citado manual DSM-5(1).
La AN se caracteriza por una restricción de la ingesta energética causada por un miedo intenso a engordar, conduciendo a un peso corporal significativamente bajo con respecto a la edad, el sexo, el curso del desarrollo y la salud física de la persona. El Índice de Masa Corporal (IMC) es igual o inferior a 18,5 kg/m2 en adultos e inferior al quinto percentil para niños y adolescentes, según la undécima edición de la Clasificación Internacional de las Enfermedades (CIE-11) establecida por la Organización Mundial de la Salud (2019) (3). Dentro del trastorno se engloban dos subtipos, por un lado se encuentra el tipo restrictivo (ANR), basado únicamente en la limitación de la ingesta alimentaria y la práctica excesiva de ejercicio físico durante, al menos, los tres últimos meses; por otro, se halla el subtipo purgativo (ANP), que mantiene la conducta de la ANR pero recurre de forma periódica a actitudes compensatorias (vómitos autoprovocados, incorrecta utilización de laxantes, medicamentos o diuréticos) como mínimo en los tres últimos meses.
La AN tiene comorbilidad, principalmente, con síntomas ansiosos y depresivos, obsesivos y con trastornos de personalidad (especialmente los tipos histriónico, antisocial y límite). La comorbilidad de las personas con el subtipo bulímico (junto con las que padecen BN) indica que éstas tienen mayores niveles de psicopatología (depresión, disforia, ansiedad, conducta antisocial, abuso de sustancias y robos) respecto al tipo restrictivo (4).
Para el diagnóstico de BN se necesita la presencia de episodios recurrentes de atracones (consumo excesivo de alimentos asociado a una falta de control) al menos una vez por semana durante tres meses, conductas compensatorias desadaptativas para no aumentar el peso y una autoevaluación excesivamente influida por el peso y la constitución corporal.
Este trastorno no se detecta con tanta facilidad porque las personas intentan ocultarlo y suelen estar en normopeso o incluso presentar sobrepeso-obesidad. La incidencia sigue siendo mayor en las mujeres con una proporción de 9 a 1 respecto a los hombres. Suele aparecer un poco más tarde que la AN, entre los 18 y 25 años.
El consumo de sustancias también es comórbido con la BN. Suele comenzar como un intento de control del hambre. Los problemas de impulsividad pueden hacer que la persona llegue a cumplir criterios de trastorno límite de la personalidad.
La complejidad de estos trastornos es manifiesta, por ello, la intervención adecuada de los TCA debe ser interdisciplinar en diversos ámbitos (atención primaria y especializada) y en régimen ambulatorio u hospitalario si los síntomas indican riesgo vital (2).
Habiendo hecho una somera descripción clínica de los TCA, cabe destacar en este punto, los aspectos neuropsicológicos de los mismos.
Desde la década de los 90 del pasado siglo, el cuerpo de conocimientos de la neuropsicología aplicada a los TCA no ha dejado de crecer consiguiendo operativizar y cuantificar procesos cognitivos implicados en los mismos y permitiendo nuevas vías de prevención y tratamiento (5).
Para enmarcar el papel de la neuropsicología en la evaluación y tratamiento de los TCA, hay que hacer una mención a los endofenotipos. Actualmente, el diagnóstico de los TCA se realiza en base al fenotipo clínicamente observable. Las conductas, cogniciones y emociones están alteradas en torno a un núcleo patológico: en AN es el bajo peso y el exceso de control en el subtipo restrictivo, en BN y otros TCA es la impulsividad o pérdida de control. Las categorías diagnósticas ayudan en la evaluación, el tratamiento y el pronóstico (6). Sin embargo, también es un hecho la amplia heterogeneidad diagnóstica intra-categorial, la comorbilidad y la fluctuación sintomática entre trastornos (7,8).
La neuropsicología está sacando a la luz endofenotipos de diferentes grupos de trastornos dotando a la clasificación DSM de un cariz más dimensional. Los endofenotipos aportan medidas cuantitativas de los trastornos al uso exclusivo de escalas y cuestionarios, sirviendo también como medida de evaluación de eficacia de nuevos tratamientos. Otra importante aportación sería la explicación de la comorbilidad.
A pesar de los hallazgos que se describen a continuación, la neuropsicología no ha podido establecer aún un modelo explicativo firme de los TCA. Los rasgos neuropsicológicos podrían ser nuevas dianas de tratamiento en los TCA con un enfoque dimensional y transdiagnóstico (9-11).
Los diversos estudios que incluyen medidas de neuroimagen revelan cambios tanto en áreas cerebrales extensas (corteza frontal y parietal) como en áreas específicas (núcleo caudado, tálamo y corteza frontal ínfero-lateral) en pacientes con un TCA en fase aguda en comparación con otros sujetos control, personas con otros trastornos psicológicos, incluso con pacientes de AN en recuperación o remisión (12).
Mediante la Tomografía por emisión de positrones (PET) se ha encontrado lo siguiente: a) Decremento en la actividad cortical parietal previa al tratamiento pero también una recuperación de la misma tras el tratamiento (13); b) Disminución en la perfusión y en el metabolismo en la corteza prefrontal superior y dorsolateral reversible con la recuperación del peso (14); y c) Incremento metabólico en el núcleo caudado, en el putamen y en la corteza frontal ínfero-lateral.
Por otra parte, mediante la Tomografía Computarizada por Emisión de Fotones (SPECT), algunos autores han encontrado resultados similares a los anteriores, reversibles con la normalización del peso. Sin embargo, otros grupos de investigación han hallado menor perfusión en áreas orbito-frontales y en la corteza prefrontal dorsolateral derecha tras la recuperación del peso. Esto es indicativo de que dichas alteraciones pueden estar explicando en parte el TCA y no ser consecuencia de él (15).
Con Resonancia Magnética Funcional (fMR), recordando que las principales áreas implicadas en los TCA son la corteza prefrontal dorsolateral (CPFDL) y ventromedial (CPFVM), la corteza prefrontal órbito lateral (CPFOL), el giro cingulado anterior, estructuras talámicas y subtalámicas y la vía fronto-estriado-talámica, el hallazgo más notorio es la falta de activación de estás áreas durante la realización de diferentes tests como el WCST y tareas de autorregulación (17-21).
También se ha explorado el Procesamiento Visual que, en condiciones normales, implica el funcionamiento armónico del sistema visual dorsal (de baja frecuencia, global y de rápido procesamiento) y también del sistema visual ventral (de alta frecuencia, local o basado en detalles y de lento procesamiento). En la AN ocurre un desequilibrio. El sistema dorsal está infra-activado y el ventral hiper-activado resultando en un procesamiento excesivo de los detalles junto con un patrón de escaneo visual caracterizado por fijaciones múltiples y muy breves (movimientos sacádicos de alta velocidad) (22). Este procesamiento visual anómalo ha sido también descrito en el trastorno obsesivo-compulsivo, la ansiedad social y la esquizofrenia (23,24).
En lo que atañe a la BN, los resultados de los estudios de neuroimagen son consistentes en la hipo-activación de las áreas relacionadas con la auto-regulación, lo que conlleva un aumento de la impulsividad: decremento en la actividad de las vías fronto-estriatales y en la corteza prefrontal que fallan al inhibir otras estructuras subcorticales activadas ante estímulos evocadores relacionados con la comida (craving) (25).
Entre los hallazgos neuropsicológicos propiamente dichos, aún hoy los estudios no han encontrado un perfil neuropsicológico muy diferente entre AN y BN (26).
A pesar de estas limitaciones, los estudios han arrojado hallazgos muy consistentes en tres tipos principales de alteraciones neurocognitivas: débil coherencia central, dificultades en tareas de cambio de criterio (componente de la función ejecutiva) e impulsividad (27,28). En ellas, el lóbulo frontal está generalmente implicado.
Según la literatura, las alteraciones en la coherencia central y en el cambio de criterio en AN y BN se postulan como potenciales endofenotipos o rasgos característicos porque no están relacionados con el estado nutricional; se dan, en cierto grado, en familiares sin el trastorno y persisten tras el tratamiento (29-35). Es decir, serían factores de riesgo o predisponentes más que la consecuencia de la alteración alimentaria en sí.
Por otro lado, la impulsividad y compulsividad podrían ser también endofenotipos compartidos entre los TCA, el trastorno obsesivo compulsivo (TOC), el abuso de sustancias, la manía, el trastorno por déficit de atención e hiperactividad, la esquizofrenia, el espectro autista y los trastornos de personalidad (10).
Por último, el papel de las emociones resulta relevante en los TCA. De hecho, las dificultades en el funcionamiento social y emocional tienen una gran importancia en el desarrollo y mantenimiento de los TCA (36).
La depresión está también muy relacionada con los TCA. Hasta ahora, la literatura lo establece como una vulnerabilidad más que correlaciona con la gravedad del trastorno. Se ha observado que hay síntomas ansiosos y depresivos con mayor impacto en la fase aguda del trastorno y que son independientes del índice de masa corporal (IMC) (28).
A la vista de lo anteriormente expuesto, parece necesario profundizar en el estudio de los endofenotipos en los TCA para diseñar, en un futuro, otras formas complementarias de intervención con un enfoque más dimensional y transdiagnóstico.
El presente trabajo, es un estudio inicial, exploratorio para analizar las posibles alteraciones neuropsicológicas en pacientes con diagnóstico de TCA a fin de obtener nuevas vías alternativas de tratamiento, es decir, en caso de que estas alteraciones existieran y se pudieran tratar ¿Podría integrarse “lo neuropsicológico” en el plan terapéutico general del TCA?
El objetivo general del presente estudio es aportar evidencia empírica descriptiva sobre posibles alteraciones neuropsicológicas en pacientes con TCA.
Un primer objetivo específico será comparar el rendimiento en pruebas neuropsicológicas de memoria, atención, velocidad de procesamiento e impulsividad entre un grupo de pacientes con TCA y otro control.
El segundo objetivo específico será comparar las funciones anteriormente mencionadas con el estado emocional, el funcionamiento diario, el comportamiento en torno la comida y la percepción de la imagen corporal en el grupo de personas con y sin TCA.
Para ello, se fijaron las siguientes hipótesis:
Hipótesis 1: El grupo de pacientes con TCA tendrá peor rendimiento en las pruebas que miden memoria, atención, velocidad de procesamiento e impulsividad que el grupo de personas sin TCA o grupo control.
Hipótesis 2: El grupo TCA tendrá peor estado emocional, peor funcionamiento diario, mayores alteraciones en la conducta alimentaria y alteración de la percepción de la imagen corporal que el grupo control.
Método
Este estudio se realizó con 38 mujeres, 19 de ellas pertenecientes al grupo clínico, con diagnóstico de TCA (grupo TCA, GTCA), y 19 sin TCA, (grupo control, GC). Debido a las características epidemiológicas habituales de los TCA, todas las participantes estaban entre los 13 y 25 años y no se incluyó a ningún hombre.
El GTCA se obtuvo en el Instituto de Ciencias de la Conducta de Sevilla (19 ± 4,3 años). El GC fue reclutado a través de contactos, correos electrónicos y redes sociales (21 ± 1 años). Se solicitaron mujeres de entre 15 y 25 años, sin TCA ni haberlo padecido, que no estuvieran bajo tratamiento psicológico o psiquiátrico y que no estuvieran tomando ningún psicofármaco.
Instrumentos y medidas
Se usaron los siguientes instrumentos de evaluación:
1. WAIS-III (Weschler Adult Inteligence Scale-III) adaptado al español por De la Guía, Hernández, Paradell y Vallar (2012) (37).
Se usaron únicamente las siguientes pruebas: Clave de Números, Búsqueda de Símbolos y Dígitos Directos e Inversos.
2. Prueba de Memoria Lógica de Rivermead (RBMT) (38). Se usó la adaptación española de Soler y Ruiz (1994). Se usó el recuerdo inmediato y demorado (después de un intervalo de 20 minutos) de un texto con 21 ítems de información (39).
3. RAVLT (Rey Auditory Verbal Learning Test) (40). Para este estudio se usó la versión española de Benedet y Alejandre (2014), denominada Test de Aprendizaje Verbal España-Complutense (41).
4. Test de Stroop (42). Adaptado al español por TEA ediciones (Luque y Ruíz, 2001).
5. Trail Making Test (TMT) (43). Editado en España por TEA ediciones con el nombre de Test del Trazo (2014).
6. Test de la Figura Compleja de Rey (CFRT) de Rey-Rey y Osterrieth (1994) (44). Se usó la figura A. Adaptada por De la Cruz por TEA ediciones en 2003.
7. Test de Clasificación de Cartas de Wisconsin o “Wisconsin Card Sorting Test” (WCST) (45), adaptado al español para TEA Ediciones por de la Cruz (2001).
8. Inventario de depresión de Beck, BDI-II (Beck Depression inventory II) (46). Adaptado al español por Sanz, Perdigón y Vázquez (2003) (47).
9. Inventario de ansiedad estado-rasgo, STAI (State-Trate Anxiety Inventory) de Spielberger, Gorshuch y Lushene (2008) (48). Ha sido adaptado al español por Guillén-Riquelme y Buela-Casal. La última revisión se hizo en 2011(49).
10. Inventario de Trastornos de la Conducta Alimentaria, EDI-3 (Eating Disorder Inventory-3) de Garner, (2004), traducido al español por Paula Elosua, López-Jáuregui y Sánchez Sánchez en 2010 por TEA ediciones(50). Es un cuestionario de 91 ítems de respuesta tipo Líkert de 0 a 4, siendo 0 nunca y 4 siempre. El EDI-3 da puntuaciones independientes en 12 escalas principales y 6 índices, así como de 3 escalas de validez. Además, para el este trabajo y con motivo de centrarnos en los aspectos característicos del comportamiento alimentario, se creó una escala ad hoc denominada “Nutrición” (N), que engloba los ítems: 1, 4, 5, 7, 11, 16, 25, 28, 32, 38, 40, 46, 47, 49, 53, 61, 64, 68, 78, 81, 86.
11. Cuestionario Disejecutivo (Dysexecutive Questionnarie, DEX) adaptado al español por Pedrero et al. (2009) (51). El cuestionario disejecutivo forma parte de una batería de evaluación del síndrome disejecutivo (BADS) (Behavioural Assessment of the Dysexecutive Syndrome) de Wilson, Alderman, Burgess, Emslie y Evans (1996) (52).
12. Cuestionario de Funcionamiento Diario, (Everyday Functioning Questionnaire, EFQ) (53). No ha sido aún validado al español.
Además, se utilizó el Índice de Masa Corporal (IMC), sólo en el grupo clínico porque algunos síntomas están relacionados con él como se ha comentado anteriormente. En el GC no se consideró esta variable al no padecer ningún TCA.
Finalmente, también en el grupo clínico se consideró el tiempo de tratamiento, fijándose el límite de un año para dividir el GTCA en dos subgrupos.
Procedimiento
Las pacientes del GTCA realizaron las pruebas neuropsicológicas y rellenaron los cuestionarios coincidiendo con su asistencia al centro para el tratamiento en régimen ambulatorio. Las pacientes firmaron un consentimiento informado. En el caso de las menores de edad, lo firmaron sus progenitores.
El protocolo de evaluación se llevó a cabo en varias sesiones a fin de evitar el cansancio a razón de una sesión por semana (no más de 3), siempre en horario de tarde (de 16:00 a 20:00 horas). Las condiciones ambientales fueron adecuadas para la realización de las pruebas de evaluación. Siempre se llevó a cabo en presencia de un psicólogo.
Las participantes del GC fueron evaluadas también en el mismo centro y en las mismas condiciones. La mayoría completó el protocolo en 2 sesiones, una por semana.
El orden de las pruebas se estandarizó para evitar efectos de fatiga y de orden. Primero se realizaron todas las pruebas neuropsicológicas alternando tests manipulativos y verbales. En otra sesión de evaluación, se rellenaron los cuestionarios.
El orden de las pruebas neuropsicológicas fue el siguiente: Clave de Números, Dígitos Directos e Inversos, Búsqueda de Símbolos, Memoria Lógica de Ribermead (inmediato), Stroop, RAVLT (aprendizaje e interferencia), Figura Compleja de Rey (copia), TMT (A y B), Figura Compleja de Rey (recuerdo), RAVLT (recuerdo demorado y reconocimiento) y WCST.
Diseño
Este trabajo es un estudio ex post facto prospectivo de casos y controles. La variable diferenciadora fue padecer un TCA. Se compararon las diferencias en las variables de funcionamiento neuropsicológico, del comportamiento alimentario, el estado emocional y el funcionamiento diario.
Variables de funcionamiento neuropsicológico: Se evaluaron las siguientes funciones: velocidad de procesamiento, atención, memoria e impulsividad a través del rendimiento medido con los instrumentos citados anteriormente de la siguiente manera:
- Memoria: RAVLT, RBMT, Figura Compleja de Rey, Dígitos Directos e Inversos.
- Velocidad de procesamiento: Clave de Números y Búsqueda de Símbolos.
- Atención: Stroop, TMT, Dígitos Directos e Inversos, WCST.
- Impulsividad: DEX (desorganización e impulsividad), TMT y WCST.
Variables de comportamiento alimentario: Escala de Nutrición creada ad hoc con el EDI-3.
Variables relacionadas con la imagen y percepción corporal: Cuestionario EDI-3.
Variables de estado emocional: la depresión se operativizó como la puntuación en los cuestionarios BDI-II y en la dimensión apatía del DEX. La ansiedad se midió a través de la puntuación en el cuestionario STAI.
Variable de funcionamiento diario: La puntuación en el cuestionario EFQ fue la medición de esta variable.
Exclusivamente en el GTCA, se hicieron dos subgrupos según el IMC y el tiempo de tratamiento.
Según el IMC, el GTCA se subdividió en: grupo A (pacientes con IMC<18,5) con n=8 y grupo B (pacientes con IMC≥18,5) con n=11.
Según el tiempo de tratamiento, las pacientes se subdividieron en un grupo cuyo tiempo de tratamiento fue inferior a 1 año (GTT-1) con n=9 y otro grupo cuyo tiempo de tratamiento fue superior a un año (GTT+1) con n=10.
Análisis de datos
El análisis de datos se realizó con el programa R versión 3.3.3 (2017-03-06) "Another Canoe" Copyright (C) 2017. The R Foundation for Statistical Computing Platform: x86_64-apple-darwin13.4.0 (64-bit).
Para el presente trabajo, dado el tamaño y heterogeneidad de la muestra, se optó por aplicar pruebas que tuvieran en cuenta la presencia de datos anómalos (outliers). Como quiera que los datos anómalos no son sinónimos de erróneos (algo inesperado no es forzosamente erróneo), se utilizó la generalización robusta del test de Welch, considerando esos posibles datos anómalos, pero reduciendo en lo posible su influencia. Se establecieron las siguientes hipótesis estadísticas para las diferencias de medias en las variables expuestas:
1. Entre el GTCA y GC: H0: µTCA = µC H1: µTCA ≠ µC
2. Entre el GA y GB H0: µGA = µGB H1: µGA ≠ µGB
3. Entre el GTT-1 y GTT+1: H0: µGTT-1 = µGTT+1 H1: µGTT-1 ≠ µGTT+1
Todos los niveles de significación se establecieron al 95% (α=0,05).
También se realizó un análisis de correlaciones entre las variables mediante el coeficiente de Pearson.
A continuación, se presentan los resultados comparando los grupos principales y los subgrupos de la muestra estudiada.
Diferencias entre GTCA y GC
En la Tabla 1 se presentan los descriptivos (media y desviación típica) de los grupos y sólo las diferencias significativas entre-grupos de las pruebas neuropsicológicas y las medidas de estado emocional, calidad de vida y funcionamiento diario.
Tabla 1. Diferencias entre GTCA y GC.
|
|
GTCA (n=19) |
GC (n=19) |
F (df) |
p<0,05 |
|
Media (dt) |
Media (dt) |
|||
|
WAIS-III |
|
|
|
|
|
Clave de Números |
8,36 (2,62) |
10,68 (2,4) |
6,62 (1,26)
|
0,0161 |
|
Búsqueda de Símbolos |
- |
- |
- |
NS |
|
Dígitos Directos e Inversos |
- |
- |
- |
NS |
|
RBMT |
|
|
|
|
|
Recuerdo inmediato |
10,78 (3,38) |
8,37 (3,13) |
5,27 (1,28) |
0,0293 |
|
Recuerdo demorado |
- |
- |
- |
NS |
|
RAVLT |
- |
- |
- |
NS |
|
STROOP |
- |
- |
- |
NS |
|
TMT A y B |
- |
- |
- |
NS |
|
CFRT (cuantitativa) copia y memoria |
- |
- |
- |
NS |
|
WCST |
|
|
|
|
|
Respuestas perseverativas |
- |
- |
- |
NS |
|
Errores totales |
59,79 (22,82) |
45,16 (17,51) |
6,43 |
0,02 |
|
Errores perseverativos |
- |
- |
- |
NS |
|
Errores no perseverativos |
- |
- |
- |
NS |
|
BDI-II |
22,5 (10,55) |
3,84 (2,97) |
54,14 (1,27) |
0,0008 |
|
STAI estado y rasgo |
- |
- |
- |
NS |
|
EDI-3 |
- |
- |
- |
|
|
DT, tendencia a la delgadez |
53,43 (8,35) |
43,58 (5,82) |
31,507 (1,13) |
0,00005 |
|
BD, insatisfacción corporal |
47,93 (7,81) |
46,84 (5,33) |
4,55 (1,13) |
0,0525 |
|
PA, alienación personal |
53,21 (9,17) |
44 (4,15) |
7,45 (1,13) |
0,017 |
|
ID, déficits interoceptivos |
55,57 (6,98) |
46,21 (4,45) |
7,014 (1,13) |
0,0199 |
|
DEX |
|
|
|
|
|
Desorganización/apatía |
19,5 (5,32) |
11,95 (4,46) |
19 (1,30) |
0,00014 |
|
Desinhibición/impulsividad |
- |
- |
- |
NS |
|
EFQ |
|
|
|
|
|
Memoria |
- |
- |
- |
NS |
|
Emociones |
9,5 (4,05) |
4,36 (2,56) |
20,174 (1,25) |
0,00014 |
|
Organización |
- |
- |
- |
NS |
|
Concentración |
- |
- |
- |
NS |
|
Comunicación |
- |
- |
- |
NS |
|
Insight |
- |
- |
- |
NS |
|
Otros |
- |
- |
- |
NS |
|
Nota. NS: no significativa; dt: desviación típica; df (degrees of freedom, grados de libertad) |
||||
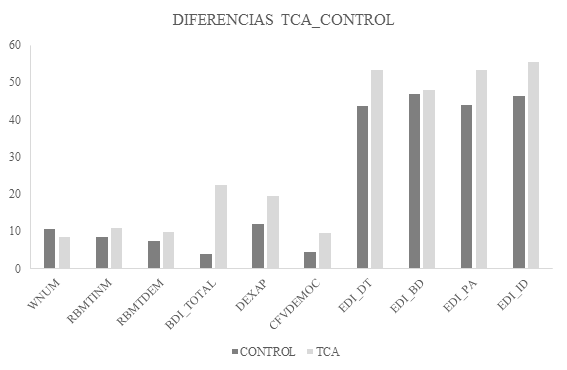
De las dos pruebas que miden velocidad de procesamiento, las diferencias fueron significativas sólo en la prueba de Clave de Números.
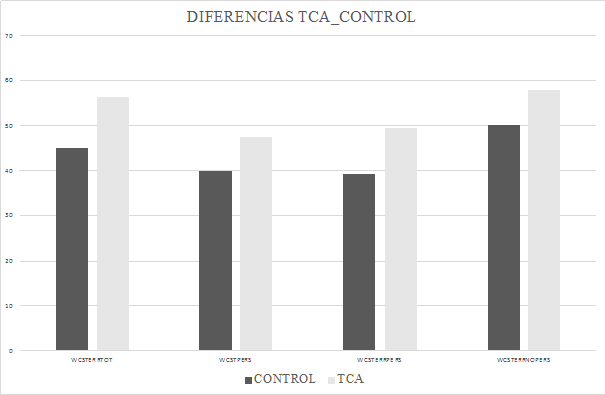
Los resultados de los demás test no arrojaron diferencias significativas salvo en la variable “errores totales” del WCST.
Sin embargo, en el estado emocional sí hubo diferencias muy significativas entre el GTCA y el GC. En depresión, el GTCA obtuvo una media y desviación típica de 22,5 (10,55). Se debe recordar que por encima de 22 puntos se considera depresión moderada (47).
En el GC la media y desviación típica fue de 3,84 (2,97); p=0,0008. Hasta 13 puntos no se considera que existan síntomas depresivos.
En lo relacionado a figura e imagen corporal, el EDI-3 reveló que las pacientes presentaban una mayor tendencia a la delgadez (DT), insatisfacción corporal (BD), alienación personal (PA) y déficits interoceptivos (ID). En la escala relacionada con el comportamiento alimentario (N) no se obtuvieron resultados significativos en las puntuaciones medias entre ambos grupos. Sin embargo, sí se dieron diferencias en los ítems. Por un lado, se evidenciaron diferencias de carácter significativo en los ítems 1, 5, 7, 11, 16, 25, 32, 40, 46, 47, 49, 53, 68, 78 y 86 (p< 0,01) y también, aunque de menor relevancia, en el apartado 64 (p<0,05). En los ítems restantes: 4, 28, 38, 61 y 81, no se obtuvieron diferencias estadísticamente significativas (p>0,05) (Tabla 2).
Tabla 2. Diferencias entre GC y GCTA en la escala de Nutrición de EDI-III
Ítem GC GTCA p
1. Como dulces e hidratos de carbono sin preocuparme 2,95 1,21 <0,001
4. Suelo comer cuando estoy disgustado 1,26 1,36 NS
5. Suelo hartarme de comida 1,58 0,64 <0,001
7. Pienso en ponerme a dieta 0,79 2,57 <0,001
11. Me siento muy culpable cuando como en exceso 1,1 4,57 <0,001
16. Me aterroriza la idea de engordar 1,84 4,63 <0,001
25. Exagero o doy demasiada importancia al peso 0,79 3,71 <0,001
28. He ido a comilonas en las que sentí que no podía parar de comer 1,42 1,36 NS
32. Estoy preocupada porque querría ser una persona más delgada 1,1 3,79 <0,001
38. Suelo pensar en darme un atracón 1,1 1,29 NS
40. No sé muy bien cuando tengo hambre o no 0,05 3,5 <0,001
46. Como con moderación delante de los demás, pero me doy un atracón cuando se van
1,74 1,07 <0,001
47. Me siento hinchado después de una comida real 1,74 3,93 <0,001
49. Si engordo un kilo, me preocupa que pueda seguir ganando peso 0,95 4,36 <0,001
53. Pienso en vomitar para perder peso 0 2,07 <0,001
61. Como o bebo a escondidas 0,31 0,5 NS
64. Cuando estoy disgustado, temo empezar a comer 0,63 1,93 <0,05
68. Me gustaría poder tener un control total sobre mis necesidades corporales
1,26 4,07 <0,001
78. Comer por placer es signo de debilidad moral 0,68 2,86 <0,001
81. Debo tener cuidado con mi tendencia a beber demasiado alcohol 0,58 0,57 NS
86. Me siento incómodo por las necesidades de mi cuerpo 0,37 2,93 <0,001
Nota. NS: No significativo
Para una mejor comprensión, en las Figuras 1 y 2 pueden observarse las diferencias en puntuaciones de las distintas pruebas de evaluación.
|
|
|
Figura 1. Comparación entre GTCA y GC en las diferentes pruebas y cuestionarios. WNUM: WAIS Clave de Números; RBMTINM; RBMT recuerdo inmediato; RBMTDEM: RBMT recuerdo demorado; DEXAP: DEX apatía; CFVDEMOC: Cuestionario de Funcionamiento de la Vida Diaria (Estado Emocional) (EFQ); EDI_DT, EDI_BD, EDI_PA, EDI_ID: diferentes escalas del EDI-3. Figura 2. Diferencias entre GTCA y GC en el Test de Wisconsin |
|
|
Diferencias en el GTCA según el tiempo de tratamiento
En la tabla 3 se presentan las medias y desviaciones típicas de los grupos de pacientes según el tiempo de tratamiento. Sólo se detallan los resultados significativos.
Tabla 3. Diferencias por tiempo de tratamiento.
|
|
GTT-1 (n=9) |
GTT+1 (n=10) |
F (df) |
p<0,05 |
|
|
|
Media (dt) |
Media (dt) |
|
||||
|
Dígitos totales |
9,14 (1,21) |
7,57 (0,97) |
7,11 (1,12) |
0,002 |
||
|
Dígitos Directos |
10 (1,15) |
8,57 (0,97) |
6,25 (1,12) |
0,028 |
||
|
BDI-II |
29,71 (8,63) |
15,28 (6,72) |
12,16 (1,12) |
0,0045 |
||
A pesar de que las muestras fueron pequeñas, hubo diferencias significativas en la prueba de Dígitos Directos y en el total de la misma, así como en la puntuación del BDI-II.
En la categoría de “Nutrición” se apreciaron resultados significativos (p<0,05) en los ítems: 16, 47 y 68, mostrando que, el GTT-1 presentaba mayores puntuaciones en comparación con el GTT+1.
Diferencias en el GTCA según el IMC
En la Tabla 4 se presentan los resultados de los subgrupos según el IMC.
Tabla 4. Diferencias por IMC
|
|
Grupo A (n=8) |
Grupo B (n=11) |
F (df) |
p<0,05 |
|
|
|
Media (dt) |
Media (dt) |
|
||||
|
EDI3-BD |
46 (4,05) |
55 (7,87) |
6,46 (1,12) |
0,026 |
||
|
EFQ total |
40,83 (9,2) |
30,5 (8) |
5,045 (1,12) |
0,044 |
||
|
Nota. Grupo A (IMC<18,5); Grupo B (IMC≥18,5); dt: desviación típica; EDI3-BD; escala de Insatisfacción Corporal del EDI-3; df: (degrees of freedom, grados de libertad). |
|
|||||
Tras la dicotomización del GTCA en función de si el IMC era inferior o mayor o igual a 18,5, se observaron diferencias significativas exclusivamente en la escala de insatisfacción corporal del EDI-3 y de la puntuación total del EFQ.
Relación entre pruebas neuropsicológicas y medidas específicamente alimentarias
Se observó una relación positiva entre la escala de Tendencia a la Delgadez del EDI-3 y la puntuación total del BDI-II (r = 0,60).
En el estudio se analizaron correlaciones entre aspectos neuropsicológicos, de imagen y figura corporal, del comportamiento alimentario y del funcionamiento de la vida diaria.
La puntuación total del Inventario de Depresión de Beck se vio altamente correlacionada con la escala de “Obsesión por la delgadez” (r = 0,6) y la escala de “Nutrición” (r = 0,6) (indicadora de conductas alimentarias incorrectas) del EDI - 3. Las escalas de impulsividad y apatía del DEX (r = 0,6), así como con la puntuación total de este cuestionario (r = 0,5) se correlacionaron con una mayor puntuación en el BDI-II. Además, también se observó que las pacientes que presentaban una mayor puntuación en el BDI-II mostraban un peor resultado en el Cuestionario del Funcionamiento de la Vida Diaria (r = 0,6).
El cuestionario DEX mostró una gran correlación con la escala de nutrición del EDI-3: con la escala de apatía (r = 0,5), de impulsividad (r = 0,6) y con la puntuación total (r = 0,7).
El Cuestionario de Funcionamiento de la Vida Diaria se correlacionó fuertemente con la escala de Nutrición del EDI- 3 (r = 0,7). En la prueba neuropsicológica de Wisconsin las personas que cometieron un mayor número de errores totales y errores no perseverativos son las que presentaron una mayor puntuación de depresión (r = 0,5).
Discusión
Tras la exposición de los resultados, se va a proceder al comentario de los mismos en función de las variables consideradas.
Velocidad de procesamiento
Dos fueron los tests de la escala WAIS para medir velocidad de procesamiento. Se observaron diferencias significativas en el de Clave de Números únicamente y no en el de Búsqueda de Símbolos. Podría explicarse porque el primero implica un cambio de criterio constante entre los códigos de dígitos y los símbolos asociados. Por tanto, los resultados en esta prueba podrían apoyar el rasgo neuropsicológico de rigidez cognitiva tan consistentemente publicado en la literatura (54).
Sin embargo, en el test de Búsqueda de Símbolos no hubo diferencias entre el GTCA y el GC. Esta prueba consiste en decidir si al menos un símbolo de dos de referencia está presente en otra fila diana. El test va aumentando en dificultad porque las diferencias entre los símbolos van siendo cada vez más difíciles de detectar. No es necesario realizar un set estimular global en esta prueba.
Una posible explicación podría ser, simplemente, que las dos muestras de participantes escogidas tienen buen rendimiento en la velocidad de procesamiento medida con este test.
Pero, por otro lado, el procesamiento tan detallado de los estímulos visuales, podría ser indicativo de la baja coherencia central y también apoyaría la consideración de este rasgo neuropsicológico en los TCA (55). El rendimiento del GTCA, similar al del GC, podría explicarse también por un procesamiento local o basado en el detalle del GTCA. El rendimiento en la Búsqueda de Símbolos del GTCA, similar al GC, podría estar sustentado en el modelo de movimientos sacádicos rápidos en el que existe hipoactivación de la vía visual dorsal e hiperactivación de la vía ventral (22).
Atención
El test de Stroop no arrojó diferencias significativas. La tarea clave de esta prueba es la número tres, la de interferencia. La persona evaluada debe inhibir la interferencia semántica (lectura de la palabra vía léxica o superficial) para pronunciar el estímulo visual del color. Al igual que en la velocidad de procesamiento, simplemente, todas las participantes de este estudio tienen buen rendimiento en esta prueba y padecer o no un TCA no es significativo.
Sin embargo, conectándolo con los hallazgos neuropsicológicos expuestos, el rendimiento del GTCA en el Stroop, similar al del GC, podría interpretarse como sintomático de debilidad en la coherencia central. Considerando el estímulo “palabra-color incongruente” como un estímulo global, las pacientes con TCA tendrían más facilidad para fijarse sólo en el detalle del color de la tinta impresa obviando la semántica. Además, esta tarea no implica un cambio de criterio como en la prueba de Clave de Números, es decir, una vez establecido el comando “pronunciar el color”, éste se mantendría constante y ayudaría a rendir mejor.
En el TMT, tanto en la forma A como en la B, las diferencias tampoco fueron significativas. Se ha de comentar que el TMT no sólo se usa para medir atención, sobre todo la alternante, sino que también mide velocidad de procesamiento. Por razones de organización, el TMT se ha incorporado en este apartado (56).
Los resultados de este trabajo no indican problemas con esta habilidad, al menos, en la muestra estudiada y medida con este test. Roberts et al. (2007) revisaron sistemáticamente los problemas con el cambio de criterio en los TCA medido con seis pruebas neuropsicológicas entre ellas el TMT. Concluyó que la rigidez cognitiva está presente en personas con TCA, pero las diferencias en el TMT fueron mínimas aún siendo una de las pruebas más comunes para medir este rasgo (54).
Memoria
En este estudio se midieron diferentes expresiones de la memoria (corto plazo, largo plazo y de trabajo) con varias pruebas verbales: Dígitos Directos e Inversos, RBMT y RAVLT. Únicamente, hubo diferencias significativas en el recuerdo inmediato de RBMT.
Otros autores tampoco han encontrado alteraciones en la memoria. Gillberg, Rastam, Went y Gillberg (2007) obtuvieron resultados similares en una prueba similar a RAVLT, la lista de 10 palabras de la Batería de Luria, durante un seguimiento de 10 años. Aunque, en este caso, el grupo de pacientes fue exclusivamente de AN (57).
Los datos de este estudio respecto a la memoria medida con pruebas verbales son consistentes con los resultados de Schilder et al. (2017) (58). Este grupo de investigación midió el cociente intelectual total (CIT), verbal (CIV) y manipulativo (CIM) de 703 personas con TCA (adultos y adolescentes) en el que hallaron que la media del CIT y CIV fue superior a las de la población normal independientemente del IMC.
López et al., (2010) revisaron sistemáticamente el cociente intelectual de personas con AN y también encontraron resultados superiores a la media (59). Calderoni et al. (2013) (60) tuvieron resultados en la misma línea usando la batería NEPSY-II en pacientes con AN (61).
Este rendimiento aumentado en pruebas de memoria podría explicarse por la Hipótesis de la Rumiación Analítica de Andrews y Thomson (2009) según la cual, la depresión se considera un mecanismo de respuesta al estrés para la solución de problemas complejos. El pensamiento rumiativo en personas con depresión puede acelerar el acceso automático a la memoria en el recuerdo de palabras semánticamente asociadas y en la selección de palabras correctas de una lista de palabras tras ensayos de interferencia (62).
En este estudio, las participantes del GTCA cursan con síntomas depresivos moderados según la puntuación media en el BDI-II (22,5) frente al GC (3,84) (p=0,0008), es decir, la Hipótesis de la Rumiación Analítica podría explicar el resultado en las pruebas de memoria del presente estudio.
Impulsividad
No se observaron diferencias significativas en la impulsividad medida con el cuestionario auto-informado DEX ni en el número de errores cometidos en el TMT.
Sin embargo, la falta de control inhibitorio se postula como un rasgo muy asentado en los TCA, sobre todo, en los diagnósticos relacionados con la bulimia según la literatura.
En un estudio en pacientes con TCA no especificado (TCANE) de Brooks et al., (2014) se observó, mediante fRM, alteraciones neurológicas similares a las relacionadas con el comportamiento obsesivo-compulsivo (63). Principalmente, en la corteza cingulada anterior (CCA), un área implicada tanto en el trastorno obsesivo compulsivo (TOC) (64) como en personas con TCA (AN y BN) en respuesta a estímulos relacionados con la comida (65).
Estado emocional
En el polo de la ansiedad, las diferencias no fueron significativas entre el GTCA y el GC. Aunque está ampliamente publicado que la sintomatología ansiosa está muy presente en los TCA, los resultados del presente estudio no pueden indicar lo mismo. Sería necesario ampliar la muestra para conseguir datos más robustos.
Sin embargo, la diferencia entre el GTCA y GC en depresión es de las más significativas de todas las variables comparadas (BDI-II p=0,0008; DEX apatía y desorganización p=0,00014). Además, se observa una ligera tendencia positiva en la relación entre la depresión y la tendencia a la delgadez de r=0,6. Estos datos están en consonancia con la evidencia publicada al respecto (28). Lo que sí es manifiesto es que, tanto la depresión como los TCA, comparten alteraciones funcionales y estructurales en regiones cerebrales involucradas en la regulación emocional: amígdala, núcleo estriado ventral, núcleo accumbens, CCA, ínsula y CPFDL (66). Dichas alteraciones podrían ser la causa de la elevada comorbilidad de los TCA con la depresión.
IMC
Tras la dicotomización del GTCA en función de si el IMC era inferior o mayor o igual a 18,5, se observaron diferencias significativas exclusivamente en la escala de insatisfacción corporal del EDI-3 y de la puntuación total del EFQ. Parece que, al menos en la muestra estudiada, la normalización del IMC acarrea más insatisfacción corporal y peor funcionamiento diario.
Tiempo de tratamiento
En la literatura está descrito que hay alteraciones funcionales que varían con la evolución del trastorno. Parece ser que ello sería debido a los efectos que los cambios nutricionales provocan en el funcionamiento cerebral. En consecuencia, se dicotomizó al GTCA teniendo en cuenta el tiempo de tratamiento superior o inferior a un año. Las muestras de los subgrupos fueron pequeñas, pero se observaron diferencias significativas en la prueba de Dígitos (Directos y total) y en la depresión medida con el BDI-II.
La mejora de la depresión podría normalizar a la baja la conexión entre memoria a corto y largo plazo (memoria de trabajo) en pacientes con TCA, lo que significa que, al reducir la rumiación depresiva, disminuiría también el rendimiento en pruebas de memoria a corto plazo y de trabajo como la de Dígitos. Es decir, el descenso de rendimiento en Dígitos por la mejora de la depresión podría explicarse por la Hipótesis Analítica de la Rumiación de Andrews y Thomson (2009) (62).
Tras el comentario de los resultados según las variables consideradas, se van a resumir los mismos en función de la coherencia central y el cambio de criterio.
Coherencia central y cambio de criterio
Ambos rasgos estarían muy relacionados. El procesamiento detallado de un set estimular implica una gran concentración en los detalles y, por tanto, no alternar o dividir la atención entre dos o más tareas o estímulos. El rendimiento del GTCA en pruebas que implican procesar información detallada, sin estructura global y de un mismo tipo sin cambiar el criterio de decisión podría estar explicado por la débil coherencia central y la rigidez cognitiva en el cambio de criterio. De este modo, se podría explicar el rendimiento en la Búsqueda de Símbolos y en el Test de Stroop. Sin embargo, el cambio de criterio que implica la Clave de Números supondría una dificultad en el GTCA para rendir a un nivel normal en comparación con el GC.
En relación a la prueba de la Figura Compleja de Rey (figura A), no se observaron diferencias cuantitativas significativas. Sin embargo, sí se observan, al menos, dos patrones diferentes de ejecución tanto de la fase de copia como de la de memoria. El protocolo de valoración cualitativa para este test es muy complejo (67). En este estudio se valoró, únicamente, la fase de memoria mediante el uso de diferentes lápices de colores para los elementos de la figura. De esta manera, se pudieron diferenciar claramente dos patrones de ejecución: uno basado en el armazón central de la figura (rectángulo grande, cruz de San Andrés y medianas horizontal y vertical) al que se le van añadiendo detalles y otro más caótico en el que se dibujan directamente los detalles. El criterio diferenciador fue empezar la fase de memoria por el rectángulo grande central. La tendencia en el GC fue de un estilo más global de procesamiento y en el GTCA más centrado en el detalle.
Rigidez Cognitiva
Se ha evidenciado una mayor dificultad de adaptarse a los cambios en las pacientes de TCA, estrechamente relacionado con un mayor nivel de perfeccionismo (68).
Sin embargo, en los datos obtenidos, sólo se evidencian diferencias en los errores totales y no en los perseverativos.
EDI-3
Comportamientos alimentarios y relacionados con la figura e imagen
Los resultados de la escala N del EDI-3 mostraron de forma específica aspectos característicos del comportamiento alimentario de las personas con TCA. En concreto, dos. Por un lado, el miedo y la preocupación por el aumento de peso que, si están presentes de modo intenso antes de la comida, puede provocar una disminución de la ingesta energética, como han afirmado numerosos estudios (69,70).
Por el otro, la posible alteración en el mecanismo de saciedad por modificaciones del correcto funcionamiento del hipotálamo. Sin embargo, dado que actualmente sigue sin comprenderse de forma íntegra el funcionamiento de la base neural en los TCA se trata de una cuestión que aún permanece en debate, mientras se encuentran estudios que afirman que podría tratarse de la causa, otros defienden que podría ser consecuencia de la enfermedad (71).
Correlaciones de variables
Finalmente, cabe destacar que a nivel neuropsicológico se observó un mayor índice depresivo en aquellas personas que según el WCST mostraron una menor capacidad de atención y una mayor rigidez cognitiva, junto a un menor control inhibitorio. Esta relación estrecha entre depresión e impulsividad ha sido corroborada previamente con otros estudios, como el de Swann et al., 2008 (72).
Habiéndose comentado los resultados de la comparación entre los GTCA y el GC, conectándolos con la evidencia publicada, no se pueden confirmar totalmente las hipótesis planteadas anteriormente.
Respecto a la hipótesis 1, no es posible afirmar que el funcionamiento neuropsicológico del GTCA sea peor que el GC. El rendimiento del GTCA fue, en general, igual al del GC. Puede interpretarse como signo de normalidad. Sin embargo, esto no implica que los datos arrojados por las pruebas de este protocolo vayan en contra de la evidencia existente, al contrario, podría ser una forma diferente de apoyarla derivada del funcionamiento derivado de los rasgos comentados.
Podría argumentarse que las pacientes con TCA tendrían un funcionamiento cognitivo diferente caracterizado ampliamente en la literatura por débil coherencia central, rigidez cognitiva e impulsividad. Quizá eso no implique psicopatología en sí mismo. Simplemente, las personas con estos rasgos pueden rendir bien en tareas que impliquen focalización de los detalles y perseveración en un objetivo sin cambio de criterio (como son muchos de los instrumentos usados en el protocolo de evaluación). No obstante, estos rasgos llevados al extremo sí podrían suponer trastornos psicológicos y podrían caracterizarse como factores neuropsicológicos de riesgo.
Esto no quiere decir que las personas del GC no sean capaces de procesar localmente o persistir en una tarea. Quizás, las personas sin TCA o, mejor dicho, sin estos rasgos, son capaces de adaptarse a demandas cambiantes de las tareas externas.
Respecto a la hipótesis 2, se puede confirmar en parte. El GTCA padece, muy significativamente, más síntomas depresivos que el GC. En este caso, los datos sí son robustos y consistentes con lo ya publicado en la literatura. Sin embargo, no se podría comentar lo mismo sobre el funcionamiento diario y la ansiedad. El EFQ es un instrumento diseñado para tener una medida más ecológica y de adaptación al contexto natural en pacientes con daño cerebral. No es un instrumento específico para pacientes con TCA y tampoco está validado en España. Sería interesante diseñar un instrumento específico para tal fin.
Limitaciones
Las principales limitaciones de este estudio fueron el tamaño y la heterogeneidad clínica de la muestra. En el grupo de las pacientes hay diversos diagnósticos de TCA (anorexia nerviosa purgativa, restrictiva y bulimia nerviosa principalmente). Como se ha expuesto en la introducción, algunos déficits son más característicos de unos trastornos que de otros y eso ha podido diluir las diferencias. Para llegar a obtener 19 participantes, no se pudo diferenciar por diagnósticos específicos. La muestra con subgrupos por diagnósticos, de haberse hecho, hubiera sido demasiado pequeña y los resultados no hubieran sido generalizables.
Tampoco se controló el tiempo de tratamiento, la evolución del trastorno ni el tratamiento farmacológico.
En línea con la mayoría de estudios sobre el tema, tampoco se ha incluido ningún hombre en este trabajo.
Nuevas líneas de investigación
La Neuropsicología de los TCA ha abierto un campo enorme de investigación. En las últimas décadas los hallazgos neuropsicológicos apoyados en estudios de imagen han caracterizado a estos trastornos.
Se necesitan más investigaciones con muestras más grandes y homogéneas, al menos, en cuanto al diagnóstico específico para poder afirmar con más contundencia los hallazgos que la neuropsicología de los TCA ha arrojado en estos últimos años.
Las diferencias en el funcionamiento neuropsicológico no deberían quedarse exclusivamente como factores de riesgo para la detección temprana de los TCA o criterio de evolución de los mismos, sino que podrían diseñarse nuevas técnicas de tratamiento que incidan en la reequilibración de las áreas y vías afectadas por exceso o por defecto de activación basadas en la neuroplasticidad. Por ejemplo, aumentando la activación de la vía visual dorsal y disminuyendo la ventral para fomentar un procesamiento más global de la información según el modelo de Feusner et al. (2017) (22). Estas nuevas vías de abordaje terapéutico supondrían una intervención alternativa, añadida a la ya existente, pero no directamente relacionada con la comida lo que podría ser más atractivo para la persona con TCA inmersa en un tratamiento tradicionalmente restrictivo, controlador y centrado en la conducta patológica.
La Terapia de Remediación Cognitiva ya se aplica en otros trastornos en los que la falta de coherencia central y la rigidez cognitiva son también patológicos como el Trastorno Depresivo Mayor, el Trastorno Obsesivo Compulsivo y el Espectro Autista. Sin embargo, la evidencia de esta intervención aplicada a los TCA es escasa (73). Futuros estudios en esta línea podrían también llevarse a cabo.
Por otro lado, sería interesante también clarificar el papel que juegan las variables emocionales ¿Tener ansiedad o depresión causa directamente un TCA? ¿Serían factores mantenedores? ¿Suponen una vulnerabilidad para la recaída o la recurrencia de un TCA?
Conclusiones
Los comportamientos sintomáticos de los TCA están íntimamente vinculados a alteraciones en el funcionamiento neuropsicológico.
Existen cambios cerebrales reversibles ligados al estado nutricional de la persona.
Sin embargo, también existen diferencias neuropsicológicas independientes que se erigen como factores predisponentes o de riesgo más que consecuencias negativas de la alteración nutricional. Serían, principalmente tres, los rasgos estables o endofenotipos: coherencia central débil, rigidez cognitiva e impulsividad. Éstos están presentes en familiares de primer grado, pueden predecir el trastorno y persisten tras la recuperación del mismo.
El enfoque neuropsicológico de los TCA les confiere un carácter más dimensional, acorde con la tendencia de la psicopatología marcada por la última edición del DSM. Supone caracterizar a los diferentes diagnósticos de TCA en función de un perfil de rasgos con correlatos neurológicos y no sólo por los síntomas cognitivos, conductuales y emocionales, al igual que se ha caracterizado el Espectro Autista o el de la Esquizofrenia. Parece ser que la impulsividad se relacionaría con la ingesta descontrolada y las purgas y la rigidez cognitiva con la restricción nutricional y el perfeccionismo clínicos.
La dimensionalización de los TCA también es importante debido a la fluctuación sintomática de los pacientes y la heterogeneidad intracategorial a las que hacíamos alusión anteriormente. El 60% de las pacientes en Reino Unido son diagnosticadas con un TCANE (74) Los factores comunes neuropsicológicos indicarían dianas terapéuticas más efectivas independientemente de la manifestación psicopatológica.
Fagundo et al. (2012) encontraron factores comunes de disfuncionalidad ejecutiva en personas con condiciones extremas de peso: anorexia y obesidad. Por ejemplo, mejorar el control de impulsos podría significar una mejoría tanto en el atracón de comida como en el consumo de drogas, la hiperactividad o el gasto compulsivo de dinero ya sea en AN purgativa, BN o Trastorno por Atracón (75).
Por tanto, este enfoque abre la puerta a la intervención en factores comunes que podrían explicar la comorbilidad de los TCA con otros trastornos (ya comentados anteriormente) en los que la rigidez cognitiva, la falta de coherencia central y la impulsividad son también síntomas nucleares ya que implicaría a las mismas áreas del sistema nervioso central.
Agradecimientos
A todo el personal del Instituto de Ciencias de la Conducta de Sevilla por su dedicación, interés y pasión por la investigación.
Conflicto de interés
No se declara ningún conflicto de interés.
Referencias
1. Asociación Americana de Psiquiatría. Manual diagnóstico y estadístico de los trastornos mentales. 5ª Ed. Madrid, España: Editorial Médica Panamericana; 2014.
2. Ministerio de Sanidad y Consumo. Guía de Práctica Clínica sobre Trastornos de la Conducta Alimentaria. Barcelona: Agència d'Avaluació de Tecnologia i Recerca Mèdiques de Cataluña; 2009.
3. International Classification of Diseases, 11th Revision (ICD-11). Geneva: World Health Organization; 2018.
4. Pérez-Álvarez M, Fernández-Hermida JR, Fernández Rodríguez C, Amigo-Vázquez I. Guía de tratamientos psicológicos eficaces I. Madrid, España: Ediciones Pirámide; 2015.
5. Verdejo-García A, Tirapu-Ustárroz J. Neuropsicología clínica en perspectiva: retos futuros basados en desarrollos presentes. Rev Neurol. 2012; 54: 180-186.
6. First MB, Pincus HA, Levine JB, Williams JB, Ustun B, Peele R. Clinical utility as a criterion for revising psychiatric diagnoses. Am J Psychiatry. 2004; 161 (6): 946-954.
7. Eddy KT, Dorer DJ, Franko DL, Tahilani K, Thompson-Brenner H, Herzog DB. Diagnostic crossover in anorexia nervosa and bulimia nervosa: implications for DSMV-V. Am J Psychiatry. 2008; 165 (2): 245-250.
8. Treasure J, Lopez C, Roberts MR. Endophenotypes in eating disorders: moving toward etiologically based diagnosis and treatment focused on pathophysiology. Pediatric Health. 2007; 1: 171-181.
9. Fairburn CG, Cooper Z, Shafran R. Cognitive behavior therapy for eating disorders: a “transdiagnostic” theory and treatment. Behav Res Ther. 2003; 41 (5): 509-528.
10. Robbins TW, Gillan CM, Smith DG, de Wit S, Ersche KD. Neurocognitive endophenotypes of impulsivity and compulsivity: towards dimensional psychiatry. Trends Cogn Sci. 2012; 16 (1): 81-91.
11. Wildes JE, Marcus MD. Incorporating dimensions into classification of eating disorders: three models and their implications for research and clinical practice. Int J Eat Disord. 2013; 46 (5): 396-403.
12. Oltra-Cucarella J, Espert-Tortajada R, Rojo-Moreno L. Neuropsychology and anorexia nervosa. Cognitive and radiological findings. Rev Neurol. 2012; 27 (8): 504-510.
13. Delvenne V, Goldman S, de Maertelaer V, Simon Y, Luxen A, Lotstra F. Brain hypometabolism of glucose in anorexia nervosa: normalization after weight gain. Biol Psychiatry. 1996; 40: 761-768.
14. Delvenne V, Goldman S, de Maertelaer V, Simon Y, Luxen A, Lotstra F. Brain glucose metabolism in eating disorders assessed by positron emission tomography. Int J Eat Disord. 1999; 25: 29-37.
15. Matsumoto R, Kitabayashi Y, Narumoto J, Wada Y, Okamoto A, Ushijima Y, et al. Regional cerebral blood Flow changes associated with interoceptive awareness in the recovery process of anorexia nervosa. Prog Neuropsychopharmacol Biol Psychiatry. 2006; 30: 1265-1270.
16. Friederich HC, Wu M, Simon JJ, Herzog W. Neurocircuit function in eating disorders. Int J Eat Disord. 2013; 46 (5): 425-432.
17. Santel S, Baving L, Krauel K, Munte TF, Rotte M. Hunger and satiety in anorexia nervosa: fMRI during cognitive processing of food pictures. Brain Res. 2006; 1114 (1): 138-148.
18. Sato Y, Saito N, Utsumi A, Aizawa E, Shoji T, Izumiyama M, et al. Neural basis of impaired cognitive flexibility in patients with anorexia nervosa. PLos ONE. 2013; 8 (5): e61108.
19. Sutoh C, Nakazato M, Matsuzawa D, Tsuru K, Niitsy T, Iyo M, et al. Changes in self-regulation-related prefrontal activities in eating disorders: a near infrared spectroscopy study. PLos ONE. 2013; 8 (3): e59324.
20. Wagner A, Aizenstein H, Mazukewicz L, Fudge J, Frank GK, Putnam K, et al. Altered insula response to taste stimuli in individuals recovered from restricting-type anorexia nervosa. Neuropsychopharmacology. 2008; 33 (3): 513-523.
21. Zastrow A, Kaiser S, Stippich C, Walther S, Herzog W, Tchanturia K, et al. Neural correlates of impaired cognitive-behavioral flexibility in anorexia nervosa. Am J Psychiatry. 2009; 166 (5): 608-616.
22. Feusner J, Deshpande R, Strober M. A translational neuroscience approach to body image disturbance and its remediation in anorexia nervosa. Int J Eat Disord. 2017; 50 (9): 1014-1017.
23. Laycock R, Crewther SG, Crewther DP. A role for the ‘magnocellular advantage’ in visual impairments in neurodevelopmental and psychiatric disorders. Neurosci Biobehav Rev. 2007; 31 (3): 363-376.
24. Li W, Arienzo D, Feusner JD. Body dysmorphic disorders: neurobiological features and an updated model. Z Klin Psychol Psychother (Gott). 2013; 42 (3): 184-191.
25. Donnelly B, Touyz S, Hay P, Burton A, Russell J, Caterson I. Neuroimaging in bulimia nervosa and binge eating disorders: a systematic review. J Eat Disord. 2018; 6: 3.
26. Solano-Pinto N, de la Pena C, Solbes-Canales I, Bernabéu-Brotóns E. Perfiles neuropsicológicos en anorexia y bulimia nerviosa. Rev Neurol. 2018; 67 (9): 355-364.
27. Jáuregui-Lobera I. Neuropsychology of eating disorders: 1995-2012. Neuropsychiatric Dis Treat. 2013; 9: 415-430.
28. Kanakam N, Trasure J. A review of cognitive neuropsychiatry in the taxonomy of eating disorders: state, trait or genetic?. Cogn Neuropsychiatry. 2013; 18 (1-2): 83-114.
29. Alvarado-Sánchez N, Silva-Gutiérrez C. Funciones ejecutivas y sintomatología asociada con los trastornos de la conducta alimentaria. Rev Latinoam Psicol. 2014; 46 (3): 189-197.
30. Eneka KT, Arit JM, Yiu A, Murray SM, Chen EY. Assessment of executive functioning in binge-eating disorder independent of weight status. Int J Eat Disord. 2017; 50 (8): 942-951.
31. Galimberti E, Fadda E, Cavallini MC, Martoni RM, Erzegovesi S, Bellodi L. Executive functioning in anorexia nervosa patients and their unaffected relatives. Psychiatry Res. 2013; 208 (3): 238-244.
32. Gillberg IC, Billstedt E, Wentz E, Anckarsäter H, Råstam M, Gillberg C. Attention, executive functions, and mentalizing in anorexia nervosa eighteen years after onset of eating disorder. J Clin Exp Neuropsychol. 2010; 32 (4): 358-365.
33. Guillaume S, Gorwood P, Jollant F, Van den Eynde F, Courtel P, Richar-Devantoy S. Impaired decision-making in symptomatic anorexia and bulimia nervosa patients: a meta-analysis. Psychol Med. 2015; 45 (16): 3377-3391.
34. Lang K, Roberts M, Harrison A, Lopez C, Goddard E, Khondoker M, et al. Central coherence in eating disorders: a synthesis of studies using the Rey Osterrieth Complex Figure Test. PLoS ONE. 2016; 11 (11): e0165467.
35. Tchanturia K, Harrison A, Davies H, Roberts M, Oldershaw A, Nakazato M, et al. Cognitive flexibility and clinical severity in eating disorders. PLoS ONE. 2011; 6 (6): e20462.
36. Fox JR, Froom K. Eating disorders: a basic emotion perspective. Clin Psychol Psychother. 2009; 16 (4): 328-335.
37. Wechsler D. WAIS-III: Escala de Inteligencia Wechsler para adultos-III. 2ª Ed. Madrid, España: TEA Ediciones; 2001.
38. Wilson BA, Cockburn J, Baddeley AD. The Rivermead Behavioural Memory Test. Reading, U: Thames Valley Test Co; 1985.
39. Soler MJ, Ruiz JC. Performance and validation of the RBMT (Rivermead Behavioural Memory Test) in a sample of Spanish brain damaged. In: 7th ESCP Conference. Lisboa (Portugal); 1994.
40. Schimit M. Rey Auditory Verbal Learning Test: a handbook. Madrid, España; 1996.
41. Benedet MK, Alejandre MA. TAVEC. Test de Aprendizaje Verbal España-Complutense. Madrid, España: TEA Ediciones; 2014.
42. Golden JCh. Stroop Test de Colores y Palabras. Madrid, España: TEA Ediciones; 2001.
43. Reitan RM. Trail Making Test: manual for administration and scoring. Madrid, España: TEA Ediciones; 1992.
44. Rey-Rey A, Osterrieth P. Test de la figura compleja de Rey-Osterrieth. Madrid, España: TEA Ediciones; 1994.
45. Heaton RK. Wisconsin Card Sorting Test Manual. Odessa, Florida: Psychological Assessment Resources, Inc; 1981.
46. Beck AT, Steer RA, Brown GK. BDI-II. Beck Depression Inventory Manual. 2ª Ed. San Antonio, Texas: Pearson PsychCorp; 1996.
47. Sanz J, Perdigón AL, Vázquez C. Adaptación española del inventario para la depresión de Beck-II (BDI-II): 2. Propiedades psicométricas en población general. Clínica y salud. 2003; 14 (3): 249-280.
48. Spielberger CD, Gorsuch RL, Lushene RE. Adaptores: Buela-Casal G, Guillén-Riquelme A y Sendedos-Cubero N. STAI. Cuestionario de ansiedad estado-rasgo. 7ª Ed. Madrid, España: TEA Ediciones; 2008.
49. Guillén-Riquelme A, Buela-Casal G. Actualización psicométrica y funcionamiento diferencial de los ítems en el State Trait Anxiety Inventory (STAI). Psycothema. 2011; 23 (3): 510-515.
50. Garner, DM. Eating Disorder Inventory-3: Professional manual. Lutz, Florida: Psychological Assessment Resources, Inc; 2004. Adaptadores: Elosua P, López-Jáuregui A, Sánchez-Sánchez F. Inventario de Trastornos de la Conducta Alimentaria-3. Madrid, España: TEA ediciones; 2010.
51. Pedrero EJ, Ruiz JM, Rojo G, Llanero M, Olivar A, Bouso JC, et al. Versión española del Cuestionario Disejecutivo (DEX-Sp): propiedades psicométricas en adictos y población no clínica. Adicciones. 2009; 21 (2): 155-166.
52. Wilson BA, Alderman N, Burgess PW, Emslie HC, Evans JJ. The Behavioural Assessment of the Dysexecutive Syndrome (BADS). Flempton, Bury St Edmunds, UK: Thames Valley Test Company; 1996.
53. Andrewes DG, Horden C, Kaye A. The Everyday Functioning Questionnaire: a new measure of cognitive and emotional status for neurosurgical outpatients. Neuropsychol Rehabil. 1998; 8 (4): 377-391.
54. Roberts ME, Tchaturia K, Stahl D, Southgate L, Trasure J. A systematic review and meta-analysis of set-shifting ability in eating disorders. Psychol Med. 2007; 37 (8): 1075-1084.
55. Lopez C, Tchanturia K, Stahl D, Treasure J. Central coherence in eating disorders: a systematic review. Psychol Med. 2008; 38 (10): 1393-1404.
56. Sochlberg MM, Mateer CA. Cognitive rehabilitation: an integrative neuropsychological approach. 1ª Ed. New York: The Guilford Press; 2001.
57. Gillberg IC, Råstam M, Wentz E, Gillberg C. Cognitive and executive functions in anorexia nervosa ten years after onset of eating disorder. J Clin Exp Neuropsychol. 2007; 29 (2): 170-178.
58. Schilder C, van Elburg A, Snellen W, Sternheim L, Hoek H, Danner U. Intellectual functioning of adolescent and adult patients with eating disorders. Int J Eat Disord. 2017; 50 (5): 481-489.
59. Lopez C, Stahl D, Tchanturia K. Estimated intelligence quotient in anorexia nervosa: a systematic review and meta-analysis of the literature. Ann Gen Psychiatry. 2010; 9:40.
60. Calderoni S, Muratori F, Leggero C, Narzisi A, Apicella F, Balottin U, et al. Neuropsychological functioning in children and adolescents with restrictive-type anorexia nervosa: an in-depth investigation with NEPSY-II. J Clin Exp Neuropsychol. 2013; 35 (2): 167-179.
61. Korkman M, Kirk U, Kemp S. NEPSY-II. A developmental neuropsychology Assessment. 2ª Ed. San Antonio, Texas: Pearson PsychCorp; 2007.
62. Andrews PW, Thomson JA Jr. The bright side of being blue: depression as an adaptation for analyzing complex problems. Psychol Rev. 2009; 116 (3): 620-654.
63. Brooks SJ, Solstrand-Dahlberg L, Swenne I, Aronsson M, Zarei S, Lundberg L, et al. Obsessive-compulsivity and working memory are associated with differential prefrontal cortex and insula activation in adolescents with a recent diagnosis of an eating disorder. Psychiatry Res. 2014; 224 (3): 246-253.
64. Saxena S, Brody AL, Schwartz JM, Baxter LR. Neuroimaging and frontal-subcortical circuitry in obsessive-compulsive disorder. Br J Psychiatry Supple. 1998; 35: 26-37.
65. Uher R, Murphy T, Brammer MJ, Dalgleish T, Phillips ML, Ng VW, et al. Medial prefrontal cortex activity associated with symptom provocation in eating disorders. Am J Psychiatry. 2004; 161 (7): 1238-1246.
66. Donofry SD, Roecklein KA, Wildes JE, Miller MA, Erickson KI. Alterations in emotions generation and regulation neurocircuitry in depression and eating disorders: a comparative review of structural and functional neuroimaging studies. Neurosci Biobehav Rev. 2016; 68: 911-927.
67. Booth R, Lowsley D. Local-global processing and cognitive style in autism spectrum disorders and typical development (Disserttion). London: University of London; 2006.
68. Buzzichelli S, Marzola E, Amianto F, Fassino S, Abbate-Daga G. Perfectionism and cognitive rigidity in anorexia nervosa: Is there an association? Eur Eat Disord Rev. 2018; 26 (4): 360-366.
69. Steinglass JE, Sysko R, Mayer L, Berner LA, Schebendach J, Wang Y, et al. Pre-meal anxiety and food intake in anorexia nervosa. Appetite. 2010; 55 (2): 214-218.
70. Steinglass JE, Sysko R, Glasofer D, Albano AM, Simpson HB, Walsh BT. Rationale for the application of exposure and response prevention to the treatment of anorexia nervosa. Int J Eat Disord. 2011; 44 (2): 134–141.
71. Kaye WH, Bailer UF. Understanding the neural circuitry of appetitive regulation in eating disorders. Biol Psychiatry. 2011; 70 (8): 704–705.
72. Swann AC, Steinberg JL, Lijffijt M, Moeller FG. Impulsivity: differential relationship to depression and mania bipolar disorder. J Affect Disord. 2008; 106 (3): 241-248.
73. Tchanturia K, Lounes N, Holttum S. Cognitive remediation in anorexia nervosa and related conditions: a systemic review. Eur Eat Disord Rev. 2014; 22 (6): 454-462.
74. Turner H, Bryant-Waugh R. Eating disorder not otherwise specified (EDNOS): profiles of clients presenting at a community eating disorder service. Eur Eat Disorders Rev. 2004; 12 (1): 18-26.
75. Fagundo AB, de la Torre R, Jiménez-Murcia S, Agüera Z, Granero R, Tárrega S, et al. Executive functions profile in extreme eating/weight conditions: from anorexia nervosa to obesity. PLoS ONE. 2012; 7 (8): e43382.