ORIGINAL
La ecografía, técnica diagnóstica en esteatosis hepática no alcohólica
Ecography, diagnostic technique in non-alcoholic hepatic esteatosis
Alicia Sahuquillo Martínez1, José Ignacio Ramírez Manent2, Mª Pilar Torres Moreno3, Juan Solera Albero4, Pedro J. Tárraga López5
1 Médico Inspector de Albacete. España
2 Director Médico CS Calviá. Islas Baleares. España
3 Mª Pilar Torres Moreno. Medico Familia. España
4 Médico familia CS Zona 7. Albacete. España
5 Médico Familia CS Zona 5 de Albacete. España
* Autor para correspondencia.
![]()
This work is licensed
under a Creative
Commons
Attribution-NonCommercial-ShareAlike 4.0 International License
La revista no cobra tasas por el envío de trabajos,
Resumen
Objetivo. Analizar le ecografia como prueba diagnostica de la esteatosis hepática no alcohólica.
Método. Estudio observacional, descriptivo y analítico, de sección transversal. Durante 12 meses se seleccionaron 100 pacientes, con 2 o más factores de riesgo cardiovascular, con nula o baja ingesta de alcohol, que acudían a consulta de Atención Primaria.
Determinaciones efectuadas. Variables demográficas y bioquímicas: Edad. Género. Ingesta de alcohol. Historia de diabetes, hipertensión arterial sistémica. Peso, talla, índice de masa corporal (IMC). Medición de presión arterial. Niveles de glucosa basal, hemoglobina glicosilada. Colesterol total, colesterol HDL, colesterol LDL, Triglicéridos, AST, ALT, bilirrubinas y fosfatasa alcalina.
También se recogieron antecedentes personales y familiares de diabetes, HTA, dislipemia, tratamiento farmacológico, cifras de otros parámetros analíticos y perímetro abdominal.
Evaluación hepática por ultrasonografía. Una vez cumplían los criterios de selección eran citados para la realización de la ecografía de abdomen completo, previa información del propósito de la técnica a efectuar y aportando el consentimiento informado firmado. La ecografía se realizaba con el paciente en ayunas y a ser posible con vejiga repleccionada, para poder efectuar la técnica en las mejores condiciones de preparación del paciente, con el fin de disminuir los artefactos ecográficos y poder valorar todas las estructuras abdominales correctamente.
Analisis Estadístico con programa SPSS 23. Las variables cualitativas se exponen como valor exacto y en porcentaje, las cuantitativas como media y desviación estándar (DE).
La comparación entre medias se realizó a través de la prueba t de Student para grupos independientes o la U de Mann-Whitney si las condiciones de normalidad (aplicación del test de Kolmogorov- Smirnoff o de Shapiro Willks) no se cumplían. En las variables cualitativas, la prueba de Ji al cuadrado.
Resultados. Han participado 100 pacientes: 44 hombres y 56 mujeres, con una edad media de 61,84. El 71% de los sujetos tienen obesidad.
El 23 % de los sujetos no tiene esteatosis, y en el 58 % es de grado leve y moderado en ambos géneros (p< 0,003). El 19 % tiene esteatosis grado 3.
Los factores de riesgo más prevalentes de los pacientes estudiados son obesidad, que la presentan el 78 % de ellos, hipercolesterolemia el 73 %, DM el 62 % e HTA el 59 %.
Conclusiones. La ecografía es la modalidad de elección para la determinación cualitativa de esteatosis, pero es una prueba subjetiva y dependiente del operador: sólo detecta infiltración grasa de moderada a grave.
Palabras clave
Esteatosis hepática; Ecografia Hepática; Obesidad; Factores de Riesgo Cardiovascular
Abstract
Objective. To analyze the ultrasound as a diagnostic test for non-alcoholic liver steatosis.
Method. Observational, descriptive and analytical study, of cross section. For 12 months, 100 patients were selected, with 2 or more cardiovascular risk factors, with no or low alcohol intake, who attended Primary Care.
Determinations made. Demographic and biochemical variables: Age. Gender. Alcohol intake. History of diabetes, systemic arterial hypertension. Weight, height, body mass index (BMI). Blood pressure measurement Basal glucose levels, glycosylated hemoglobin. Total cholesterol, HDL cholesterol, LDL cholesterol, triglycerides, AST, ALT, bilirubins and alkaline phosphatase.
Personal and family history of diabetes, HBP, dyslipidemia, drug treatment, figures of other analytical parameters and abdominal perimeter were also collected.
Hepatic evaluation by ultrasonography. Once they met the selection criteria, they were cited for the realization of the ultrasound of the entire abdomen, prior information on the purpose of the technique to be performed and providing the signed informed consent. The ultrasound was performed with the patient on an empty stomach and, if possible, with a bladder replenished, in order to perform the technique in the best conditions of preparation of the patient, in order to reduce the ultrasound devices and to assess all the abdominal structures correctly.
Statistical Analysis with SPSS program 23. The qualitative variables are shown as exact value and in percentage, the quantitative variables as mean and standard deviation (SD).
The comparison between means was made through the Student t test for independent groups or the Mann-Whitney U test if the normal conditions (application of the Kolmogorov-Smirnoff or Shapiro Willks test) were not met. In qualitative variables, the chi-square test.
Results. 100 patients participated: 44 men and 56 women, with a mean age of 61.84. 71% of subjects are obese.
23% of the subjects do not have steatosis, and in 58% it is mild and moderate in both genders (p <0.003). 19% have grade 3 steatosis.
The most prevalent risk factors of the patients studied are obesity, which is presented by 78% of them, hypercholesterolemia 73%, DM 62% and HT 59%.
Conclusions. Ultrasound is the modality of choice for the qualitative determination of steatosis, but it is a subjective and operator-dependent test: it only detects moderate to severe fat infiltration.
Keywords
Hepatic steatosis; Liver ultrasound; Obesity; Cardiovascular risk factors
Introducción
Esteatosis hepática
La enfermedad hepática grasa no alcohólica (EHGNA) es muy frecuente y de curso insidioso. Consiste en la aparición de cambios por infiltración grasa en el hígado, no relacionados con el consumo de alcohol. Esta patología comprende un amplio rango de lesiones hepáticas, que va desde esteatosis hepática simple (también llamado hígado graso), hasta esteatohepatitis(1) o cirrosis.
La prevalencia de EHGNA(2-6) oscila entre 10-25% de la población occidental, y asciende hasta 4,6 veces más en población obesa. Otros factores de riesgo asociados a EHGNA son el perímetro abdominal (>102 cm en hombres y >88 cm en mujeres), hiperinsulinemia, hipertrigliceridemia y alteraciones en el metabolismo de la glucosa o diabetes mellitus tipo 2(DM).
La EHGNA suele cursar asintomática y con grados variables de alteración en las pruebas de laboratorio. La biopsia hepática(7) es la herramienta diagnóstica más sensible y específica de confirmar la infiltración grasa en el hígado, pero su naturaleza invasiva hace que su utilidad sea reducida. Sin embargo, la utilización del ultrasonido como método de evaluación es importante debido a su amplia disponibilidad y bajo costo. Se estima que la ecografía(8) tiene una sensibilidad del 89% y una especificidad del 93%.
Concepto
La EHGNA(9) es una enfermedad metabólica de curso crónico e insidioso debida a acumulación de triglicéridos en las vacuolas de los hepatocitos. Normalmente el hígado tiene 5 g de contenido de grasa por cada 100 g de peso, siendo los fosfolípidos los que más abundan, llegando a constituir aproximadamente hasta el 50% del contenido total, en menos proporción (7%) se hayan los triglicéridos (TG) y colesterol no esterificado. Por lo tanto el diagnóstico de hígado graso no alcohólico (HGNA) se establece cuando el órgano tiene más de un 5 % de su peso total con contenido lipídico y predominante constituido por TG. Para entender mejor esta enfermedad es necesario conocer anatómicamente como es el hígado normal y como cambia cuando se acumula con grasa.
Antecedentes históricos
En 1952, Zelman y cols(4) fueron los primeros en describir la existencia de excesiva cantidad de grasa en el hígado de personas obesas sin consumo de alcohol. Unos años más tarde, en 1958, Westerwater y Fainier(5) describieron la presencia de alteraciones en las pruebas de función y morfología hepática en pacientes obesos, y que estos parámetros mejoraban con la pérdida de peso.
El término HGNA fue usado por primera vez por Heribert Thaler y cols(6) en la literatura científica alemana en 1960. Posteriormente, en 1981, Ludwig y cols(10) describieron la presencia de inflamación y necrosis asociadas a esteatosis en biopsias hepáticas, y a este proceso se le denominó esteatohepatitis no alcohólica (EHNA).
Desde entonces ha habido un enorme de interés científico por el conocimiento de este tema. Como prueba, si realizamos una búsqueda en PubMed con el término “non alcoholic fatty liver”, aparecen más de 3.000 referencias bibliográficas en los últimos años.
Epidemiología
El HGNA es la enfermedad hepática más diagnosticada en los países occidentales, con una prevalencia que oscila entre el 20% y el 30%, y amenaza con convertirse en un serio problema de salud pública ya que no solo se considera capaz, en algunos casos, de evolucionar a esteatohepatitis y cirrosis, sino que también se ha asociado con resistencia a la insulina, obesidad, hipertensión arterial (HTA), DM, hiperlipidemia y enfermedades cardiovasculares (ECV). El HGNA es especialmente prevalente en pacientes obesos. Así, en un estudio basado en necropsias de sujetos no seleccionados de la población general, Wanles y Lentz(11-12) encontraron esteatosis en el 70 % de los pacientes obesos y en el 35 % de los no obesos, y EHNA en el 18,5 % de los obesos y en el 2,7 % de los no obesos había inflamación y fibrosis. Otros estudios realizados en obesos, mediante biopsias, muestran una prevalencia de HGNA alrededor del 60 % y entre un 20 % y un 25 % de EHNA. Además, cuando se estudian pacientes diabéticos se observa que un 75 % de los diabéticos tipo 2 tienen HGNA. Este proceso también afecta a la población infantil, estimándose una prevalencia de HGNA cercana al 2 % entre niños y adolescentes.
Estudios epidemiológicos(12) sugieren que hay una distribución uniforme de HGNA entre hombres y mujeres, aunque hay variaciones de género entre los diferentes tipos de gravedad. En numerosas series(15), se observa que las mujeres tienen la enfermedad más avanzada que los varones, lo que sugiere que en el género femenino el curso de la enfermedad podría ser más agresivo.
Diversos estudios muestran variaciones raciales(12), observándose que el HGNA parece ser menos prevalente en afroamericanos en comparación con europeos e hispanoamericanos. Esto puede deberse a diferencias genéticas en la distribución de la grasa corporal o en la termogénesis metabólica .También se han descrito asociaciones entre gemelos, lo que sugiere que hay factores genéticos que predisponen al desarrollo de EHNA.
Etiopatogenia
Factores etiológicos
El HGNA puede ser causado por múltiples factores etiológicos. La causa más frecuente es la obesidad. Si bien, hay numerosos procesos patológicos asociados que pueden causarlo, los cuales enumeramos a continuación, para posteriormente describir los mecanismos patogénicos.
Procesos etiológicamente(13) relacionados con la aparición de HGNA:
§ Resistencia a la insulina (RI).
§ Obesidad.
§ Diabetes mellitus tipo 2.
§ Hiperlipidemia.
§ Edad avanzada.
§ Género femenino.
Tabla 1. Procesos asociados a la enfermedad hepática por depósito de grasa(13)
|
Factores nutricionales |
Fármacos |
|
By pass intestinal |
Amiodarona, didanosina, L-asparginasa |
|
Pérdida brusca de peso |
Nicardipino, nifedipino, diltiazem, espironolactona |
|
Otras deficiencias nutricionales: enfermedad celíaca, síndrome de Mauric y Kwashiorkor |
Valproico, aminosalicílicos, zidovudina, vitamina A, zidovudina, sulfasalacina |
|
Tóxicos |
Metotrexato, tamoxifeno, corticoides , estrógenos |
|
Petroquímico, cocaína, fosforados, toxina bacilo cereus |
Oxacilina, tetraciclinas, naproxeno |
|
Metabólicas |
Otras |
|
Enfermedad por almacenamiento de ésteres de colesterol, por deficiencia de carnitina, de Schuacham, de Weber-Christian, de Wilson y de Wolman |
Fibrosis quística, glucogenosis, defectos en el ciclo de la urea, defectos mitocondriales y peroxisomales de la oxidación de ácidos grasos, abetalipoproteinemia |
|
Lipodistrofias, deficit alfa1-antitripsina |
Síndrome del ovario poliquístico |
|
Galactosemia y fructosemia |
Enfermedad inflamatoria intestinal |
|
Síndrome de Alstrom, Bardet-Biel |
Diverticulosis intestinal,VIH |
Debido a su asociación con el síndrome metabólico (SM), el HGNA, se encuentra frecuentemente en pacientes con obesidad, diabetes, hiperlipidemia, hipertensión, hiperuricemia y síndrome de ovario poliquístico(14-15).
Pruebas diagnósticas de la esteatosis hepática
Valoración clínica y analítica
La EHGNA es una manifestación hepática del síndrome metabólico, que incluye obesidad central, junto con otros componentes. Más del 80% de los pacientes con EHGNA son obesos, y sólo un 16 % de los individuos tienen un IMC normal y ningún factor de riesgo cardiovascular.
La EHGNA tradicionalmente se pensaba que era más prevalente en mujeres, aunque diferentes estudios reflejan distintos resultados. Los pacientes afectados son de 40-60 años y tienen a menudo sobrepeso y obesidad. La mayoría de los pacientes con EHGNA son clínicamente asintomáticos, aunque algunos presentan fatiga, dispepsia, dolor hipocondrio derecho y hepatoesplenomegalia. La exploración física de pacientes con EHGNA debería incluir de rutina las medidas antropométricas: IMC y perímetro abdominal.
Elevación de enzimas hepáticas se detecta en aproximadamente el 20% de los pacientes con EHGNA. Los niveles de Aspartato aminotransferasa (AST/GOT) y alanino aminotransferasa (ALT/GPT) pueden ser normales o moderadamente elevados (1,5-2 veces por encima del límite normal) con una relación AST/ALT < 1, teniendo en cuenta que esta enzimas son unos pobres marcadores de hígado graso. En un estudio realizado por Marchenise et al, donde incluían a 799 sujetos obesos, los niveles de ALT y AST se incrementaban, según crecía el grado de obesidad y sólo el 21% excedió el límite alto de los valores normales. Además, los niveles de fosfatasa alcalina y gammaglutitranspeptidasa/(GGT), pueden variar, independientemente del IMC. Stranges et al(16), también concluyeron que el IMC no es un indicador reproducible, y encontraron que la obesidad abdominal era consistentemente un mejor indicador de los niveles de ALT y GGT y el hígado graso.
Los enzimas hepáticos normalmente no discriminan entre esteatosis, esteatohepatitis y cirrosis, aunque un descenso de albúmina y descenso de recuento de plaquetas, aumento del cociente GOT/GPT a menudo indican cirrosis. Es importante apreciar que EHGNA es la causa más probable de elevación de transaminasas en una persona con otra posible enfermedad hepática. Por tanto se necesitan más pruebas para clarificar si esos cambios son debidos a la esteatosis o a otra enfermedad hepática subyacente. Se necesitan biomarcadores que discriminen entre esteatohepatitis y esteatosis. Se sugiere que PCR específica pueda valorarlo pero no ha sido confirmado. La ferritina sérica está elevada en aproximadamente el 60% de los pacientes con EHNA, probablemente refleja el daño al hepatocito y la inflamación hepática con un incremento de las reservas de hierro hepáticas.
Así, aunque el posible papel del hierro en la exarcerbación de EHGNA ha sido debatido, el peso de la evidencia está en contra de esto: algunos estudios muestran una débil relación con hemocromatosis y la mutación C282Y(17).
Ecografía hepática
El hígado es una víscera sólida, voluminosa, fácilmente visible en la ecografía, localizada por detrás del reborde costal y por debajo del diafragma. Se extiende desde el hipocondrio derecho hasta el epigastrio. El hígado es asiento de numerosas enfermedades, primarias o secundarias, y debido a su densidad homogénea, permite la visualización de estructuras más posteriores situadas en el retroperitoneo e incluso a su través se pueden obtener imágenes del corazón, utilizando la vía subcostal(18).
Desde un punto de vista funcional el hígado se divide en 3 lóbulos: lóbulo hepático derecho (LHD), lóbulo hepático izquierdo (LHI) y lóbulo caudado (LC). La cisura lobar principal separa el LHD del LHI y pasa a través de la fosa vesicular hasta la vena cava inferior (VCI). El LC es posterior, su cara inferior limita directamente con la vena y su cara superior con el ligamento venoso(19).
Técnica
Para la exploración del hígado se utiliza una sonda cónvex de baja frecuencia (2,5-5 MHz). Con el paciente en decúbito supino se deberá conocer la localización hepática y sus relaciones. Tanto en los cortes transversales como longitudinales, anterior a él se observará la piel, el tejido celular subcutáneo, músculos rectos del abdomen, el diafragma y más cefálico y posterior el pulmón derecho y el corazón. El resto de estructuras intrabdominales se ven posteriores al hígado.
Para la evaluación ecográfica del hígado se hacen cortes longitudinales desde la línea media hacia la zona lateral derecha del cuadrante superior derecho del abdomen. Los cortes se realizan siguiendo el borde costal aunque en ocasiones, en pacientes muy obesos o cuando existe mucho aire en la cavidad abdominal deberemos utilizar la vía intercostal para su mejor visión. Al estar localizado el hígado por debajo de la parrilla costal puede resultar muy útil solicitar al paciente una inspiración profunda o Valsalva mantenidos para que el descenso del diafragma nos facilite su visualización.
Para completar la exploración realizaremos cortes transversales, perpendiculares a la línea sagital, y cortes oblicuos, comenzando en epigastrio. Con mínimas variaciones en el desplazamiento del transductor, conseguiremos visualizar el LHI, pedículo hepático, venas suprahepáticas y sistema excretor biliar. Debemos explorar el hígado en su totalidad y comprobar que se visualiza todo su contorno, desde la punta del LHI a nivel lateral izquierdo de epigastrio hasta la punta inferoposterior del LHD y todo el contorno yuxtadiafragmático.
Valoración ecográfica de hígado normal
El hígado normal presenta una ecoestructura homogénea (similar a la del bazo y algo mayor que la corteza del riñón). En su interior se observan pequeñas áreas anecoicas, redondeadas o lineales, correspondientes a las venas. Las venas pertenecientes al sistema porta tienen “pared ecogénica”, al estar rodeadas de tejido colágeno, mientras que las venas suprahepáticas y sus ramas no. Aunque la principal característica que permite diferenciarlas es la ecogenicidad de la pared, también podemos diferenciar vasos suprahepáticos y portales por su dirección. La ramificación portal es fundamentalmente horizontal y apunta hacia el hilio hepático aumentando los vasos de diámetro al acercarse a éste, mientras que las venas suprahepáticas presentan una ramificación fundamentalmente vertical, orientadas hacia VCI, aumentado su diámetro al dirigirse a ésta.
Ecográficamente se puede ver la vena porta a nivel de hilio hepático con un diámetro a ese nivel que no debe superar los 11-12 mm. A nivel intrahepático se pueden ver sus dos ramas, una derecha posterior y caudal, y la izquierda anterior y craneal. Tanto la derecha como la izquierda dan a su vez dos ramas que se dirigen a los segmentos hepáticos correspondientes. A excepción de la porción ascendente de la rama portal izquierda, que es intersegmentaria, el resto de las ramas portales presenta una localización intrasegmentaria.
La vena porta transporta sangre parcialmente oxigenada, aportando más de la mitad de los requerimientos de oxígeno de los hepatocitos. El resto es aportado por la arteria hepática que, junto con las ramas de la vía biliar, acompañan a las ramas portales en lo que se denomina tríada portal.
Ecográficamente, en condiciones normales, la arteria hepática es difícil de valorar: en hilio se observa la vena porta y por encima y paralela a ella la vía biliar principal, ambas como estructuras tubulares sonoluscentes; entre ambas se observa una formación redondeada sonoluscente que corresponde a la arteria hepática, su rama derecha. Es posible también observarlas en cortes transversales con una imagen de "cabeza de Mickey Mouse", donde la cara corresponde a la vena porta, la oreja medial con respecto a ella es la arteria hepática, y la oreja lateral corresponde a la vía biliar.
La sangre que perfunde el parénquima hepático es recogida por venas hepáticas, visualizándose éstas como estructuras sonoluscentes que se dirigen hacia la vertiente anterior de la VCI justo por debajo del diafragma. Estas venas hepáticas o suprahepáticas principales son tres: derecha, media e izquierda, y su localización es intersegmentaria.
Tras el nacimiento, la vena umbilical se atrofia y oblitera formando el ligamento redondo, que ecográficamente se corresponde con una formación ecogénica situada en el lóbulo izquierdo, que en cortes transversales aparece como una estructura redondeada, hiperecoica, situada entre el segmento lateral y el medial del lóbulo izquierdo. Si no se conoce su localización se puede pensar en un nódulo sólido o en una calcificación en parénquima. En el corte longitudinal muestra una morfología lineal que desde la porta izquierda se dirige a la superficie hepática.
Las cisuras aparecen como formaciones lineales ecogénicas. La más importante es la del ligamento venoso, que se sitúa entre el lóbulo caudado y el lóbulo izquierdo (segmento lateral). Es una referencia fundamental para la localización del lóbulo caudado. La cisura principal se extiende desde fosa vesicular hacia hilio y es un referente para la división hepática en lóbulo derecho y lóbulo izquierdo.
La forma del hígado está condicionada por las estructuras que lo rodean: diafragma, riñón derecho (RD), vesícula biliar, etc. a cuya morfología se adapta, así, su cara anterior es plana o ligeramente convexa, la cara diafragmática es convexa, mientras que la cara posterior cóncava se adapta a la morfología de RD, de VCI, etc. Esta morfología hace que los bordes hepáticos formen ángulos agudos en LHD y en lóbulo izquierdo LHI; es importante conocer esta morfología pues su modificación puede ser signo indirecto de crecimiento o de ocupación del parénquima hepático (Figura 1).
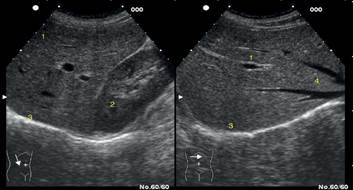
Figura 1. Corte longitudinal y transversal en el hipocondrio derecho: en el longitudinal (izquierda) se observa el lóbulo hepático derecho (1), riñón derecho(2) y el diafragma (3). En el corte transversal (derecha) del lóbulo hepático derecho: el diafragma y las venas suprahepáticas (4)(19)
Los límites hepáticos son siempre regulares y bien definidos y su modificación indica alteración hepática. La medida más utilizada y fiable es el diámetro longitudinal máximo obtenido en línea medioclavicular, que no debe sobrepasar los 150 mm, medida desde cúpula hasta borde inferior. Se utiliza también como valor el diámetro antero-posterior de LHI, que en cortes transversales no debe ser superior a 50 mm.
Dentro de lo dinámico que debe ser el estudio ecográfico se pueden valorar «signos indirectos» de hepatomegalia, que aunque subjetivos poseen valor:
· Extensión del borde inferior de LHD por debajo del nivel correspondiente a polo inferior de riñón derecho.
· La vena suprahepática media se sitúa en la cisura lobar principal dividiendo el hígado en dos lóbulos: el LHD y el LHI.
· La vena suprahepática derecha dividirá a su vez el LHD en dos segmentos, un segmento anterior que se sitúa entre vena suprahepática media y vena suprahepática derecha, y un segmento posterior entre la vena suprahepática derecha y el limite hepático.
· La vena suprahepática izquierda dividirá a su vez el LI en dos segmentos, un segmento medial o lóbulo cuadrado que se sitúa entre vena suprahepática media y vena suprahepática izquierda, y un segmento lateral entre la vena suprahepática izquierda y el límite hepático.
Nos queda por definir el lóbulo caudado, que es la porción del hígado situada entre VCI y la cisura del ligamento venoso. Este lóbulo puede simular de menor ecogenicidad que el resto del parénquima y no ser patológico; se debe a la atenuación sónica que provoca la grasa y el tejido fibroso del ligamento venoso que es su límite superior.
Valoración ecográfica de la esteatosis hepática
El papel de la ecografía en el estudio de la patología difusa se reserva fundamentalmente a descartar la presencia de lesiones focales en un paciente con alteraciones analíticas y/o portador de una hepatomegalia. No obstante, ciertas patologías difusas pueden adquirir un patrón ecográfico más o menos característico que ayuda a su valoración.
La característica ecográfica fundamental de la infiltración grasa es el hígado hiperecoico llamado "hígado brillante", igualando o superando la ecogenicidad del parénquima pancreático. Este aumento de ecogenicidad por la infiltración grasa provoca atenuación sónica posterior, que dificulta la valoración de las partes más profundas del hígado
En función de estas características se distinguen tres grados:
· Tipo I. Leve. Discreto aumento difuso de la ecogenicidad, con normal valoración del diafragma y de los bordes de los vasos intrahepáticos.
· Tipo II. Moderada. Moderado aumento difuso de la ecogenicidad, con dificultad para la valoración del diafragma y vasos intrahepáticos (Figura 2).
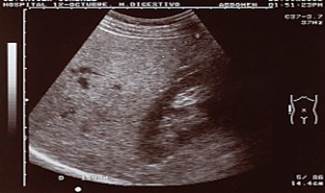
Figura 2. Enfermedad hepática grasa. Hígado brillante con escasa visualización de vasos intrahepáticos (grado II) (20)
· Tipo III. Grave. Marcado aumento de la ecogenicidad, con escasa o nula visualización de las paredes de los vasos intrahepáticos, del diafragma y de la porción posterior del LHD, debido a la pobre penetración de los ultrasonidos (Figura 3).
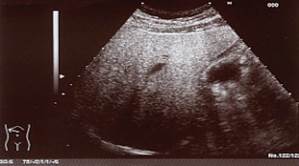
Figura 3. Enfermedad hepática grasa. Atenuación posterior (grado III)20
Esta afectación del parénquima hepático en la esteatosis puede presentarse como:
· Patrón difuso: afecta a la totalidad del parénquima, aunque dentro de este patrón es bastante frecuente el observar zonas hipoecoicas que representan "áreas de parénquima normal" de límites más definidos (parecen continuarse con el parénquima graso) y sin efecto masa (es frecuente su localización en el hilio hepático o en la zona próxima a la vesícula.
· Patrón focal: corresponde a regiones de ecogenicidad aumentada sobre el fondo de un parénquima normal. Este patrón es frecuente, sobretodo en LHD. Es de fácil diagnóstico y fácil de diferenciar de la lesión ocupante de espacio (LOE) por la ausencia de efecto masa: no desplazan ni comprimen vasos hepáticos, ni alteran el contorno del hígado, y suelen presentar márgenes geográficos.
Para evaluar el grado de infiltración grasa, se usan la escala de medición propuesta por D. F. Chan, et al(19) (Tabla 2). Esta escala estratifica la esteatosis hepática en 3 grados: hígado normal o grado 0 (0 puntos), esteatosis hepática leve o grado 1(1 a 3 puntos), esteatosis hepática moderada o grado 2 (4 a 6 puntos) y esteatosis hepática grave o grado 3 (7 a 9 puntos).
Tabla 2. Escala de evaluación del hígado graso
|
Características |
Puntuación |
Definición |
|
Ecoestructura |
0 |
Normal: La ecogenicidad del parénquima hepático es homogénea y no hay diferencia de contraste entre el parénquima hepático y el renal. |
|
1 |
Cambio graso leve: Leve aumento de la ecogenicidad del parénquima hepático. |
|
|
2 |
Cambio graso moderado: Intermedio entre la puntuación 1 y 3. |
|
|
3 |
Cambio graso grave: Existe una diferencia importante entre la ecogenicidad del parénquima hepático y la ecogenicidad del parénquima renal. |
|
|
Visibilidad del Diafragma |
0 |
Normal: El parénquima hepático se distingue claramente de la superficie del diafragma. El contorno del diafragma es claramente observado. |
|
1 |
Cambio graso leve: Atenuación leve de la onda de ultrasonido en el parénquima hepático. |
|
|
2 |
Cambio graso moderado: Intermedio entre la puntuación 1 y 3. |
|
|
3 |
Cambio graso grave: Marcada atenuación de la onda de ultrasonido a través del parénquima hepático. No es posible visualizar el diafragma. |
|
|
Estructuras vasculares hepáticas |
0 |
Normal: La pared de las estructuras vasculares y su lumen son claramente visualizadas. |
|
1 |
Cambio graso leve: Leve disminución de la definición de las paredes de las estructuras venosas portales periféricas. |
|
|
2 |
Cambio graso moderado: Intermedio entre la puntuación 1 y 3. |
|
|
3 |
Cambio graso grave: Solo es posible observar las paredes de la porta central, no se observan las paredes de las estructuras portales periféricas. |
Utilizando estos criterios, la sensibilidad media de la ecografía para el diagnóstico de EHDG es del 87% (60-100), y la especificidad es del 86% (56-95%). Cuanto mayor es el depósito de grasa, mayor es la sensibilidad y la especificidad.
Las principales limitaciones de la ecografía son que es operador dependiente, la obesidad del paciente y que la fibrosis hepática y la cirrosis pueden tener apariencias similares.
Tomografía axial computarizada (TAC) y resonancia magnética hepática
A pesar de los grandes avances en el desarrollo de multidetectores en tomografía computarizada y las técnicas ultra-rápidas en resonancia magnética, no han desplazado a la ecografía como la técnica inicial de evaluación en pacientes con sospecha de alteración en el hígado, la vía biliar o enfermedades parenquimatosas; lo anterior debido a sus múltiples aplicaciones, disponibilidad, comodidad y a su bajo costo en los sistemas de salud. A pesar de esto, la ecografía aún tiene limitaciones como interposición gaseosa y obesidad.
La tomografía computarizada(20) por su rapidez, su buena capacidad de visualización morfológica en la detección de enfermedad focal o difusa, así como las relaciones anatómicas con los órganos vecinos, la convierte en una buena alternativa diagnóstica para el médico especialista, que a la vez con los avances en las técnicas de multidetectores y la amplia disponibilidad de ellos en el medio, obliga a que se tenga varios protocolos de este tipo de ayuda imaginológica, y que sumado a las nuevas técnicas como la tomografía de doble energía permiten una excelente evaluación del hígado.
Por otra parte, la resonancia magnética, por su excelente contraste tisular de los tejidos blandos, por los diferentes tipos de secuencias que permiten caracterizar mejor las diferentes enfermedades del hígado y por no utilizar radiación ionizante y medios de contrastes yodados, la convierte en una ayuda diagnóstica superior a la tomografía computarizada.
Actualmente, con el desarrollo de medios de contraste específicos para el hígado, la reducción de artificios de movimiento respiratorio con secuencias de mayor velocidad y desarrollo de sincronización y navegadores respiratorios, y el avance exploratorio de nuevas técnicas de imágenes como la DW-MRI (Difusión) y la PW-MRI (Perfusión) en la práctica clínica, no sólo para el diagnóstico de la cirrosis, sino también para el diagnóstico de la fibrosis hepática moderada y avanzada, la resonancia magnética es un método que permite evaluar las enfermedades hepáticas focales y difusas desde un punto de vista morfológico y funcional, aunque aún quedan algunos retos por superar.
Objetivos
Objetivo principal
· Analizar el valor de la ecografia en la Estratificación del grado de esteatosis en leve, moderado o grave.
· Evaluar la correlación entre los resultados ecográficos, con los niveles séricos de triglicéridos, aminotransferasas (GOT y GPT) y el IMC.
· Analizar la prevalencia de esteatosis hepática en población con varios factores de riesgo cardiovascular.
Objetivos secundarios
· Determinar las características epidemiológicas de dichos pacientes, incluyendo género, edad y/o varios factores de riesgo cardiovascular.
Justificación del estudio
· Dada la importancia de los factores de riesgo cardiovascular, nuestro estudio se ha desarrollado para comprobar si la presencia o ausencia de esteatosis hepática en este tipo de pacientes, si es mayor que en el resto de la población y si repercute en un aumento del riesgo cardiovascular.
· También se ha estadificado la esteatosis en sus distintos grados para evaluar si el perfil hepático se altera según la gravedad de la esteatosis hepática.
Material y métodos
Marco demográfico
Casas de Haro
Es un municipio de España, en la provincia de Cuenca, comunidad autónoma de Castilla-La Mancha. Tiene una superficie de 110,88 km2 con una población de 879 habitantes y una densidad de 7,98 hab/km².
En los últimos 10 años, ha habido un descenso de población significativo en el género femenino, y se ha mantenido estable en los hombres.
El grupo de edad más numeroso es entre 31-49 años, en ambos géneros. Destaca también que el grupo de mujeres de más de 80 años, es superior al de los hombres, 56 y 37 respectivamente (Figura 4).
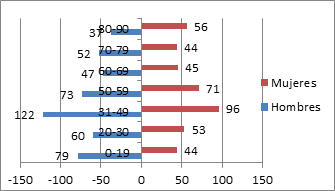
Figura 4. Distribución de población por edades
La riqueza de sus habitantes proviene del sector primario. Dentro de la agricultura debemos destacar el cultivo de la vid y la elaboración de vinos ", por lo que se hace figurar en su escudo un racimo de uvas. Dentro de la ganadería señalamos el ganado ovino y caprino, con la correspondiente elaboración de quesos en sus diferentes modalidades.
Organización
Consultorio de Casas de Haro
Un consultorio médico hace referencia a una estructura sanitaria más pequeña, generalmente localizada en un pueblo, y con menos profesionales. Como mínimo lo compone un médico rural. Uno o varios consultorios suelen depender organizativamente de un centro de salud de referencia. El centro de salud al que pertenece Casas de Haro es a San Clemente, que dista 17 km.
El consultorio de Casas de Haro se construyó en el año 1998 y tiene unos 150 m2. Consta de una sala de espera, la consulta de medicina, la consulta de enfermería, un baño de uso público, un baño de uso exclusivo para el personal sanitario y un almacén. Está en proyecto la construcción de una sala anexa polivalente espaciosa para poder atender a los pacientes que requieran cuidados más específicos y urgentes y también que sirva como sala de aerosoles, extracciones, etc. También carece de línea ADSL por lo que el acceso a las historias clínicas está enlentecido. La población que se atiende a diario oscila entre 30-40 pacientes (incluidas tareas administrativas, como cumplimentar recetas).
Pacientes
Estudio observacional, descriptivo y analítico, de sección transversal. Durante 12 meses se seleccionaron 100 pacientes, con 2 o más factores de riesgo cardiovascular, con nula o baja ingesta de alcohol, que acudían a consulta de Atención Primaria, en el consultorio de Casas de Haro (Cuenca). Se calculó el tamaño muestral sobre un 24% de prevalencia de SM en población general y un 30% de prevalencia de EHGNA en éstos y se seleccionaron por muestreo aleatorio sistemático cada uno de los pacientes.
El diagnóstico de la EHGNA se debe basar en la combinación de datos de la historia clínica y métodos de diagnósticos no invasivos. Un adecuado proceso diagnóstico debe incluir los siguientes aspectos básicos:
· Diagnóstico de sospecha de EHGNA, incluyendo la verificación de abstinencia alcohólica y excluyendo las causas potenciales de esteatosis hepática y el diagnóstico de las posibles enfermedades asociadas.
· Valoración del RCV de estos pacientes.
· Evaluar de la severidad de la esteatosis hepática mediante técnicas no invasivas, como la ecografía.
La población seleccionada cumple los siguientes criterios de inclusión:
· Abstinencia o consumo escaso de alcohol (< 20 g/día en mujeres y < 30 g/ día en hombres).
· Alteración o no de pruebas de función hepática, no debidas a hepatitis víricas o a otras enfermedades hepatobiliares o sistémicas, ni tampoco por causas medicamentosas (glucocorticoides, estrógenos sintéticos, amiodarona, aspirina, etc.)
Determinaciones efectuadas
Variables demográficas y bioquímicas
· Edad.
· Género.
· Ingesta de alcohol.
· Historia de diabetes, hipertensión arterial sistémica.
· Peso, talla, índice de masa corporal (IMC) (definido como peso/talla2).
· Medición de presión arterial (definida como ≥ 130/85 mmHg).
· Niveles de glucosa basal (definida como ≥ 110 mg/dL), hemoglobina glicosilada.
· Colesterol total (definiendo como hipercolesterolemia ≥ 200 mg/dL), colesterol HDL (definido como < 40 mg/dL en hombres y < 50 mg/dL en mujeres), colesterol LDL,
· Triglicéridos (definido como hipertrigliceridemia ≥ 200 mg/dL,
· AST, ALT, bilirrubinas y fosfatasa alcalina.
· También se recogieron antecedentes personales y familiares de diabetes, HTA, dislipemia, tratamiento farmacológico, cifras de otros parámetros analíticos y perímetro abdominal.
Evaluación hepática por ultrasonografía
Una vez cumplían los criterios de selección eran citados para la realización de la ecografía de abdomen completo, previa información del propósito de la técnica a efectuar y aportando el consentimiento informado firmado.
La ecografía se realizaba con el paciente en ayunas y a ser posible con vejiga repleccionada, para poder efectuar la técnica en las mejores condiciones de preparación del paciente, con el fin de disminuir los artefactos ecográficos y poder valorar todas las estructuras abdominales correctamente.
Para los estudios sonográficos se utilizó un aparato ecográfico ESAOTE MyLab 20 Plus (Figura 5).
Figura 5. Ecógrafo empleado en el estudio de marca Esaote
La característica ecográfica fundamental de la infiltración grasa es el aumento de ecogenicidad hepática, debido al depósito de grasa (esteatosis) en los hepatocitos. Dependiendo del número de hepatocitos con grasa, este depósito puede ser leve (< 33%), moderado (33-66%) o grave (> 66%).
Esta hiperecogenicidad es de grano fino muy denso lo que le confiere al hígado un aspecto " brillante", igualando o superando la ecogenicidad del parénquima pancreático, y ligeramente aumentado de ecogenicidad respecto a la corteza renal. Este aumento de ecogenicidad por la infiltración grasa provoca atenuación sónica posterior, que dificulta la valoración de las partes más profundas del hígado.
Análisis estadístico
Las variables analizadas se incluyeron y ordenaron en la base de datos EXCEL. Las variables cualitativas se exponen como valor exacto y en porcentaje, las cuantitativas como media y desviación estándar (DE).
La comparación entre medias se realizó a través de la prueba t de Student para grupos independientes o la U de Mann-Whitney si las condiciones de normalidad (aplicación del test de Kolmogorov- Smirnoff o de Shapiro Willks) no se cumplían. En las variables cualitativas, la prueba de Ji al cuadrado.
Resultados
Descripción de la muestra
Distribución por género
Han participado 100 pacientes: 44 hombres y 56 mujeres, con una edad media de 61,84 (DE +/- 9,5 años) (Figura 6).
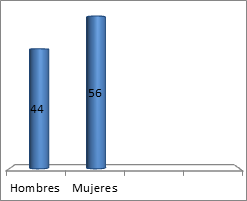
Figura 6. Distribución por género
Distribución por edades
Los grupos de edad más frecuentes fueron entre 51-74 años, siendo la edad del 32% de la muestra entre 51 y 64 años. Los grupos menos frecuentes son los >75 y < 50 años, con 22% y 21% del total respectivamente (Figura 7).
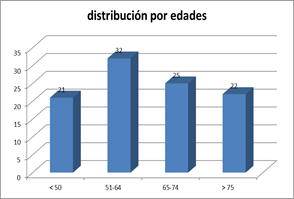
Figura 7. Distribución por edades
El 71% de los sujetos tienen obesidad, siendo 33% de grado 1, el 29 % de grado 2 y el 9 % grado 3. Sólo el 6% tienen normopeso y el 23% presentan sobrepeso (Figura 8).
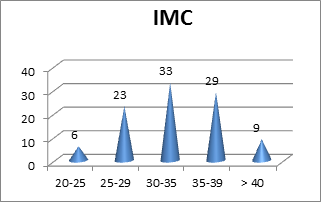
Figura 8. Clasificación por peso (IMC)
Grado de esteatosis por género
El 23 % de los sujetos no tiene esteatosis, y en el 58 % es de grado leve y moderado en ambos géneros (p< 0,003). El 19 % tiene esteatosis grado 3 (Figura 9).
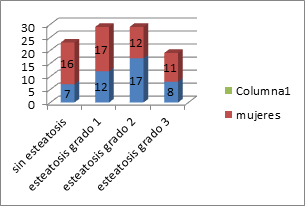
Figura 9. Grado de esteatosis por género
Sólo 14 de los obesos no tienen esteatosis hepática y de los sujetos con normopeso, 13 tienen esteatosis en sus distintos grados, principalmente esteatosis leve (Figura 10).
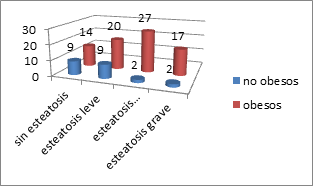
Figura 10. Grado de esteatosis y obesidad
Hipertrigliceridemia sólo presentan el 24 %. No son fumadores el 89 % y antecedentes familiares de accidente cerebrovascular (ACV) e infarto agudo de miocardio (IAM) sólo lo presentan el 17% y 20 %, respectivamente (Tabla 3).
Tabla 3. Los principales factores de riesgo
|
Factores de riesgo |
SÍ |
NO |
|
Antecedentes familiares de ACV |
17 |
83 |
|
Antecedentes familiares IAM |
20 |
80 |
|
Tabaquismo activo |
11 |
89 |
|
Diabetes mellitus |
62 |
38 |
|
Hipertensión arterial |
59 |
41 |
|
Obesidad |
78 |
22 |
|
Hipercolesterolemia |
73 |
27 |
|
Hipertrigliceridemia |
24 |
76 |
Tratamiento farmacológico de la DM e HTA
Respecto al tratamiento farmacológico de la HTA, los IECAS/ARA 2, los toman el 51% de los sujetos, seguido de diuréticos el 35%. La metformina es el antidiabético que más toman el 29% de los diabéticos, y las incretinas el 10% (Tabla 4).
Tabla 4. Tratamiento farmacológico de diabetes e hipertensión arterial
|
ANTIDIABÉTICOS ORALES |
SÍ |
NO |
ANTIHIPERTENSIVOS |
SÍ |
NO |
|
Metformina |
29 |
71 |
Calcioantagonistas |
18 |
82 |
|
Sulfonilureas |
2 |
98 |
Diuréticos |
35 |
65 |
|
Repaglinida |
2 |
98 |
IECAS/ARA II |
51 |
49 |
|
Incretinas |
10 |
90 |
Alfabloqueantes |
1 |
99 |
|
Insulina |
5 |
95 |
betabloqueantes |
8 |
91 |
Tratamiento hipolipemiante y otros fármacos
El tratamiento hipolipemiante más usado son las estatinas por un 44% de los sujetos y los fibratos por un 11%. Los inhibidores de la bomba de protones (IBP) los toman el 65 % y los antiagregantes el 19%( Tabla 5).
Tabla 5. Tratamiento hipolipemiante y otros fármacos
|
HIPOLIPEMIANTES |
|
|
OTROS FÁRMACOS |
|
|
|
Estatinas |
44 |
56 |
Uricosúricos |
4 |
96 |
|
Fibratos |
11 |
89 |
Antiagregantes |
19 |
81 |
|
Ezetimiba |
2 |
98 |
IBP |
65 |
35 |
|
|
|
|
Analgésicos |
18 |
82 |
|
|
|
|
Antidepresivos |
22 |
78 |
Parámetros clínicos y analíticos
La Tabla 6 describe los resultados de los diferentes parámetros clínicos y analíticos. Respecto a la HTA, el 78% tiene cifras de PAS ≤140 mmHg, y el 91% PAD ≤ 90 mmHg. El 69% presenta perímetro abdominal >102 cm.
Tabla VI. Valores de los distintos parámetros analíticos
|
PARÁMETROS CLÍNICOS Y ANALÍTICOS |
VALORES |
|
|
Presión arterial sistólica |
≤ 140 mmHg (78%) |
> 140 mmHg (22%) |
|
Presión arterial diastólica |
≤ 90 mmHg (91%) |
> 90 mmHg (9%) |
|
Perímetro abdominal |
≤ 102 cm (31%) |
> 102 cm (69%) |
|
Glucemia basal |
≤ 110 mg/dl (55%) |
> 110 mg/dl (45%) |
|
Hemoglobina A1c |
≤ 6,5 % (75%) |
> 6,5 % (25%) |
|
Colesterol total |
≤ 200 mg/dl (59%) |
> 200 mg/dl (41%) |
|
Colesterol LDL |
≤ 130 mg/dl (66%) |
> 130 mg/dl (33%) |
|
Colesterol HDL |
≤ 45 mg/dl (27%) |
> 45 mg/dl (73%) |
|
Triglicéridos |
≤ 150 mg/dl (64%) |
> 150 mg/dl (36%) |
|
GOT |
≤ 31 UI/L (85%) |
> 31 UI/L (15%) |
|
GPT |
≤ 31 UI/L (66%) |
> 31 UI/L (34%) |
|
GGT |
≤ 35 UI/L (58%) |
> 35 UI/L (42%) |
|
FA |
≤ 104 UI/L (78%) |
> 104 UI/L (21%) |
|
Bilirrubina total |
≤ 1,1 mg/dl (93%) |
> 1,1 mg/dl (7%) |
|
Urea |
≤ 50 mg/dl (85%) |
> 50 mg/dl (15%) |
|
Creatinina |
≤ 1,0 mg/dl (82%) |
> 1,0 mg/dl (18%) |
|
Ácido úrico |
≤ 7 mg/dl (83%) |
> 7 mg/dl (17%) |
|
Ferritina |
≤ 400 mg/dl (91%) |
> 400 mg/dl (9%) |
|
Proteínas totales |
≤ 8,7 g/dl (100%) |
> 8,7 g/dl (0%) |
|
Albúmina |
≤ 4,8 g/dl (83%) |
> 4,8 g/dl (17%) |
|
PCR |
≤ 5 mg/dl (82%) |
> 5 mg/dl (18%) |
|
TSH |
≤ 4.2 UI/ml (79%) |
> 4.2 µUI/ml (21%) |
Respecto a la glucemia basal, en el 55% es inferior a 110 mg/dl con una HbA1c < 6,5% el 75% de los pacientes.
El colesterol total < 200 mg/dl corresponde al 59 %, con LDLc < 130 mg/dl el 66 %. El 73 % de los pacientes tienen el HDLc > 45 mg/dl y los triglicéridos < 150 mg/dl el 64% del total.
En relación al perfil hepático la GOT ≤ 31UI/L en el 85% de los pacientes, siendo GPT ≤31 UI/L en el 66% y la GGT ≤ 35 UI/L presente en el 58%.
Clasificación según perímetro abdominal
En la Figura 11 destaca que el perímetro abdominal está alterado (>102 cm) en el 69% de los pacientes, tanto hombres como mujeres, y sólo en 3 mujeres es <88 cm.
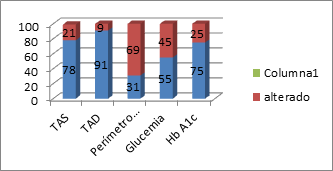
Figura 11. Control de los principales factores de riesgo medido en porcentajes
Parámetros de perfil hepático
En la Figura 12 destaca que la GOT está dentro de los parámetros normales en el 85% de los pacientes, seguida por GPT normal en el 66% y GPT en el 58% del total.
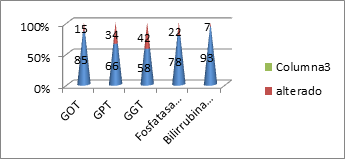
Figura 12. Resultados de los distintos parámetros del perfil hepático
Distribución por edades
El grupo de edad más frecuente de presentación de esteatosis es entre 50-70 años, cuya distribución mayoritariamente es de grado leve y moderado en el 28% del total en ambos casos, y en un 13% del grupo de edad de <65 años de grado es grave (Figura 13).
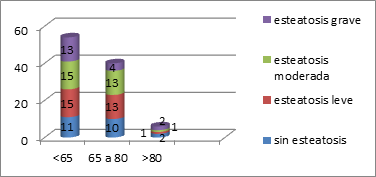
Figura 13. Distribución del grado de esteatosis por edades
Esteatosis y perímetro abdominal
La distribución de esteatosis en pacientes con perímetro abdominal >100 cm es estadísticamente significativa (p= 0,017) en relación a los pacientes con perímetro abdominal <100 cm. El 65% del total de pacientes con perímetro abdominal elevado presentan esteatosis en sus distintos grados (Figura 14).
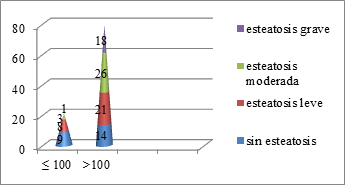
Figura 14. Clasificación según el perímetro abdominal
Esteatosis según IMC
En obesidad grado 2 y 3, el grado de esteatosis es moderado y grave, en 15 y 14 de los sujetos respectivamente. En la Figura 15, destaca que a mayor grado de obesidad aumenta la gravedad de la esteatosis, siendo estadísticamente significativo (p = 0,001).
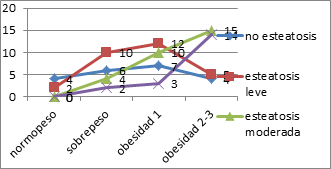
Figura 15. Esteatosis según IMC
Esteatosis según cifras de HDLc
Todos los pacientes con HDLc bajo, presentan esteatosis hepática. El 23% de los pacientes. con HDLc >40 mg/dl no tiene esteatosis hepática (Figura 16).
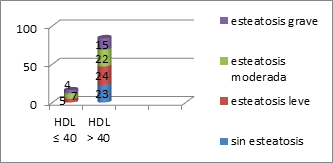
Figura 16. Distribución según cifras de HDLc
Esteatosis y cifras de triglicéridos
En la Figura 17 destaca que las cifras de triglicéridos influyen en el grado de esteatosis. El 33% de los pacientes con cifras de triglicéridos normales no tiene esteatosis, y solo el 5% con triglicéridos > 150 mg/dl no tiene esteatosis. El 95% de los pacientes con hipertriglicericemia tiene esteatosis hepática en sus distintos grados (p = 0,015).
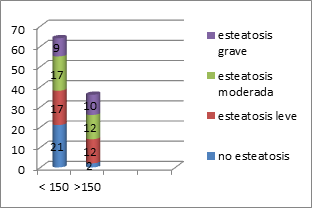
Figura 17. Según cifras de triglicéridos
Esteatosis y diabetes mellitus
Los pacientes con glucemias basales <100 mg/dl (Figura 18), presentan menor prevalencia de esteatosis hepática. En nuestro estudio 17 pacientes con glucemia basal <100 mg/dl no tienen esteatosis, mientras que de los diabéticos 12 de ellos tendrán esteatosis grave, siendo estadísticamente significativo (p= 0,002).
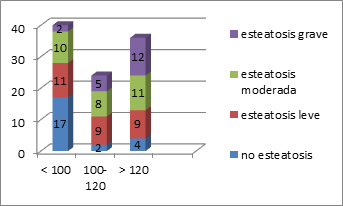
Figura 18. Esteatosis y diabetes mellitus
Lo mismo sucede con valores de HbA1c <6,5% (Figura 19), los sujetos tienen menos esteatosis hepática que aquellos con HbA1c >6,5% (p = 0,004).
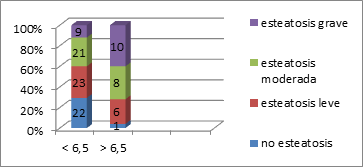
Figura 19. Esteatosis y hemoglobina glicosilada
Esteatosis e hipertensión arterial
Respecto al factor de riesgo HTA (Figura 20), en nuestro estudio los pacientes hipertensos tienen más prevalencia de esteatosis hepática en sus diferentes grados. Por el contrario, 15 de los pacientes no hipertensos no tienen esteatosis, mientras que de los hipertensos sólo 8 no tendrán esteatosis hepática (p = 0,027).
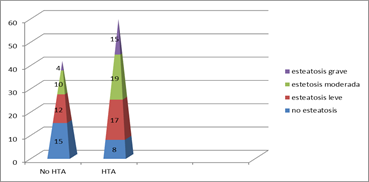
Figura 20. Esteatosis y HTA
Esteatosis y riesgo cardiovascular
Al calcular el riesgo cardiovascular score, son pacientes de bajo riesgo cardiovascular el 64% del total, de riesgo intermedio el 31% y el 4 % de riesgo alto o muy alto (Figura 21).
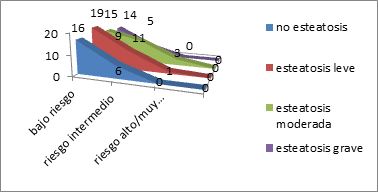
Figura 21. Riesgo cardiovascular score y esteatosis hepática
Discusión
Esteatosis hepática
La EHGNA(1-5) es una enfermedad hepática inflamatoria de carácter crónico, de gran relevancia en la actualidad por su fuerte asociación con enfermedades de prevalencia creciente como la obesidad y la DM, hechos que nuestros resultados confirman, al encontrar una alta relación entre la aparición de EHGNA y el padecimiento de estas patologías (p=0,02). Existe una estrecha relación entre la aparición de EHNA y el número de criterios de síndrome metabólico (p= 0,000). El HGNA es especialmente prevalente en pacientes obesos. La prevalencia de EHGNA(2-6) oscila entre 10-25% de la población occidental, y asciende hasta 4,6 veces más en la población obesa. En nuestro estudio, la prevalencia de esteatosis hepática es del 72 % de los pacientes, siendo obesos el 78 %, de los cuales el 82 % tiene esteatosis en sus distintos grados, siendo estadísticamente significativo (p = 0,014).
Así, en un estudio basado en necropsias de sujetos no seleccionados de la población general, Wanless y Lentz(12) encontraron esteatosis en el 70% de los pacientes obesos y en el 35% de los no obesos, EHNA en el 18,5% de los obesos y en el 2,7% de los no obesos había hallazgos de inflamación y fibrosis. Otros estudios realizados en obesos, mediante biopsias, muestran una prevalencia de HGNA alrededor del 60% y entre un 20% y un 25% de EHNA. Además, cuando se estudian pacientes diabéticos se observa que un 75% de los diabéticos tipo 2 tienen HGNA. Este proceso también afecta a la población infantil, estimándose una prevalencia de HGNA cercana al 2% entre niños y adolescentes.
Estudios epidemiológicos sugieren que hay una distribución uniforme de HGNA entre hombres y mujeres, aunque hay variaciones de género entre las diferentes tipos de gravedad. En numerosas series, se comprueba que las mujeres tienen la enfermedad más avanzada que los varones, lo que sugiere que en el género femenino el curso de la enfermedad podría ser es más agresivo. En nuestro estudio la distribución de la esteatosis por géneros es similar, siendo de grado leve y moderado en ambos sexos, aunque las mujeres tienen mayor porcentaje de esteatosis grado 3 respecto al hombre. Diversos estudios muestran variaciones raciales, observándose que el HGNA parece ser menos prevalente en afroamericanos en comparación con europeos e hispanoamericanos. Esto puede deberse a diferencias genéticas en la distribución de la grasa corporal o en la termogénesis metabólica .También se han descrito asociaciones entre gemelos, lo que sugiere que hay factores genéticos que predisponen al desarrollo de EHNA.
Aunque el modelo de la teoría del doble impacto es ampliamente aceptado para explicar la patogénesis del HGNA, los mecanismos específicos que median la progresión de la esteatosis a esteatohepatitis y aquellos que se dirigen a mantenerse como esteatosis simple, en algunos pacientes son pobremente entendidos. La presencia de esteatosis es un prerrequisito de esteatohepatitis, pero no es la causa de desarrollo de higado graso. Algunos estudios recientes han encontrado que la acumulación de lípidos en el hígado puede ser un mecanismo protector para pacientes con obesidad, RI o elevación de ácidos grasos libres. Los hepatocitos, expuestos a altos niveles de circulación de ácidos grasos libres, y ácidos grasos libres almacenados en forma de TG podría facilitar el estrés oxidativo y la inflamación crónica, por tanto, prevenir el daño hepatocelular. Sin embargo, si elevados niveles de ácidos grasos libres en el torrente sanguíneo juegan un papel importante en la patogénesis del HGNA y si los niveles plasmáticos y en el hígado descienden en el plasma pueden ejercer un efecto protector sobre los hepatocitos todavía no aclarado.
El HGNA es un espectro de lesiones histológicas que van desde la esteatosis hasta esteatohepatitis y cirrosis. Es conocido que la esteatosis por sí misma se considera una enfermedad no progresiva, mientras que la esteatohepatitis es la constelación de lesiones con potencial para progresar: esteatosis macrovesicular de distribución difusa, inflamación lobular o parenquimatosa mixta, crónica y de polimorfonucleares, con o sin necrosis focal, y con grados variables de fibrosis perisinusoidal y perivenular, degeneración vesicular y presencia de cuerpos hialinos de Mallory y granulomas lipídicos. La combinación de esteatosis macrovesicular con cambios vacuolares de los hepatocitos y/o fibrosis perisinusoidal constituye el patrón histológico considerado diagnóstico de esteatohepatitis.
Técnicas diagnósticas
Ecografía
Muchos avances se han producido desde que se sospechase que la esteatosis hepática podía aparecer en pacientes con sobrepeso con o sin diabetes y sin estar expuestos a ingesta de alcohol. Las tres modalidades principales son: el ultrasonido, la tomografía axial computarizada (TAC) y la resonancia magnética (RM), pero ninguna distingue entre esteatosis simple y esteatohepatitis no alcohólica.
La ecografía es la modalidad de elección para la determinación cualitativa de esteatosis(14-16), pero en cierta forma es subjetiva y dependiente del operador: sólo detecta infiltración grasa de moderada a grave. Otra limitación es que la sensibilidad disminuye cuando la cantidad de infiltrado graso afecta menos de un tercio de los hepatocitos. Existe un sistema de graduación basado en estas características sonográficas, propuesto por varios grupos, para minimizar el sesgo por el observador y mejorar el acuerdo diagnóstico. Ya que la distribución en parches de la enfermedad es difícil de determinar sólo por ecogenicidad, se reduce la certeza del sistema de graduación.
La sensibilidad del ultrasonido para detectar esteatosis hepática y fibrosis varía en gran rango por diversos factores: primero, hay diferencias importantes en los criterios para definir esteatosis y fibrosis, particularmente la importancia de la atenuación posterior del rayo, pues tanto la esteatosis como la fibrosis producen un patrón de ecos brillantes, pero la fibrosis se caracteriza por un patrón áspero de ecos que se distingue de los ecos gruesos y finos de la esteatosis. Segundo, hay diferencia importante entre los transductores ultrasonográficos utilizados; la atenuación y dispersión posterior es considerablemente menor con el rayo de 3.5 MHz que con el de 5 MHz; además, se ha visto que al utilizar los transductores de 10 y 3.5 MHz de forma conjunta, la atenuación dependiente de la frecuencia de un rayo que pasa por el hígado se correlaciona con su contenido de grasa.
Tomografía axial computerizada
La densidad hepática estimada por TAC es más confiable que el ultrasonido para detectar y graduar la infiltración grasa del hígado. Al aumentar la esteatosis, la atenuación del hígado disminuye alrededor de 1.6 Unidades Hounsfield (UH) por cada miligramo de TG depositado por gramo de tejido hepático. En la TAC sin contraste, el valor de atenuación hepática normal (45 a 65 UH) es, en promedio, 10 UH mayor que la del bazo.
En los pacientes con cambios grasos, sin embargo, la densidad suele ser 10 UH menos que la del bazo en la TAC sin contraste y mayor de 25 UH con contraste. Aún más, se ha comunicado que la densidad hepática determinada por el índice de atenuación hígado-bazo (Índice H-B), en TAC sin contraste, se correlaciona con el grado de esteatosis macrovesicular. El índice de atenuación del hígado (IAH) y el del hígado-bazo son útiles para evaluar la historia natural del hígado graso y los cambios inducidos por el tratamiento.
La diferencia de atenuación hígado-bazo depende del tiempo en la TAC con contraste, y su sensibilidad varía con el tipo de escáner, la velocidad de inyección y el tiempo de las mediciones. Al utilizar un valor discriminatorio para la diferencia de H-B de 20.5 UH, entre 80 a 100 segundos después de la inyección, la sensibilidad y especificidad para diagnosticar hígado graso es de 86 y 87%, respectivamente; de los 100 a 120 segundos, y la diferencia en la atenuación hepática y esplénica de 18.5 UH tiene sensibilidad y especificidad de 93%. Las zonas libres de grasa resultan en especificidad más elevada y reducida sensibilidad que la TAC sin contraste. Finalmente, la sensibilidad se incrementa con la gravedad de la esteatosis.
Conclusiones
1. La prevalencia de la esteatosis hepática en nuestro estudio es elevada (72%), teniendo en cuenta que el 78% de los sujetos del estudio son obesos.
2. En nuestro estudio a pesar de tratarse de una enfermedad hepática de carácter crónico, no se ha apreciado elevación de los parámetros analíticos hepáticos, sobretodo GOT, GPT y GGT, que deberían estar aumentados en relación a la inflamación o gravedad de la enfermedad hepática. Habría que correlacionar estos datos con un diagnóstico de esteatohepatitis o fibrosis, con técnicas diagnósticas más específicas (elastografía, RMN/TAC o incluso biopsia.).
3. La gravedad de la esteatosis respecto al grado de obesidad medido a través del IMC y perímetro abdominal es estadísticamente significativa (p=0,001, p=0,017, respectivamente).
4. El 95% de los sujetos con hipertriglicericemia tienen esteatosis hepática en sus distintos grados (p= 0,015). Por otro lado, en nuestro análisis no se han encontrado resultados estadísticamente significativos entre colesterol total (p = 0,427), las fracciones de HDLc (p= 0,102) y LDLc (p= 0,554), con la esteatosis hepática.
Todos los pacientes en tratamiento con metformina tienen esteatosis hepática, aunque cerca del 30% de ellos tienen esteatosis hepática moderada, siendo grave en los no tratados con metformina (p= 0,002), por lo que habría que destacar el efecto protector de ésta en los pacientes con esteatosis.
Referencias
1. Barba JR. Esteatosis hepática, esteatohepatitis y marcadores de lesión hepática. Rev. Mex. Patol. Clin. 2008; 55:216-232.
2. Bedogni G, Miglioli L, Masutti F, Tiribelli C, Marchesini G, Bellentani S. Prevalence of and risk factors for nonalcoholic fatty liver disease: The Dionysos Nutrition and Liver Study. Hepatology. 2005; 42:44-52.
3. Bellentani S, Saccoccio G, Masutti F, Crocè LS, Brandi G, Sasso F, et al. Prevalence of and risk factors for hepatic steatosis in Northern Italy. Ann Intern Med. 2000; 32:112-7.
4. Parés A, Tresserras R, Núñez I, Cerralbo M, Plana P, Pujol FJ, et al. Prevalencia y factores aso ciados a la presencia de esteatosis hepática en varones adultos aparentemente sanos. Med Clin (Barc). 2000; 114:561-5.
5. Lee JY, Kim KM, Lee SG, Yu E, Lim YS, Lee HC, et al. Prevalence and risk factors of non-alcoholic fatty liver disease in potential living liver donors in Korea: A review of 589 consecutive liver biopsies in a single center. J Hepatol. 2007; 47:239-44.
6. Marín E, Segura JM. Utilidad de la ultrasonografía en el diagnóstico de las enfermedades hepáticas difusas. Rev Esp Enferm Dig. 2011; 103:227-31.
7. García C. Enfermedad hepática grasa no alcohólica. En: Montoro MA, García JC, editores. Gastroenterología y hepatología. Problemas comunes en la práctica clínica. Madrid. Jarpyo editores. 2012; 56:815-24.
8. Ricote G, García C. Estado actual de la esteatohepatitis no alcohólica. Med Clin (Barc). 2003; 121:102-8.
9. Pan J, Fallon M. Gender and racial differences in nonalcoholic fatty liver disease. World J Hepatol. 2014; 6:274-83.
10. Terán A, Crespo J. Cribado de la enfermedad hepática por depósito de grasa: cómo y a quién. Gastroenterol Hepatol. 2011; 34:278-88.
11. Brunt EM, Kleiner DE, Wilson L.A, Belt P, Neuschwander-Tetri BA. NASH Clinical Research Network (CRN). Nonalcoholic fatty liver disease (NAFLD) activity score and the histopathologic diagnosis in NAFLD: distinct clinicopathologic meanings. Hepatology. 2011; 53:810-20.
12. Takahashi Y, Fukusato T. Histopathology of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis.World J Gastroenterol. 2014; 20:39-48
13. Stranges S, Dorn JM, Muti P, Freudenheim JL, Farinaro E, Russell M, et al. Body fat distribution, relative weight, and liver enzyme levels: a population-based study. Hepatology. 2004; 39:754–763.
14. Bugianesi E, Manzini P, D'Antico S, Vanni E, Longo F, Leone N, et al. Relative contribution of iron burden, HFE mutations, and insulin resistance to fibrosis in nonalcoholic fatty lier. Hepatology. 2004; 39: 179-87.
15. García G, Torres J. Manual de ecografía clínica. Hígado: SEMI; 2012;8: 51-61.
16. Díaz N, Acuña A. Principios físicos de la ecografía. Semergen. 2003; 29:75-97.
17. Martín A, Castellano G. Seguimiento ecográfico de los pacientes con hepatopatía crónica. Rev Esp Ecografía Dig. 2006; 8:1-10.
18. Ruales F, Barbano J, Gómez E. Infiltración grasa hepática difusa y su correlación con el índice de masa corporal, los triglicéridos y las transaminasas. Acta Gastroenterol Latinoam. 2012; 42:278-84.
19. Caballería L, Torán P, Auladell A, Pera G .Esteatosis hepática no alcohólica. Puesta al día. Aten Primaria. 2008; 40:419-24.
