ORIGINAL
Excreción urinaria de uratos en niños y adolescentes obesos aquejados de Síndrome Metabólico
Urine excretion of urates in obese children and adolescents affected by Metabolic Syndrome
Yeidys Rodríguez Peña1, Sergio Santana Porbén2, María del Rosario Liriano Ricabal3, José Reynaldo Salabarría González4, María del Carmen Valdés5 Alonso
1 Médico, Especialista de PrimerGrado en Medicina General Integral. Especialista de Primer Grado en Laboratorio Clínico. Servicio de Laboratorio Clínico. Cuba
2 Médico, Especialista de Segundo Grado en Bioquímica Clínica. Máster en Nutrición en Salud Pública. Profesor Asistente. Servicio de Laboratorio Clínico. Cuba
3 Médico, Especialista de Primer Grado en Laboratorio Clínico. Profesor Asistente. Cuba
4 Médico, Especialista de Segundo Grado en Laboratorio Clínico. Profesor Consultante. Servicio de Laboratorio Clínico. Cuba
5 Médico, Especialista de Segundo Grado en Endocrinología. Profesor Asistente. Servicio de Endocrinología. Cuba
* Autor para correspondencia.
|
|
Attribution-NonCommercial-ShareAlike 4.0 International License La revista no cobra tasas por el envío de trabajos, |
|
Resumen
Introducción. El Síndrome metabólico (SM) asociado a la obesidad pediátrica se puede presentar con trastornos del metabolismo de las bases nitrogenadas que se trasladan hacia una excreción urinaria aumentada de uratos.
Objetivos.Describir el comportamiento de la excreción urinaria de uratos en niños y adolescentes obesos diagnosticados con SM.
Diseño del estudio. Analítico, de corte transversal.
Serie de estudio. Cincuenta y dos niños y adolescentes obesos atendidos en la consulta ambulatoria del Servicio de Endocrinología del Hospital “Juan Manuel Márquez”.
Material y métodos. La presencia del SM en los niños y adolescentes estudiados (Varones: 52,0%; Edad promedio: 11,4± 3,9 años) se identificó de la concurrencia de la circunferencia abdominal (CA) aumentadamás 1 (o más) de cualquiera de los siguientes factores de riesgo (FR): hipertensión arterial, Diabetes mellitus, y dislipidemias. De todos los casos se obtuvo el índice uratos/creatinina (mg/mg) en muestras matutinas de orina. La excreción urinaria de uratos (mg.24 horas-1) se estimó del índice uratos/creatinina después de ajustado según el sexo y la talla. La uricosuria de 24 horas así estimada, y los estados de hiperuricosuria (uricosuria 24 horas > punto de corte para la edad), se distribuyeron según la presencia del SM.
Resultados. El 34,6% de los niños se presentó con una (o más) manifestaciones del SM. La frecuencia de hiperuricosuria para toda la serie fue del 55,8%. Los niños con SM presentaron valores mayores de uricosuria (∆ = +56,8 mg. 24 horas-1; p > 0,05)y una mayor frecuencia de hiperuricosuria (∆ = +25,2%; p > 0,05). La frecuencia de hiperuricemia fue solo del 3,8%.
Conclusiones. ElSM pudiera asociarse con una excreción aumentada de uratos.
Palabras clave
Obesidad; Síndrome Metabólico; Uricosuria de 24 horas; Hiperuricosuria; Índice Uratos/Creatinina
Abstract
Introduction. Disorders of the metabolism of nitrogen bases eventually translating into an increased urine excretionof urates might be present in the Metabolic Syndrome (MS) associated with obesity.
Objectives. To describe the behavior of urates urine excretion in obese children and adolescents diagnosed with MS.
Study design. Analytical, cross-sectional.
Study serie. Fifty-two obese children and adolescents assisted at the Outpatient Clinic of the Endocrinology Service, “Juan Manuel Márquez” Pediatric Teaching Hospital (Havana city, Cuba).
Material and method. Presence of MS in the studied children and adolescents (Boys: 52.0%; Average age: 11.4 ± 3.9 years) was established from the concurrence of augmented abdominal circumference (CA) plus 1 (or more) of any of the followingrisk factors (RF): blood hypertension, Diabetes mellitus, and dyslipidemias. Urates/creatinine (mg/mg) index in urine morning samples was obtained in all cases. Urates urine excretion (mg. 24 hours-1) was estimated from the calculated urates/creatinine index after adjusting for sex andheight. 24 hours uricosuria values thus estimated, and hyperuricosuria states (24 hours uricosuria > cutoff point for age), were distributedaccording with MS presence.
Results.Thirty-four-point-six percent of the children presented with one (or more) manifestations of MS. Frequency of hyperuricosuria for the entire serie was 55.8%. Children with MS exhibited higher uricosuria values (∆ = +56.8 mg. 24 hours-1; p > 0.05) and a greater frequencyof hyperuricosuria (∆ = +25.2%; p > 0.05). Frequency of hyperuricemia was just 3.8%.
Conclusions. MS might be associated with an increasedurates excretion.
Keywords
Metabolic Syndrome; 24 hours uricosuria; Hyperuricosuria; Urates/Creatinine index
Introducción
La obesidad se ha convertido en un grave problema de salud a nivel mundial. En la actualidad cerca de 1.600 millones de personas muestran exceso de peso.(1,2) La situación es particularmente dramática en las edades infanto-juveniles.(3,4) En los Estados Unidos, el 60% de la población exhibe un peso excesivo para cualquier estándar de salud.(5) En este país, uno de cada 5 niños o adolescentes es obeso.(6)
El resto del mundo no se encuentra en mejor posición. En Europa, las cifras de prevalencia de obesidad se encuentran entre un 15 – 30%.(7,8) En la América Latina, México, los países centroamericanos y caribeños, Venezuela, Colombia, y Brasil, por citar los más emblemáticos, muestran tasas excesivas de obesidad, aún más llamativas por el rápido incremento que se ha visto en las mismas en años recientes.(9,10) En Cuba se estima que hoy la tercera parte de la población adulta tiene un peso excesivo.(11) En los niños menores de 5 años esta cifra fue del 6,7% en el 2011.(11) En los adolescentes, la frecuencia de obesidad fue del 19%.(11)
La obesidad se ha reconocido como un importante factor de riesgo para el desarrollo de enfermedades crónicas no transmisibles como Diabetes Mellitus, Hipertensión Arterial y las Dislipidemias, entre otras. Estas distintas entidades serían las formas de expresión del denominado Síndrome Metabólico (SM): una construcción clínica para alertar del riesgo cardiovascular aumentado de estos pacientes.(12,13)
La hiperuricemia también es otro rasgo distintivo del SM.(14,15) En un niño/adolescente obeso la hiperuricemia puede dar lugar a la artritis gotosa y la nefritis gotosa. La primera de estas entidades puede causar deformidad permanente de las articulaciones con invalidez para el paciente,(16) mientras que la segunda conduciría a la pérdida de la función renal.(17)
Una concentración elevada de uratos en sangre debe ir seguida de una excreción urinaria aumentada de ácido úrico.(18) La cuantía de la uricosuria puede señalar la gravedad de la repercusión del exceso de peso y la obesidad sobre la función renal. Asimismo, las intervenciones farmacológicas y alimentarias en la hiperuricemia deben ir seguidas de la reducción de las cantidades excretadas en la orina. Sin embargo, no abundan los reportes sobre la frecuencia de hiperuricosuria en niños y adolescentes obesos con síndrome metabólico e hiperuricemia.
La excreción aumentada de uratos en la orina ha sido vista tradicionalmente como un marcador de la litiasis renal (LR), pero en este momento muchos investigadores han señalado el cambio ocurrido en el patrón epidemiológico de la LR debido a la urbanización de las sociedades, y con ello, la adopción de nuevos estilos de vida y alimentación.(19,20) Estos mismos cambios han empujado al alza de la obesidad y las enfermedades crónicas no metabólicas (ECNT). Se abre entonces la oportunidad de utilizar la uricosuria como un marcador de distrés metabólico en los sujetos en riesgo de exceso depeso en virtud de sus estilos de vida.
La determinación de la uricosuria de 24 horas conlleva la colección de la orina emitida durante un día de la vida de un sujeto. Son conocidas las dificultades para obtener una muestra representativa de orina de 24 horas.(21,22) También la indicación de estudios en colecciones de orina de 24 horas se destaca por una baja tasa de satisfacción.(23,24)
En investigaciones previas se han expuesto ecuaciones predictivas para la determinación de la excreción urinaria de sustancias de interés clínico como las proteínas totales, la albúmina, el calcio, los fosfatos, los uratos, la urea y el nitrógeno ureico.(25) En distintos escenarios diagnósticos se ha constatado una correlación superior al 80%,(25) lo que implicaría que los resultados obtenidos con estas ecuaciones predictivas pudieran sustituir efectivamente los logrados con las colecciones de 24 horas.
Teniendo en cuenta que la infancia y laadolescencia representan una ventana de oportunidad para la prevención de la aparición de las ECNT (y sus complicaciones) en la adultez, se hace cada vez más necesaria la detección temprana de las primeras anomalías en el metabolismo corporal de los sujetos con peso excesivo. Si este fuera el caso, la presencia de hiperuricosuria en un niño/adolescente obeso llamaría la atención sobre la presencia de distrés metabólico que se intervendría tempranamente. En base a lo dicho, se ha completado esta investigación que estuvo orientada a establecer la magnitud y la frecuencia de los valores aumentados de la excreción urinaria de uratos en el Síndrome Metabólico asociado a la obesidad infanto-juvenil.
Material y Método
Diseño de la investigación: Transversal, analítico.
Locación de estudio: Hospital Pediátrico Docente “Juan Manuel Márquez”. La Habana.
Serie de estudio: Fueron elegibles para participar en este estudio los niños y adolescentes obesos de ambos sexos atendidos en la Consulta ambulatoria del Servicio de Endocrinología del Hospital Pediátrico Docente “Juan Manuel Márquez” entre Julio del 2017 – Septiembre del 2018 (ambos meses inclusive) cuyos padres/familiares consintieron en ello, y que completaron los procedimientos del estudio. Se excluyeron los niños y adolescentes con antecedentes de LR.
La edad se estratificó como se muestra: Preescolares: Entre 1 – 4 años; Escolares: Entre 5 – 12 años; y Adolescentes: Entre 13 – 19 años.
Mediciones antropométricas: De cada niño/adolescente participante se obtuvieron la talla (centímetros), el peso corporal (kilogramos), y la circunferencia de la cintura (centímetros) con una exactitud de una décima, según los protocolos avanzados internacionalmente, y empleando instrumentos de medición debidamente calibrados.(26-29)
El Índice de Masa Corporal (IMC) del niño/adolescente estudiado se calculó con los valores correspondientes de la talla y el peso corporal.(30) Los valores calculados del IMC se estratificaron ulteriormente según se muestra a continuación(31) Peso disminuido para la Talla: IMC < percentil 10; Peso preservado para la Talla: IMC comprendido dentro de los percentiles 10 – 90, y Peso excesivo para la Talla: IMC > percentil 90; respectivamente. La obesidad se estableció frente a valores del IMC > percentil 97 de los estándares para el sexo y la edad.(30)
La circunferencia de la cintura (CC) se dicotomizó como sigue(32) Obesidad abdominal ausente: CC < percentil 90 vs. Obesidad abdominal presente: CC > percentil 90. Adicionalmente, el índice cintura-talla (ICT) se calculó de los valores corrientes de la talla y la CC del niño/adolescente estudiado, y se dicotomizó como se muestra(33) Obesidad abdominal ausente: ICT ≤ 0,5 vs. Obesidad abdominal presente: ICT > 0,5.
Medición de la tensión arterial: La tensión arterial (TA) se midió en cada uno de los niños/adolescentes mediante los procedimientos operacionales recomendados globalmente.(34)
Los valores sistólicos (mm Hg) y diastólicos (mm Hg) de la TA se contrastaron con los estándares internacionales de referencia, como sigue: (35,36) Valores preservados: TAS y/o TAD ≤ percentil 90 para el sexo, la edad, y la talla vs. Valores elevados: TAS y/o TAD > percentil 95 + 5 mm Hg.
Determinaciones bioquímicas: De cada niño/adolescente estudiado se obtuvieron los valores séricos basales de glucosa (mmol.L-1), colesterol total (mmol.L-1), triglicéridos (mmol.L-1), y uratos (mmol.L-1). Lasdeterminaciones bioquímicas se completaron en una muestra de sangre venosa retirada del niño/adolescente tras una noche de ayunas, según los procedimientos vigentes en el Servicio de Laboratorio Clínico del Hospital Pediátrico “Juan Manuel Márquez”. Las muestras de sangre retiradas fueron depositadas en tubos sin anticoagulante y centrifugadas después de retraído el coágulo. El suero resultante se conservó a –20oC hasta su utilización.
Los valores séricos obtenidos se dicotomizaron según los puntos de corte establecidos en el Servicio hospitalario de Laboratorio Clínico: Hiperglicemia en ayunas: > 6,5 mmol.L-1; Hipercolesterolemia: > 5,2 mmol.L-1; Hipertrigliceridemia: > 1,9 mmol.L-1; e Hiperuricemia: > 340 µmol.L-1; respectivamente.
Diagnóstico del Síndrome metabólico: El SM se diagnosticó en aquel niño/adolescente que se presentócon Obesidad corporal (IMC ≥ percentil 97 de los estándares nacionales) y Obesidad abdominal (Índice Cintura-Talla > 0,5) en los que, además, concurrieron el diagnóstico y tratamiento de Diabetes Mellitus y/oel diagnóstico y tratamiento de hipertensión arterial y/o el tratamiento instalado por una dislipidemia diagnosticada.(37)
Excreción urinaria de uratos: La uricosuria de 24 horas (mg.24 horas-1) se estimó del índice Uratos/Creatinina (IUC: mg. mg-1) construido para una muestra matutina de orina tal y como se ha descrito anteriormente, y después de ajustado según el sexo, la edad, la talla y la superficie corporal del niño/adolescente estudiado.(25)
La uricosuria de 24 horas se estratificó ulteriormente de la forma siguiente según la edad del niño/adolescente(38,39) Preescolares: Entre 1 – 4 años: Valores preservados: ≤ 300 mg. 24 horas-1 vs. Valores elevados: > 300 mg. 24 horas-1; Escolares: Entre 5 – 12 años: Valores preservados: ≤ 450 mg. 24 horas-1 vs. Valores elevados: > 450 mg. 24 horas-1; y Adolescentes: Entre 13 – 19 años: Valores preservados: ≤ 600 mg. 24 horas-1 vs. Valores elevados: > 600 mg. 24 horas-1; respectivamente.
Procesamiento de datos y análisis estadístico-matemático de los resultados: Los datos clínicos, antropométricos y bioquímicos de los niños/adolescentes estudiados se anotaron en los formularios previstos por el diseño experimental de la investigación, y almacenados en un contenedor digital construido con EXCEL versión 7,0 para OFFICE de WINDOWS (Microsoft, Redmon, Virginia, Estados Unidos), como paso previo al procesamiento de datos y el análisis estadístico-matemático de los resultados.
Según el tipo de la variable, los datos se redujeron hasta estadígrafos de locación (media), dispersión (desviación estándar) y agregación (frecuencias absolutas / relativas, porcentajes).La frecuencia de SM se estimó como el número de niños/adolescentes con una, dos o más manifestaciones del mismo, respecto del tamaño de la serie de estudio. La frecuencia de hiperuricosuria en 24 horas se obtuvo como el número de niños/adolescentes con una excreción urinaria de uratos en 24 horas mayor que el punto de corte establecido para la edad.
La frecuencia estimada de hiperuricosuria se ajustó según la presencia (o no) del SM. Se analizó si la hiperuricosuria dependía de la presencia de SM mediante test de independencia basada en la distribución ji-cuadrado.(40) En todas las pruebas estadísticas se utilizó un nivel de significación menor del 5% para denotar la asociación de interés como significativa.(40)
Consideraciones éticas: Para la realización de la presente investigación se obtuvo el consentimiento informado de los padres/familiares del niño/adolescente. En el transcurso de la entrevista, se les informó de los propósitos y objetivos de la investigación, la naturaleza de los procedimientos experimentales, y el tratamiento de los datos recabados del niño/adolescente. Se aseguró la confidencialidad, la discreción y el anonimato en el tratamiento estadístico de los resultados. Se aseguró también la observancia del principio de libre participación del niño/adolescente en el estudio, así como la negación a participar en el mismo, y el derecho a abandonarlo en cualquier momento, sin que ello mermara la calidad de la asistencia médica que se le brinda al niño/adolescente en la institución.
La presente investigación se realizó después de la aprobación extendida por el Comité de Ética y el Consejo científico del Hospital Pediátrico Docente “Juan Manuel Márquez”.
Resultados
Participaron en el presente estudio 52 niños y adolescentes,
los que representaron el 7,2% delos atendidos por obesidad en la Consulta
ambulatoria del Servicio hospitalario de Endocrinología durante la ventana de
observación de la investigación.
La Tabla 1 muestra las características demográficas y clínicas de la serie de
estudio. Prevalecieron los varones sobre las hembras. Los escolares fueron
mayoría. La edad promedio fue de 11,4 ± 3,9 años. La HTA fue la condición
clínica más frecuente entre los niños y adolescentes estudiados. La
hiperuricemia solo afectó al 3,8% de ellos.
Tabla 1. Características demográficas y clínicas de la serie de estudio. Se presentan el número y [entre corchetes] el porcentaje de niños y adolescentes que ocupaban el estrato definido de la correspondiente categoría. En instancias selectas, los resultados de la característica se expresan como la media ± desviación estándar de las observaciones.
|
Característica |
Hallazgos |
|
Sexo |
Varones: 30 [58,0] |
|
|
Hembras: 22 [42,0] |
|
Edad, años, promedio ± desviación estándar |
11,4± 3,9 |
|
Edad, años |
Preescolares: 1 – 4 años: 3 [ 5,8] |
|
|
Escolares: 5 – 12 años: 29 [55,8] |
|
|
Adolescentes: 20 [38,4] |
|
Hipertensión arterial |
11 [21,1] |
|
Trastornos de la utilización periférica de los glúcidos/Hiperglicemia a las 2 horas |
4 [ 7,7] |
|
Dislipidemias |
3 [ 5,8] |
|
Hiperuricemia |
2 [ 3,8] |
|
Síndrome metabólico |
Presente: 18 [34,6] |
|
|
Ausente: 34 [65,4] |
|
Fuente: Registros del estudio. |
|
|
Tamaño de la serie de estudio: 52. |
|
El 7,7% de los niños/adolescentes estudiados mostró hiperglicemias a las 2 horas del test de sobrecarga con Dextrosa. Sin embargo, no se reportaron diabéticos en la serie de estudio, y ninguno de los niños/adolescentes estudiados era tratado farmacológicamente por Diabetes.
De los niños y adolescentes obesos estudiados en este trabajo, 18 fueron diagnosticados con SM, lo que representa el 34,6% delaseriede estudio. Según el grupo etario, la distribución del SM fue como sigue: Preescolares: 0,0%; Escolares: 24,1%; y Adolescentes: 55,0%; respectivamente.
La Tabla 2 muestra los valores antropométricos de la serie de estudio. Los valores de la talla y el peso corporal se incrementaron con la edad del niño: expresión de las tasas propias de crecimiento y desarrollo. De forma similar, el IMC aumentó con la edad. Un IMC aumentado en cada edad pudiera reflejar una mayor contribución de la grasa corporal al peso del niño.
Tabla 2. Valores promedio de las características antropométricas de los pacientes estudiados. Los resultados se expresan como la media ± desviación estándar de las observaciones.
|
Característica |
Edad |
Todos |
||
|
|
1 – 4 años |
5 – 12 años |
13 – 19 años |
|
|
Número de casos |
3 |
29 |
20 |
52 |
|
Talla, centímetros |
113,0 ± 9,5 |
144,6 ± 11,6 |
169,8 ± 10,8¶ |
152,5 ± 19,1 |
|
Peso corporal, kilogramos |
34,0 ± 7,9 |
58,2 ± 13,8 |
91,9 ± 12,6¶ |
69,8 ± 22,6 |
|
IMC, Kg.m-2 |
26,5 ± 4,4 |
27,6 ± 4,1 |
31,9 ± 4,3¶ |
29,2 ± 4,7 |
|
SC, m2 |
1,0 ± 0,1 |
1,5 ± 0,2 |
2,0 ± 0,2¶ |
1,7 ± 0,4 |
|
Circunferencia de la cintura, centímetros |
73,0 ± 5,8 |
89,3 ± 10,5 |
102,7 ± 10,4¶ |
93,5 ± 13,0 |
|
Índice Cintura/Talla |
0,6 ± 0,0 |
0,6 ± 0,1 |
0,6 ± 0,1 |
0,6 ± 0,1 |
|
¶ p < 0,05. Test de Kruskal-Wallis para los rangos múltiples. |
||||
|
Fuente: Registros del estudio. |
||||
|
Tamaño de la serie de estudio: 52. |
||||
A medida que la edad del niño fue mayor, asimismo fue superior la SC del mismo. La superficie corporal es un indicador de las dimensiones físicas del sujeto, e integra las influencias de la talla y el peso corporal. El conocimiento de la superficie corporal del niño y el adolescente es primordial en este estudio para la estimación de la uricosuria de 24 horas.
El valor promedio de la CC fue de 93,5 ± 13,0 cm. La CC fue superior a medida que se incrementó la edad del niño. Los adolescentes mostraron los valores mayores de la circunferencia de la cintura. La CC es un indicador antropométrico de la grasa visceral y abdominal: la locación topográfica de la grasa corporal vinculada con la aparición y desarrollo de la resistencia a la insulina y el SM. Por su parte, el ICT promedio fue de 0,6 ± 0,1: superior a un punto de corte propuesto universalmente de 0,5. El ICT fue independiente de la edad del niño (p > 0,05; datos no mostrados).
La Tabla 3 muestra los valores de las determinaciones bioquímicas hechas en los pacientes estudiados. La creatinina sérica promedio fue de 62,7 ± 13,1 mmol.L-1. Ello significó un filtrado glomerular estimado (eFG) de 110,2 ± 17,1 mL.minuto-1. Si bien los valores de creatinina sérica fueron (al menos) numéricamente dependientes de la edad, este comportamiento no tuvo repercusión clínica por cuanto los valores promedio se correspondieron con los esperados para la edad del niño.(41) Además, el eFG fue constante para cualquier edad (p > 0,05; test de Kruskal-Wallis para R ≥ 3 rangos independientes).
Tabla 3. Determinaciones bioquímicas completadas en la serie de estudio. Los resultados se expresan como la media ± desviación estándar de las observaciones.
|
Característica |
Edad |
Todos |
||
|
|
1 – 4 años |
5 – 12 años |
13 – 19 años |
|
|
Número de casos |
3 |
29 |
20 |
52 |
|
Creatinina, suero, mmol.L-1 |
51,9 ± 8,4 |
56,5 ± 8,8 |
73,3 ± 11,9 |
62,7 ± 13,1 |
|
eFG, mL.minuto-1 |
98,4 ± 19,3 |
115,5 ± 17,8 |
104,4 ± 13,3 |
110,2 ± 17,1 |
|
Uratos, suero, mmol.L-1 |
225,3 ± 91,3 |
312,0 ± 84,0 |
342,8 ± 66,6 |
319,0 ± 81,3 |
|
Creatinina, orina, mmol.L-1 |
8’025,7 ± 3’603,3 |
9’684,2 ± 4´757,1 |
12’399,7 ± 7’592,4 |
10’632,9 ± 6’045,2 |
|
Creatinina, orina, mg.L-1 |
906,9 ± 407,2 |
1’094,3 ± 537,6 |
1’401,2 ± 857,9 |
1’201,0 ± 683,1 |
|
Uratos, orina, mmol.L-1 |
3’183,0 ± 1’061,8 |
3’405,2 ± 1’463,9 |
3’745,5 ± 2’073,0 |
3’523,3 ± 1’689,8 |
|
Uratos, orina, mg.L-1 |
534,7 ± 178,4 |
572,1 ± 245,9 |
629,2 ± 348,3 |
591,9 ± 283,9 |
|
Índice Uratos/Creatinina, mg/mg |
0,6 ± 0,1 |
0,6 ± 0,3 |
0,5 ± 0,2 |
0,6 ± 0,3 |
|
Uricosuria, mg.24 horas-1 |
291,8 ± 80,5 |
521,9 ± 216,0 |
744,3 ± 367,3 |
594,2 ± 303,5 |
|
Fuente: Registros del estudio. |
||||
|
Tamaño de la serie de estudio: 52. |
||||
Las concentraciones séricas promedio de uratos fueron de 319,0 ± 81,3 mmol.L-1 para todas las edades. De forma similar a lo observado con la creatinina sérica, los valores de los uratos se incrementaron (numéricamente) con edades mayores del niño, pero ello no tuvo repercusión clínica: los valores promedio de uratos se encontraron siempre dentro de los intervalos de referencia para la edad. Se ha de señalar que solo 2 de los pacientes (el 3,8% de la serie) mostraron valores séricos elevados de los uratos a la inclusión en el estudio.
Sea que se exprese como unidades de sustancia o unidades de masa, el comportamiento de la creatinina urinaria fue dependiente de la edad, reflejando los cambios que ocurren en la composición corporal del niño a medida que transita de una etapa de crecimiento y desarrollo a otra.(42) No obstante, el único interés que tiene la determinación de la creatinina urinaria en este estudio es el de servir como el denominador de las ecuaciones predictivas empleadas en la estimación de la uricosuria de 24 horas.(25)
El comportamiento de los uratos urinarios fue modestamente dependiente de la edad del niño, pero ello no tuvo repercusión clínica. Por otro lado, el interés del estudio radicó en las cantidades de este analito que se excretarían en una colección de 24 horas de orina teniendo en cuenta el Índice Uratos-Creatinina.
El índice Uratos/Creatinina promedio fue de 0,6 ± 0,3; e independiente de la edad del niño (p > 0,05; test de Kruskal-Wallis para R ≥ 3 rangos independientes). Se debe señalar que 8 pacientes (15,0% de la serie de estudio) mostraron un índice Uratos/Creatinina > 0,8: punto de corte elegido en el Servicio de Laboratorio Clínico donde se completó el presente trabajo.(38)
En contraste con los hallazgos expuestos anteriormente, la uricosuria de 24 horas fue dependiente (si bien numéricamente) de la edad del niño (p > 0,05; test de Kruskal-Wallis para R ≥ 3 rangos independientes). Los niños preescolares mostraron los valores más bajos de uricosuria de 24 horas, en contraposición con los adolescentes, que exhibieron los valores más elevados. La diferencia acumulada de grupo etario-a-grupo etario fue de 452,2 mg.24 horas-1. La plausibilidad de los datos y la variabilidad biológica asociada impidieron que la asociación entre la uricosuria de 24 horas y la edad alcanzara significación estadística. La uricosuria de 24 horas fue también independiente del sexo del niño/adolescente estudiado: Varones: 662,5 ± 357.0 mg.24 horas-1 vs. Hembras: 501,0 ± 186,6 mg.24 horas-1 (D = +161,5 mg.24 horas-1; p > 0,05; test t de Student para muestras independientes).
La Figura 1 muestra el comportamiento de la uricosuria de 24 horas en los obesos estudiados, de acuerdo con la presencia del SM. La presencia del SM se asoció con valores (numéricamente) mayores de la uricosuria de 24 horas: SM Ausente: 574,5 ± 349,9 mg.24 horas-1 vs. SM Presente: 631,3 ± 200,2 mg.24 horas-1 (D = + 56,8 mg.24 horas-1; p > 0,05; test t de Student para muestras independientes).
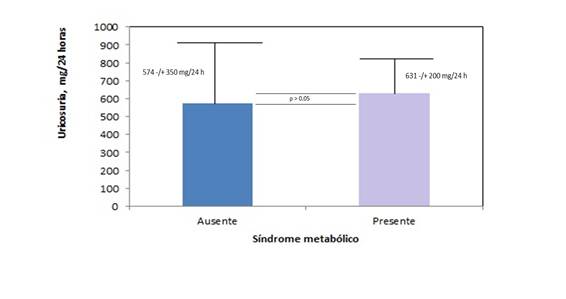 Fuente:
Registros del estudio.
Fuente:
Registros del estudio.
Tamaño de la serie de estudio: 52.
Figura 1. Asociación entre la uricosuria de 24 horas y la presencia del Síndrome metabólico en la serie de estudio.
El 55,8% de los niños y adolescentes examinados presentóhiperuricosuria de 24 horas. Por grupo etario, la proporción de valores de hiperuricosuria de 24 horas fue como sigue: Preescolares: 33,3%; Escolares: 55,2%; y Adolescentes: 60,0%; respectivamente. Si bien se observó una tendencia hacia frecuencias mayores de hiperuricosuria de 24 horas con cada grupo etario, ésta no alcanzó significación estadística. La hiperuricosuria de 24 horas fue también independiente del sexo del niño/adolescente: Varones: 56,7% vs, Hembras: 54,5% (D = +2,2%; p > 0,05; test de homogeneidad basado en la distribución ji-cuadrado).
Finalmente, la Figura 2 muestran el comportamiento de la hiperuricosuria de 24 horas en los pacientes estudiados según la presencia o no de SM. La frecuencia para-toda-la-serie-de-estudio de la hiperuricosuria de 24 horas fue del 55,8%. La frecuencia de hiperuricosuria se distribuyó de forma diferente según la presencia del SM: SM Ausente: 47,0% vs. SM Presente: 72,2% (D = 25,2%; c2= 2,57; p> 0,05; test de homogeneidad basado en la distribución ji-cuadrado). La frecuencia de hiperuricosuria de 24 horas en los niños y adolescentes con SM fue 1,5 veces mayor que la observada en aquellos no diagnosticados con esta entidad, pero este hallazgo tampoco fue significativo (OR = 2,92; IC 95% = 0,85 – 10,02; p > 0,05).
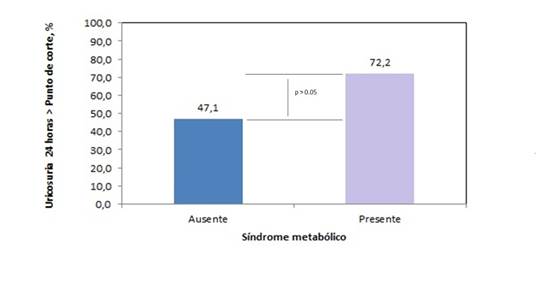
Fuente: Registros del estudio.
Tamaño de la serie de estudio: 52.
Figura 2. Asociación entre la hiperuricosuria de 24 horas y la presencia del Síndrome metabólico.
Discusión
El interés primario del trabajo reseñado en esta exposición fue evaluar la asociación entre la obesidad, el SM, y la hiperuricosuria. Por ello, la serie de estudio fue construida con niños y adolescentes obesos que eran atendidos ambulatoriamente por el exceso de peso, en primer lugar, y la aparición de manifestaciones en ellos del SM, después. Existe un interés actualmente por evaluar si el peso corporal, y por extensión el exceso de peso (del cual la obesidad es la manifestación más extrema), puede influir sobre la excreción urinaria de sustancias selectas,(43,44) sin que hasta ahora se haya podido demostrar una relación significativa.
Un trabajo previo menciona una frecuencia del SM del 33,3% en niños y adolescentes obesos atendidos por HTA en la consulta ambulatoria del Servicio hospitalario de Nefrología de la institución.(45) Esta cifra se alinea con los resultados mostrados en esta investigación, y toda una línea de indagación epidemiológica, que alertan continuamente sobre la expansión de los trastornos metabólicos secundarios / asociados a la obesidad infantil en todo el mundo.(3-5)
La prevalencia de hiperuricosuria en una población infantil general, no restringida, es poco conocida, dada la escasa literatura existente sobre los trastornos de la excreción urinaria de uratos en estas edades. En la presente investigación, la hiperuricosuria afectó a poco más de la mitad de la muestra. De forma interesante, La Manna et al. (2001) encontraron una frecuencia de hiperuricosuria del 59,8% en niños que se presentaron con manifestaciones de LR.(46) El reconocimiento de la hiperuricosuria ha estado relegado por la mayor importancia que siempre se le ha brindado a la hipercalciuria como causa de la LR,(47,48) lo cual es llamativo cuando el cuadro epidemiológico de la LR está cambiando ante el avance de los cambios en los estilos de vida y alimentación y de la obesidad, desde un panorama que era dominado por los cálculos de oxalatos y calcio, hacia otro en el que comienzan a prevalecer los cristales de uratos.(49,50)
El presente trabajo ha encontrado cifras superiores de uricosuria de 24 horas, junto con una mayor proporción de hiperuricosuria, entre los niños obesos con 1, 2 ó más manifestaciones del SM, aun cuando estos hallazgos no alcanzaron significación estadística. Aun así, los resultados sostenidos en una misma dirección son llamativos, y ello obliga a la discusión y contextualización de los mismos.
El ácido úrico que se excreta en la orina puede tener dos orígenes. El primero estará dado por la cuantía de los ingresos en la dieta de purinas y pirimidinas como las aportadas con las carnes rojas y los derivados cárnicos, principalmente). La segunda fuente de ácido úrico que aparece en la orina es la debida a la síntesis, reutilización y catabolismo de las bases nitrogenadas durante el ciclo celular y la síntesis de ácidos nucleicos.(51,52)
Lo anteriormente expuesto nos lleva a considerar los patrones dietéticos en los niños obesos. Se han descrito dietas con alto contenido energético y poco valor nutricional en los niños obesos. Estos hábitos dietéticos se organizan alrededor de bebidas azucaradas, alimentos elaborados con glúcidos y cereales refinados, y grasas saturadas. También se han descrito ingresos importantes de carnes rojas y sucedáneos industriales de las mismas (como los embutidos), en estos niños.(51,52) Todo lo anterior lleva a concluir que la hiperuricosuria vista en este estudio podría ser el resultado en gran parte de los estilos dietéticos presentes en los niños estudiados.
Hoy se le ha prestado importancia a la influencia del consumo de fructosa en la aparición de estados alterados del metabolismo del ácido úrico, en virtud del uso cada vez mayor de jarabes edulcorantes ricos en fructosa como alternativos al uso de azúcares en bebidas, dulces y comidas. El consumo cada vez mayor de fructosa como edulcorante puede conducir a una mayor síntesis endógena de purinas y pirimidinas y con ello la producción aumentada de ácido úrico.(53,54) Pero aun así faltarían otros factores que pudieran explicar el comportamiento de la hiperuricosuria en la presente serie de estudio.
Una mayor excreción de uratos en la orina podría deberse al cambio en el pH de la orina. Un pH ácido favorecería una mayor presencia de ácido úrico en la colección de orina. Precisamente, los hábitos dietéticos que se presentan en los niños obesos pueden trasladarse a una orina ácida, y con ello, a una uricosuria aumentada. Luego, la uricosuria observada en los niños obesos puede ser el resultado de la cuantía de las purinas de origen dietético y/o una producción aumentada de ellas dada por disparadores externos como el consumo incrementado de glucosa y orinas cada vez más ácidas.(48,51-52,55) Estas hipótesis podrían ser sustanciadas en trabajos ulteriores.
Se hubiera anticipado que la frecuencia de hiperuricosuria en los niños obesos no se alteraría si al exceso de peso ya presente se le sumaran las manifestaciones reconocidas como integrantes del SM, esto es: la hiperglicemia, la hiperlipidemia, la hipertensión arterial, y la Diabetes mellitus. Este no fue el caso en el presente estudio, y la presencia del SM hizo que la proporción de hiperuricosuria se incrementara hasta alcanzar casi las tres cuartas partes de aquellos con manifestaciones del SM. Si bien la asociación no es significativa, desde el punto de vista estadístico, esta tendencia al aumento podría tener significación clínica importante, pues los pacientes obesos con SM tendrán más probabilidades de presentar una hiperuricosuria.
Finalmente, otro elemento que pudiera influir en la aparición de hiperuricosuria en niños obesos complicados metabólicamente sería la desregulación de los mecanismos de reabsorción tubular del ácido úrico bajo la presencia de inflamación y resistencia a la insulina. Se han descrito extensamente los sistemas tubulares de reabsorción del ácido úrico a fin de mantener las concentraciones séricas dentro del rango de la homeostasis.(56,57) Es probable que las complicaciones metabólicas que desencadenan la obesidad alteren estos sistemas,(58) y traiga consigo un aumento de la excreción renal de ácido úrico. En un medio ácido, estas cantidades aumentadas de ácido úrico podrían precipitar, e iniciar así una enfermedad calculosa. Hoy muchos llaman la atención de que los niños adolescentes obesos pueden estar en riesgo incrementado de LR en razón de los trastornos ambientales, dietéticos, metabólicos, y renales aquí reseñados.(59)
Conclusiones
La hiperuricosuria se presentó en poco más de la mitad de niños y adolescentes obesos atendidos en una Consulta ambulatoria del servicio de Endocrinología de un hospital pediátrico. La hiperuricosuria fue independiente del sexo y la edad de los niños estudiados. Los niños y adolescentes obesos con manifestaciones del SM mostraron cifras mayores de uricosuria de 24 horas, y una mayor proporción de hiperuricosuria, si bien estas diferencias solo fueron numéricas.
Futuras extensiones
En virtud de la dependencia anotada en varios textos entre la cuantía de la excreción urinaria de uratos y los hábitos dietéticos del niño/adolescente, futuras investigaciones deberían incorporar una encuesta dietética para evaluar la presencia en la dieta regular de los mismos de aquellos productos tenidos como fuente importante de uratos y sus precursores. Estas encuestas dietéticas deberían incluir también el consumo de bebidas azucaradas industriales.
Limitaciones del estudio
La determinación de las cantidades excretadas de ácido úrico en cada uno de los niños examinados se hizo de acuerdo con un modelo determinístico basado en el índice de excreción de la sustancia corregido para el sexo, edad y la talla del niño, y expresado éste como una fracción de las cantidades esperadas de creatinina en la orina en un día de 24 horas.(25) Este modelo es válido en niños con un estado nutricional adecuado para su sexo y edad. En tales condiciones, la ecuación predictiva basada en este modelo determinístico asegura una exactitud analítica mayor del 80% y una concordancia diagnóstica mayor del 90%. Sin embargo, estas ecuaciones se aplicaron a niños obesos, que por definición de su condición de salud, tienen un peso excesivo para la talla. También en los niños obesos se ha descrito importante infiltración grasa del músculo esquelético.(60) Todo ello pudiera afectar las bases teóricas del modelo determinístico empleado en la excreción urinaria de urato de 24 horas. No obstante, éste no parece ser el caso por cuanto los resultados fueron estadísticamente similares utilizando otra estrategia de predicción, ésta basada en la densidad de la orina,(61) lo cual indica la robustez del modelo determinístico construido. Aun así, próximos trabajos validarán este enfoque.
Addendum
Una calculadora que ofrece los cálculos descritos en este trabajo está disponible online en: http://nefrocalc.sarhugo.com. También se ofrece al lector interesado una aplicación para dispositivos móviles: http://nefrotoolbox.sarhugo.com/.
Referencias
1. Arroyo-Johnson C, Mincey KD. Obesity epidemiology worldwide. GastroenterolClin 2016;45:571-9.
- Swinburn BA, Sacks G, Hall KD, McPherson K, Finegood DT, Moodie ML,Gortmaker SL. The global obesity pandemic: Shaped by global drivers and local environments. Lancet 2011;378(9793):804-14.
- Orsi CM, Hale DE, Lynch JL. Pediatric obesity epidemiology. Curr Op Endocrinol DiabObes 2011;18:14-22.
4. Lo JC, Maring B, Chandra M, Daniels SR, Sinaiko A, Daley MF; et al. Prevalence of obesity and extreme obesity in children aged 3–5years. Pediatr Obes 2014;9:167-75.
5. Hruby A, Hu FB. The epidemiology of obesity: A big picture. Pharmacoeconomics 2015;33:673-89.
6. Cunningham SA, Kramer MR, Narayan KV. Incidence of childhood obesity in the United States. N EnglJMed 2014;370:403-11.
7. Berghöfer A, Pischon T, Reinhold T, Apovian CM, Sharma AM, Willich SN. Obesity prevalence from a European perspective: A systematic review. BMC Public Health2008; 8(1):200-200. Disponible en: https://bmcpublichealth.biomedcentral.com/articles/10.1186/1471-2458-8-200. Fecha de última visita: 6 de Mayo del 2019.
8. Cattaneo A, Monasta L, Stamatakis E, Lioret S, Castetbon K, Frenken F; et al. Overweight and obesity in infants and pre‐school children in the European Union: A review of existing data. Obes Rev 2010;11:389-98.
9. Filozof C, Gonzalez C, Sereday M, Mazza C, Braguinsky J. Obesity prevalence and trends in Latin‐American countries. Obes Rev 2001;2:99-106.
10. Rivera JÁ, de Cossío TG, Pedraza LS, Aburto TC, Sánchez TG, Martorell R. Childhood and adolescent overweight and obesity in Latin America: A systematic review. The Lancet Diab Endocrinol 2014;2:321-32.
11. Acosta Jiménez SM, Rodríguez Suárez A, Díaz Sánchez ME. La obesidad en Cuba. Una mirada a su evolución en diferentes grupos poblacionales. RCAN Rev Cubana Aliment Nutr 2013;23:297-308.
12. Engin A. The definition and prevalence of obesity and Metabolic syndrome. Adv Exp Med Biol 2017;960:1-17. Disponible en: http://doi:10.1007/978-3-319-48382-5_1. Fecha de última visita: 9 de Mayo del 2019.
13. Haffner S, Taegtmeyer H. Epidemic obesity and the metabolic syndrome. Circulation 2003;108:1541-5.
14. Puig JG, Martinez MA. Hyperuricemia, gout and the metabolic syndrome. Curr OpRheumatol 2008;20:187-91.
15. Choi HK, Ford ES. Prevalence of the metabolic syndrome in individuals with hyperuricemia. Am JMed 2007;120:442-7.
16. Yamanaka H. Gout and hyperuricemia in young people. Curr OpRheumatol 2011;23:156-60.
17. Nakagawa T, Cirillo P, Sato W, Gersch M, Sautin Y, Roncal C; et al. The conundrum of hyperuricemia, metabolic syndrome, and renal disease. Intern Emerg Med 2008;3:313-8.
18. Abate N, Chandalia M, Cabo-Chan AV, Moe OW, Sakhaee K. The metabolic syndrome and uric acid nephrolithiasis: Novel features of renal manifestation of insulin resistance. Kidney International 2004;65:386-92.
19. Chou YH, Su CM, Li CC, Liu CC, Liu ME, Wu WJ, Juan YS. Difference in urinary stone components between obese and non-obese patients. Urol Res 2011;39:283-7.
20. Li WM, Chou YH, Li CC, Liu CC, Huang SP, Wu WJ; et al. Association of body mass index and urine pH in patients with urolithiasis. Urol Res 2009;37:193-193. Disponible en: https://doi.org/10.1007/s00240-009-0194-4. Fecha de última visita: 10 de Mayo del 2019.
21. Caleffi A, Manoni F, Alessio MG, Ottomano C, Lippi G. Quality in extra-analytical phases of urinanalysis. Biochem Med [Zagreb] 2010;20:179-83.
22. Tormo C, Lumbreras B, Santos A, Romero L, Conca M. Strategies for improving the collection of 24-hour urine for analysis in the clinical laboratory: redesigned instructions, opinion surveys, and application of reference change value to micturition. Arch Pathol Lab Med 2009;133:1954-60.
23. Turner WJ, Merlis S. Vicissitudes in research: The twenty‐four hour urine collection. Clin PharmacolTher 1971;12(2 Part1):163-6.
24. Miler M, Simundić AM. Low level of adherence to instructions for 24-hour urine collection among hospital outpatients. Biochem Med [Zagreb] 2013;23:316-20.
25. Salabarría González JR, Santana Porbén S, Liriano Ricabal MR. Excreción urinaria de una sustancia predicha del índice sustancia-creatinina. Rev LatinoamPatolClínMedLab 2015;62:119-26. Disponible en: https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=58177. Fecha de última visita: 10 de Mayo del 2019.
26. Onis M; for the WHO Multicentre Growth Reference Study Group. WHO Child Growth Standards based on length/height, weight and age. ActaPaediatr 2006;95:76-85.
27. Onis MD, Onyango AW, Borghi E, Siyam A, Nishida C, Siekmann J. Development of a WHO growth reference for school-aged children and adolescents. Bull WorldHealthOrg 2007;85:660-7.
28. Callaway CW, Chumlea WC, Bouchard C, Himes JH, Lohman TG, Martin AD;et al.Circumferences. En: Anthropometric standardization reference manual [Editores: Lohman TG, Roche AF, Martorell R].Human KineticsBooks. Champaign [Illinois]: 1991. Pp. 44-55.
29. Berdasco A, Esquivel M, Jiménez JM, Mesa D, Posada E, Romero JM; et al. Segundo estudio nacional de crecimiento y desarrollo, Cuba 1982: valores de peso y talla para la edad. Rev Cubana Pediatr 1991;63:4-21.
30. World Health Organization. WHO child growth standards: Length/height for age, weight-for-age, weight-for-length, weight-for-height and body mass index-for-age, methods and development. Geneva: 2006. Disponible en:https://apps.who.int/iris/bitstream/handle/10665/43413/924154693X_eng.pdf. Fecha de última visita: 10 de Mayo del 2019.
31. Esquivel Lauzurique M. Valores cubanos del índice de masa corporal en niños y adolescentes de 0 a 19 años. Rev CubanaPediatr 1991;63:181-90.
32. Esquivel Lauzurique M, Rubén Quesada M, González Fernández C, Rodríguez Chávez L, Tamayo Pérez V. Curvas de crecimiento de la circunferencia de la cintura en niños y adolescentes habaneros. Rev Cubana Pediatr 2011;83:44-55. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312011000100005&lng=es. Fecha de última visita: 13 de Diciembre del 2018.
33. Maffeis C, Banzato C, Talamini G; for the Italian Obesity Study Group. Waist-to-height ratio, a useful index to identify high metabolic risk in overweight children.JPediatr 2008;152:207-13.
34. Pickering TG, Hall JE, Appel LJ, Falkner BE, Graves J, Hill MN; et al. Recommendations for blood pressure measurement in humans and experimental animals: Part 1: Blood pressure measurement in humans: A statement for professionals from the Subcommittee of Professional and Public Education of the American Heart Association Council on High Blood Pressure Research. Circulation 2005;111:697-716.
35. National High Blood Pressure Education Program Working Group. Update on the Task Force (1987) on high blood pressure in children and adolescents. Pediatrics 1996;98:649-58.
36. Falkner B, Daniels SR. Summary of the Fourth Report on the Diagnosis, Evaluation, and Treatment of High Blood Pressure in Children and Adolescents. Hypertension [Dallas] 2004;44:387-8.
37. Zimmet P, Alberti KGM, Kaufman F, Tajima N, Silink M, Arslanian S; for the IDF Consensus Group. The metabolic syndrome in children and adolescents– An IDF consensus report. Pediatric Diabetes 2007;8:299-306.
38. Passwell JH, Modan M, Brish M, Orda S, Boichis H. Fractional excretion of uric acid in infancy and childhood: Index of tubular maturation. Arch Dis Child 1974;49:878-82.
39. Stapleton FB, Linshaw MA, Hassanein K, Gruskin AB. Uric acid excretion in normal children.JPediatr 1978;92:911-4.
40. Santana Porbén S, Martínez Canalejo H. Manual de Procedimientos Bioestadísticos. Segunda Edición. EAE Editorial Académica Española. ISBN-13: 9783659059629. ISBN-10: 3659059625. Madrid: 2012.
41. Salabarría, J.S.; Santana, S.; Martinez, H; Benitez, L.M.: Intervalos de predicción como valores de referencia para la creatinina sérica en una población infantil. Bol. Med Hosp Infant Méx 1997;54:115-23.
42. Monteagudo Rodríguez Y, Santana Porbén S, Salabarría González JR. Intervalos locales de referencia para la excreción urinaria de creatinina en niños y adolescentes cubanos. Rev Cubana AlimentNutr 2015;25(Supl 1):S59-S90.
43. Kim SS, Luan X, Canning DA, Landis JR, Keren R. Association between body mass index and urolithiasis in children.JUrol 2011;186:1734-39.
44. Eisner BH, Eisenberg ML, Stoller ML. Influence of body mass index on quantitative 24-hour urine chemistry studies in children with nephrolithiasis. JUrol 2009;182:1142-5.
45. Oquendo de la Cruz Y, Piñeiro Lamas R, Duarte MC, Guillen Dosal A. Síndrome metabólico en niños y adolescentes hipertensos obesos. Rev Cubana Pediatr 2010;82(4):31-40.Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312010000400004&lng=es. Fecha de última visita: 11 de Mayo del 2019.
46. La Manna A, Polito C, Marte A, Iovene A, Di Toro R. Hyperuricosuria in children: Clinical presentation and natural history. Pediatrics 2001;107:86-90.
47. Praga M, Alegre R, Hernández E, Morales E, Domínguez-Gil B, Carreño A, Andrés A. Familialmicroscopic hematuria causedbyhypercalciuria and hyperuricosuria. Am JKid Dis 2000;35:141-5.
48. Polito C, La Manna A, Napp B, Villani J, Di Toro R. Idiopathic hypercalciuria and hyperuricosuria: Family prevalence of nephrolithiasis. Pediatr Nephrol 2000;14:1102-4.
49. Dwyer ME, Krambeck AE, Bergstralh EJ, Milliner DS, Lieske JC, Rule AD. Temporal trends in incidence of kidney stones among children: A 25-year population based study. JUrol 2012;188:247-52.
50. Matlaga BR, Schaeffer AJ, Novak TE, Trock BJ. Epidemiologic insights into pediatric kidney stone disease. Urol Res 2010;38(6):453-57.Disponible en: https://rd.springer.com/article/10.1007/s00240-010-0327-9. Fecha de última visita: 12 de Mayo del 219.
51. Clifford AJ, Riumallo JA, Young VR, Scrimshaw NS. Effect of oral purines on serum and urinary uric acid of normal, hyperuricemic and gouty humans. J Nutr 1976;106(3):428-34.Disponible en:https://academic.oup.com/jn/article-abstract/106/3/428/4763582. Fecha de última visita: 13 de Mayo del 2019.
52. Choi HK, Atkinson K, Karlson EW, Willett W, Curhan G. Purine-rich foods, dairy and protein intake, and the risk of gout in men.NEngl J Med 2004;350:1093-103.
53. Nakagawa T, Tuttle KR, Short RA, Johnson RJ. Hypothesis: Fructose-induced hyperuricemia as a causal mechanism for the epidemic of the metabolic syndrome. Nature Clin PractNephrol 2005;1:80-6.
54. Johnson RJ, Nakagawa T, Sanchez-Lozada LG, Shafiu M, Sundaram S, Le M;et al. Sugar, uric acid, and the etiology of diabetes and obesity. Diabetes 2013;62:3307-15.
55. Shavit L, Ferraro PM, Johri N, Robertson W, Walsh SB, Moochhala S, Unwin R. Effect of being overweight on urinary metabolic risk factors for kidney stone formation.Nephrol Dial Transplant 2015;30:607-13.
56. Bobulescu IA, Moe OW. Renal transport of uric acid: Evolving concepts and uncertainties. Adv Chronic Kidney Dis 2012;19:358-71.
57. Hediger MA, Johnson RJ, Miyazaki H, Endou H. Molecular physiology of uratetransport. Physiology 2005;20:125-33.
58. Facchini F, Chen YDI, Hollenbeck CB, Reaven GM. Relationship between resistance to insulin-mediated glucose uptake, urinary uric acid clearance, and plasma uric acid concentration. JAMA 1991;266:3008-11.
59. Cameron MA, Maalouf NM, Adams-Huet B, Moe OW, Sakhaee K. Urinecomposition in type 2 diabetes: Predisposition to uric acid nephrolithiasis. J Am SocNephrol 2006;17:1422-8.
60. Goodpaster BH, Wolf D. Skeletal muscle lipid accumulation in obesity, insulin resistance, and type 2 diabetes. Pediatr Diab 2004;5:219-26.
61. Santana Porbén S, Salabarría González JR, LirianoRicabal, MR.Excreción urinaria de una sustancia predicha de la densidad urinaria. Revista LatinoamPatolClínMedLab 2015;62(3): 163-73. Disponible en:https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=59469. Fecha de última visita: 16 de Mayo del 2019.
