ORIGINAL
Controversias en el Cribado de Cáncer de Próstata: ¿es útil el Antígeno Prostático Específico?
Controversies in Prostate Cancer Screening: is the Prostate Specific Antigen useful?
Pablo Yago Giménez1, Loreto Tarraga Marcos2, Fátima Madrona Marcos3, Pedro Juan Tárraga López4
1 Pablo Yago Giménez. Médico. Facultad de Medicina de Albacete, España
2 Loreto Tarraga Marcos. Enfermera Hospital Clinico Zaragoza, España
3 Fatima Madrona Marcos. Médico Residente. EAP Zona 5 A de Albacete, España
4 Pedro Juan Tárraga López. Profesor facultad de Medicina de Albacete, España
* Autor para correspondencia.
![]()
This work is licensed
under a Creative
Commons
Attribution-NonCommercial-ShareAlike 4.0 International License
La revista no cobra tasas por el envío de trabajos,
Resumen
El cáncer de próstata es uno de los cánceres que más importancia está cobrando en los últimos años, debido a su alta incidencia y prevalencia en la población mundial. El uso del cribado del cáncer de próstata mediante el Antígeno Prostático Específico (PSA) ha contribuido a incrementar el diagnóstico temprano de este cáncer, pero también el sobrediagnóstico y sobretratamiento de este. Numerosos estudios han intentado encontrar una evidencia estadísticamente significativa que demostrase el descenso de mortalidad de los pacientes realizando el cribado. Dos grandes estudios destacan en este campo y son el estudio americano PLCO, que no ha encontrado descenso de la mortalidad y el estudio europeo ERSPC que sí la ha encontrado.
Las condiciones de uso del PSA en la población no son del todo claras, aunque según se ha estudiado, es necesario el uso del cribado durante al menos 10 años para demostrar descenso de la mortalidad por cáncer de próstata. Es por esto que, sí hay una contraindicación clara y es su uso en pacientes mayores de 70 años por que éstos no tienen la esperanza de vida suficiente para que el cribado demuestre algún beneficio. En caso de población asintomática el paciente debe decidir si se quiere someter al cribado en función de los beneficios y riesgos que asuma.
Este trabajo tiene como objetivo realizar una revisión ampliada de la evidencia del cribado del cáncer de próstata mediante el PSA y ver en qué condiciones estaría indicado someterse a dicho cribado.
Palabras clave
Antígeno Próstata especifico (PSA); Cancer Próstata; Cribados
Abstract
Prostate cancer is one of the most important cancers in recent years, due to its high incidence and prevalence in the world population. The use of prostate cancer screening using Prostate Specific Antigen (PSA) has contributed to increasing the early diagnosis of this cancer, but also the overdiagnosis and over-treatment of this cancer. Numerous studies have attempted to find statistically significant evidence to demonstrate the decrease in mortality of patients performing screening. Two large studies stand out in this field and are the American PLCO study, which has not found a decrease in mortality and the European ERSPC study that has found it.
The conditions of use of PSA in the population are not entirely clear, although as it has been studied, it is necessary to use screening for at least 10 years to demonstrate a decrease in prostate cancer mortality. That is why, there is a clear contraindication and it is its use in patients over 70 years because they do not have enough life expectancy for the screening to show any benefit. In the case of an asymptomatic population, the patient must decide if they want to be screened according to the benefits and risks they assume.
This work aims to carry out an expanded review of the evidence of prostate cancer screening using PSA and see under what conditions it would be indicated to undergo such screening.
Keywords
Prostate Cancer; Prostate Specific Antigen (PSA); Screening
Introducción
Epidemiología del cáncer en el mundo, Europa y España
El cáncer es una enfermedad plenamente establecida en el mundo actual y con gran impacto en los Planes de Salud que se realizan en todo el mundo. Las estadísticas reflejan que el cáncer afectará a uno de cada tres hombres y una de cada cuatro mujeres durante su periodo de vida.(1) A nivel europeo nos encontraremos con que se diagnostican una cuarta parte de los cánceres de todo el mundo lo que hace que se reflexione acerca de la magnitud de este problema, en 2018 se estimó que en Europa el cáncer más incidente fue el cáncer de mama (13.4%), seguido del cáncer de colon (12.8%), pulmón (12%), y cáncer de próstata (11.5%).
En cuanto a la mortalidad se estima que el cáncer de pulmón ocupe el primer puesto (20%), seguido del cáncer colorrectal (12.6%), el cáncer de mama (12%), cáncer de páncreas (12%) y cáncer de próstata (10%). La mortalidad por países de Europa refleja que los países del este ostentan las mayores tasas de mortalidad, y por el contrario los países escandinavos son los que ostentan una menor tasa de mortalidad.(2) (Figura 1)
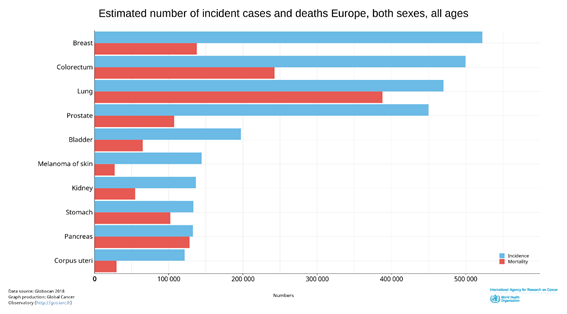
Figura 1. Incidencia y mortalidad del cáncer en Europa 2018. Fuente: Globocan
El Cáncer en la población española demuestra que España se localiza como un país de riesgo intermedio-bajo de padecer cáncer en relación con la media europea, sin embargo, va a ser una de las enfermedades que más gasto público conllevan dentro del Sistema de Salud, por la cantidad de pruebas diagnósticas, tratamientos y de seguimiento que son necesarias para tratar a estos pacientes. Siendo así, que es la segunda causa de mortalidad en el sexo femenino y desde el año 2000 es la primera causa en sexo masculino(3). En España(4) los datos del año 2015 reflejan una incidencia de 247.771 casos, de los cuales, 148.827 van a pertenecer a los varones (482,7 casos por 100.000 habitantes) y 98.944 a mujeres (284,5 por cada 100.000 habitantes). Esta incidencia con relación a las tasas europeas nos sitúa en un nivel intermedio bajo. En cuanto a los cánceres más frecuentes dentro de la población española van a ser los siguientes: Cáncer colorrectal (41.441), próstata (33.370), pulmón (28.347), mama (27.747) y vejiga urinaria (21.093).
La tasa de incidencia ha experimentado un aumento paulatino desde los registros de 1993 hasta los últimos registros de 2015, que se podrían explicar por el desarrollo tecnológico y técnico a la hora del diagnóstico de los tumores actualmente. Así mismo, el cáncer de próstata también ha visto aumentado su incidencia en estos años debido a la introducción paulatina del cribado del PSA en atención primaria, ya que desde 1993 a 2015 ha aumentado la tasa de incidencia del cáncer de próstata de 54, 1 por cada 100.000 habitantes a 103,4 por cada 100.000 habitantes.
En cuanto a la mortalidad, los cánceres que con más probabilidad causan la muerte serían: 1. Cáncer de pulmón. 2. Cáncer colorrectal, 3. Cáncer de páncreas, 4. Cáncer de mama y 5. Cáncer de próstata.
Según la REDECAN(5), las estimaciones para 2019 sobre los cánceres en España van a ser muy similares a las citadas anteriormente, siendo el cáncer de próstata el más incidente de 2019 en toda la población española seguido del cáncer de mama y el de pulmón (Figura 2):
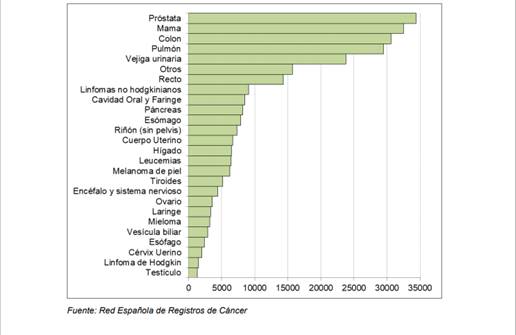
Figura 2. Número estimado de tumores incidentes en España en 2019. Fuente: Redecan.
Cáncer de Próstata. Concepto, factores etiológicos y predisponentes
La próstata es una glándula que se ubica en la pelvis masculina compuesta por glándulas que se disponen en los lóbulos. Su función consiste en segregar componentes que creen las mejores condiciones para una viabilidad del semen. La próstata se divide en tres zonas, la zona periférica, la zona de transición y la porción periuretral. La mayoría de los cánceres de próstata tienden a aparecer en la porción periférica de la próstata, y suelen comenzar con la aparición de una glándula mutada paraneoplásica que comienza a dividirse sin control. El hecho de que se produzcan en su mayoría en la zona periférica, lo hace más susceptible de ser palpado mediante el tacto rectal.(6)
La edad es el principal y primer factor de riesgo para padecer esta enfermedad, ya que el crecimiento de las glándulas prostáticas durante toda la vida va a condicionar la aparición de células con mutaciones que en última instancia van a conducir al cáncer de próstata. Distintos estudios han demostrado que conforme avanza la edad es más frecuente encontrar focos cancerígenos en la próstata, así se descubrió en autopsias(7) que hasta el 75% de los hombres padecía cáncer de próstata con 85 años, datos que confirman el avance de esta neoplasia con la edad de los varones.
Tener predisposición familiar al cáncer de próstata u otros cánceres también supondrían un factor de riesgo, tanto es así, que se ha visto que mutaciones en el gen BRCA2 se asocian a una mayor incidencia y agresividad del cáncer de próstata, a su vez, también se han identificado recientemente distintos genes y alelos en pacientes con cánceres de próstata familiares que confieren un riesgo especial, como el gen RNASEL que codifica una enzima que media en la respuesta a infecciones virales por medio del interferón. Otros genes que se están estudiando en personas de alto riesgo son ELAC2, MSR1, OGG1, CHEK2, PON1(8) .
Ser de etnia afroamericana también supone un factor de riesgo, sin embargo, diversos estudios han identificado que los emigrantes afroamericanos adquieren el riesgo del país en el que son acogidos. Por lo tanto, se habla de que pueden interferir factores epigenéticos. La exposición a andrógenos, la dieta rica en grasas animales y el sedentarismo conllevan un mayor riesgo aunque este efecto esta menos demostrado.(4)
Se ha relacionado también la presencia de factores infecciosos e inflamatorios en la aparición del cáncer de próstata, esto es debido a que una posible infección por un patógeno iniciaría una cascada de inflamación que podría desembocar en la diferenciación de células malignas. Tanto es así que se ha evidenciado diferencias estadísticamente significativas entre la aparición del cáncer y la infección de enfermedades de transmisión sexual(9)y prostatitis.(10)
Epidemiología del cáncer de Próstata en Europa y España
El cáncer de próstata es el cáncer más incidente en la población masculina europea con casi un 22% y el tercero en cuanto a mortalidad con un 10%, estos datos se pueden extrapolar a la población española estimándose en el año 2018 una tasa de incidencia de 104.2 casos por 100.000 habitantes. Siendo en 2018 el cáncer con mayor tasa cruda de incidencia en España, por encima del cáncer de mama.(2) (Figura 3)
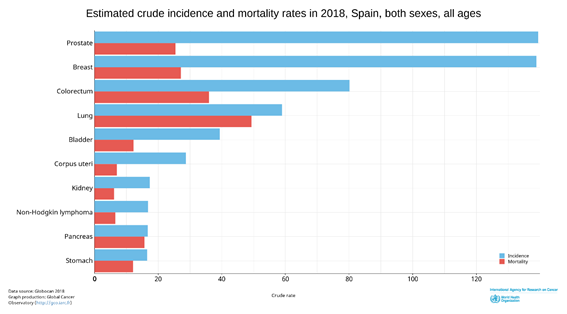
Figura 3. Tasa cruda de incidencia y mortalidad del cáncer en España. Fuente: Globocan.
Las tasas de incidencia del cáncer de próstata constatan un crecimiento progresivo durante los años debido a muchos factores, entre los cuales destacan la longevidad de la población española y el cribado con el PSA que se realiza en atención Primaria.
Clínica. Diagnóstico precoz y tratamiento
La clínica del cáncer de próstata suele abarcar desde estadios asintomáticos, que pasan desapercibidos sin causar molestia al paciente durante su vida, hasta estadios metastásicos que comprometen seriamente la vida del paciente en un corto periodo de tiempo. (11) Y es esta evolución tan impredecible, lo que conlleva dentro de la atención primaria la problemática del diagnóstico precoz, ya que actualmente el cribado del cáncer de próstata se realiza mediante el uso del PSA y el tacto rectal. El uso del tacto rectal normalmente sólo detecta el 18 % de los cánceres y se condiciona de su uso que, si el tacto es positivo tendrá más posibilidades de padecer un Cáncer con riesgo de mayor malignidad.(12)
El PSA se define propiamente como una glicoproteína que circula en sangre asociado a macromoléculas y en forma libre, es específica de la próstata pero no específica del cáncer de próstata. El PSA puede verse elevado por diversas situaciones que afecten a la próstata, como una biopsia, una cirugía, relaciones sexuales recientes e incluso una retención aguda de orina. También aumenta en situaciones de crecimiento de próstata o una inflamación, como podría ser la HBP o la prostatitis. Así, muchos falsos positivos al realizarse la prueba del PSA son debidos principalmente a la HBP y se correlacionan con el aumento de la edad, de modo que a mayor edad hay más prevalencia de cáncer de próstata y contradictoriamente más falsos positivos.
Se han estandarizado unos valores normales para la prueba del PSA en función del rango de edad del paciente.(13) Para hombres con edades comprendidas entre los 40-49 años el punto de corte estaría en los 2.5 ng/ml, para hombres de entre 50-59 años sería 3.5ng/ml, para hombres de entre 60-69 años sería 4.5ng/ml y para mayores de 70 años sería de 6.5 ng/ml.
Otros parámetros que complementan a la cifra absoluta del PSA en sangre son el incremento del PSA al año que, si se incrementa 0,75ng/ml al año orienta hacia cáncer de próstata. También es útil ver el PSA libre en contraposición al PSA total, ya que se ha visto que un mayor PSA libre respecto al total indica probabilidad de enfermedad benigna como la HBP frente al cáncer de próstata que normalmente va a asociado a unos niveles de PSA libre bajos.
Una prueba que se puede realizar en AP(14) para ayudar a decidir sobre el paciente es la densidad de PSA-densidad transicional de PSA que se basa en la relación del PSA medido (siempre que comprenda cifras entre 4-10ng/ml), con el volumen prostático medido por ecografía transrectal. Esta prueba se basa en la premisa de que la mayoría del PSA se excreta por la zona de transición de la próstata y el crecimiento de esta se produce por la zona de transición también, de modo que, midiendo la zona de transición y el volumen prostático nos puede orientar hacia si un paciente tiene un CaP o no. Esta prueba se ve limitada(15) por la pericia del médico que realiza la ecografía y porque su uso puede dejar de diagnosticar un número de neoplasias.
De modo que, ante un valor de PSA elevado en una persona mayor estaría indicado realizar una biopsia por sextantes de la próstata, siendo analizada posteriormente por el patólogo. Este modelo conlleva un importante sobrediagnóstico y un elevado caso de potenciales riesgos ya que en la mayoría de los pacientes las biopsias tendrán resultado negativo. Actualmente se está implementando el uso de la RM(16) con una eficacia superior al 90% y consiguiendo la fusión de imágenes con la ecografía para realizar una correcta biopsia en el sitio más sospechoso, además de que la RM permite estadificar el estadio local.
La prevención primaria del cáncer de próstata es un tema complicado, debido a que los factores de riesgo con mayor evidencia y mejor estudiados son los ya mencionados, y como características en común de todos ellos es que son inherentes a la persona y no se puede hacer nada para intervenir sobre ellos. Sin embargo, se han descrito diferentes factores de riesgo que podrían afectar al cáncer de próstata, aunque no hay demasiada literatura sobre ello.
Uno de estos factores sería la dieta y el ejercicio. La alimentación basada en grasas saturadas y el sedentarismo podrían incrementar el factor de riesgo para padecer cáncer de próstata, ya que se ha visto(17) una correlación entre el cáncer de próstata y el consumo elevado de grasas saturadas. Esto estaría relacionado con la obesidad, de modo que la resistencia a la insulina condicionaría un estado proinflamatorio. Sin embargo, la relación estadística entre estos parámetros es muy pobre y aún se necesitan más estudios. Aun así(8), se debe recomendar el uso de dieta saludable y ejercicio por su potencial beneficio en diversas neoplasias o enfermedades cardiovasculares. También se ha relacionado el consumo de carnes rojas con un aumento del riesgo de padecer cáncer de próstata(18), esto es debido a que en su preparación, se liberan diversos carcinógenos como consecuencia de la cocción a altas temperaturas a la que se somete la carne, que podrían incrementar el riesgo de padecer cáncer de próstata. Por lo tanto una reducción en su consumo podría significar un ligero descenso en la incidencia del cáncer de próstata.
El tabaco ha sido estudiado como posible factor de riesgo del cáncer de próstata, si bien nunca se ha demostrado significativamente que el tabaco haya sido factor de riesgo directo para la aparición del CaP, sí que se ha puesto de manifiesto(19) la capacidad del tabaco, (siempre que se haya consumido durante los últimos 10 años), para configurar un peor pronóstico y desenlace del cáncer de próstata diagnosticado. Todavía hacen falta estudios que expliquen el método por el que el tabaco pueda condicionar este peor pronóstico al paciente, por lo tanto, se debe de aconsejar la retirada del tabaco a todas las personas en AP.
Durante un tiempo se relacionó la toma de suplementos alimentarios ricos en selenio y vitamina D con el descenso de cáncer de próstata. Para demostrar esto se realizaron estudios (20) que pudiesen confirmar esta premisa, uno de los más importantes fue el estudio SELECT que comparaba entre cuatro grupos, (toma de selenio, toma de vitamina e, selenio + vitamina e y placebo) dando como resultado que no había ninguna asociación estadísticamente significativa salvo la relación entre la toma de vitamina e y un aumento del riesgo de cáncer de próstata, y una aparente relación entre la toma de selenio y la aparición de Diabetes Mellitus. Por lo que no se recomienda actualmente la toma de ninguno de estos suplementos.
Se ha relacionado la presencia de concentraciones elevadas de andrógenos con mayor riesgo de cáncer de próstata por lo que se investigó si el uso de anti-andrógenos como método de prevención reducía la incidencia de CaP, destacando dos estudios. Un primer estudio(21) evaluó el uso de finasteride como medida preventiva dando como resultado el descenso del riesgo de cáncer de próstata clínico, aunque aumentó también el riesgo de cáncer de alto grado. También pone de manifiesto que el uso de finasteride como medida de prevención primaria lleva asociados los efectos secundarios propios del fármaco, que sería la alteración de la función sexual. Con todo esto no se recomienda el uso como prevención primaria.
El segundo estudio(22) evaluó el uso de Dutasteride como medida de prevención primaria, también en este estudio se puso de constancia el descenso del riesgo del cáncer de próstata asociando los mismos efectos secundarios que en el estudio del finasteride. Sin embargo y debido al uso de este fármaco en patologías como la HBP podría estar indicado en pacientes con inicio de HBP y que tuviesen un riesgo elevado de cáncer de próstata. Sobre este tema aunque se ha encontrado evidencia de un posible descenso del riesgo, hacen falta más estudios que indiquen cual sería el mejor momento de introducir estos fármacos o a que población estarían mejor dirigidos, aunque en casos individualizados podrían ser de gran ayuda.(23)
De este modo tal y como se ha expuesto anteriormente, el PSA supone la principal prueba de cribado del cáncer de próstata en atención primaria, sin embargo, es una prueba muy sensible y poco específica, lo que puede condicionar problemas tanto al médico como al paciente en caso de ser positiva. El valor positivo del PSA durante la analítica, crea una ansiedad en el paciente por la posibilidad de que pueda padecer un cáncer de próstata y al médico por la necesidad de estudiar a qué se debe este valor. En los últimos años se ha utilizado excesivamente esta prueba como cribado precoz del cáncer de próstata, por lo tanto, han aumentado así mismo el uso de biopsias prostáticas a los pacientes, con el aumento también de los efectos secundarios de esta prueba, como puede ser la hemospermia o la prostatitis por la punción y herida.
Debido a la naturaleza de la evolución del cáncer de próstata, (siendo de un crecimiento muy lento), se ha puesto en entredicho el uso de esta prueba argumentando que conlleva muchos más riesgos que beneficios para la población general. Los riesgos serían el sobrediagnóstico (de tumores que nunca darían clínica por su ritmo lento de crecimiento o por el fallecimiento del paciente antes de que den sintomatología) y el sobretratamiento de estos tumores con los efectos secundarios propios del tratamiento.
Objetivo
El objetivo principal de este trabajo es la revisión ampliada de la evidencia de uso del cribado del cáncer de próstata con la prueba del PSA. Ver en qué casos y en qué pacientes estaría indicado realizar esta prueba.
Recoger las recomendaciones de las distintas sociedades científicas en torno al cribado del cáncer de próstata.
Como objetivo secundario ver como se podría complementar la prueba del PSA para realizar el diagnóstico temprano del cáncer de próstata.
Material y método
Los artículos que aquí se citan corresponden a una búsqueda bibliográfica de dos bases de datos, medes y web of science. Los términos de búsqueda que se utilizaron en medes fueron “Prevención del cáncer de próstata” y “Uso del PSA en Atención Primaria” se incluyen artículos que hablen de la prevención y que sean a partir del año 2000.
Los términos de búsqueda utilizados en WOS son: “Prostate cancer epidemiology”, “Prostate cancer in Spain”, “Primary prevention of prostate cancer”, “Secondary prevention of prostate cancer”, “Selenium and prostate cancer”, “Smoking and prostate cancer”, “Risk factor of próstate cancer”, “Screening and prostate cancer”. Para las búsquedas de artículos el criterio de inclusión es el de más veces citado,
Se realizaron búsquedas seleccionadas en el Wos sobre el estudio PLCO Y ERSPC y sobre las recomendaciones de la Task force sobre el cribado del cáncer de próstata siendo como criterio de inclusión la publicación en los últimos años.
También se realizaron búsquedas de artículos propios de la bibliografía de los artículos seleccionados para la elaboración de este trabajo.
Resultados
El manejo del PSA como cribado poblacional de cáncer de próstata ha sido objeto de gran controversia dentro del ámbito clínico en los últimos años, debido a la estrecha relación beneficio-riesgo que se aplica de esta prueba en la población general.
Actualmente hay dos grandes estudios de cohortes que evalúan el uso del PSA como cribado del cáncer de próstata: El “ECA European Randomiced Study of Screening for Prostate Cancer” o ERSPC y el estudio norteamericano “US Prostate, Lung, Colorectal and Ovarian (PLCO) Screening Trial”
El estudio ERSPC ha ido actualizando sus resultados cada dos años. En el año 2012 con 11 años de seguimiento(24), encontró un RR 0.79 (0,69-0,91) p =0,001 correspondiente a una reducción del riesgo relativo del 21% a favor del cribado que tras correcciones de no participación subió al 29% RR 0,71(0,69-0,91) p= 0,001 aunque este descenso del riesgo relativo sólo sería significativo en pacientes entre los 65 y 69 años. NNS (screening) es de 936 y el NND (tienen que ser diagnosticados para evitar una muerte por cáncer de próstata) de 33.
En el año 2014 se llevó a cabo otra revisión del estudio con 13 años de seguimiento(25) con un RR de 0,79(0,69-0,91) p= 0,001 que corresponde con una reducción del 21%, igual a la revisión de 2012 sin embargo tras el ajuste de no-participación el RR fue de 0,73(0,61-0,88) p< 0,0007 que corresponde con una reducción del 27%. El NNS fue de 781 y el NND de 27. Al igual que en la revisión anterior la reducción de riesgo sólo fue significativa en el rango de edad de 65-69 años, no mostrando ninguna evidencia en personas de 70 años en adelante.
A raíz de estos datos se evaluaron las ratios de incidencia del cáncer de próstata por su categoría de riesgo al diagnóstico en las ramas del ERSPC(26), se calcularon los riesgos relativos de cada brazo de riesgo siendo: riesgo bajo, riesgo intermedio, riesgo alto y riesgo de enfermedad metastásica. Los riesgos serían para el bajo RR 2,14 (2,03-2,25), para el intermedio fue de RR 1,24 (1,16-1,34), para el alto riesgo fue RR 1 (0,89- 1,13) y para el riesgo de enfermedad metastásica fue RR 0,6 (0,52-0,7).
En cuanto al estudio norteamericano o PLCO se publicó en 2016 una revisión del PLCO que abarcaba 15 años de seguimiento randomizado. El PLCO tras 13 años de seguimiento(27) no mostró diferencias significativas entre el cribado y el uso puntual siendo su RR de mortalidad por cáncer de próstata de 1,09 (0,87-1,36) p<0,001. Tras 15 años de seguimiento los resultados obtenidos fueron del RR 1,04 (0,87-1,24) p<0,001.
El estudio Göteborg(28) realizado en Suecia trataba de demostrar también el beneficio del uso del PSA en el cribado y diagnóstico temprano del cáncer de próstata. Este estudio es de tipo cohortes prospectivo y se asignaron dos grupos al azar: El primero con cribado cada 2 años con PSA y un grupo control sin el cribado. Los resultados de este estudio tras 14 años de seguimiento fueron la reducción del riesgo de morir por el cáncer de próstata en un 44% siendo el RR 0,56 (0,39–0,82) p=0·002. El NNS fue de 293 y el NND 12. Este estudio sólo incluyó pacientes de entre 61 hasta 70 años y predice que los beneficios posibles de este cribado serían en personas que lleven al menos 10 años de seguimiento.
Durante los últimos años se han estado realizando revisiones sistemáticas del grupo Cochrane sobre el tema del cribado del cáncer de próstata, tanto en 2006 como en 2010 no se encontraron diferencias estadísticamente significativas que orientasen a la utilización del PSA como reductor de mortalidad en el cáncer de próstata. En 2013(29) se publicó la actualización de la revisión de Cochrane que consistía en un metaanálisis de cinco estudios entre los que se encontraban el ERSPC y el PLCO, siendo el ERSPC el único que aportaba diferencia significativa a favor del cribado de cáncer de próstata. Entre los pacientes que incluía este metaanálisis figuraban edades comprendidas entre los 45 hasta los 80 años y un seguimiento de 7 a 20 años.
El resultado de la última revisión de la Cochrane fue que no había diferencias estadísticamente significativas con RR de 1 (0,86-1,17). Las conclusiones de este artículo exponen que para que se pueda producir algún descenso en la mortalidad por el uso del PSA hacen falta 10 años de seguimiento y no puede ser aplicado a personas mayores de 70 años ya que normalmente suelen tener una esperanza de vida menor de 10-15 años. (Tabla 1)
Tabla 1. Resumen de las conclusiones de los artículos científicos.
|
Resumen de los resultados obtenidos |
|
|
ERSPC: 11 años de seguimiento: Descenso del 21% de mortalidad con el cribado en varones de entre 65-69 años. No realizar cribado en mayores de 70 años. 13 años de seguimiento: Descenso del 21% de mortalidad en varones 65-69 años. No realizar cribado en mayores de 70 años. Descenso de riesgo relativo sólo en enfermedad metastásica. PLCO: 13 años de seguimiento: No hay evidencia de descenso de mortalidad. 15 años de seguimiento: No hay evidencia de descenso de mortalidad. Estudio Göteborg: 14 años de seguimiento: Descenso del 44% de mortalidad en varones de 61-70 años. Metaanálisis de la Cochrane: 2006: No hay evidencia de descenso de la mortalidad. 2010: No hay evidencia de descenso de la mortalidad. 2013: No hay evidencia de descenso de la mortalidad. |
|
Discusión
El uso del PSA como cribado del cáncer de próstata es objeto de controversia dentro de la literatura médica, debido al uso extendido de éste desde su descubrimiento en los años 70 a su aparición en programas de prevención del cáncer de próstata realizados a partir de los años 90 en Atención Primaria. Antes de la aparición del PSA, el cáncer de próstata se diagnosticaba precozmente mediante el tacto rectal, aunque éste era un método poco sensible para diagnosticar neoplasias de reciente aparición y cuando detectaba anomalías el cáncer de próstata solía llevar una evolución fulminante. Algunos autores citan(30) que sólo un 18 % de los cánceres de próstata son detectados por el tacto rectal exclusivamente y sin ayuda del PSA.
Para definir el cribado de cáncer de próstata antes hay que referirse a lo que significa realizar un cribado poblacional, siendo aquella prueba que se aplica a toda la población seleccionada con el fin del diagnóstico y tratamiento temprano de esa enfermedad, por tanto, para que un cribado poblacional se pueda llevar a cabo necesitamos varios puntos: El primero de ellos es que esa enfermedad tenga una alta prevalencia en la población a la que queremos aplicar el cribado, para así poder detectar cuantos más casos mejor y poner tratamiento antes de que empeoren las condiciones. La segunda, que tenga un tratamiento efectivo para poder emplearlo en la población cuando se detecte la enfermedad aunque se encuentre en un periodo asintomático. La tercera, que la prueba sea segura y eficiente ya que se va a intentar realizar la prueba a un conjunto poblacional bastante grande y no debería suponer mucho riesgo de efectos secundarios. Y por último que la prueba venga avalada por estudios científicos con una potencia estadísticamente significativa de que el uso de esa prueba como método de cribado, reduce la mortalidad por dicha enfermedad.
Es por esto que se están realizando los estudios anteriormente mencionados, para intentar encontrar evidencia estadísticamente significativa de que el cribado de cáncer de próstata reduce la mortalidad por cáncer de próstata. Durante muchos años no había una evidencia clara de este descenso en la mortalidad y es por eso que en 2012(31) la U.S. Preventive Services Task Force avaló por la no utilización del PSA como método del cribado del cáncer de próstata en ninguna de las edades, argumentando que los beneficios no superaban a los riesgos derivados del uso de dicha prueba.
Como indicó la Task Force el PSA es una prueba en la que hay que valorar el riesgo-beneficio cada vez que se pida, esto es debido a dos situaciones citadas anteriormente:
1. Esta prueba no es específica del cáncer de próstata y un resultado positivo aislado no indica la necesidad de someter al paciente a nuevas pruebas si no están incluidas dentro de un contexto clínico sugerente. Ya que el siguiente paso que seguiría el médico tras un PSA elevado sería el uso de la biopsia prostática, esta prueba se realiza normalmente guiada por ecografía, pero se realiza por sextantes prostáticos de forma aleatoria en cada sextante, esto quiere decir que aún teniendo una biopsia negativa no podríamos descartar totalmente que el paciente no padeciese un cáncer de próstata. Esto va a generar un estado de ansiedad y nerviosismo en el paciente ante la incertidumbre del valor de PSA elevado pero una biopsia negativa, a esto también hay que sumarle los riesgos propios derivados del uso de la propia prueba como va a ser la hemospermia, la hematuria, el sangrado rectal y la fiebre (no necesariamente por infección de la próstata, sino por el mero hecho del procedimiento). También hay que mencionar las complicaciones derivadas de sufrir una prostatitis grave que estiman(12) en <1% o de situaciones que requieran ingreso hospitalario que estiman en un 0,3%.
2. La otra situación que hay que valorar es la propiamente debida a la historia natural de la enfermedad, como se ha mencionado antes el cáncer de próstata es edad dependiente en la mayoría de los casos, lo que indicaría que aparecería siempre que se alcanzase mucha longevidad. Ahora bien, el hecho de que un paciente tenga cáncer de próstata no indica que se vaya a manifestar como enfermedad sintomática, ya sea porque el paciente fallezca antes de que este hecho se produzca (en lo que se deduce que sería un paciente mayor afectado de distintas enfermedades y con un pronóstico vital corto), o por que el cáncer de próstata nunca crezca tanto como para producir clínica ni sintomatología. Es aquí cuando se introduce el término de sobrediagnóstico, facilitado por el PSA elevado en una prueba de rutina, se estima(32) que las cifras de sobrediagnóstico oscilarían entre el 29-56% y que este aumentaría conforme la edad de los pacientes.
Derivado de este sobrediagnóstico aparece el concepto del sobretratamiento que sería el tratamiento de todos aquellos cánceres que nunca van a dar clínica específica ni afectarían la vida del paciente. El problema del sobretratamiento no es desdeñable, ya que el tratamiento del cáncer de próstata no metastásico actualmente suele ser la prostatectomía radical teniendo una mortalidad intraoperatoria <1%.(11) Esta operación conlleva efectos secundarios importantes que alteran mucho la calidad de vida del paciente. Las complicaciones más frecuentes(4) de la prostatectomía radical es la incontinencia urinaria y la disfunción eréctil, estando presentes hasta en un 75% de las personas. Otras que se presentan con menos frecuencia son la fístula urinaria, y la estenosis uretral. También habría que sumar las complicaciones derivadas del uso de la quimioterapia o la radioterapia en función del tumor.
Debido a lo anteriormente mencionado el uso actual del PSA para el cribado del cáncer de próstata pasa por encontrar la evidencia suficiente para poder decir que su uso prematuro es capaz de reducir la mortalidad por cáncer de próstata, apoyándonos en la literatura científica nos encontramos con resultados contradictorios.
El estudio PLCO(27) compara dos grupos en los que uno sería el trato estándar (visitas a su MAP y tacto rectal si hay sintomatología) del paciente frente a otro que realizaría un cribado intenso, realizándose un PSA al año durante 6 años y un tacto rectal los primeros 4 años, con un punto de corte para el PSA de 4ng/ml.(26,25)Este estudio fue realizado en Estados Unidos y tras 15 años de seguimiento, no ha encontrado evidencia estadísticamente significativa de que el cribado pueda producir un descenso en la mortalidad. El PLCO ha sido también muy criticado tras un estudio de los grupos que lo componen, ya que algunos autores apuntan que hay contaminación dentro del grupo control. La contaminación correspondería a la determinación del PSA ocasional de los pacientes catalogados en el grupo con un tratamiento estándar, alterando así la atención estándar a la que estaban destinados dentro del estudio. Esta contaminación podría alterar la potencia estadística del estudio y por lo tanto arrojar valores que no serían los adecuados para el cribado del PSA. Los propios investigadores realizaron una comprobación(33,34) dentro del grupo control observando que hasta el 80% de los varones se habían sometido a una determinación del PSA ajena a la intervención del estudio. Debido a esto la U.S. Task Force revisó sus recomendaciones de 2012.
El otro gran estudio contrapuesto al PLCO es el estudio europeo ERSPC, este estudio seleccionó(35) sujetos de entre 49-74 años y los dividió en un brazo de cribado, en el cuál había determinaciones de PSA (siendo un PSA positivo si >3-4ng/ml ), y un brazo control, en el que no las había, y fue llevado a cabo al principio en 7 países que fueron Holanda, Bélgica, Suecia, Finlandia, Italia, España y Suiza, realizándose en un centro de cada país y posteriormente se unieron 2 centros más de Francia. Este estudio a diferencia del PLCO sí reveló diferencias estadísticamente significativas a favor del descenso de mortalidad mediante el uso del PSA. También advirtió que hasta un 76% de los PSA positivos correspondían a falsos positivos. Sin embargo, tal y como ocurren en el PLCO, hay que analizar los resultados obtenidos por el ERSPC. Ya que hay diferencias entre los distintos centros, siendo Holanda y Suecia los únicos países en los que se encuentra una reducción significativa de la mortalidad por cáncer de próstata, aunque en el estudio sugieren que esto es debido a que se necesita un mayor tiempo de evolución para que se muestren estas reducciones en otros países o a una contaminación del grupo control. Como resultados hay que destacar un ascenso de cánceres de próstata de bajo riesgo diagnosticados en el grupo de cribado durante los primeros años, aunque luego con el tiempo se igualaban las tasas de diagnóstico entre los grupos y posteriormente aparecía un descenso de la incidencia de cáncer metastásico en el brazo de cribado con el tiempo de seguimiento, no observándose en los primeros años. Esto es debido al diagnóstico temprano de la neoplasia que hace que se reduzca hasta en un 40% la aparición de enfermedad metastásica(26) en el brazo de cribado (considerando enfermedad metastásica la puntuación Gleason alta y el PSA> 100ng/ml). Por lo tanto, el estudio ERSPC revela que hay una reducción de la mortalidad asociada al cribado del cáncer de próstata mediante el PSA, aunque este resultado existe a expensas de una tasa de sobrediagnóstico alta, que podría condicionar bastante morbilidad al sujeto que se somete a esta prueba y que el beneficio de someterse a este cribado sólo será evidente pasados entre 10-15 años de seguimiento. Siendo la mortalidad por cáncer de próstata metastásico la única que descendería. El ERSPC(12) también se sometió a un estudio de contaminación de sus grupos revelándose una tasa de contaminación del 17% en el grupo control tras 4 años de seguimiento. Esta cifra no condicionaría una pérdida de potencia estadística del estudio ya que está planteado para asumir hasta un 20% de contaminación sin que se afecte su potencia estadística.
A la vista de los resultados obtenidos por estos estudios, la U.S. Task Force tuvo que reevaluar sus recomendaciones de 2012 sobre el cribado del cáncer de próstata. En 2012 concluía que(31), aunque existían potenciales beneficios con el cribado del cáncer de próstata, no superaban los riesgos del sobrediagnóstico y sobretratamiento, argumentando que el 90% de los varones estadounidenses con un PSA positivo habría recibido un tratamiento de cirugía, radioterapia o anti andrógenos y ponía en evidencia los efectos adversos de los falsos positivos que suelen ser más prevalentes conforme la edad del varón. Exponían el estado de ansiedad que padecía el paciente ante la prueba positiva y también los riesgos de aplicar un tratamiento con mucha morbilidad ante un resultado que era erróneo en la mayoría de los casos. A esto había que sumar el hecho de que en ese momento no había ninguna evidencia estadística del descenso de mortalidad con el uso del PSA. Estas recomendaciones causaron impacto en la práctica clínica ya que muchos médicos dejaron de realizar esta prueba con sus pacientes y durante un tiempo en Estados Unidos no se produjo cribado con el PSA.
Sin embargo, en 2018 la U.S. Task Force reevaluó sus criterios de 2012 a la vista de los resultados estadísticamente significativos del estudio ERSPC y de la contaminación del estudio PLCO, así las nuevas recomendaciones serían(36):
· La U.S. Task Force no recomienda el cribado en pacientes de etnia afroamericana y varones con antecedentes familiares de cáncer hereditario que tengan alto riesgo de padecer cáncer de próstata.
En los pacientes de etnia afroamericana se ha sugerido que se beneficiarían de un cribado de cáncer de próstata siempre antes de los 55 años. Aunque no se ha demostrado la evidencia de que el cribado pueda disminuir la mortalidad en estos pacientes la Task Force reconoce que el propio riesgo aumentado a padecer cáncer de próstata de alto grado por su etnia los haría candidatos a utilizar el cribado, siempre exponiendo los posibles riesgos asociados a éste y los beneficios para que el paciente elija la opción que crea correspondiente. Sin embargo, no recomienda el cribado del cáncer de próstata en personas afroamericanas mayores de 70 años.
· En los pacientes que tienen historia de cáncer familiar hereditario la U.S. Task Force no recomienda el cribado.
Aunque reconocen que el cribado podría aportar beneficios a estos pacientes dada su condición de mayor riesgo a padecer cáncer de próstata, por tanto, el médico debería informar al paciente de los potenciales beneficios que tendría someterse al cribado y los posibles riesgos. La Task Force no ha encontrado evidencias estadísticamente significativas de que el uso del cribado reduzca la mortalidad en estos pacientes y por lo tanto no puede recomendarlo. En estos grupos de pacientes la U.S Task Force recomienda la realización de más estudios que evidencien el descenso de mortalidad con el uso del cribado con el PSA.
· En pacientes de edades comprendidas entre los 55 años y los 69 años la Task Force no recomienda el cribado universal, sino que, ante la petición de un varón de esa edad de realizársele dicho cribado, se informe al paciente los potenciales riesgos y beneficios. Posteriormente será cada sujeto quien valore individualmente en función de los riesgos y beneficios que se obtienen del cribado con el PSA y así decidir si quiere someterse al cribado, asumiendo que hay un descenso de la mortalidad para ese rango de edad con su correspondiente sobrediagnóstico y sobretratamiento.
· No recomienda el cribado en varones mayores de 70 años ya que no hay evidencia de descenso de la mortalidad.
También pone en relevancia(37) una nueva vía para el tratamiento del cáncer de próstata que sería la vigilancia activa, en la cual pacientes que han sido diagnosticados de un cáncer de bajo riesgo (por su PSA y su Gleason), se beneficiarían de un seguimiento más estrecho basándose en el análisis del PSA con una mayor frecuencia y biopsias para ver cuanto evoluciona el cáncer. De este modo el paciente podría evitar el tratamiento tan radical y con tanta morbilidad que se asocia al cáncer de próstata.
En definitiva, la U.S. Task Force reevaluó sus criterios de cribado del cáncer de próstata a raíz de que se había encontrado una reducción de la mortalidad en el estudio ERSPC, sin embargo, y así lo manifiesta en sus criterios, el riesgo de sobrediagnóstico y sobretratamiento es tan grande que aún con evidencia estadística de descenso de mortalidad deja a elección del paciente la decisión de someterse al cribado siempre habiendo sido debidamente explicado por su médico. También esta importancia al sobrediagnóstico y sobretratamiento vendría explicada porque se ha demostrado descenso de la mortalidad cuando el cribado se aplica durante 10 años, lo que incrementaría mucho los riesgos del cribado aún demostrando descender la incidencia de enfermedad metastásica. Lo que pone en seguro la U.S. Task Force es que se necesitan muchos más estudios y más tiempo de evolución de éstos para poder elaborar unos consejos claros aplicables a todos los grupos de varones.
También la Sociedad Europea de Urología elaboró sus propios criterios para el cribado y diagnóstico precoz del cáncer de próstata.(38) (Tabla 2)
Tabla 2. Criterios de uso del PSA por la EAU.
|
Criterios de la Sociedad Europea de Urología para uso de PSA. |
|
· No se debe realizar pruebas del PSA a pacientes sin realizar las correspondientes explicaciones sobre ventajas e inconvenientes de esta prueba. · Realizar el PSA a hombre que tengan riesgo de padecer un cáncer de próstata como son los hombres >50 años, > 45 años con historia de cáncer hereditario, afroamericanos >45 años, hombres con un PSA >1ng/ml a los 40 años y con un PSA de 2ng/ml a los 60 años. Para estos dos grupos poblacionales el seguimiento se debería llevar a cabo con determinaciones de PSA cada 2 años. En personas que no tienen riesgo aumentado, realizar seguimiento cada 8 años. · No realizar la determinación del PSA a varones con esperanza de vida < a 15 años por que los riesgos superan a los beneficios.
|
Todas estas recomendaciones son dirigidas principalmente a los médicos de Atención Primaria que suponen la primera línea de uso de esta prueba, en España hay varios estudios que han intentado cuantificar y valorar el uso que se le da al PSA como cribado, pese a que la Sociedad Española de Medicina de Familia y Comunitaria(39) no recomienda realizar el PSA para cribado del cáncer de próstata sino que su uso se recomienda en varones sintomáticos. En España un estudio transversal que se elaboró en el Departamento de Salud(40) número 5 de la Comunidad Valenciana intenta poner datos al conocimiento y uso que se tienen del PSA en dicha área de salud. En el estudio utilizaban un cuestionario que evaluaba a los médicos de familia, y que arrojaba datos como que entre el 57-78% utiliza el PSA para diversas patologías urológicas, aunque un 83% de los profesionales admitían que sabían suficiente sobre el PSA como para saber cuando indicarlo. Sólo se encontró un bajo porcentaje de los encuestados que admitía utilizar el PSA como cribado del cáncer de próstata, lo que contrasta con los datos de uso del PSA por los médicos de Atención Primaria, ya que hasta un 70% lo utilizaban en varones de 40-60 años asintomáticos y un 49% pedía esta prueba para el diagnóstico de cáncer en pacientes de hasta 80 años.
Como conclusión al estudio se recoge que se necesita más formación para poder pedir la prueba en aquellos casos que corresponda y no realizarla en otros en los que no está indicado, como sería en edades superiores a los 70 años. Muchos médicos del estudio (hasta un 64%) ponen en duda la utilidad del PSA como prueba de diagnóstico del cáncer de próstata. Durante el estudio se informó que aquellos médicos que admitían mayor desconocimiento sobre esta prueba realizaban más mediciones al año y en edades más tardías que aquellos que admitían estar bien informados.
En otro estudio(11) se estudió el número de peticiones realizadas a hombres sin enfermedad prostática por los médicos de atención primaria de Cataluña de 13 centros de salud y facultativos de laboratorio y se relacionó por medio de una encuesta con la experiencia de cada uno sobre el uso de esta prueba. En 2015 se pidió el PSA al 15,2% de los hombres mayores de 49 años sin enfermedad prostática. Sin embargo, durante el cuestionario que se pasó a los facultativos, obtuvo bastante puntuación que la petición de la prueba vendría orientada por los síntomas prostáticos que padeciera el paciente y que los protocolos de vigilancia activa estaban muy aceptados. Se encontraron diferencias estadísticamente significativas entre los profesionales estudiados, siendo así, que aquellos profesionales que conocían las 5 guías clínicas incluidas en el cuestionario eran profesionales con más de 11 años de experiencia, mientras que los que no la conocían correspondían a profesionales con menos años de experiencia. Un dato que arroja el estudio es que el 61% de las solicitudes de PSA fueron demandadas por el paciente y en el cuestionario reveló que la mayoría de los médicos pensaban que era conveniente pedir PSA a partir de los 60 años y repetir la prueba anualmente. Los médicos exponen que intentan seguir las recomendaciones de las sociedades científicas respecto a este tema, pero aun explicándoselo bien al paciente, éste quiere realizarse el cribado del cáncer de próstata. Este estudio pone en relieve que muchos profesionales conocen las guías y recomendaciones acerca del uso del PSA en la práctica clínica e intentan seguirlas, pero los pacientes desatienden los consejos que éstos les proporcionan y demandan realizarse el cribado del cáncer de próstata, esto conduce a la práctica de la medicina defensiva con estos pacientes realizando sus peticiones. Sin embargo, se hace patente la necesidad de unas recomendaciones claras y universales sobre el cribado del cáncer de próstata que lleven a un protocolo multidisciplinar.
Toda esta incertidumbre hacia los protocolos y sobre la necesidad o no de realizar el PSA como prueba de detección de cáncer de próstata, se ve repercutida en la derivación de los pacientes desde la Atención Primaria a Urología. Aunque no es(41) la principal causa por la que los pacientes son derivados, la elevación del PSA ha experimentado un incremento de hasta el 40% en los últimos años como indicación de derivación a Urología y que 1 de cada 3 pacientes con sospecha de cáncer de próstata fueron derivados por el aumento del PSA. No obstante, durante los últimos años, aunque no ha descendido el número de interconsultas si que ha aumentado la adecuación, es decir, que las interconsultas están basadas en una alta sospecha de neoplasias y basándose en los protocolos de las sociedades científicas, logrando así una correcta utilización de las consultas y el servicio de derivación de atención primaria.
Perspectivas de futuro
El marcador del PSA para el cribado del cáncer de próstata, como se ha mostrado anteriormente, ha resultado no ser tan beneficioso como se pensó en un principio y es por eso que actualmente hay mucha investigación encaminada al descubrimiento de un marcador nuevo que pudiese reemplazar al PSA y que conlleve muchos menos efectos perjudiciales para el que se somete al cribado. Actualmente las líneas de investigación se basan en dos grupos: aquellos marcadores que se podrían determinar por medio de la orina, y los que se podrían determinar en suero.
Los marcadores que se determinan en la orina son el PCA3, el gen de fusión y SelectMDx.
El PCA3(42) es un gen que se determina en mayor proporción en el cáncer de próstata frente al tejido normal y se detecta en orina tras una estimulación prostática. Hay estudios(43) que mediante el uso de PCA3 han recogido un ahorro de entre el 40-67% de las biopsias, y para la segunda biopsia destaca su alto VPN 90% que hace indicar baja probabilidad de tener una biopsia positiva si sale menor de 25. Para los casos de vigilancia activa(44) no ha mostrado ningún resultado de cuales tumores vayan a progresar y cuáles no.
El gen de fusión es la fusión génica entre el gen TMPRSS2 y miembros de la familia genética de ETS. Esta fusión(45) no se da nunca en próstata benigna, aunque en el cáncer de próstata sólo aparece en el 50% de los casos. Su combinación con PCA3 para la estratificación del CaP ofrece información pronóstica.(46)
SelectMDX corresponde a la sobreexpresión de ARNm de los genes HOXC6, DLX1 y TDRD1 estos genes podrían estar involucrados en la génesis de CaP y se relacionan con CaP de alto grado. Un estudio(47) SelectMDX alterado combinado con los factores de riesgo ya usado anteriormente, confiere una mejor correlación pronóstica del tumor, también hay estudios que indican que su uso en varones con PSA>3ng/ml podría ahorrar costes y ganar años de calidad de vida.
Dentro de los marcadores serológicos que se están estudiando destacan las formas moleculares precursoras e inactivas del PSA de donde aparecen el Pro-PSA e índice PHI, y el 4k score.
El Pro-PSA es un precursor inactivo del PSA libre que se encuentra en mayor concentración en el CaP, forma el índice PHI integrado con el PSA total y el PSA libre y sirven como ayuda para la decisión de una primera biopsia en > 50 años con tacto rectal normal y PSA de 2-10 ng/ml según la FDA.(48) También ha demostrado(49) eficacia al ayudar en la decisión de una segunda biopsia ahorrando hasta un 50% cuando tiene un punto de corte de 29%.
El 4K score(50) se basa en el análisis de cuatro kalicreínas (PSA libre, total, hK2 y PSA intacto) es un marcador que indica probabilidad de padecer un CaP de alto grado y se puede utilizar en pacientes sin CaP como con cáncer de bajo grado, pudiendo predecir la aparición de metástasis en >60 años con >3 ng/ml de PSA.
Con todo esto ningún marcador todavía ha logrado superar al PSA debido a que muchos de ellos no cubren todos los estadios del cáncer metastásico o son influidos por los tratamientos anti androgénicos que tomaba el paciente previamente. También es importante el gasto que supone para la sanidad pública la realización de estas pruebas ya que son gestionadas por laboratorios privados y no son rentables.
Conclusión
El PSA sigue siendo la prueba que en primera instancia se debe de pedir cuando haya sospecha clínica de CaP o algún dato de la exploración alterado, en casos de varones asintomáticos siempre hay que informar de las ventajas e inconvenientes que conllevaba someterse a esta prueba y dejar que el paciente decida en base a los beneficios que puede obtener de realizarse el cribado.
Hay evidencia del descenso de mortalidad con el PSA del cáncer de próstata metastásico cuando se realiza un seguimiento de entre 10 y 15 años por lo que una persona con una esperanza de vida menor a esta no debería indicársele esta prueba. En pacientes que tienen mayor riesgo de padecer CaP no se ha demostrado descenso de mortalidad con el cribado seguramente por falta de estudios que lo demuestren, pero la sociedad europea de urología aboga por una determinación a partir de los 45 años y un seguimiento más estrecho.
Todavía se necesita muchos estudios que valoren otros marcadores que puedan sustituir al PSA como prueba de cribado, que sean económicos y aplicables a la población general sin efectos adversos tan graves como el sobrediagnóstico o sobretratamiento.
Agradecimientos
Quiero agradecer a mi tutor el Dr. Pedro Tárraga por su inestimable dirección y colaboración para la elaboración de este trabajo, por su capacidad resolutiva de los problemas que me he ido encontrando y por las correcciones realizadas.
Agradecer al Dr. Antonio Mateos por atenderme en relación con las dudas que tenía sobre la REDECAN y ofrecerme las estimaciones de incidencia del cáncer en España para 2019.
Por último, quiero agradecer al Doctor en ciencias químicas Juan Miguel Yago por brindarme su apoyo y ayudarme a perfeccionar este trabajo.
Referencias
1. López PJT, Albero JS, Rodríguez-Montes JA. Primary and Secondary Prevention of Colorectal Cancer. Clin Med Insights Gastroenterol. 1 de enero de 2014;7:CGast.S14039.
2. Ferlay J, Colombet M, Soerjomataram I, Dyba T, Randi G, Bettio M, et al. Cancer incidence and mortality patterns in Europe: Estimates for 40 countries and 25 major cancers in 2018. Eur J Cancer. 1 de noviembre de 2018;103:356-87.
3. Galceran J, Ameijide A, Carulla M, Mateos A, Quirós JR, Rojas D, et al. Cancer incidence in Spain, 2015. Clin Transl Oncol. 1 de julio de 2017;19(7):799-825.
4. Marzo-Castillejo M, Vela-Vallespín C, Bellas-Beceiro B, Bartolomé-Moreno C, Melús-Palazón E, Vilarrubí-Estrella M, et al. Recomendaciones de prevención del cáncer. Actualización PAPPS 2018. Aten Primaria. 1 de mayo de 2018;50:41-65.
5. REDECAN - Estimaciones de la incidencia del cáncer en España, 2019 [Internet]. [citado 8 de marzo de 2019]. Disponible en: http://redecan.org/es/page.cfm?id=210&title=estimaciones-de-la-incidencia-del-cancer-en-espana,-2019
6. DENNIS K. Harrison. Principios de medicina interna - 19a Edición, volúmenes 1-2. Edición: 19. Aravaca, Madrid: LUIV4; 2016. 3235 p.
7. Sakr WA, Haas GP, Cassin BF, Pontes JE, Crissman JD. The frequency of carcinoma and intraepithelial neoplasia of the prostate in young male patients. J Urol. agosto de 1993;150(2 Pt 1):379-85.
8. Patel AR, Klein EA. Risk factors for prostate cancer. Nat Rev Urol. febrero de 2009;6(2):87-95.
9. Dennis LK, Dawson DV. Meta-analysis of measures of sexual activity and prostate cancer. Epidemiol Camb Mass. enero de 2002;13(1):72-9.
10. Dennis LK, Lynch CF, Torner JC. Epidemiologic association between prostatitis and prostate cancer. Urology. julio de 2002;60(1):78-83.
11. Giménez N, Filella X, Gavagnach M, Allué JA, Pedrazas D, Ferrer F. Cribado del cáncer de próstata mediante antígeno prostático específico: perspectiva del médico en atención primaria y en el laboratorio clínico. Med Fam SEMERGEN. 1 de septiembre de 2018;44(6):409-19.
12. Jalón Monzón A, Escaf Barmadah S, Viña Alonso LM, Jalón Monzón M. Aspectos actuales sobre el cribado en el cáncer de próstata. SEMERGEN - Med Fam. 1 de julio de 2017;43(5):387-93.
13. Barry MJ. Prostate-Specific–Antigen Testing for Early Diagnosis of Prostate Cancer. N Engl J Med. 3 de mayo de 2001;344(18):1373-7.
14. Vivo Ocaña A. Diseño y evaluación de un modelo predictivo para el diagnóstico del cáncer de próstata en Atención Primaria. 2012 [citado 18 de febrero de 2019]; Disponible en: https://repositorio.uam.es/handle/10486/11318
15. Martínez Jabaloyas JM, García Morata F, Villamón Fort R, Pastor Hernández F, Gil Salom M, García Sisamón F. Valor de la densidad del antígeno prostático específico y de la densidad del antígeno prostático específico de la zona transicional en el diagnóstico del cáncer de próstata. Actas Urol Esp. junio de 2003;27(6):442-9.
16. Morote J, Maldonado X, Morales-Bárrera R. Cáncer de próstata. Med Clínica. 5 de febrero de 2016;146(3):121-7.
17. Brenes Bermúdez FJ, Alcántara Montero A. ¿Detección precoz o cribado en la prevención del cáncer de próstata? SEMERGEN - Med Fam. 1 de marzo de 2017;43(2):100-8.
18. Hayes RB, Ziegler RG, Gridley G, Swanson C, Greenberg RS, Swanson GM, et al. Dietary factors and risks for prostate cancer among blacks and whites in the United States. Cancer Epidemiol Biomark Prev Publ Am Assoc Cancer Res Cosponsored Am Soc Prev Oncol. enero de 1999;8(1):25-34.
19. Zu K, Giovannucci E. Smoking and aggressive prostate cancer: a review of the epidemiologic evidence. Cancer Causes Control. 1 de diciembre de 2009;20(10):1799-810.
20. Lippman SM, Klein EA, Goodman PJ, Lucia MS, Thompson IM, Ford LG, et al. Effect of Selenium and Vitamin E on Risk of Prostate Cancer and Other Cancers The Selenium and Vitamin E Cancer Prevention Trial ( SELECT). Jama-J Am Med Assoc. 7 de enero de 2009;301(1):39-51.
21. Thompson IM, Goodman PJ, Tangen CM, Lucia MS, Miller GJ, Ford LG, et al. The Influence of Finasteride on the Development of Prostate Cancer. N Engl J Med. 17 de julio de 2003;349(3):215-24.
22. Andriole GL, Bostwick DG, Brawley OW, Gomella LG, Marberger M, Montorsi F, et al. Effect of Dutasteride on the Risk of Prostate Cancer. N Engl J Med. 1 de abril de 2010;362(13):1192-202.
23. Pinto Á, Segura PP. Primary prevention and early diagnosis of prostate cancer: recommendations from the prevention and early diagnosis working group of the Spanish Society of Medical Oncology (seom). Eur J Cancer Prev. 1 de marzo de 2016;25(2):137-41.
24. Schröder FH, Hugosson J, Roobol MJ, Tammela TLJ, Ciatto S, Nelen V, et al. Prostate-Cancer Mortality at 11 Years of Follow-up [Internet]. http://dx.doi.org/10.1056/NEJMoa1113135. 2012 [citado 1 de octubre de 2018]. Disponible en: https://www.nejm.org/doi/10.1056/NEJMoa1113135?url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org&rfr_dat=cr_pub%3Dwww.ncbi.nlm.nih.gov
25. Schröder FH, Hugosson J, Roobol MJ, Tammela TLJ, Zappa M, Nelen V, et al. The European Randomized Study of Screening for Prostate Cancer – Prostate Cancer Mortality at 13 Years of Follow-up. Lancet. 6 de diciembre de 2014;384(9959):2027-35.
26. Buzzoni C, Auvinen A, Roobol MJ, Carlsson S, Moss SM, Puliti D, et al. Metastatic Prostate Cancer Incidence and Prostate-specific Antigen Testing: New Insights from the European Randomized Study of Screening for Prostate Cancer. Eur Urol. 1 de noviembre de 2015;68(5):885-90.
27. Pinsky PF, Prorok PC, Yu K, Kramer BS, Black A, Gohagan JK, et al. Extended mortality results for prostate cancer screening in the PLCO trial with median follow-up of 15 years. Cancer. 15 de febrero de 2017;123(4):592-9.
28. Hugosson J, Carlsson S, Aus G, Bergdahl S, Khatami A, Lodding P, et al. Mortality results from the Goteborg randomised population-based prostate-cancer screening trial. Lancet Oncol. agosto de 2010;11(8):725-32.
29. Ilic D, Neuberger MM, Djulbegovic M, Dahm P. Screening for prostate cancer. Cochrane Database Syst Rev. 31 de enero de 2013;(1):CD004720.
30. Catalona W, Richie J, Ahmann F, Hudson M, Scardino P, Flanigan R, et al. Comparison of Digital Rectal Examination and Serum Prostate-Specific Antigen in the Early Detection of Prostate-Cancer - Results of a Multicenter Clinical-Trial of 6,630 Men. J Urol. mayo de 1994;151(5):1283-90.
31. Moyer VA, U.S. Preventive Services Task Force. Screening for prostate cancer: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med. 17 de julio de 2012;157(2):120-34.
32. Brenes Bermúdez FJ. Uso del antígeno prostático específico en atención primaria. SEMERGEN - Med Fam. 1 de abril de 2017;43(3):173-4.
33. Pinsky PF, Blacka A, Kramer BS, Miller A, Prorok PC, Berg C. Assessing contamination and compliance in the prostate component of the Prostate, Lung, Colorectal, and Ovarian (PLCO) Cancer Screening Trial. Clin Trials. agosto de 2010;7(4):303-11.
34. Shoag JE, Mittal S, Hu JC. Reevaluating PSA Testing Rates in the PLCO Trial. N Engl J Med. 5 de mayo de 2016;374(18):1795-6.
35. Schroder FH, Hugosson J, Roobol MJ, Tammela TLJ, Zappa M, Nelen V, et al. Screening and prostate cancer mortality: results of the European Randomised Study of Screening for Prostate Cancer (ERSPC) at 13 years of follow-up. Lancet. 6 de diciembre de 2014;384(9959):2027-35.
36. Grossman DC, Curry SJ, Owens DK, Bibbins-Domingo K, Caughey AB, Davidson KW, et al. Screening for Prostate Cancer: US Preventive Services Task Force Recommendation Statement. JAMA. 8 de mayo de 2018;319(18):1901-13.
37. Bibbins-Domingo K, Grossman DC, Curry SJ. The US Preventive Services Task Force 2017 Draft Recommendation Statement on Screening for Prostate Cancer: An Invitation to Review and Comment. JAMA. 16 de mayo de 2017;317(19):1949-50.
38. Mottet N, Bellmunt J, Bolla M, Briers E, Cumberbatch MG, De Santis M, et al. EAU-ESTRO-SIOG Guidelines on Prostate Cancer. Part 1: Screening, Diagnosis, and Local Treatment with Curative Intent. Eur Urol. abril de 2017;71(4):618-29.
39. Cepeda Piorno J, Rivas del Fresno M, Fuente Martín E, González García E, Muruamendiaraz Fernández V, Fernández Rodríguez E. [Advantages and risks of the use of prostate-specific antigen (PSA) in the health-care area No. 4 of Gijon (Asturias)]. Arch Esp Urol. junio de 2005;58(5):403-11.
40. Panach-Navarrete J, Gironés-Montagud A, Sánchez-Cano E, Doménech-Pérez C, Martínez-Jabaloyas JM. Uso del antígeno prostático específico en atención primaria (PSA). SEMERGEN - Med Fam. 1 de abril de 2017;43(3):189-95.
41. Sopeña-Sutil R, Tejido-Sánchez A, Galván-Ortiz de Urbina M, Guerrero-Ramos F, García-Álvarez G, Passas-Martínez JB. Evolución de las derivaciones de atención primaria a urología. Impacto de un protocolo en enfermedad prostática y de formación continuada. Actas Urol Esp. 1 de junio de 2015;39(5):296-302.
42. Haese A, de la Taille A, van Poppel H, Marberger M, Stenzl A, Mulders PFA, et al. Clinical Utility of the PCA3 Urine Assay in European Men Scheduled for Repeat Biopsy. Eur Urol. noviembre de 2008;54(5):1081-8.
43. Gittelman MC, Hertzman B, Bailen J, Williams T, Koziol I, Henderson RJ, et al. PCA3 Molecular Urine Test as a Predictor of Repeat Prostate Biopsy Outcome in Men with Previous Negative Biopsies: A Prospective Multicenter Clinical Study. J Urol. julio de 2013;190(1):64-9.
44. Tosoian JJ, Loeb S, Kettermann A, Landis P, Elliot DJ, Epstein JI, et al. Accuracy of PCA3 Measurement in Predicting Short-Term Biopsy Progression in an Active Surveillance Program. J Urol. febrero de 2010;183(2):534-8.
45. Tomlins SA, Rhodes DR, Perner S, Dhanasekaran SM, Mehra R, Sun XW, et al. Recurrent fusion of TMPRSS2 and ETS transcription factor genes in prostate cancer. Science. 28 de octubre de 2005;310(5748):644-8.
46. Tomlins SA, Aubin SMJ, Siddiqui J, Lonigro RJ, Sefton-Miller L, Miick S, et al. Urine TMPRSS2:ERG Fusion Transcript Stratifies Prostate Cancer Risk in Men with Elevated Serum PSA. Sci Transl Med. 3 de agosto de 2011;3(94):94ra72.
47. Dijkstra S, Govers TM, Hendriks RJ, Schalken JA, Van Criekinge W, Van Neste L, et al. Cost-effectiveness of a new urinary biomarker-based risk score compared to standard of care in prostate cancer diagnostics - a decision analytical model. Bju Int. noviembre de 2017;120(5):659-65.
48. Catalona WJ, Partin AW, Sanda MG, Wei JT, Klee GG, Bangma CH, et al. A Multicenter Study of [-2]Pro-Prostate Specific Antigen Combined With Prostate Specific Antigen and Free Prostate Specific Antigen for Prostate Cancer Detection in the 2.0 to 10.0 ng/ml Prostate Specific Antigen Range. J Urol. mayo de 2011;185(5):1650-5.
49. Lazzeri M, Briganti A, Scattoni V, Lughezzani G, Larcher A, Gadda GM, et al. Serum Index Test %[-2]proPSA and Prostate Health Index are More Accurate than Prostate Specific Antigen and %fPSA in Predicting a Positive Repeat Prostate Biopsy. J Urol. octubre de 2012;188(4):1137-43.
50. Stattin P, Vickers AJ, Sjoberg DD, Johansson R, Granfors T, Johansson M, et al. Improving the Specificity of Screening for Lethal Prostate Cancer Using Prostate-specific Antigen and a Panel of Kallikrein Markers: A Nested Case-Control Study. Eur Urol. agosto de 2015;68(2):207-13.
