REVISIÓN
Evaluación de la saciedad en personas que han sufrido trastornos de la conducta alimentaria
Evaluation of the satiety in people who have suffered eating disorders
Sandra Pinto González, Susana Martín Gutiérrez, Ignacio Jáuregui-Lobera, Griselda Herrero Martín.
Universidad Pablo de Olavide. Sevilla. España
* Autor para correspondencia.
![]()
This work is licensed
under a Creative
Commons
Attribution-NonCommercial-ShareAlike 4.0 International License
La revista no cobra tasas por el envío de trabajos,
Resumen
Las personas que sufren Trastornos de la Conducta Alimentaria presentan alteraciones fisiológicas en los mecanismos de control del hambre y la saciedad. Estos mecanismos están regulados tanto por señales procedentes del sistema digestivo, como por señales originadas en el sistema nervioso central, y señales informativas del estado nutricional y metabólico.
Conociendo estos mecanismos y las sustancias implicadas en su regulación, se pretende comprender las posibles causas de estas alteraciones, y sus posibles cambios tras superar el trastorno, diferenciando entre Anorexia Nerviosa, Bulimia Nerviosa y obesidad causada por Trastorno por Atracón.
Esta revisión tiene por objeto evaluar las alteraciones fisiológicas que presentan los pacientes con Anorexia Nerviosa, Bulimia Nerviosa y Trastorno por Atracón en los mecanismos de control del hambre y la saciedad durante el desarrollo del trastorno, y valorar la continuidad de estas alteraciones tras la superación de trastorno.
Palabras clave
Trastorno de la Conducta Alimentaria; mecanismos de control; hambre; saciedad; regulación de la ingesta; Anorexia Nerviosa; Bulimia Nerviosa; Trastorno por Atracón; obesidad
Abstract
People who suffer from eating disorders have physiological alterations in the control mechanisms of hunger and satiety. These mechanisms are regulated by signals from the digestive system, signals from the central nervous system, and informative signals of nutritional and metabolic status.
Knowing these mechanisms and the substances implied in their regulation, we try to understand the possible causes of these alterations, and their possible changes after overcoming the disorder, differentiating between Anorexia Nervosa, Bulimia Nervosa and obesity caused by Binge Eating Disorder.
The objective of this review is to evaluate the physiological alterations presented by patients with Anorexia Nervosa, Bulimia Nervosa and Binge Eating Disorder in the control mechanisms of hunger and satiety during the development of the eating disorder, and to assess the continuity of these alterations after overcoming disorder.
Keywords
eating disorder; mechanisms of control; hunger; satiety; regulation of food intake; Anorexia Nervosa; Bulimia Nervosa; Binge Eating Disorder; obesity
Introducción
Los Trastornos de Conducta Alimentaria (TCA) son un grupo de patologías psiquiátricas que se caracterizan por la presencia de alteraciones en relación a la ingesta de alimentos, dando lugar a un deterioro físico y psicosocial.
El manual diagnóstico y estadístico de los trastornos mentales, en su quinta edición (DSM-5) clasifica los Trastornos de la conducta alimentaria y de la ingesta de alimentos en 8 categorías: Anorexia nerviosa (AN), Bulimia nerviosa (BN), Trastorno por atracón (TA), otros trastornos alimentarios o de la ingesta de alimentos especificados (ej. Síndrome del comedor nocturno), otros trastornos de la conducta alimentaria o de la ingesta de alimentos no especificados, e incluye otros 3 trastornos que anteriormente se encontraban en la categoría de “Trastornos de inicio en la infancia, niñez y adolescencia” como son la Pica, Rumiación y Trastorno de restricción/evitación de la ingesta de alimentos(1).
Los TCA estudiados en nuestra revisión bibliográfica son Anorexia y Bulimia Nerviosa, y obesidad causada por Trastorno por atracón. La etiopatogenia de estos trastornos es de origen biopsicosocial, es decir, intervienen factores biológicos, socioculturales y psicológicos (personalidad previa).
A continuación, se detallan los aspectos más importantes y diferenciales de cada trastorno.
Anorexia Nerviosa (AN)
La característica principal de este trastorno es el rechazo a mantener el peso corporal igual o por encima del valor mínimo normal, en relación a la edad, talla y sexo(2).
Este sentimiento de rechazo se manifiesta a través de una restricción de la ingesta energética que produce una pérdida de peso superior al 15% del peso inicial, y conlleva a un peso corporal significativamente bajo.
Suele existir una asociación entre este trastorno y rasgos de personalidad con tendencia al perfeccionismo, hiperresponsabilidad, necesidad de aprobación y falta de respuesta a las necesidades internas. Estos pacientes no suelen tener conciencia de enfermedad ni del riesgo que corren al persistir en estas conductas(3).
Dependiendo del método utilizado para la pérdida de peso, podemos diferenciar dos tipos de AN: de tipo restrictivo o con atracones/purgas. En el primero caso, se recurre a dieta extrema, ayuno o ejercicio físico excesivo; mientras que el segundo tipo, se caracteriza por episodios recurrentes de atracones o purgas (vómito autoprovocado o uso incorrecto de laxantes y/o diuréticos).
El inicio de la anorexia nerviosa se sitúa en las etapas iniciales e intermedias de la adolescencia, con la aparición de las primeras restricciones en la ingesta.
Respecto al desarrollo del problema, desde los planteamientos de la teoría cognitiva conductual para la anorexia nerviosa(4) se define la necesidad extrema del control sobre la ingesta como característica central de este trastorno, que está asociada directamente a sentimientos de ineficacia, perfeccionismo y baja autoestima. Las personas con este trastorno experimentan como éxito el control que realizan sobre su propio cuerpo y que enmascara el fracaso percibido en otras áreas de funcionamiento. Es, por tanto, un medio para mejorar su autoestima ya que encuentran en el control de su cuerpo un instrumento para sentirse mejor con ellas mismas(2).
El mantenimiento del problema se produce a partir de tres mecanismos: la restricción de comida, que mejora su sentimiento de control; la propia situación de hambre, cuyos síntomas fisiológicos son percibidos como una amenaza sobre el control de la comida, y que les anima a seguir restringiendo la ingesta calórica; y las preocupaciones excesivas sobre la figura y peso corporal, que se encargan de sostener todo este proceso(5).
Bulimia Nerviosa (BN)
Este trastorno se caracteriza por un cuadro de ingesta voraz, acompañado de conductas compensatorias inapropiadas, y sentimientos de culpa y vergüenza.
Su distinción con la AN reside en la aparición de episodios recurrentes de atracón, seguidos de comportamientos compensatorios inapropiados, como pueden ser el vómito autoinducido, uso abusivo de laxantes y/o diuréticos, o ejercicio físico excesivo; que se realizan con el fin de evitar el aumento de peso y reducir la ansiedad.
Estas conductas compensatorias actúan como reforzadores negativos que mantienen el problema, el cual frecuentemente pasa desapercibido entre conocidos y familiares de la persona afectada; pues estos pacientes no suelen mostrar signos de infrapeso como ocurre en la AN, sino que suelen tener un peso normal o incluso sobrepeso, haciendo que en ocasiones el problema sea difícil de diagnosticar(2).
Al igual que en los casos de AN, los pacientes con BN presentan pensamientos disfuncionales relacionados con el peso y la silueta corporal, en los que basan su autoevaluación.
Es por ello que estos pacientes suelen presentar estados emocionales negativos como ansiedad, depresión e ira. “El hambre que experimentan no sólo es material sino también emocional y la comida cumple un papel esencial en la resolución de los problemas emocionales y existenciales”(3).
Como podemos observar, en ambos trastornos existe una alteración en la regulación de los mecanismos de hambre/saciedad, llegando en la AN a perderse la sensación de hambre, y en la BN descontrolando la ingesta de alimentos.
Trastorno por atracón (TA)
El trastorno por atracón se caracteriza por la aparición de episodios de ingesta compulsiva (atracones) que se definen por dos características esenciales; ingesta excesiva de alimentos en un corto periodo de tiempo, y sensación de pérdida de control sobre esa ingesta.
También existe malestar posterior a los atracones pero, a diferencia de la BN, hay ausencia de conductas compensatorias. El trastorno por atracón está asociado con obesidad y con una elevada comorbilidad psiquiátrica y médica(6).
Con esta revisión se pretenden buscar y analizar las posibles alteraciones en los mecanismos de control de hambre-saciedad y sus diferencias en AN, BN y TA, para así poder comprender mejor estas enfermedades y evaluar el posible mantenimiento de las alteraciones tras superar el trastorno.
Metodología
Para realizar la búsqueda bibliográfica, hemos recurrido a las bases de datos PubMed, SciELO y Dialnet.
Los criterios de inclusión empleados para la búsqueda han sido; artículos completos, de acceso libre, redactados en inglés o español, que evalúen los cambios en los mecanismos de control hambre-saciedad en personas que han padecido un trastorno de la conducta alimentaria. Quedan excluidos aquellos estudios realizados en animales.
Los términos utilizados en la búsqueda han sido: satiety, eating disorder, anorexia nervosa, bulimia nervosa, regulation of food intake, mecanismos de control hambre-saciedad, alteraciones en la saciedad, cambios tras superar un Trastorno de la Conducta Alimentaria.
Los resultados obtenidos tras la búsqueda fueron escasos, sólo 26 artículos, de los cuáles únicamente 11 aportaban información relevante para la elaboración de este artículo. Por ello, se amplió el criterio de inclusión, incorporando aquellos estudios y revisiones bibliográficas realizadas sobre los mecanismos de control hambre-saciedad en personas sanas, y sus alteraciones durante el desarrollo de un trastorno alimentario.
Resultados
Antes de comenzar, se debe diferenciar entre hambre-apetito, y plenitud-saciedad. Se define “hambre” como el impulso de ingerir alimentos para satisfacer las necesidades fisiológicas del organismo. En cambio, el término “apetito” hace referencia al impulso instintivo o antojo de ingerir un determinado alimento para satisfacer los deseos personales, es decir, es de carácter emocional.
Por su parte, el término “plenitud” hace referencia a la sensación producida en cuanto se finaliza el tiempo de ingestión del alimento a la hora de la comida. Este proceso tiene que ver con el volumen, el peso y el contenido energético de los alimentos. La saciedad, en cambio, consiste en la inhibición de la sensación de hambre(7) y el deseo de seguir comiendo de una comida a otra. La duración de la sensación de saciedad depende de la cantidad y del tipo de alimento consumido en la comida previa(8).
Por tanto, se podrían considerar los procesos de plenitud y saciedad como los causantes de que las personas comiencen a comer, mantengan la ingesta y, a continuación, llevarla a su fin, generando una supresión de la motivación por comer (inmediatamente después de una comida), y preservar esa inhibición por un determinado periodo de tiempo(9).
Esta regulación de la ingesta alimentaria se lleva a cabo mediante una compleja red funcional en la que participan tanto señales neurales como humorales, que interconectan funcionalmente diversos tejidos implicados en la homeostasis del estado nutricional(7) (Figura 1).
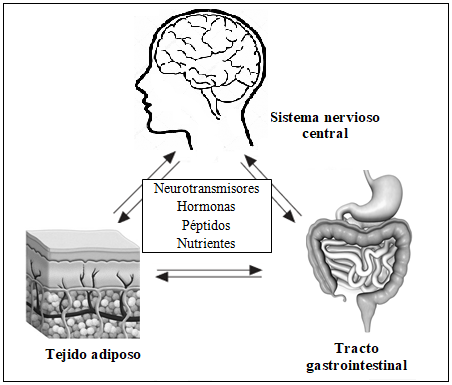
Figura1. Red funcional de regulación de la ingesta alimentaria. Adaptada de Salvador J. et al(7)
El hipotálamo es la región cerebral clave en el control de la alimentación. Las múltiples regiones hipotalámicas envían y reciben señales procedentes de la ínsula, la corteza orbitofrontal, el núcleo accumbens y el sistema de recompensa dopaminérgico, así como señales químicas, incluyendo péptidos y hormonas gastrointestinales, para regular la conducta alimentaria. Los estudios muestran una compleja interacción entre los mecanismos homeostáticos y hedonistas de la ingesta, compartiendo mecanismos neurobiológicos con las adicciones(10).
Son muchas las moléculas implicadas en los mecanismos de regulación del hambre-saciedad. Muchas de ellas son sintetizadas en sistemas endocrinos difusos como el tejido adiposo, el tracto gastrointestinal o el Sistema Nervioso Central (SNC). Los mecanismos que regulan su secreción y su acción no son bien conocidos. No obstante, el descubrimiento de péptidos como la leptina, grelina o la colecistoquinina (CCK), entre otros, han permitido profundizar en el conocimiento de la regulación de la ingesta y sus relaciones con otros sistemas homeostáticos(7).
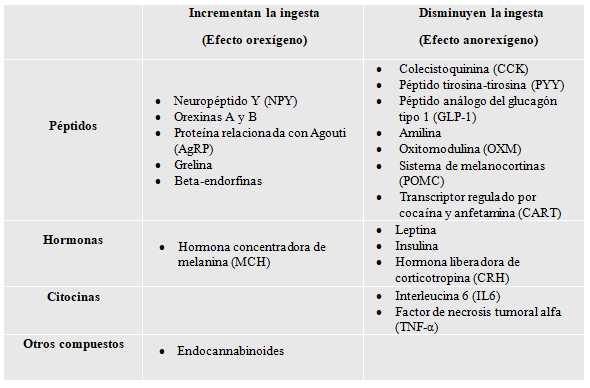
A continuación, se recogen diferentes sustancias implicadas en los mecanismos de control de hambre-saciedad, de las que se tratarán más profundamente a lo largo de esta revisión bibliográfica (Tabla 1).
Tabla 1. Sustancias reguladoras del hambre/saciedad
El sistema de control de la ingesta alimentaria está formado, desde un punto de vista funcional, por los siguientes componentes:
v Señales procedentes del tracto gastrointestinal
v Señales informativas del estado nutricional y metabólico
v Señales originadas en el sistema nervioso central
Señales procedentes del tracto gastrointestinal
En respuesta a la llegada de alimentos al tubo digestivo, el tracto gastrointestinal envía señales al SNC tanto por vía neural, como mediante la secreción de péptidos que se originan en las células de la mucosa gástrica e intestinal. Estas señales controlan la saciedad, y se caracterizan por regular el comportamiento alimentario a corto plazo, es decir, el inicio, mantenimiento y la finalización de la ingesta.
En cambio, se producen numerosas interacciones con otras señales periféricas que, procedentes del tejido adiposo y del páncreas, informan al SNC acerca de la homeostasis metabólica y del estado nutricional. De este modo, a excepción de la grelina, los péptidos de origen gastrointestinal se liberan en respuesta a la ingesta y provocando un efecto saciante rápido y de corta duración, cuya actividad se ve modulada por el estado nutricional del individuo(7).
Estos péptidos son liberados por células enteroendocrinas, y pueden actuar como hormonas o bien ejercer un efecto paracrino sobre células cercanas(11).
Las principales hormonas peptídicas con efecto saciante o también conocidas como hormonas anorexigénicas son:
Colecistoquinina (CCK), secretada por las células L del duodeno y yeyuno, que son estimuladas por la ingesta de grasas y proteínas, y los productos derivados de su metabolización. La CCK alcanza su pico de actuación a los 10-30 minutos de haberse iniciado la ingesta(7,13).
La acción de la CCK se realiza mediante la interacción con sus receptores CCK-1, localizados principalmente en el tracto gastrointestinal, y con receptores CCK-2, ubicados en el sistema nervioso.
La CCK junto a su receptor CCK-1 intervienen en la inhibición de la grelina y en la estimulación de la liberación del péptido tirosina-tirosina (PYY), produciendo un efecto saciante (7,13).
Además de estos mecanismos, la CCK puede actuar a modo endocrino sobre receptores específicos del SNC, aunque se considera que la acción saciante tiene lugar fundamentalmente como consecuencia de los efectos gastrointestinales. Asimismo, la CCK también estimula la contracción de la vesícula biliar por efecto directo sobre receptores CCK-1 en el músculo liso, estimulando la secreción pancreática, modulando la actividad motora intestinal, y enlenteciendo el vaciamiento gástrico por interacción con receptores pilóricos(7).
Así pues, conceptualmente, la CCK ejerce un efecto saciante postprandial rápido, encaminado a la finalización de la ingesta. Se ha observado un efecto potenciador bidireccional del efecto saciante entre la leptina y la CCK, así como entre la insulina y la CCK, traduciendo la interacción entre señales controladoras de la ingesta a corto y largo plazo.
En pacientes con obesidad se han detectado altos niveles de esta hormona, sin embargo, los niveles son bajos en individuos con anorexia(13).
Péptido Tirosina-Tirosina (PYY), pertenece a la misma familia que el polipéptido pancreático (PP) y el neuropéptido Y (NPY). El PYY es sintetizado por las células L del íleon distal y del colon, y secretado en respuesta a la ingesta de carbohidratos y grasas. Su secreción es directamente proporcional al contenido energético de la ingesta.
Inicialmente, las células L segregan PYY (1-36), el cuál es metabolizado posteriormente a PYY (3-36), ejerciendo este último el efecto anorexiante, ya que inhibe la secreción de NPY y, por tanto, disminuye el apetito y aumenta gasto calórico(7,13).
Los valores plasmáticos de PYY (3-36) aumentan a partir de los 15-30 minutos del comienzo de la ingesta y permanecen elevados durante las siguientes 6 horas(13).
En obesidad los valores basales de PYY se encuentran bajos en comparación a sujetos delgados. Por el contrario, en anorexia nerviosa estos valores se encuentran más elevados (p <0.0001). Existen diferencias en los subtipos de anorexia nerviosa, los valores plasmáticos de PYY antes de la ingesta son más elevados en AN restrictiva que en AN purgativa, incluso tras controlar el IMC(14).
En relación a la bulimia nerviosa, no se observa un aumento de los niveles de PYY tras la ingesta de alimentos(13).
Péptido análogo del glucagón tipo 1 (GLP-1), liberado por su precursor proglucagón, y secretado por las células L enteroendocrinas situadas en el íleon distal y el colon. La liberación de GLP-1 se produce por la llegada de nutrientes a las regiones proximales del intestino delgado, principalmente por la ingesta de grasas e hidratos de carbono, así como por el contenido calórico. Su vida útil es muy corta; aproximadamente 2 minutos, ya que posteriormente es degradado por la enzima dipeptidil peptidasa IV(7,11,13).
GLP-1 es un potencial inhibidor del apetito tanto a nivel central, ya que puede atravesar la barrera hematoencefálica; como a nivel periférico en el tubo digestivo, enlenteciendo el vaciado gástrico y el tránsito intestinal. Su principal efecto es la liberación de insulina y la inhibición del glucagón(7).
La concentración plasmática de GLP-1 es inferior en individuos con obesidad. Debido a su gran efecto anorexiante, se han buscado alternativas para el desarrollo de un análogo de GLP-1 con una vida media mayor para el tratamiento de esta patología(13).
Con respecto a los individuos que padecen anorexia, se observa al igual que en obesidad, concentraciones de GLP-1 bajas en comparación con individuos sanos(13). Sin embargo, en el estudio llevado a cabo por Natacha Germain et al.(15) se observan concentraciones circadianas de GLP-1 significativamente superiores (p <0.001) en individuos con anorexia nerviosa comparándolos con controles sanos y con sujetos de constitución delgada.
Existen otros péptidos de origen gastrointestinal que presentan un efecto potenciador de la saciedad, cuyas características, efectos y mecanismos reguladores son menos conocidos que los anteriores, como es la oxintomodulina (OXM) y la amilina, entre otros.
Por otra parte, el tracto digestivo también secreta compuestos estimulantes del apetito, como es la Grelina.
Grelina, hormona peptídica de 28 aminoácidos, perteneciente a la familia de secretagogos de hormona de crecimiento. Es la única de origen gastrointestinal con efecto orexiante, y la molécula con mayor poder estimulante del apetito encontrado en la circulación periférica(7).
Es producida principalmente por la mucosa del fundus gástrico; aunque también la producen otros tejidos como la hipófisis (concretamente las células somatotropas, lactotropas y tirotropas), varios núcleos del hipotálamo, placenta y corazón. Además, el hígado, el páncreas endocrino, las gónadas, los pulmones y los linfocitos también expresan pequeñas cantidades de grelina(12).
Esta variada distribución sugiere que la grelina posee un amplio espectro de actividades biológicas. Su principal función es la estimulación del apetito y disminución del gasto energético, aunque también interviene en el metabolismo de glúcidos y lípidos, en la regulación del ciclo sueño-vigilia, en la actividad cardíaca, así como en la motilidad gástrica (13,16).
La grelina parece estimular el apetito y la ingesta alimentaria mediante acciones tanto en las vías orexigénicas como anorexigénicas del hipotálamo. Por un lado, tiene un efecto excitatorio sobre las neuronas productoras de neuropéptido Y (NPY) y proteína asociada Agouti (AGRP); y por otro lado, ejerce un efecto inhibidor sobre las neuronas productoras de pro-opiomelanocortina (POMC), previniendo así la liberación del péptido anorexigénico.
La secreción de grelina se ve influenciada por la ingesta de alimentos. En situaciones de ayuno, los niveles de grelina son relativamente altos y no bajan hasta una vez terminada la ingesta, independientemente del contenido calórico de la misma. En cambio, en pacientes con anorexia nerviosa no se produce una caída significativa de los niveles de grelina plasmática después de la ingesta. Esta respuesta anómala puede deberse a una la alteración en la expresión, modulación y señalización de esta hormona, que forma parte de un proceso adaptativo a la restricción de alimentos continuada, y cuya finalidad es restaurar la conducta alimentaria normal(13,16).
La concentración de grelina tiene una correlación inversa a la adiposidad, es decir, cuanto mayor contenido graso, menor será su concentración. Por ello, los pacientes obesos presentan bajas concentraciones de grelina. Sin embargo, los pacientes con bulimia nerviosa acompañada de episodios de vómitos, presentan unos niveles plasmáticos de grelina mucho mayores que los pacientes con bulimia nerviosa sin vómitos(13).
El tratamiento nutricional junto con el tratamiento cognitivo-conductual en individuos con anorexia nerviosa hospitalizados de urgencia, provoca una disminución e incluso la normalización de los niveles plasmáticos de grelina(16).
Señales informativas del estado nutricional y metabólico
Además de las señales que proceden del tracto gastrointestinal, relacionadas generalmente con mensajes dirigidos al comienzo o finalización de la ingesta, existen otros indicadores que informan al SNC sobre situación nutricional global del organismo a largo plazo. Las principales hormonas que intervienen en este proceso son la leptina y la insulina.
Leptina, hormona sintetizada y secretada principalmente por el tejido adiposo (adipocitos blancos concretamente), y otros tejidos extra-adiposos como la placenta, músculo esquelético y estómago(11), la cual es liberada a la circulación sistémica.
La acción de la leptina sobre el comportamiento alimentario tiene lugar en el hipotálamo, donde estimula el sistema melanocortinérgico e inhibe el complejo neuronal NPY/AgRP, lo que produce un efecto anorexiante y estimulador del consumo energético (Figura 2)(7).
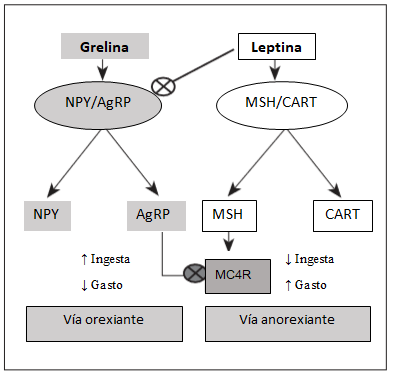
Figura 2. Mecanismos de acción de la grelina y leptina. Salvador J. et al.(7)
Su principal función es producir saciedad. La leptina alcanza el SNC y se une a sus receptores OB-R localizados en el hipotálamo provocando un aumento de la actividad neuronal de las neuronas POMC/CART, y disminuyendo la actividad de las neuronas NPY/AgPR, lo cual provoca una reducción de la ingesta de alimentos y un aumento del gasto energético debido a la disminución de la expresión de péptidos orexigénicos, y al aumento de la expresión de péptidos anorexigénicos.
La regulación de la concentración de leptina está sujeta a múltiples factores. Las concentraciones de estrógenos, glucocorticoides e insulina, junto con a la ingesta de alimentos y diversas moléculas (cortisol, TNF-α, il-6), estimulan la secreción de leptina(17)
Las concentraciones en plasma aumentan en proporción a la masa de grasa corporal, por tanto, se puede utilizar como biomarcador de la adiposidad. Las personas con obesidad presentan mayores concentraciones de leptina circulante en comparación con sujetos delgados, en cambio, aparece una resistencia a la misma, por lo que pierde su efecto saciante. En AN, los niveles de leptina son bajos debido a una menor cantidad de grasa corporal(17), lo que posibilita y potencia los efectos de otras señales centrales y periféricas de acción orexiante (NPY, AgRP, grelina), y atenúa las de carácter anorexiante (CCK, PYY, GLP-1) para favorecer la ingesta de alimentos(7).
Esto convierte a esta hormona en el principal regulador del peso y de la conducta alimentaria a largo plazo(18).
Insulina, hormona secretada por las células β del páncreas. Los niveles de insulina en plasma vienen determinados por el contenido de masa grasa, y por la ingesta reciente de carbohidratos y proteínas.
Su mecanismo de acción se basa en su unión con sus receptores del SNC, situados en el hipotálamo. Atraviesa el SNC y se une a sus receptores en la misma región hipotalámica donde actúa la leptina, ejerciendo ambas un efecto anorexigénico, provocando saciedad. La insulina, además, activa la termogénesis, amplifica el efecto inhibidor de la ingesta de la CCK y la hormona del crecimiento, y disminuye la expresión del neuropéptido Y (NPY)(18).
En situaciones de ayuno los niveles plasmáticos de insulina son bajos, pero se ven aumentados con la realimentación(17).
Citoquinas, son marcadores inmunológicos que se relacionan con el sistema neuroendocrino y nervioso ya que, entre otras de sus funciones, destaca su participación en la regulación del metabolismo y del sistema neuroendocrino, liberando hormonas involucradas en la regulación del apetito que actúan inhibiendo la ingesta(19).
Sus mecanismos pueden ser directos o a través de inducir cambios en las concentraciones de insulina, leptina o en la actividad del eje hipotálamo-hipófiso-adrenal.
El factor de necrosis tumoral alfa (TNF-α), y la interleucina 6 (IL-6) son las más características. Su incremento en sangre produce efectos anorexígenos. Por un lado, inhibe la expresión de hormonas relacionadas con el apetito (grelina, NPY), y por otro, provoca un aumento en la producción de leptina.
En el metaanálisis llevado a cabo por Dalton B et al.(19) se observa como los niveles de estas citoquinas son elevadas en el grupo de desórdenes alimentarios (anorexia y bulimia nerviosa) frente a los controles sanos.
Señales originadas en el sistema nervioso central
La información transmitida tanto por el estado nutricional como por las reservas de tejido adiposo, así como los mensajes transportados a través de las hormonas gastrointestinales, alcanzan el SNC donde modularán la actividad de grupos neuronales concretos que serán los responsables últimos de la ingesta alimentaria a través de la regulación de la expresión de hambre o saciedad.
El control de la ingesta está regulado en el SNC por el hipotálamo y el tronco cerebral. En diversas regiones del hipotálamo se traducen las señales procedentes del tracto digestivo y de otros órganos (hígado, tejido adiposo, páncreas), expresando péptidos que intervienen en la regulación del apetito(7).
Neuropéptido Y (NPY), péptido de 36 aminoácidos perteneciente a la familia del polipéptido pancreático y del PYY, caracterizado por su gran efecto orexiante. Sus niveles son elevados antes de la ingesta alimentaria y se mantienen durante ella, lo que sugiere que tiene un papel en el inicio y mantenimiento de la ingesta. Su síntesis ocurre en el núcleo arcuato del hipotálamo(7,17).
Sus principales funciones son: regulación del peso corporal, incremento de la ingesta (especialmente HC), disminución de la termogénesis, y estimulación de la lipogénesis en hígado y tejido adiposo. Para poder llevar a cabo sus funciones biológicas, debe de unirse a sus receptores Y1 e Y5(18).
La ruta del NPY se activa durante el ayuno, cuando hay una pérdida de peso corporal, si existe una restricción de la ingesta calórica, ejercicio excesivo, en situación de lactancia, y en casos de diabetes no controlada(17).
En cuanto a la regulación hormonal, es destacable que la grelina estimula la producción del NPY, mientras que la leptina la inhibe(7).
En individuos con AN, los niveles de NPY son elevados frente a controles sanos, sin embargo, los niveles se normalizan tras la recuperación ponderal y reaparición del ciclo menstrual(17).
Hormona concentradora de melanina (MCH), es un péptido de 19 aminoácidos sintetizado en la zona incerta del subtálamo y en el hipotálamo lateral, cuya función es producir un efecto orexiante al unirse con su receptor MCH 1(18).
Orexinas A y B, son péptidos de 33 y 28 aminoácidos respectivamente, que se sintetizan en la misma región que la MCH y actúan sobre 2 tipos de receptores, distribuidos en el núcleo dorsomedial y el núcleo arcuato.
Entre sus funciones destacan la estimulación del apetito (efecto orexiante) y su implicación en la regulación del ciclo sueño-vigilia(6). La orexina A estimula la ingesta y consumo de oxígeno, y su expresión se ve inhibida por la presencia de glucosa y leptina en plasma, y estimulada por la presencia de grelina.
En el estudio llevado a cabo por Bronskyse J et al.(20) se observan niveles altos de orexinas en niñas con AN, sin embargo, estos niveles disminuyen durante las 8 semanas de realimentación.
Proteína relacionada con Agouti (AgRP), péptido con efecto orexígeno, cuya expresión se produce en todas las neuronas del núcleo arcuato del hipotálamo que sintetizan neuropéptido Y. Su principal mecanismo de acción consiste en bloquear los receptores MC3 y MC4 de la melanocortina, impidiendo así su efecto anorexiante(7).
Las neuronas NPY/AgRP se inhiben por la acción de la insulina y la leptina, y son activadas por la grelina. De este modo, constituye uno de los sistemas funcionales hipotalámicos más importantes en el control del apetito.
Su concentración alcanza niveles elevados durante el ayuno y disminuye con la ingesta (18).
Melanocortinas, grupo de hormonas peptídicas provenientes de su precursor proopiomelanocortina (POMC) que, por efecto de las enzimas proconvertasas, da lugar a diferentes péptidos como son el alfa, beta y gamma MSH (hormona estimulante de melanocitos), la corticotropina (ACTH), y betaendorfina, entre otros.
El péptido más ligado a la regulación del comportamiento alimentario es el alfa-MSH, que actúa principalmente produciendo saciedad y regulando el gasto energético(23).
Hormona liberadora de Corticotropina (CRH), expresada en el núcleo paraventricular hipotalámico ejerce efecto anorexigénico(7). Unido a sus receptores, regula el balance energético e influye en la respuesta ante el estrés. Anormalidades en la señalización de sus receptores se relaciona con la fisiopatología de los desórdenes alimenticios(18).
Sistema Endocannabinoide, complejo de señalización compuesto por receptores, ligandos y enzimas de síntesis y degradación que mantiene la homeostasis energética(21). Los receptores CB1 se expresan en regiones del SNC implicadas en la regulación del comportamiento alimentario, y en órganos periféricos como el tejido adiposos, tejido gastrointestinal, músculo esquelético y músculo hepático; mientras que los receptores CB2, se localizan en las células del sistema hematopoyético e inmunológico, junto con los ligandos endógenos anandamida (AEA) y 2-araquidonoilglicerol (2AG), y se encuentran vinculados a la regulación neuroendocrina tanto en animales como en humanos(21,22).
El sistema endocannabinoide se encuentra profundamente involucrado en los mecanismos de control hambre-saciedad.
Este sistema puede estar implicado en la fisiopatología de los TCA. En el estudio llevado a cabo por Monteleone Matias et al.(22) se observaron niveles plasmáticos elevados de AEA en pacientes con TCA. Los niveles altos de AEA se correlacionaron inversamente con los niveles de leptina en anorexia nerviosa (p=0.03). Sin embargo, en pacientes con trastorno por atracón, los niveles de AEA eran altos pero no existía correlación con los niveles de leptina, debiéndose a una posible señalización deficiente de la hormona.
Transcriptor regulado por anfetamina y cocaína (CART), péptido expresado de manera significativa en regiones del hipotálamo relacionadas con el control de la ingesta, como son el núcleo arcuato, paraventricular, dorsomedial y lateral, junto a otros neuropéptidos anorexigénicos como la propiomelanocortina (POMC), precursor de la melanocortina y péptidos orexigénicos, el neuropéptido Y (NPY), y el péptido relacionado con la proteína del gen Agouti (AgRP)(7,17).
En estas regiones hipotalámicas, y especialmente en el núcleo arcuato, coexisten sistemas con capacidad orexiante, como el constituido por el NPY y AgRP; y otros con efecto anorexiante, como el formado por la melanocortina y CART. Muchas señales hormonales alcanzan esta región e interactúan con los receptores localizados en estos sistemas para ejercer así sus efectos estimuladores o inhibidores del apetito, conformando el mecanismo regulador del hambre-saciedad.
Mientras que la leptina, la insulina y el PYY (3-36) inhiben la actividad del sistema NPY/AgRP y estimulan la del complejo melanocortina/CART; la grelina ejerce el efecto contrario. Ambos sistemas se encuentran conectados bidireccionalmente(24).
Ante bajos niveles de leptina o de su receptor, se produce una reducción en la expresión de CART, lo que sugiere su relación en el efecto anorexiante de la leptina(7).
En AN, los niveles de CART se encuentran elevados, sin embargo, vuelven a normalizarse tras la completa recuperación del paciente(17).
Otros péptidos y neurotrasmisores, como la hormona liberadora de corticotropina (CRH), las urocortinas, neurotensina y serotonina, cuyas funciones están relacionadas con la inhibición de la ingesta alimentaria; y el péptido análogo a la galanina (GALP) y ácido gamma-antibutírico (GABA), que actúan estimulando la ingesta, entre otros(7).
Discusión
Se han observado diferentes alteraciones en los mecanismos de control hambre-saciedad en función del trastorno analizado. A continuación, analizaremos cada una de ellas.
Alteraciones en Anorexia Nerviosa
En AN se observa una baja concentración de leptina, frente a unos niveles de grelina aumentados. Pese a ello, las pacientes con anorexia no presentan un aumento del apetito, posiblemente por la pérdida de sensibilidad de los receptores a causa de la restricción calórica. Estos cambios son reversibles tras la recuperación ponderal.
En cuanto a las concentraciones de CCK e insulina, aparecen disminuidas en pacientes con anorexia, lo cual favorece el efecto orexiante de otros compuestos (Figura 3).
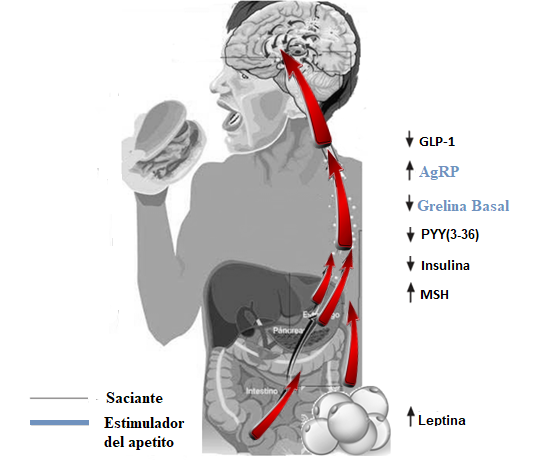
Figura 3. Señales reguladoras de la ingesta en anorexia nerviosa
Se ha observado que diferentes citoquinas, como el TNF-α y la IL6, desempeñan un papel importante en el mantenimiento de la enfermedad, ya que sus altas concentraciones de forma prolongada conducen a una inhibición de la ingesta. Además, estas citoquinas favorecen la producción de calor y la pérdida ponderal(26).
Alteraciones en Bulimia Nerviosa
Algunos estudios muestran que existen alteraciones en la saciedad tras la ingesta en pacientes con BN. Se ha observado una disminución de los niveles de leptina y un aumento de NPY en estos individuos (Figura 4).
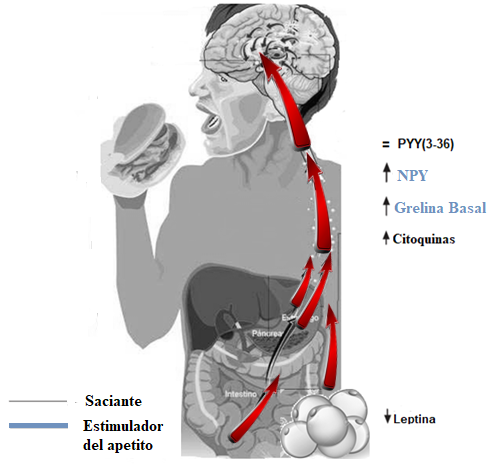
Figura 4. Señales reguladoras de la ingesta en bulimia nerviosa
Otras investigaciones señalan unas concentraciones de grelina mucho mayores en pacientes con bulimia nerviosa purgativa, que en aquellos no purgativa, lo cual contribuiría a la ingesta compulsiva(27).
En cualquier caso, parece que las alteraciones en los niveles de péptidos implicados en el control del comportamiento alimentario son secundarias, ya que no se observan desviaciones significativas en las concentraciones de leptina, NPY y PYY (3-36) en pacientes recuperadas de anorexia o bulimia nerviosa(28).
Alteraciones en obesidad asociada a Trastorno por atracón
En obesidad, se ha observado un aumento en la concentración de leptina, relacionada con el mayor contenido adiposo, la cual no se ve reflejada en un mayor efecto anorexiante, debido a alteraciones en su trasporte y unión con sus receptores, provocando una resistencia a la leptina.
Además, la obesidad se relaciona frecuentemente a una hiperinsulinemia asociada a insulinorresistencia, lo que contribuye a la pérdida de su efecto saciante(25).
En cuanto a las concentraciones de CCK pre y postpandrial, se ha observado que no hay diferencias significativas entre pacientes obesos e individuos con normopeso. La grelina sí se ve disminuida en obesos frente a controles, tendiendo a normalizarse al producirse una reducción ponderal, lo cual reafirma la hipótesis de que la grelina es un marcador del estado nutricional.
También se ha detectado que las concentraciones de otros péptidos de efecto saciante, como son GLP-1 y PYY (3-36), están disminuidas en individuos obesos, tanto basalmente como en respuesta a la ingesta (Figura 5).
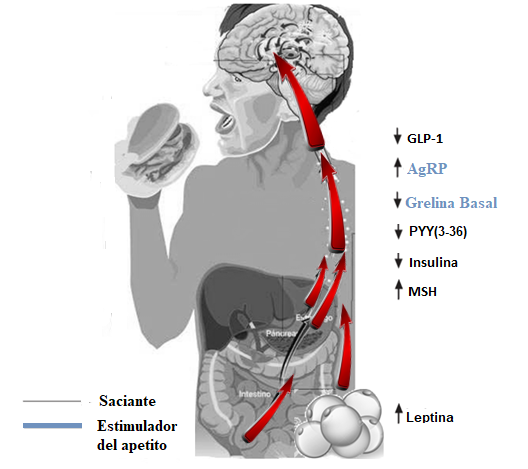
Figura 5. Señales reguladoras de la ingesta en obesidad.
Por último, en cuanto a los valores de MSH y AgRP, se observa que las concentraciones de ambos péptidos están elevadas en el paciente obeso, manteniendo los niveles elevados tras la pérdida de peso.
Conclusiones
Existen muchos estudios acerca de la regulación del comportamiento alimentario y sus alteraciones, tanto en sujetos sanos como enfocados a trastornos de la conducta alimentaria; pero son pocos los que analizan estas alteraciones tras haber superado un TCA, lo cual dificulta nuestra investigación.
Se ha observado que las alteraciones presentes en pacientes con AN se revierten con la recuperación ponderal, por lo que, podemos decir que no habrá cambios en la saciedad tras superar la enfermedad.
En cambio, en pacientes tratados de BN se continúan presentando dificultades para detectar las señales de saciedad una vez superado el trastorno. Las concentraciones de grelina se encuentran aumentadas, lo que contribuye a la aparición de episodios de ingesta compulsiva.
Por otro lado, en individuos obesos se ha detectado una disminución de las concentraciones de otros péptidos de efecto saciante, como son GLP-1 y PYY (3-36), tanto basalmente como en respuesta a la ingesta. Sin embargo, los niveles de MSH y AgRP (péptidos de efecto orexígeno), se encuentran elevados incluso tras la pérdida de peso, lo cual contribuye al mantenimiento de una ingesta excesiva.
Por tanto, se podría intuir que los mecanismos de control hambre-saciedad continúan alterados, en cierta medida, en pacientes con BN y obesidad asociada a TA tras la recuperación. De ahí la importancia del tratamiento nutricional durante la recuperación, para que los pacientes aprendan cual es la ingesta adecuada de alimentos, ya que no siempre reciben las señales físicas/fisiológicas de saciedad.
Para ello, también se emplean tratamientos farmacológicos que contribuyen a producir saciedad, así como técnicas de mindfulness para conectar con las sensaciones corporales, permitiendo identificar las señales de hambre y saciedad.
En conclusión, se necesitarían más estudios acerca de los cambios producidos en los mecanismos de control del hambre-saciedad tras superar el TCA para poder afirmar si éstos son o no reversibles a largo plazo.
Referencias
1. Vázquez R, López X, Ocampo MT, y Mancilla-Díaz JM. Eating disorders diagnostic: from the DSM-IV to DSM-5. Rev Mex Trastor Aliment. 2015; 6: 108-120.
2. Fairburn CG, Harrison, PJ. Eating disorders. Lancet. 2003; 361(9355): 407–16.
3. Bayón Pérez C, Bonan V. Trastornos de la conducta alimentaria e intervenciones psicoterapéuticas que incorporan mindfulness. En: Miró MT, Simón V, editores. Mindfulness en la práctica clínica. 3ª Edición. Bilbao: Desclée de Brouwer, 2012.
4. Fairburn CG, Shafran R, Cooper Z. A cognitive behavioural theory of anorexia nervosa. Behav Res Ther, 1999 Jan; 37(1): 1-13.
5. Fairburn, CG, Cooper Z, Bohn K, O’Connor ME, Doll H, Palmer RL. The severity and status of eating disorder NOS: implications for DSM-V. Behav Res Ther. 2007 Aug; 45(8): 1705-15.
6. García A. El trastorno por atracón en el DSM-5. Rev Iberoam Psicosom. 2014; 110:70-74.
7. Frühbeck G, Salvador J. Regulación de la ingesta alimentaria: una perspectiva clínica. Endocrinol y Nut. 2005; 52(8): 404-430.
8. Nuñez Hernández VJ, Vargas Cerero EA, Sánchez Madrigal J, Jaramillo E, Martínez Navarro J, Nava A. Nociones sobre fisiología del apetito. Apetito y hambre. Residente. 2014; 9(1): 15-19.
9. Bellisle F, Blundell JE. Satiation, satiety and the control of food intake. 1ª Edición. England Woodhead Pub.; 2013.
10. Palma J-A, Iriarte J. Regulación del apetito: bases neuroendocrinas e implicaciones clínicas. MedClin (Barc). 2012; 139(2): 70–75.
11. Strader AD, Woods SC. Asociación Americana de Gastroenterología Hormonas gastrointestinales e ingesta de alimentos. Rev Gastroenterol Mex. 2005; 70(4): 439-452.
12. Tucci S. Grelina en regulación del apetito y papel en obesidad y trastornos alimentarios: Abordajes terapéuticos. Rev Venez. Endocrinol y Metab. 2008; 6(2): 15-23.
13. Crespo MÁ, González LC, Lozano MG, Paz SF, Pérez MR, Gago EV, et al. Las hormonas gastrointestinales en el control de la ingesta de alimentos. Endocrinol y Nut. 2009; 56(6): 281-351.
14. Eddy KT, Lawson EA, Meade C, Meenaghan E, Horton SE, Misra M, et al. Appetite regulatory hormones in women with anorexia nervosa: Binge-eating/purging versus restricting type. J Clin Psychiatry. 2015 Jan; 76(1): 19-24.
15. Germain N, Galusca B, Le Roux CW, Bossu C, Ghatei MA, Lang F, et al. Constitutional thinness and lean anorexia nervosa display opposite concentrations of peptide YY, glucagon-like peptide 1, ghrelin, and leptin. Am J Clin Nutr. 2007 Apr; 85(4): 967-71.
16. Schalla MA, Stengel A. The role of ghrelin in anorexia nervosa. Int J Mol Sci. 2018 Jul; 19(7): 2117.
17. Lourenço T. Análisis de la implicación de diferentes factores reguladores del apetito y del estado nutricional en pacientes con Anorexia Nerviosa y en pacientes con bajo peso constitucional. Universidad Autónoma de Madrid. Departamento de medicina. 2007.
18. González ME, Ambrosio KG, Sánchez S. Regulación neuroendocrina del hambre, la saciedad y mantenimiento del balance energético. Invest Salud. 2006 Dic; 8(3): 191-200.
19. Dalton B, Bartholdy S, Robinson L, Solmi M, Ibrahim MAA, Breen G, et al. A meta-analysis of cytokine concentrations in eating disorders. J Psychiatr Res. 2018 Aug; 103: 252-264.
20. Bronsky J, Nedvidkova J, Krasnicanova H, Vesela M, Schmidtova J, Koutek J, et al. Changes of orexin A plasma levels in girls with anorexia nervosa during eight weeks of realimentation. Int J Eat Disord. 2011 Sep; 44(6): 547-52.
21. Romero C, Duarte B, Ginez I, Reboredo T, Ruiz J. et al. Regulación de la ingesta de alimento: una aproximación al sistema endocannabinoide. Acad biomed digit. 2015; 61.
22. Monteleone P, Matias I, Martiadis V, De Petrocellis L, Maj M, Di Marzo V. Blood levels of the endocannabinoid anandamide are increased in anorexia nervosa and in binge-eating disorder, but not in bulimia nervosa. Neuropsychopharmacology. 2005 Jun;30(6):1216-21.
23. Marsh DJ, Hollopeter G, Huszar D, Laufer R, Yagaloff KA, Fisher SL, et al. Response of melanocortin-4 receptor-deficient mice to anorectic and orexigenic peptides. Nat Genet. 1999 Jan; 21(1):119-22.
24. Vettor R, Fabris R, Pagano C, Federspil G. Neuroendocrine regulation of eating behavior. J Endocrinol Invest. 2002 Nov; 25(10): 836-54.
25. Verdich C, Toubro S, Buemann B, Madsen JL, Holst JJ, Astrup A. The role of postprandial releases of insulin and incretin hormones in meal-induced satiety-effect of obesity and weight reduction. Int J Obes Relat Metab Disord. 2001 Aug; 25(8): 1206-14.
26. Bessesen DH, Faggioni R. Recently identified peptides involved in the regulation of body weight. Semin Oncol. 1998 Apr; 25(2 Suppl 6): 28-32.
27. Tanaka M, Naruo T, Muranaga T, Yasuhara D, Shiiya T, Nakazato M, et al. Increased fasting plasma ghrelin levels in patients with bulimia nervosa. Eur J Endocrinol. 2002 Jun; 146 (1): R1-3.
28. Gendall KA, Kaye WH, Altemus M, Conaha CW, La Via MC. Leptin, neuropeptide Y and peptide YY in long-term recovered eating disorder patients. Biol Psychiatry. 1999 Jul; 46(2): 292-9.
