ORIGINAL (Versión española)
Cambiar al Cruce bariátrico. A switch to the switch
A switch to the Duodenal Switch
Aniceto Baltasar, Nieves Pérez, Rafael Bou, Marcelo Bengochea, Carlos Serra
Hospital Alcoy y Clínica San Jorge. Alcoy, Alicante, España
* Autor para correspondencia.
![]()
This work is licensed
under a Creative
Commons
Attribution-NonCommercial-ShareAlike 4.0 International License
La revista no cobra tasas por el envío de trabajos,
Resumen
Introducción. El Cruce duodenal (CD) es un procedimiento bariátrico que combina una gastrectomía vertical (GV) y una derivación bilio-pancreática (DBP) y consigue la mayor pérdida de sobreso perdido (PSP) a largo plazo y resolución de comorbilidades.
Objetivos. Presentamos nuestra experiencia sobre 950 pacientes CD tratados desde 1994 a 2011 de obesidad mórbida (OM) desde 1994 a 2011 y 27 años de seguimiento en Hospital Comarcal de enseñanza e Institución Privada de España.
Métodos. Estudio observacional, retrospectivo y longitudinal de 950 pacientes consecutivos tratados con cirugía de CD.
Resultados. Hubo 518 CD abiertos (CDA) y 432 CD laparoscópicos (CDL). Mortalidad operatoria del 0,84% (1,38% en CDA y 0,38% en CDL), 4,84% incidencia de fugas, dos insuficiencia hepática (0,2%) y desnutrición calórico proteica (DCP) en el 3,1%. A los 5 años, pérdida de del 80% de IMC y PSP de 90% y % perdido del IMC esperado del 100%.
Conclusiones. El CD es la técnica bariátrica más agresiva, y con la mejor pérdida de peso a largo plazo. Se describen las complicaciones operatorias y las pautas de seguimiento a largo plazo. Y se propone un cambio para aceptar esta terapia.
Palabras clave
Obesidad mórbida; Cruce duodenal; Cirugía bariátrica; Gastrectomía Vertical; Derivación bilio-pancreática; Pérdida de peso
Abstract
Background. Duodenal Switch (DS) is a procedure that combines a Sleeve-Forming Gastrectomy (SFG) plus a biliopancreatic diversion (BPD) for the treatment of morbid obesity (MO) with a higher weight loss and resolution of comorbidities
Objectives. Report our experience with 950 consecutive DS operations performed from 1994 to 2016.
Setting. Mix of teaching and private institution in a county hospital of Spain.
Methods. We report an observational, retrospective and longitudinal study of 950 consecutive morbidly obese patients treated by DS surgery.
Results. We performed 518 open and 432 laparoscopic DS. Operative mortality was 0.84% (1.38% in DS and 0.38% in LDS), 4.84% had leaks, two had hepatic failures (0.2%) and malnutrition was present in 3.1%. At 5 years, the percentage of BMI lost was 80%, and percentage of expected BMI loss was more than 100%.
Conclusions. DS is the most aggressive bariatric surgery (BS) technique, but with the best long-term weight loss. We describe operative complications and long-term follow-up guidelines.
Keywords
Morbid obesity; Duodenal Switch; Bariatric surgery; Sleeve-Forming Gastrectomy; Biliary pancreatic diversion; Weight loss
Introducción
El Cruce Duodenal (CD) es una técnica mixta que consta de dos operaciones, Gastrectomía vertical (GV) para reducir la ingesta más Derivación Bilio-Pancreática (DBP) que produce malabsorción intestinal. Es la técnica más compleja en cirugía bariátrica (CB).
Scopinaro comenzó en la DBP en 1976 (1) publicó los resultados en 1980 (2). Hess (3) en 1998 describe el CD como: 1) La GV elimina la curvatura mayor gástrica, reduce el volumen gástrico, y la ingesta y permite un vaciado normal y 2) Deriva la ingesta post-píloro desde duodeno (D1) a ileon a través de una Anastomosis Duodeno-ileal (ADI) y 3) Exclusión de 50% del intestino proximal como DBP para causar malabsorción.
Hess (4) mide todo el intestino delgado, sin tensión, desde Treitz a válvula ileocecal y utiliza el 50% de su longitud como Asa Bilio-Pancreática (ABP), 40% como Asa Alimentaria (AA) y 10% como Asa Común (AC).
Lagacé (5) informó en 1995 los primeros buenos resultados del CD en 61 pacientes con un nuevo tipo de gastrectomía y Marceau en 1998 (6) es el primer autor que publica el CD y comparó 252 DBP con gastrectomía distal y 465 CD con una mortalidad operatoria del 1,7%. Hess (7) sutura e invagina la serosa gástrica para cubrir las grapas de la GV y evitar la fuga en la línea de grapas y Baltasar (8,9) describe la parte gástrica de la operación como GV.
El CD (10-18) fue considerada un técnica estándar en los años 90 (Figura 1). Ren (19) hizo el primer CDL en octubre de 1999 y Baltasar (20) describe el primer CDL en Europa en 2000 (21). Paiva (22) en Brasil y Scopinaro (23) en Italia inician en 2000 la DBP laparoscópica estándar.
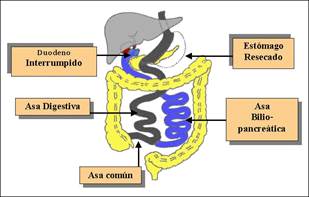
Figura 1. Cruce duodenal = GV + DBP
Para medir los resultados del peso se usa el IMC = Kg/m2 de Quetelet, pero… después de revisar 7.410 pacientes nuestro matemático desarrolló el concepto de IMC predictivo o esperado (24) tomando como control un IMC Inicial superior a 25 y hacer el cálculo no desde IMCI sino del IMCI en Exceso de 25. El % de pérdida de sobrepeso perdido (PSP) no son iguales en un OM grado 2 comparados con la Obesidad triple. El PSP sería entonces un IMC esperado dependiente del diferente IMCI o IMC predictivo=IMCI x 0:4+11.75. Este concepto ha sido ya utilizado por Molina (25) de forma positiva.
Técnica operatoria
CDA por laparotomía
El paciente está en Trendelenburg. Se hace una incisión transversa supraumbilical entre ambos márgenes costales (Figura 2 a-b). Se seccionan los ligamentos redondo y falciforme. Y se extirpan vesícula y apéndice. Hoy el abordaje abierto solo lo usamos en re-operaciones, pues da mejor exposición y menos hernias que la laparotomía media.
Figura 2. a) Incisión; b) Cicatriz invisible; c) Dermolipectomía supra púbica
El abdomen se cierra en dos capas de Maxon continuo. Tras la pérdida de peso, la cicatriz se acorta en un tercio en longitud (Figura 2b) y permite que la herida transversa superior en la cirugía de contorno corporal alcance el área púbica en la abdominoplastia (Figura 2c). Iniciamos el CDA el 17/03/1994 y con tiempos quirúrgicos de 91 minutos.
CD laparoscópico (CDL)
Lo realizan tres cirujanos. Se usan seis puertos (24-27). El trocar óptico, “puerto principal” de Ethicon # 12 ingresa bajo visión al abdomen, en el borde lateral del músculo recto derecho, a tres traveses de dedo por debajo del margen costal de trabajo. El puerto supraumbilical central de 10 mm se usa para la cámara en la línea media.
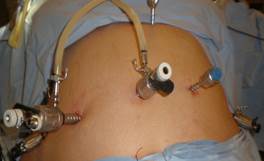
Figura 3. Colocación de trocares
Hay cuatro puertos de 5 mm, dos subcostales situados a la derecha y a la izquierda, uno en la hipocondrío izquierdo y el otro en epigastrio utilizado para retraer el hígado (Figura 3). Para evitar deslizamientos usamos trocares Termanian. Se mide todo el intestino delgado desde válvula ileocecal a Treitz.
Se marca el AC con un clip. El AA se divide con grapadora lineal. El ABP empieza en Duodeno (D1) y se empalma con una anastomosis yeyuno-ileal término-lateral en Y de Roux (AYR) con sutura reabsorbible continua monoplano en la unión de AA y AC. El defecto mesentérico se cierra con una sutura no reabsorbible.
Se devasculariza toda la curvatura mayor gástrica desde 3 cm distal al píloro hasta el ángulo de His. Se pasa una sonda naso-gástrica de 12 mm a curvatura menor y se usa como guía para dividir el estómago de forma secuencial con grapadoras aplicadas desde el píloro. Las paredes gástricas, posterior y anterior a la línea de grapas y epiplón se aproximan con sutura continua invaginante para evitar fugas y torsión del tubo gástrico.
Se crea un túnel retro-duodenal en D1, distal a la arteria gástrica derecha, que permite la división duodenal con grapadora lineal antes del esfínter de Oddi. Se refuerza el muñón duodenal con sutura invaginante continua.
El AA proximal pasa retro cólica a la derecha y se realiza una Anastomosis Duodeno-Ileal (ADI). La operación tiene cuatro líneas de sutura (refuerzo gástrico, ADI, anastomosis yeyuno-ileal y muñón duodenal distal) y se colocan drenajes, uno al lado del tubo gástrico y otro en la ADI.
Todas las anastomosis son manuales con sutura continua monocapa. Se inician con el punto deslizante y autobloqueante de Serra-Baltasar (26-27) y finalizan con nudo Cuschieri (28). El intestino se mide con pinzas marcadas a 5 cm de distancia para evitar lesiones de la serosa intestinal.
Extraemos el estómago sin bolsa protectora. Una sutura Maxon cierra la fascia del puerto de 12 mms para evitar hernias. Iniciamos el CDL en 5.10.2000 (29). El tiempo operatorio promedio fue de 155' después de los primeros 50 casos.
Al alta, los pacientes recibieron prescripciones con complejo de vitamina A 20,000 UI, vitamina D 50,000 UI, carbonato de calcio 1000 mg y sulfato ferroso 300 mg., vitaminas B1 y B12
Material y Métodos
Han sido intervenidos 950 pacientes OM consecutivos (518 abiertos y 432 laparoscópicos) desde 1994 a 2011, después de una evaluación preoperatoria multidisciplinaria completa y el consentimiento informado legal. 782 eran mujeres (82.3%) y 168 hombres (17.7%). La edad promedio fue de 35 años (24-63). 474 extranjeros (361 ciudadanos de EEUU, 17 de Canadá, 73 de Noruega y 25 de Inglaterra) fueron intervenidos por el mismo equipo en el centro privado.
El Índice de Masa Corporal Inicial (IMCI) promedio (Kg / m2) fue de 49.23 (Mujeres-49.26 y Hombres-49.07). Rango de obesidad: a) Obesidad no grave, grado 2 con comorbilidades (IMCI <40), 110 pacientes (media 37,66); b) Obesos Mórbidos (OM) (IMCI 40-50), 464 pacientes (media 45,11); c) Súper-Obesos - (SO) (IMC de 50-60), 272 pacientes (media 54.32) y d) pacientes con Obesidad Triple (OT) e IMCI > 60, 104 pacientes (media > 66.50) y un paciente con IMCI-100.
Comorbilidades: 115 pacientes sufrían diabetes tipo 2 (DMII), 103 hipertensión, 5 enfermedades cardíacas, 62 dislipidemias, 19 SAOS, 16 osteoartritis, 1 pseudo tumor cerebral.
Resultados
Principales complicaciones intraoperatorias: Tres
pacientes necesitaron traqueotomía por fallo de intubación oral y
desaturación severa, sin incidentes.
En tres pacientes, la sonda gástrica de 12 mm no pasó más allá de cardias y el engrapado del estómago se hizo visualmente.
La mortalidad operatoria a 30 días ocurrió en seis CDA pacientes (1,38%). Las causas fueron: a) Fuga en ADI – 1; b) Fuga AYR, Rabdomiólisis y fracaso muntiorgánico – 1; c) Embolia pulmonar – 2; d) Fuga en el muñón duodenal – 1; e) Fuga en su ángulo de His - 1. Dos pacientes con CDL murieron (0.38%) por émbolos pulmonares. La mortalidad promedio de ambos grupos fue de 0.84%.
Morbilidad postoperatoria.
1. Fugas. Hubo 46 fugas para una tasa de fugas total de 4.84%.
a) Fugas en su ángulo de His: 21 casos (2,3% de incidencia). Fueron tratados con endoprótesis -10, drenaje o laparotomías y 3 con derivación en Y-de Roux. Uno de ellos murió.
b) Fuga del muñón duodenal. Un paciente sufrió una fuga en el muñón duodenal y se reparó, pero murió de sepsis. Desde entonces, protegemos todo grapado del muñón duodenal con una sutura invaginante y no hubo más filtraciones.
c) Fugas de ADI: 24 casos (2,5% de incidencia). La DIA es la anastomosis más difícil. Diecinueve de ellos sufrieron fugas tempranas, se trataron exitosamente con drenaje o volvieron a realizar la anastomosis, cinco casos presentaron fugas tardías (hasta 2-14 años después), y necesitaron una nueva operación y rehacer la anastomosis. En un caso, la fuga se produjo 3 años después de la intervención, como una fístula gastro-pleural y se trató con gastrectomía total.
d) Fuga en AYR. A un paciente con divertículo de intestino delgado a 100 cm de la válvula ileocecal, se extirpó y se realizó una AYR abierta en el sitio sin incidentes. Hubo fuga y las pruebas radiológicas de diagnóstico no aclararon la causa, y con diagnóstico tardío, fue re-explorado sufrió rabdomiólisis y falleció.
2. Embolia pulmonar. Dos pacientes con BMI-70 inicial y BMI-65 tuvieron embolia a pesar de la terapia profiláctica y murieron. La trombosis venosa profunda en un caso fue tratada con éxito.
b) Fallo hepático. Dos pacientes sufrieron insuficiencia hepática (0.2%). El primero ocurrió en una paciente 6 meses después de la cirugía, se incluyó en lista urgente de trasplante hepático pero murió a la falta de donante. La segunda paciente sufrió insuficiencia hepática tres años después de la cirugía, y recibió un trasplante de hígado más reversión de la DBP con éxito y sana 4 años después. Un paciente ha fallecido 13 años tras CDA por alcoholismo.
c) Desnutrición calórico-proteica (DCP). Treinta y tres pacientes (3,3%) desarrollaron DCP y 24 requirieron alargamiento del AC. 13 de ellos se hicieron abiertos sin complicaciones. En 11 casos, el AC se alargó laparoscópicamente y en dos de ellos el intestino delgado resultó lesionado por las pinzas de disección que perforaron fácilmente por debilidad de la pared (Figura 4). Ambos casos fueron diagnosticados intraoperatoriamente y reparados, pero murieron más tarde debido a fugas. Se encontraron mútiples hernias mucosas en la débil pared muscular entre los vasos del mesenterio. Este tipo de hernias no han sido informadas previamente. Por lo tanto, recomendamos laparotomía para el alargamiento intestinal.
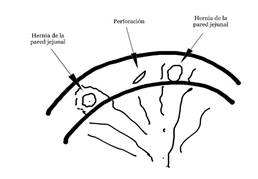
Figura 4. Hernias en intestino delgado
d) Fístula pancreático-cutánea. (Figura 5). Las dos fístulas y las lesiones de la piel sanaron espontáneamente.
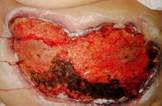
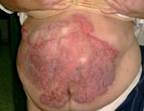
Figura 5. Quemaduras cutáneas tras after dos fistulas pancreáticas
e) Hipoglucemia: Dos pacientes tuvieron episodios recurrentes de hipoglucemia que requirieron reversión de la DBP.
f) Evisceración en cuatro casos sin
consecuencias después de una reparación adecuada.
g) Obstrucción intestinal tardía: 7 casos (incidencia
de 0,73%). Tratamos a dos en nuestra unidad y los otros fueron tratados en
otras unidades con resección del intestino delgado.
h) Beriberi. Tres casos de deficiencia de vitamina B1, con síntomas neurológicos, cambios en la marcha y caída espontánea, todos corregidos con éxito. Esta grave complicación necesita administración urgente de B1 intravenosa.
10) Fracturas debidas a la mala absorción de Ca que requirió Vitamina D25 + Ca. Se presentaron dos casos que son asintomáticos después de la atención adecuada.
11) Megacolon tóxico debido a colitis pseudo membranosa 16 años después de la cirugía. La paciente requirió una colectomía subtotal a 22 cm del ano con ileostomía terminal y luego, más tarde se unió el íleon al recto.
12) Varios: neumonía-4. Seroma-4, infección de herida-15. Hemorragia diegestivas-5 (3 que requieren laparotomías). Sepsis relacionada con el catéter -3
Mortalidad a largo plazo: Una apendicitis aguda no diagnosticada a los dos años. Una necrosis intestinal por hernia interna a los 3 años. Hubo otras causas de muerte no relacionadas con el CD (cáncer, melanoma, infarto de miocardio, etc.)
Resultados de pérdida de peso.
El gráfico (Figura 6) muestra en azul el IMC esperado promedio que estaba alrededor de 30 y en rojo el porcentaje del % exceso IMC esperado perdido y que al final se mantenía rondando el 100 %.
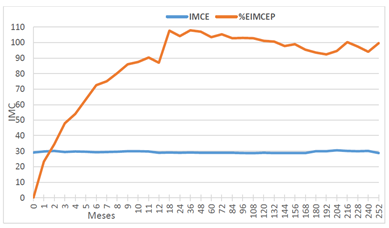
Figura 6. IMC esperado es 30 %IMC Esperado I supera el 100%
El gráfico (Figura 7) muestra en azul la evolución del IMC promedio a lo largo de los meses (empieza en 49 y termina cerca de los 30) y en rojo el % de pacientes seguidos (empieza en 100, sigue con 38,5 a los 5 años, 25,8 a los 10 años y termina en 0,9 a los 20 años)
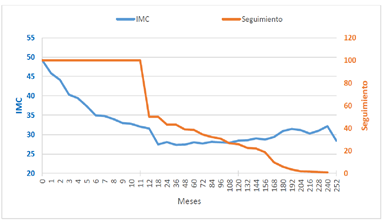
Figura 7. Caída del IMC y % de seguimiento
Por lo tanto, el PSP final, del 90%, ha sido excelente en la serie y probablemente sea mejor que con cualquier otra operación de obesidad.
El CD es muy eficaz en los Súper/Súper obesos. Una paciente con IMCI-100 bajó a IMCF-34 (Figura 8)
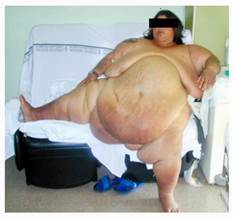
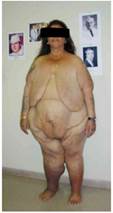

232 Kg, 149 cm, IMC-100 6 meses 132 K-100 Kg
2 años.79 Kg -153 Kilos, PSP-86%
Figura 8. CD muy efectivo Súper/Súper Obesidad con IMC-100
Corrección de comorbilidades:
Diabetes tipo II
El CD es una operación muy efectiva para tratar la diabetes. El 98% de nuestros pacientes son normo glucémicos con una hemoglobina glicosilada normal. Dos pacientes no diabéticos sufrieron hipoglucemia grave y huvo que revertir la DBP.
La hipertensión se corrigió en el 73% de los casos y la apnea del sueño en el 100%.
Calidad de vida
Utilizamos la Clasificación Horia-Ardelt de la escala BAROS para evaluar los cambios en la calidad de vida de los pacientes. Los cambios después de la cirugía incluyeron: autoestima, actividad física, actividad social, actividad laboral más actividad sexual en una escala de -1 a +1. El puntaje promedio fue de 2.03 de un máximo de 3 puntos en 348 pacientes, lo que significa una mejora significativa en su calidad de vida.
Los síntomas gastrointestinales se evaluaron de un mínimo de 1 como excelente a un máximo de 5 como muy malo. En los 558 pacientes evaluados, la ingesta de alimentos de todos los tipos fue de 1.4, vómitos -1.3, apetito -1.96, tipo de deposiciones (de pastosas a líquidas) - 2.2, frecuencia (sin problema a intolerable) -1.8, olor a heces - 3.35, hinchazón abdominal- 2.26. Por lo tanto, la suma de todas las medidas fue 12.14, para una calificación total de 5 (excelente) a 35 (mala). El peor efecto secundario fue el mal olor de las heces con una media de 3,35.
Discusión
El CD nunca fue una terapia popular entre los cirujanos,. Hess (7) describe cómo después de ver un vídeo nuestro en Seatle-1996 en la Reunión de ASBS modificó el procedimiento con una sutura invaginante de curvatura mayor y solo tuvo una fuga en 188 casos. Muy pocos cirujanos siguieron haciendo el CD y de hecho se creó una subdivisión en la ASBS denominada “The switchers” con logo propio (Figura 9). El CD siguió siendo impopular, y tuvimos que reunirnos, por años, fuera de la sede de los congresos como un grupo aparte de 25-30 cirujanos.

Figura 9. Switchers logo
“Los del cruce” hemos seguido haciendo la intervención y muchos pacientes, incluso extra-nacionales supieron de sus ventajas y buscaban esta terapia. No hemos escondido las dificultades de la operación y sobretodo sus complicaciones. Más de 72 cirujanos bariátricos nos visitaron y hemos intervenido en directo en varios congresos nacionales y extranjeros. Un vídeo de CDL fue segundo premio en IFSO 2002 de Sao-Paulo (29).
Tres pacientes requirieron una traqueotomía de emergencia (30,31).En el 2000 usamos endoprótesis rígida no-extraíble (32), y luego endoprótesis extraíbles (33) para tratar fugas. Nueve pacientes requirieron gastrectomía total (34). En tres pacientes usamos una derivación Y-Roux (35,36) en las fugas y esta técnica de 2007, es hoy la terapia de elección cuando falla la endoprótesis extraíble (37). Informamos de trastornos hepáticos (38) y fallo hepático (39). Desnutrición calórico-proteica (40). Fugas (41) por alargamientos laparoscópicos. Un paciente sufrió Fístula pancreático-cutánea (42).
Buchwald (43) en la conferencia de consenso de 2004 declaró que en OM, la cirugía debe considerarse para pacientes con obesidad superior a clase I (IMC 30-34.9 Kg/m2) y comorbilidades asociadas. La morbi-mortalidad debe ser baja, y obtener un PSP óptimo y sostenido con efectos secundarios mínimos. Ninguna CB es 100% exitosa o duradera en todos los pacientes y no hay un único procedimiento estándar y probablemente nunca lo habrá. Además, la CB no puede ser la solución para los 1.700 millones con OM.
Las fugas de la GV son causa de importante morbilidad manifestada en las reuniones específicas de GV de Deitel y Gagner (44). El CD es un procedimiento largo y difícil que requiere cirujanos expertos y con experiencia. La mortalidad operatoria debiera ser <1% y la morbilidad <5%. Nuestra mortalidad 0.38% del CDL es baja.Como los pacientes con CD tienen cuatro líneas de sutura, la detección temprana de fugas es esencial.
Mason (45) llamó la atención a la taquicardia como la primera señal de advertencia de fugas y ningún paciente debería ser dado de alta con taquicardia.
Duncan (46) da el alta precoz en cirugía ambulatoria. Aunque nuestra estancia tras CDL es de 2-3 días, instruimos al ingreso a los pacientes, a tomar pulso y temperatura de forma digital, y nos notifican dichos parámetros cada cuatro horas, durante dos semanas, a una base de datos telemática (47,48). Los pacientes con cambio significativo en estos parámetros necesitan una consulta inmediata y urgente.
DeMaria (49) informó que 450 instituciones y 800 cirujanos participaron en el programa 2009 de BSCOE en dos años (2007-9). A sólo 0,89% de los 57.918 pacientes se les hizo CDL.
Nelson (50), utilizando datos BOLD de 2007-2010, identificó 78.951 pacientes sometidos a derivación gástrica (DG) o CD. De estos pacientes, 98% tenían DG con IMCI-52 y solo 2% a CD con IMCI-48. El CD se asoció con tiempos de operación quirúrgicos más largos, pérdida de sangre y estancias hospitalarias más prolongadas. Las tasas de reintervención temprana fueron más altas en el grupo con CD (3.3% vs. 1.5%). La caída del IMC fue significativamente mayor en los casos de CD en todos los intervalos de seguimiento (P> 0.05). En los SO (IMC> 50) también hubo mayor caída a los 2 años, CD el 79% frente al 67% de la DG. La mejora de las comorbilidades (diabetes, hipertensión y apnea del sueño) fue superior con CD (todas P <0,05).
English (51) en ASMBS-2016 informa que la obesidad ha aumentado de forma alarmante en las últimas 5 décadas en EEUU, del 13,4% al 36,4%. En 2014 se realizaron 215,666 operaciones en 795 centros acreditados, GV- 58,1%. Y solo 1187 BPD, 0,6% CD y 26% de ellos CDL. Los costos indirectos de la obesidad y el impacto económico general se estiman en $ 1,42 billones, 8,2 % del producto interno bruto y más del doble del gasto en defensa. La obesidad es el quinto factor de riesgo más importante de mortalidad en el mundo. Y la tasa de reintervención del 14%. Las revisiones, incluidas las conversiones, pueden superarse en breve y sugiere la necesidad de desarrollar mejores algoritmos basados en la evidencia para minimizar el uso de nuevas operaciones. Se necesitan operaciones iniciales más efectivas.
Iannelli (52) en 110 pacientes con IMC>50 encontró una reducción en la tasa de complicaciones postoperatorias al realizar CD de dos etapas. Al estudiar el procedimiento, solo 39 pacientes (35.5%) requirieron GV y se evitó la DBP al 74.5% de los pacientes.
Biertho (53) hizo CD en 1000 pacientes en 2006-2010. La tasa de conversión en el grupo de laparoscopia fue del 2.6%. Hubo una muerte postoperatoria (0.1%) debido a embolia. La estancia hospitalaria media fue más corta en el grupo de CDL (6 a 6 días versus 7 a 9 días, P <0 .01). Las tasas de complicaciones fueron del 7.5%, sin diferencias significativas. No se encontraron diferencias en los abscesos o fugas abdominales.
Biertho (54) también trató a 566 pacientes entre 2011-2015 con CDL con IMC-49 y sin mortalidad a los 90 días. La estadía promedio en el hospital fue de 4.5 días. Las complicaciones mayores a los 30 días ocurrieron en el 3% de los pacientes y las menores el 2.5%. El PSP fue 81% a los 12 m, del 88% a los 24 m, y del 83% a los 36 meses. Los pacientes con HbA1C por encima del 6% disminuyeron del 38% al 1,4%. La readmisión fue del 3.5% y el 0.5% de los pacientes necesitaron una nueva operación. La tasa de complicaciones a corto y medio plazo del CDL es como otros procedimientos bariátricos mixtos y con excelentes resultados metabólicos.
Biron (55) estudió la calidad de vida de 112 pacientes. El seguimiento fue 8.8 años. Observó cierta disminución en la calidad de vida a lo largo plazo después de los cambios iniciales que ocurrieron 1-2 años después de la cirugía, durante el llamado "período de luna de miel". El CD mejora la calidad de vida específica de la enfermedad a corto y largo plazo.
Prachand (56) observó PSP a los 2 años en 350 pacientes de 54% en 152 pacientes con DG frente a 68% en 198 pacientes con CD con solo un fallecido (P = no significativo). La comparación directa de los resultados de PSP a 3 años entre CD = 68.9% fue mucho mayor que con DG= 54.9% y mostró que el CD fue más efectivo.
Para Strain (57) el CD proporciona una mayor pérdida de peso que la DG en pacientes con obesidad severa. El peso promedio disminuyó en 31.2% después de la DG y 44.8% después del CD.
Topart (58) en 2002-2009 realizó 83 CD y 97 DG, con IMCI-55. Después de 3 años de seguimiento, el PSP promedio fue del 63,7% después de la DG y del 84,0% después de CD (P> 0,0001). Los resultados fueron significativamente mejores con CD que con DG.
Våge (59) 2001-2008 trató a 182 pacientes consecutivos con CD sin mortalidad a los 30 días. Un paciente necesitó cirugía debido a una fuga; tres pacientes debido a sangrado y uno debido a fugas de bilis. Seis pacientes (3.2%) se sometieron a revisión quirúrgica por DCP, datos similares a los nuestros (3.3%).
En resumen, los pacientes sometidos a CD constantemente reducen el IMC más que los pacientes con DG. ¿Entonces, por qué hay tan pocos pacientes con CD? .
Angrisani (60) informa que en 2018 se hicieron 685,874 operaciones bariátricas mundiales; 92.6% primarias and 7.4% de revisión. 96% quirúrgicas y 4% endoluminal. GV-53.6%, DG-30.1% y Bagua-4.8% y solo 1.3% CDL. ¿Es la DBP una operación demasiado compleja o los resultados de CD no son tan buenos? La GV es irreversible pero la continuidad intestinal se puede restaurar a la normalidad. El CDL puede realizarse en dos etapas, la GV como operación inicial, en pacientes de alto riesgo con IMCI> 60.
Rabkin (61) informa que el CD no está asociado con deficiencias nutricionales extensas. Los estudios anuales de laboratorio, que se requieren después de cualquier tipo de operación bariátrica, parecen ser suficientes para identificar tendencias desfavorables. En pacientes seleccionados, son necesarios suplementos de hierro y calcio adicionales.
Keshishian (62) realizó una biopsia hepática con aguja preoperatoria en 697 pacientes con CD. Hubo empeoramiento transitorio de la AST (13% del valor de referencia, P <.02) y ALT (130-160% de los niveles de referencia, P <.0001) hasta 6 meses después del CD. Y observó una mejoría progresiva de 3 grados en la gravedad de NASH y del 60% en la esteatosis hepática a los 3 años tras CD.
Diabetes tipo 2
Buchwald (63) informa que CD y DBP tienen tasas de resolución de diabetes que superan el 90%. En comparación, la tasa de la DG es de aproximadamente 70%. Tsoli (64) mostró que GV era comparable al DBP en la resolución de la DT2 pero menor en la dislipidemia y la presión arterial. En nuestra primera cirugía de diabetes (65), el paciente tenía un bajo IMC-35 y realizamos con éxito un CDL sin GV para tratar la diabetes con excelentes resultados.
Våge (66) piensa que CD es efectivo en DMII, hipertensión e hiperlipidemia. Y que la duración de la diabetes y la edad de los pacientes son los predictores preoperatorios más importantes.
CD por estadios
¿Qué parte de la operación se debe hacer primero? ¿La DBP o la GV? La mayoría de los cirujanos recomiendan hacer la GV. Sin embargo, Marceau (67) de 2001 a 2009, trató a 1.762 pacientes todos programados para CD. Los procedimientos de la primera etapa fueron 48 BPD aislados sin SG y 53 casos sólo GV. Las conclusiones fueron que GV y BPD contribuyen de forma independiente a los resultados metabólicos beneficiosos. Los resultados a largo plazo en términos de pérdida de peso y resolución de anormalidades metabólicas fueron mejores con DBP aislada que con GV aislada. Los resultados de CD de una etapa fueron superiores a los realizados en dos etapas.
Moustarah (68) trató a 49 pacientes SO con BPD sin SG. El peso inicial fue de 144 Kg. y IMCI-52.54 y la caída en el IMC de 14.5 Kg/m2 fue muy significativa (p <0.001).
La DBP sin GV es raro como único procedimiento de pérdida de peso; pero en pacientes cuyas indicaciones clínicas justifican la omisión del GV, la DBP aislada tiene mejores resultados de pérdida de peso. En esta serie, la pérdida de peso a los 2 años se compara favorablemente con otras operaciones bariátricas realizadas comúnmente.
Nosotros creemos que la BPD sin GV totalmente es reversible y es una ventaja, ya que la GV puede agregarse en cualquier momento posterior. La cirugía infra duodenal de la DBP, es más fácil en el paciente SO, que la infra diafragmática de la GV.
El mayor problema del seguimiento del paciente con CD es que otros médicos y/o cirujanos pueden no entender cómo prevenir o tratar sus complicaciones a largo plazo. El seguimiento de los pacientes con CD es muy importante. Damos al alta una explicación técnica detallada de la operación de cada una de las posibles complicaciones y de su corrección, y una extensa una hoja explicativa de los análisis de laboratorio necesarios de por vida.
La determinación de albúmina sérica es el dato más importantes a largo plazo para detectar DCP. La PTH y vitamina D25 (para detectar la absorción y los déficits de calcio y proteger la patología ósea), hemograma para corregir los déficits de Fe con terapia intravenosa y déficits en todos los oligoelementos como Mg, Cu.
Además de las fugas, la complicación más grave a largo plazo de CD es la DCP. La corrección quirúrgica es simple al usar la técnica de "X-en beso" como una anastomosis yeyuno-yeyunal para alargar el AC, preferiblemente por laparotomía.
Hoy somos privilegiados con las unidades de endocrinología, en comparación con hace 15 años cuando no creían en la cirugía y su apoyo era muy limitado. También lo es el apoyo enfermería bariátrica y nutricionistas.
Como grabamos todas los CDL, proporcionamos a los pacientes los videos digitalizados de toda la operación, porque si es necesaria una nueva operación, el cirujano debiera conozcer todos los detalles la técnica original.
Hay que destacar la significativa contribución que los autores españoles desde los años 90 hicieron sobre las DBP como Larrad A (69,70), Solano J (71), Ballesteros M (72), Hoyuela (73) en DBP. Así como Sánchez-Pernaute A (74) con el hoy popular CDL de una sola anstomosis (SADI).
A switch to the Duodenal Switch?
Cómo cambiar al CD. ¡Una llamada!
El CD no ha dicho todavía su última palabra pues Halawani (75) dice que un tercio (34.9%) de los adultos estadounidenses son obesos.El número CDL en EEUU es inferior al 1% para los años 2011-2015. Hay que añadir el CD a la práctica de los"Centro de Excelencia en Obesidad" (CEO).
El CD es de mejor que la DG y da PSP superior y tiene una tasa más baja de recuperación de peso. Conserva el píloro y produce un vaciamiento gástrico más lento. Con ajustes a la longitud del AC y el tamaño del tubo gástrico cualquier paciente obeso pueda ser candidato al CD.
Los pacientes con IMC <50 pueden ser también candidatos. El CD es una opción viable debido a su flexibilidad. El cirujano puede ajustar el tamaño del TG y alterar el impacto de la restricción. La longitud de AC poder ser variable.
El CD es bueno para pacientes crónicos, con antiinflamatorios no esteroideos y esteroides. La tasa más alta de mortalidad temprana en comparación con la GVL (0.28%) es ligeramente más alta (0.43%). aunque todavía se considera un procedimiento complejo de alto riesgo y los resultados deben analizarse con cautela.
El CD es muy versátil y puede ofrecer un manejo integral de la obesidad y sus comorbilidades metabólicas. Con dedicación, capacitación adecuada y una educación integral, el CD se puede implementar en la práctica.
Conclusiones
Las técnicas CD no son comunes para el manejo de la OM. El CD es la técnica más compleja y su curva de aprendizaje es más larga que otras operaciones. Para estandarizar la técnica, tomamos al menos 25 casos en CDA y 50 en CDL. El CD es seguro y el más eficaz en términos de resultados de pérdida de peso a largo plazo.
Aprobación ética
Todos los procedimientos que involucran participantes humanos se realizaron en los estudios citados en este documento de acuerdo con los estándares éticos de los comités de investigación nacionales e institucionales y con la Declaración de Helsinki y las enmiendas.
Consentimiento informado
El consentimiento informado se obtuvo de todos los participantes individuales incluidos en los estudios citados.
Conflicto de intereses
Ninguno de los autores tiene ningún conflicto de intereses para divulgar.
Referencias
1. Scopinaro N, Gianetta E, Civalleri D, et al: Biliopancreatic bypass for obesity: I. An experimental study in dogs. Br J Surg 1979; 66:613-7
2. Scopinaro N, Gianetta E, Civalleri D et al: Two years of clinical experience with biliopancreatic bypass for obesity. Am J Clin Nutr 1980; 33:506-14
3. Hess DS, Hess DW: Biliopancreatic Diversion with a Duodenal Switch. Obes Surg 1998; 8:267-282
4. Hess D: Limb Measurements in Duodenal Switch. Obes Surg 2003; 13:966
5. Lagacé M, Marceau P, Marceau S. et al.: Biliopancreatic Diversion with a New Type of Gastrectomy: Some Previous Conclusions Revisited. Obes Surg 1995; 5:411-418
6. Marceau P, Hould FS, Simard S. et al: Biliopancreatic Diversion with Duodenal Switch. World J. Surg. 1998; 22:947–954.
7. Hess DS, Hess DW, Oakley RS: The Biliopancreatic Diversion with the Duodenal Switch: Results beyond 10 Years. Obes Surg 2005; 15:408-416
8. Baltasar A, Bou R, Bengochea M.: Hybrid bariatric Surgery: Duodenal Switch and bilio-pancreatic diversion. Video-Revista de Cirugía. VCR 1996; 12:16-41. www.youtube.com/watch?v=3mNnZte3W_I&feature=youtu.be
9. Baltasar M, Bou R, Cipagauta LA y col.: Hybrid Bariatric Surgery: Bilio-pancreatic Diversion and Duodenal Switch - Preliminary Experience. Obes Surg 1995; 5:419-423.
10. Baltasar A, del Río J, Bengochea M, y col.: Cirugía híbrida bariátrica: Cruce duodenal en la derivación bilio-pancreática. Cir. Esp. 1996; 59:483-486.
11. Baltasar A, del Río J, Escrivá C et al. Preliminary results of the duodenal switch. Obes Surg 1998; 7:500-4.
12. Baltasar A., Bou R, Miró J, Pérez N: Cruce duodenal por laparoscopia en el tratamiento de la obesidad mórbida: técnica y estudio preliminar. Cir Esp. 2001; 70:102-104.
Baltasar A, Bou R, Bengochea M y col.: Duodenal switch: an effective therapy for morbid obesity-intermediate results. Obes Surg 2001; 11:54-8.
14. Baltasar A, Bou R, Bengochea M.: Open Duodenal Switch. Video. BMI-2011, 1.5.4 (356-359). www.youtube.com/watch?v=h0nTzeUDI5o
15. Baltasar A.: Hand-sewn Laparoscopic duodenal Switch. Surg Obes Relat Dis 2007; 3:94-6
16. Anthone G, Lord R, DeMeester T, et al: The Duodenal Switch Operation for the Treatment of Morbid Obesity. Ann Surg. 2003; 238(4): 618–628.
17. Almogy G, Crookes P, Anthone G. Longitudinal Gastrectomy as a Treatment for the High-Risk Super-Obese Patient. Obes Surg 2004; 14, 492-497
18. Rabkin RA.: Concept. The duodenal switch as an increasing and highly effective operation for morbid obesity. Obes Surg 2004; 14: 861-865.
19. Ren CJ, Patterson E, Gagner M. Early results of laparoscopic biliopancreatic diversion with duodenal switch: a case series of 40 consecutive patients. Obes Surg 2000; 10:514-523.
20. Baltasar A, Bou R, Miró J. et al.: Avances en técnica quirúrgica. Cruce duodenal por laparoscopia en el tratamiento de la obesidad mórbida: técnica y estudio preliminar. Cir. Esp. 2001; 70:102-104. www.youtube.com/watch?v=GSfzgYYxZJ8.
21. Weiner RA; Blanco-Engert R.; Weiner S et al.: Laparoscopic biliopancreatic diversion with duodenal switch: Three different duodeno-ileal anastomotic techniques and initial experience. Obes Surg 2004; 14:334-340
22. Paiva D, Bernardes L, Suretti L.: Laparoscopic Biliopancreatic Diversion for the Treatment of Morbid Obesity: Initial Experience. Obes Surg 2001; 11:619-622
23. Scopinaro N; Marinari G, Camerini G.: Laparoscopic Standard Biliopancreatic Diversion: Technique and Preliminary Results. Obes Surg 2002; 12:241-244
24. Baltasar A, Perez N, Serra C, Marceau P et al.: Weight Loss Reporting: Predicted BMI after Bariatric Surgery. Obes Surg 2011; 21:367–372. DOI 10.1007/s11695-010-0243-7
25. Molina A, Fàtima F, Vives M, et al. Usefulness of Baltasar’s expected body mass index as an indicator of bariatric weight loss surgery. Obes Surg 2016. DOI 10.1007/s11695-016-2163-7
26. Serra C, Pérez N, Bou R, Baltasar A.: Sliding Self-Locking First Stitch and Aberdeen Knots in Suture Reinforcement with Omentoplasty of the Laparoscopic Gastric Sleeve Staple line. Obes Surg 2014; 24:1739–1740. DOI 10.1007/s11695-014-1352-5 https://www.youtube.com/watch?v=i4kNc8PJcEk
27. Baltasar A, Bou R, Serra R, Bengochea M and Pérez N: Use of self-locking knots in running intestinal bariatric sutures. Glob Surg, 2015; 2:100-101. doi:10.15761/GOS.1000132
28. Cuschieri A. Szabo Z, West D.: Tissue Approximation in Endoscopic Surgery: Suturing & Knotting. Informa Healthcare 1995 November. ISBN-13: 9781899066032
29. Baltasar, R. Bou, J. Miró, M. Bengochea, N. Pérez. Hand-sutured laparoscopic duodenal switch. Technical aspects. V13. Obes Surg. 2012; 12: 402
30. Baltasar A, Bou R, Bengochea M et al.: Emergency Tracheotomy in Morbid Obesity. Sci Forschen. Obes Open Access 3(2): doi http://dx.doi.org/10.16966/2380-5528.132
31. Baltasar A, Bou R, Bengochea M, Serra C, Pérez N.: Difficult intubation and emergency tracheotomy in morbid obesity. BMI-Latina 2013; 3:4-7
32. Baltasar A. Wall-stent prosthesis for severe leak and obstruction of the duodenal switch. Obes Surg 2000; 10: 2:29
33. Serra C, Baltasar A, Andreo L. et al: Treatment of Gastric Leaks with Coated Self-expanding Stents after Sleeve Gastrectomy. Obes Surg 2007; 17:866-872
34. Serra C, Baltasar A, Pérez N. et al: Total Gastrectomy for Complications of the Duodenal Switch, with Reversal. Obes. Surg 2006; 16:1082-1086
35. Baltasar A, Bou R, Bengochea M, et al. Use of a Roux limb to correct esophago-gastric junction fistulas after sleeve gastrectomy. Obes Surg 2007; 17:1409–10
36. Baltasar A, Serra C, Bengochea M et al: Use of Roux limb as remedial surgery for sleeve gastrectomy fistulas. Surg Obes Relat Dis 2008; 4:759–763
37. Mcheimeche H, Dbouk S, Saheli R et al. Double Baltazar Procedure for Repair of Gastric Leakage Post-Sleeve Gastrectomy from Two Sites: Case Report of New Surgical Technique. Obes Surg 2018; 28:2092–2095.
38. Baltasar A, Serra C, Pérez N, et al. Clinical Hepatic Impairment after the Duodenal Switch. Obes Surg 2014; 14:77–8.
39. Baltasar A.: Liver failure and transplantation after duodenal switch. Surg Obes Relat Dis 2014; 10: c93-c96.
40. Baltasar A, Bou R, Bengochea M, Serra C.: Malnutrición calórico-proteica. Tres tipos de alargamiento de asa común. BMI-Latina 2011; 5:96-97.
41. Baltasar A, Bou R, Bengochea M: Fatal perforations in laparoscopic bowel lengthening operations for malnutrition. Surg Obes Relat Dis 2010; 6:572–574 www.youtube.com/watch?v=Hw_aPYLjGXI
42. Bueno J, Pérez N, Serra C et al. Fistula pancreato-cutánea secundaria a pancreatitis postoperatoria tras cruce duodenal laparoscópico. Cir. Esp 2004; 76:184–6.
43. Buchwald H.: 2004 ASBS. Consensus Conference Statement Bariatric surgery for morbid obesity: Health implications for patients, health professionals, and third-party payers. Surg Obes Relat Dis 2005; 1:371–381
44. Deitel M, Gagner M, Erickson AL, et al. Third International Summit. Current Status of sleeve gastrectomy. Surg Obes Relat Dis 2011; 7: 749–59.
45. Mason R. Diagnosis and treatment of rapid pulse. Obes Surg 1995; 3:341
46. Duncan T, Tuggle K, Larry Hobson L et al. PL-107. Feasibility of laparoscopic gastric bypass performed on an outpatient basis. SOARD 2011; 7: 339–354
47. Baltasar A.: Simple bariatric tele-medicine. BMI-Latina 2015; 5:901-902
48. Baltasar A. WhatsApp© Assistance in Bariatric Surgery Journal of Obesity & Eating Disorders ISSN 2471-8203. 2017. 3;1:28. DOI: 10.21767/2471-8513.100017
49. DeMaria E, Pate V, Warthen M. et al: Original article Baseline data from American Society for Metabolic and Bariatric Surgery-designated Bariatric Surgery Centers of Excellence using the Bariatric Outcomes Longitudinal Database. SOARD 2010; 6:347–355
50. Nelson D, Blair KS, MD; Martin M.: Analysis of Obesity-Related Outcomes and Bariatric Failure Rates with the Duodenal Switch vs Gastric Bypass for Morbid Obesity. Arch Surg 2012; 147:847-854
51.
English W, DeMaria M,
Brethauer SA et al.: American Society for Metabolic and Bariatric Surgery
estimation of metabolic and bariatric procedures performed in the United States
in 2016. SOARD 2018; 14:259–263
52. Iannelli A, Schneck AS, Topart P. et al.: Laparoscopic sleeve gastrectomy followed by duodenal switch, in selected patients versus single-stage duodenal switch for super-obesity: case– control study. SOARD 2013; 9: 531–538
53. Biertho L, Lebel S, Marceau S et al.: Perioperative complications in a consecutive series of 1000 duodenal switches. SOARD 2013. 9:63–68
54. Biertho L, Simon‑Hould F, Marceau S, et al. Current Outcomes of Laparoscopic Duodenal Switch. Ann Surg Innov. Res 2016; 10:1. DOI 10.1186/s13022-016-0024-7
55. Biron S, Biertho L, Marceau S. Long-term follow-up of disease-specific quality of life after bariatric surgery. Surg Obes Relat Dis 2018 Accepted SOARD 3291
56. Prachand V, DaVee R, Alberdy JA.: Duodenal switch provides superior weight loss in the super-obese (BMI>50) compared with gastric bypass. Annals of Surg 2006; 244:611-619.
57. Strain CW, Gagner M, Inabnet WB et al.: Comparison of effects of gastric bypass and biliopancreatic diversion with duodenal switch on weight loss and body composition 1-2 years after surgery. Surg Obes Relat Dis 2007; 3:31-36
58. Topart P, Becouarn G, Salle A. Five-year follow-up after biliopancreatic diversion with duodenal Switch. Surg Obes Relat Dis 2011; 7:199–205
59. Våge V, Gåsdal R, Lakeland C et al. The Biliopancreatic Diversion with a Duodenal Switch (BPDDS): How Is It Optimally Performed? Obes Surg 2011; 21:1864–1869.
60. Angrisani L, Santonicola A, Iovino P et al. IFSO Worldwide Survey 2016: Primary, Endoluminal, and Revisional Procedures. Obes Surg 2018; 28:3783–3794 https://doi.org/10.1007/s11695-018-3450-2
61. Rabkin R, Rabkin JM, Metcalf B. et al.: Nutritional Markers following Duodenal Switch for Morbid Obesity. Obes Surg 2004; 14:84-90.
62. Keshishian A, Zahriya K, Willes EB.: Duodenal Switch Has No Detrimental Effects on hepatic Function and Improves Hepatic Steatohepatitis after 6 Months. Obes Surg 2005; 15: 1418-1423
63. Buchwald H, Estok R, Fahrbach K, et al. Weight and type 2 diabetes after bariatric surgery: systematic review and meta-analysis. Am J Med 2009; 122: 248–56. e5.
64. Tsoli M, Chronaiou A, Kehagias I.: Hormone changes and diabetes resolution after biliopancreatic diversion and laparoscopic sleeve gastrectomy: a comparative prospective study. Surg Obes Relat Dis 2013; 9:667–678.
65. Baltasar A. Primera operación metabólica de diabetes en España. BMI-Latina 2016; 6:996-9
66. Våge V, Roy M., Nilsen M, Berstad M. Predictors for Remission of Major Components of the Metabolic Syndrome after Biliopancreatic Diversion with Duodenal Switch. Obes Surg 2013; 23:80–86 DOI 10.1007/s11695-012-0775-0
67. Marceau P, Biron S, Marceau S et al K.: Biliopancreatic Diversion-Duodenal Switch: Independent Contributions of Sleeve Resection and Duodenal Exclusion. Obes Surg 2014; 24:1843–1849.DOI 10.1007/s11695-014-1284-0
68. Moustarah F, Marceau S, and Lebel S, et al.: Weight Loss
after Duodenal Switch without Gastrectomy for the treatment of Severe Obesity:
Review of a single institution Case Series of Duodeno-Ileal Intestinal Bypass. Can
J Surg. 2010; 53(4): S51.
69. Larrad A, Moreno B, Camacho A. Resultados a los dos años de la técnica de Scopinaro en el tratamiento de la obesidad mórbida. Cir. Esp. 1995; 58: 23. 22.
70. Larrad A; Sánchez-Cabezudo C; Borrajo et al. Short-, Mid- and Long-Term Results of Larrad Biliopancreatic Diversion. Obes Surg,2007; 17, 202-210
71. Solano J, Resa JJ, J A Fatas et al.: Derivación bilio-pancreática laparoscópica para el tratamiento de la obesidad mórbida. Aspectos técnicos y análisis de los resultados preliminares
72. Ballesteros M, González T, Urioste A.: Biliopancreatic Diversion for Severe Obesity: Long-Term Effectiveness and Nutritional Complications. Obes Surg 2016; 26:38–44 DOI 10.1007/s11695-015-1719-2
73. Hoyuela C, Veloso E, Marco C. Derivación bilio-pancreática con cruce duodenal y su impacto en las complicaciones posoperatorias. Cir. Esp. 2006;80 Supl 1:1-250 175
74. Sánchez-Pernaute A, Rubio M, Torres A et al. Proximal Duodenal–Ileal End-to-Side Bypass with Sleeve Gastrectomy: Proposed Technique. Modern surgery: Technical innovation Obes Surg (2007) 17:1614–1618 DOI 10.1007/s11695-007-9287-8
75. Halawani HM, Antanavicius G, Bonanni F.: How to Switch to the Switch: Implementation of Biliopancreatic Diversion with Duodenal Switch into Practice. Obes. Surg. 2017; 27 (9): 2506-2509. doi: 10.1007 / s11695-017-2801-8.
