
ORIGINAL
Atoxoplasmosis
en jilgueros (Carduelis carduelis): diagnóstico y ensayo terapéutico
Atoxoplasmosis in goldfinches (Carduelis carduelis):
diagnosis and therapeutic essay
Óscar
Miñana Morant
Clínica
Veterinaria Babieca. Gandía (Valencia). España
*
Autor para correspondencia.

This work is licensed
under a Creative
Commons
Attribution-NonCommercial-ShareAlike 4.0
International License
La revista no cobra tasas por el envío de trabajos,
Resumen
Objetivo. El diagnóstico de la atoxoplasmosis ante mortem en
aves paseriformes en ocasiones resulta complicado por la toma de muestras en
animales tan pequeños. En este estudio se pretende demostrar que la punción y
citología hepática es un método de diagnóstico fiable, fácil y seguro. Por otro
lado se propone un protocolo de tratamiento que combina tres fármacos para
combatir y eliminar los merozoitos de Isospora serini (syn.
Atoxoplasma) en la fase extraintestinal de la atoxoplasmosis.
Material y métodos. Para la realización de
este ensayo se utilizan cuatro jilgueros (Carduelis carduelis) con
sintomatología clínica (inactividad y hepatomegalia), a los que se le
diagnostica atoxoplasmosis mediante análisis coprológicos y citología hepática.
Se les administra un protocolo combinando sulfadoxina, pirimetamina y toltrazurilo.
Resultados. Se comprueba
una remisión de la sintomatología con disminución del tamaño hepático, además
de reducción en unos casos y eliminación total en otros, de ooquistes en heces
y merozoítos en células mononucleares.
Conclusiones. La reducción de parásitos tanto de las fases intestinales
como extraintestinales con los tratamientos administrados pueden ayudar a
superar el período crítico, hasta que las aves puedan hacerse inmunes a las
infecciones por el coccidio. Aunque los jilgueros se han mantenido
asintomáticos desde el inicio de los tratamientos y durante un largo período de
tiempo, con el protocolo administrado en este estudio no se puede confirmar que
se haya eliminado totalmente el parásito debido a la existencia de posibles falsos
negativos y se hacen necesarias nuevas investigaciones para comparar diferentes
protocolos y confirmar los resultados de los estudios.
Palabras clave
Isospora serini; merozoitos; sulfadoxina; pirimetamina;
hepatomegalia; citología
Abstract
Aims. The diagnosis of ante-mortem atoxoplasmosis in
passerines is sometimes complicated because taking samples from such small
animals. The aim of this study is to demonstrate that puncture and liver
cytology is a reliable, easy and safe diagnostic method. Also, a treatment
protocol is proposed that combines three drugs to combat and eliminate the
merozoites of Isospora serini (syn. Atoxoplasma) at the
extraintestinal phase of atoxoplasmosis.
Material and methods. Four
goldfinches (Carduelis carduelis) with clinical symptoms (inactivity and
hepatomegaly) are used to perform this test. Those birds are diagnosed with
atoxoplasmosis through coprological analysis and liver cytology, and was
administered a protocol combining sulfadoxine, pyrimethamine and toltrazuril.
Results. Is verified a remission of the symptomatology with reduction
of the hepatic size, and reduction in some cases and total elimination in
others of oocysts in feces and merozoites in mononuclear cells.
Conclusions. The reduction of parasites in the intestinal and
extraintestinal phases due the treatments administered can help to overcome the
critical period, until the birds can become immune to infections by Coccidium.
The goldfinches have remained asymptomatic since the beginning of the
treatments and for a long period of time with the protocol administered in this
study. But is not possible to confirm that the parasite has been completely
eliminated because the existence of possible false negatives. Then, new researches
to compare different protocols and confirm the results of those studies are
required.
Keywords
Isospora serini; merozoites; sulfadoxine; pyrimethamine;
hepatomegaly; cytology
Introducción
La atoxoplasmosis es una patología parasitaria de vital
importancia para aquellos que se dedican a la medicina aviar y en especial a
los paseriformes. Esta enfermedad puede llegar a producir efectos devastadores
en algunos aviarios produciendo altas tasas de mortalidad sobre todo en
animales más jóvenes. El microorganismo
(protozoo del orden Coccidia) tiene un ciclo de vida asexual en las
células mononucleares (fase extraintestinal
que puede afectar a hígado, bazo, pulmones y cerebro) y un ciclo de vida sexual en la mucosa intestinal(1). Esta enfermedad causa una
síntomatología totalmente inespecífica: diarrea, depresión, adelgazamiento,
plumaje desaliñado, ojos semicerrados o hundidos, diarreas, distensión del
abdomen.
A pesar de ser una enfermedad muy común supone un verdadero
reto para el veterinario clínico a la hora de realizar un tratamiento efectivo
que suponga la eliminación total del parásito. Los merozoítos
intramacrofágicos, contenidos en la vacuola parasitófora, permanecen
relativamente protegidos de los fármacos utilizados en el tratamiento de las
coccidiosis intestinales(2). Los fármacos elegidos para el
tratamiento de esta patología deberían ser capaces de acumularse en las células
macrófagas y alcanzar concentraciones endocelulares que consigan un efecto parasiticida.
Aunque se han propuesto varios protocolos terapéuticos a lo
largo del tiempo, actualmente no existe un protocolo resolutivo, consiguiendo
sólo reducir o eliminar la emisión de ooquistes pero no la de macrófagos
infectados que acaban reconstruyendo la reserva de merozoítos intestinales
capaces de perpetuar el ciclo sexual(2).
Para la realización de este ensayo se utilizan cuatro
jilgueros diagnosticados de atoxoplasmosis mediante análisis coprológicos y
citología hepática a los que se les administra un protocolo combinando tres
fármacos (sulfadoxina, pirimetamina y toltrazurilo). La sulfadoxina presenta
una buena absorción oral y sus concentraciones terapéuticas llegan a casi todos
los tejidos uniéndose a las proteínas plasmáticas, considerándose una sulfamida de absorción rápida, excreción
muy lenta y acción prolongada(3); la pirimetamina ejerce un efecto sinérgico con las
sulfamidas y está descrita en el tratamiento de atoxoplasmosis(2,4,5);
el toltrazurilo se utiliza para combatir las formas agudas de la enfermedad
actuando en las fases intestinales(2,4,6).
En este estudio se realizan dos ensayos a distintas dosis,
comprobando una remisión de la sintomatología y disminución del tamaño hepático
en todos los casos, con reducción en unos casos y eliminación en otros de
ooquistes en heces y merozoítos en células mononucleares.
Objetivos
La atoxoplasmosis es una enfermedad parasitaria que afecta a
aves paseriformes, principalmente a Canarios, Jilgueros, Pinzones, Gorriones,
Estorninos y Minás(7). Es producida por un protozoo del orden Coccidia,
concretamente por Isospora (sin. Atoxoplasma) serini. Este
protozoo se transmite vía oro-fecal, siendo los ooquistes muy resistentes en el
medio ambiente y se ha demostrado que es un parásito hospedador específico(7).
El contagio es siempre oral a través de alimentos o agua
contaminados por heces. Influyen condiciones ambientales como la mala higiene,
el hacinamiento, exposición a concursos, cambios bruscos de temperatura y
cualquier situación estresante como la muda, el destete o déficits
nutricionales. El microorganismo tiene un
ciclo de vida asexual en las células mononucleares (fase extraintestinal que puede afectar a hígado, bazo, pulmones y
cerebro) y un ciclo de vida sexual en
la mucosa intestinal(1,2,4).
La coccidiosis extraintestinal o atoxoplasmosis causa una
síntomatología totalmente inespecífica: diarrea, depresión, adelgazamiento,
plumaje desaliñado, ojos semicerrados o hundidos (por la deshidratación),
cloaca sucia por las diarreas que pueden ser blanquecinas o hemorrágicas,
aumento aparente del apetito (el animal está todo el día en el comedero, aunque
come poco), distensión del abdomen (por inflamación del duodeno y por la
hepatomegalia). Ocurre mayoritariamente en aves jóvenes, y desencadena un
problema de malabsorción con pérdida de proteínas, que lleva a la pérdida de
peso y disminución de la musculatura pectoral. Además se produce anemia que
puede reflejarse en un cambio de coloración azulada en el pico e incluso en
síntomas neurológicos (poco frecuentes) debido a la hipoxia causada por la
anemia(2).
Respecto al tratamiento se han descrito algunas drogas como
la sulfaclorpiracina, sulfaclorpiridazina y toltrazurilo(1,4) que
actúan sólo sobre las etapas intestinales del parásito. Otros tratamientos
propuestos con cierto efecto sobre las formas extraintestinales son el
diclazuril y clazuril(2,4), el sulfato de primaquina (antimalárico)(2),
o la combinación pirimetamina/ sulfametoxipirazina2,5)
(antimaláricos). También se han propuesto los tratamientos con tetraciclinas(2)
y con las sulfamidas utilizadas para las coccidiosis intestinales
(sulfaquinoxalina, sulfametazina, sulfametoxazol)(2,4,6,8).
El objetivo del estudio es valorar la respuesta al
tratamiento combinando un fármaco que actúa contra las formas intestinales
(toltrazurilo) con otros dos fármacos que pueden actuar sobre las formas
extraintestinales (pirimetamina y sulfadoxina).
Material y Métodos
El presente ensayo se realiza en cuatro jilgueros silvestres (Carduelis
carduelis) (jilgueros 1- 4) capturados unas semanas antes, y diagnosticados de atoxoplasmosis mediante análisis
coprológico y citología hepática y con síntomas compatibles con la enfermedad.
En el momento de empezar el tratamiento médico todos los
animales presentan pérdida de actividad, embolamiento (Figura 1) y distensión
abdominal con hepatomegalia (el hígado sobresale de la línea del esternón) (Figura
2). Aparentemente ninguno ha dejado de comer.

Figura
1. Jilguero embolado.

Figura
2. Distensión abdominal con hepatomegalia grave.
La confirmación del diagnóstico se realiza mediante el examen
coprológico en fresco y con flotación en solución de NaCl evidenciando los
ooquistes de coccidios por ambos métodos (Figura 3). Los ooquistes esporulados
confirman que se trata de coccidios del género Isospora (2 esporocistos
y 4 esporozoitos) (Figura 4).
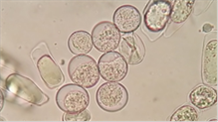
Figura
3. Ooquistes de coccidios en heces 40x
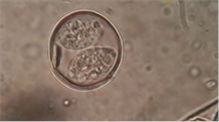
Figura
4. Ooquiste de Isospora sp en heces100x
La citología hepática se realiza por punción con aguja fina
30G (Figura 5) y posterior tinción con Diff Quick evidenciando la presencia de
merozoitos de Atoxoplasma en el citoplasma de las células mononucleares(7)
(Figura 6, 7). También podemos observar dichos merozoitos en un frotis de
sangre en este caso (Figura 8).

Figura
5. Punción hepática aguja 30 G.
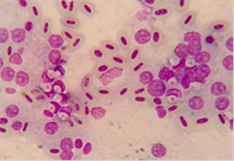
Figura
6. Merozoitos en células mononucleares (citología hepática).
Tinción Diff Quick 100x
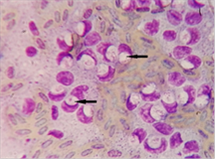
Figura 7. Atoxoplasmosis
grave (impronta hepática) Tinción Diff Quick 100 x (ampliada)
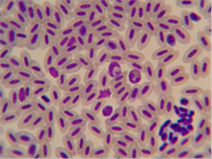
Figura 8.
Frotis sanguíneo con merozoito en célula central de la imagen. Tinción
Hemacolor 100x
Ensayo 1
Se inicia un tratamiento con toltrazurilo (Baycox@
50 mg/ml- Lab Bayer Hispania S.L., Barcelona) a la dosis de 20 mg/kg vía oral
24h (PO)(9) durante 2 días, descansando 5 días y repitiendo el
tratamiento 2 días más. El tratamiento se aplica con sonda diluyendo el
medicamento 1:50 con agua para reducir su alcalinidad(2). Los
animales mejoran rápidamente y una vez finalizado el tratamiento los análisis
coprológicos realizados durante tres días consecutivos son negativos.
Dos semanas después en un control coprológico, se vuelven a
observar coccidios en los cuatro jilgueros y además todos presentan un mayor
aumento del tamaño del hígado en distinto grado.
Se realiza una triple terapia combinando sulfadoxina, pirimetamina y toltrazurilo, con la finalidad de
comprobar si se llega a eliminar el parásito tanto a nivel intestinal como
extraintestinal. Se inicia el tratamiento con sulfadoxina 20 mg/kg y
pirimetamina 1 mg/kg (Fansidar® comprimidos 500mg/25mg-
Lab. Roche, Boulogne-Bilancourt) cada 12h (BID) PO durante 40 días (dosis en
base a la pirimetamina(9)) combinando con tortrazurilo 20 mg/kg 24h
PO 2 días a la semana. La preparación del medicamento se realiza disolviendo el
comprimido a partes iguales con agua y un jarabe
para preparar suspensiones (Ora-sweet®- Lab.
Perrigo, Australia). La medicación se administra por sonda para asegurar que los
jilgueros toman la dosis exacta durante todo el período de tratamiento. Durante
dicho tratamiento todos los animales se mantienen aislados en jaulas
individuales.
Ensayo 2
La pobre respuesta al tratamiento observada en uno de los
jilgueros (jilguero 1) invita a la realización de un segundo ciclo de
tratamiento de 40 días en este animal, combinando toltrazurilo a la misma dosis
y aumentando la dosis de sulfadoxina a 80 mg/kg BID PO y pirimetamina a 4 mg/kg
BID PO.
Resultados
Uno de los jilgueros (jilguero 4) fallece durante el
tratamiento con toltrazurilo antes de iniciar el tratamiento con sulfadoxina y
pirimetamina. Se realiza la necropsia e histopatología determinando que la causa principal de la muerte de este jilguero es una
duodenitis y hepatitis de alto grado debida a atoxoplasmosis y asociada a
coccidiosis enteroepitelial intensa, caracterizándose
el cuadro como atoxoplasmosis grave.
Ensayo 1
Los jilgueros 1- 3 completan el primer período de tratamiento
durante el cual se realizan exámenes coprológicos y citologías hepáticas cada
20 días observando una progresiva reducción de merozoítos en las citologías
hepáticas y ausencia de ooquistes en heces desde los primeros controles (Tabla
1).
Finalizado este período de tratamiento, dos jilgueros
(jilguero 2 y 3) son negativos a las citologías hepáticas y a los análisis
coprológicos seriados (3 días consecutivos), mientras que uno de ellos
(jilguero 1) sigue dando positivo en las citologías, aunque con una reducción
considerable en el número de merozoitos (Tabla 1).
Los dos animales negativos se mantienen en observación sin
tratamiento y el jilguero positivo sigue con tratamiento de toltrazurilo 2 días
a la semana en el agua de bebida durante un mes.
Los controles realizados cada 20 días durante los dos meses
posteriores al tratamiento siguen dando negativo en los jilgueros 2 y 3 (tanto
en las citologías como en las coprologías), mientras que el jilguero 1 sigue
siendo positivo en las citologías hepáticas (Tabla 1).
Ensayo 2
Durante el segundo ciclo de tratamiento realizado en el
jilguero 1 los controles de heces son negativos, pero las citologías hepáticas
siguen dando positivo (Tabla 1).
Finalizados los dos ensayos se siguen realizando controles
mensuales en los tres jilgueros hasta 6 meses postratamiento. Los tres
jilgueros siguen siendo negativos en los análisis coprológicos y sólo el jilguero
1 es positivo en las citologías hepáticas. Los tres animales han experimentado
una reducción del tamaño hepático, observando incluso en el jilguero 2 una
remisión de la hepatomegalia.
En el último control ocho meses después, los jilgueros 1 y 2
vuelven a dar positivo en heces y en la citología hepática (aunque el jilguero
2 mantiene el tamaño normal del hígado). Sólo el jilguero 3 sigue siendo
negativo en ambas pruebas (Tabla 1).
En ningún caso se han observado efectos secundarios con los
tratamientos aplicados, habiendo mejoría clínica y reducción del tamaño
hepático en todos los animales (Figuras 9- 14). Tampoco se ha observado ninguna
complicación en ninguna de las punciones hepáticas.
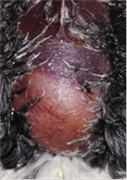
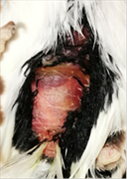
Figura 9. Jilguero 1 (dia 1)Figura 10. Jilguero 1
postratamiento
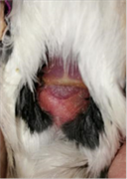
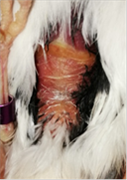
Figura 11. Jilguero 2 (dia 1)Figura
12. Jilguero 2 postratamiento
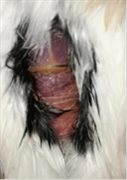
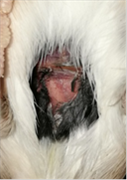
Figura 13. Jilguero 3 (día 1)Figura 14. Jilguero 3
postratamiento
Discusión
Los coccidios con etapas extraintestinales son patógenos,
provocando cambios clínicos graves. La mortalidad puede alcanzar el 80% en aves
jóvenes(2,4).
La detección de los eliminadores se realiza mediante el
análisis coprológico, bien directo o por métodos de concentración como es la
flotación.
Algunos estudios han demostrado que la emisión de ooquistes
en heces sigue un ciclo que coincide con la cinética del aparato
gastrointestinal del ave, variando el pico de emisión dependiendo de si la
especie es muy territorial (jilgueros, lúganos, canarios) o si es una especie
más gregaria (gorriones) o incluso dependiendo de si el parásito coloniza
partes del intestino delgado proximal (duodeno) o partes del intestino bajo. Por
ello como el pico de emisión puede variar, debemos realizar análisis coprológicos
de heces recogidas en franjas horarias distintas y durante al menos tres días
consecutivos. Se ha observado que en general las eliminaciones más frecuentes
ocurren por la tarde(1,2,10).
Debido al gran parecido morfológico de Atoxoplasma con
los coccidios intestinales, es prácticamente imposible diferenciarlos en el
examen coprológico, y sólo podemos distinguirlos por las lesiones que causan.
Para realizar el diagnóstico de atoxoplasmosis en el animal
vivo podemos recurrir a:
- Biopsia hepática.: la histopatología puede revelar tejido
hepático normal debido a la pequeña muestra de tejido que se puede tomar en
estas especies de aves tan pequeñas, y la distribución multifocal de las
lesiones hepáticas que se asocian a la infección por Atoxoplasma, dando
como resultado un diagnóstico negativo falso(6).
- Citología hepática: técnica menos invasiva para el
diagnóstico y control de la evolución de la enfermedad(8), siendo
esta técnica más viable para las especies más pequeñas, aunque con las mismas
desventajas de poder obtener falsos negativos.
- Frotis sanguíneo: podemos encontrar Atoxoplasma en
las células mononucleares(2,4,6) (Figura 8). Se recomienda realizar
múltiples frotis ya que estos pueden llegar a dar negativo en animales
sintomáticos con excreción de ooquistes por heces.
- Frotis de la capa leucocitaria (buffy coat): aumenta la
probabilidad de encontrar el parásito en sangre(2,4,6). Una vez
centrifugada la sangre se toma la muestra de la capa blanca que separa los
hematíes del plasma. En muchas ocasiones supone todo un reto realizar este tipo
de prueba debido a los pequeños volúmenes de sangre que se pueden tomar en
estas especies de aves.
- Reacción en Cadena de la Polimeresa (PCR) en heces o sangre(4)
y microscopía electrónica(4) (pruebas no siempre disponibles).
Actualmente la PCR (prueba no invasiva) aplicada normalmente en heces (pero
también en sangre o tejidos del cadáver), permite identificar fácilmente a las
aves infectadas pero asintomáticas (prueba efectuada en la Universidad de
Georgia, USA).
El diagnóstico postmortem se puede realizar a partir del anális histopatológico de los tejidos diana (hígado, bazo, pulmones, intestinos)(4)
o sus improntas.
Los merozoitos de Atoxoplasma
en las células mononucleares en una impronta o en sangre periférica se observan como un cuerpo
de inclusión redondeado u ovalado en el citoplasma de la célula hospedadora
(monocito, linfocito, macrófago) que se tiñe poco y presenta cromatina que se
tiñe de rosa y causa un desplazamiento del núcleo de la célula, adoptando este
una forma de medialuna(7,11) (Imágenes 6,7,8).
Respecto al tratamiento se han propuesto varios protocolos:
- Toltrazurilo(2,4,6): Diluido a una concentración
de 1:50 para reducir su alcalinidad. Dicha alcalinidad puede provocar un
"mouth and crop burning" que frena hasta 48h la alimentación de las
aves(2). Se puede administrar directamente en el pico para combatir
las fases agudas de la enfermedad y conseguir reducir las bajas. Se realiza un
tratamiento de dos días consecutivos, descansar cinco días y repetir dos días(9).
No hay ninguna constancia de que actúe contra las formas extraintestinales(6,12)
pudiendo causar estas la reaparición de formas intestinales después del
tratamiento, como ha ocurrido en nuestro caso. Se puede repetir el tratamiento mensualmente
y también se puede usar en colectividades en el agua de bebida la dosis de 25
mg/litro(5).
- Sulfacloropirazina (no disponible en España)(2,4,6):
300 mg/litro de agua durante 5 días, descansar tres días y repetir 5 días más.
Este ciclo se repite cuatro veces. Este tratamiento se tiene que hacer al menos
tres veces al año y hacerlo coincidir antes y después de la época de
reproducción para minimizar el contagio a los polluelos. No funciona para
formas extraintestinales.
- Diclazuril y Clazuril(2,4): pueden usarse y
parecen tener algo más de efectividad en las fases extraintestinales (tampoco
están disponibles en España).
- Sulfato de Primaquina (no disponible en España): antimalárico
que puede ser eficaz en las formas extraintestinales (puede eliminar la
infección macrofágica)(2).
- Pirimetamina + sulfametoxipirazina(2,5): otro
antimalárico efectivo en las fases extraintestinales, a una dosis de 300
mg/litro con una pauta similar a la usada con la sulfacloropirazina. Sólo
disponible en España la pirimetamina.
- Tetraciclinas: usadas en pautas similares a las utilizadas
contra las clamidofilas(2).
- Sulfamidas utilizadas para las coccidiosis intestinales(2,4,6,8):
sulfaquinoxalina, sulfametazina, sulfametoxazol.
El uso de sulfamidas según la experiencia de algunos autores(2)
puede provocar síndromes hemorrágicos graves, por lo que se recomienda su uso
acompañado de suplementos con vitamina B y vitamina K. Sin embargo en nuestro
caso no se han utilizado dichos suplementos y no se han observado efectos
secundarios.
Dentro de los cinco tipos de sulfamidas que existen según su
velocidad de absorción y excreción, la sulfadoxina se considera una sulfamida
de absorción rápida, excreción muy lenta y acción prolongada(3). Las
sulfonamidas en la mayoría de los casos se absorben por vía oral y las
concentraciones terapéuticas llegan a casi todos los tejidos del cuerpo
uniéndose a las proteínas plasmáticas en diversos grados. Se metabolizan en el
hígado y se excretan por el rinón(3).
|
La combinación sulfadoxina y pirimetamina
utilizada en este ensayo (no disponible en España) actúa como antiprotozoario(13)
y se utiliza para el tratamiento de la malaria. La pirimetamina es
un inhibidor de la dihidrofolato reductasa y la sulfadoxina es un antagonista
competitivo del ácido para-aminobenzoico (PABA), bloqueando así dos fases de
la vía metabólica del ácido fólico esencial para la supervivencia del
parásito(5,14). De esta manera se impide su división nuclear en el
momento de la formación de los esquizontes dentro de los eritrocitos y en el
hígado(14).
El toltrazurilo actúa inhibiendo el
transporte de electrones en la fosforilación oxidativa, produce anormalidades
en el aparto de Golgi e impide la división celular y formación de la pared
del microgameto(5).
En el ensayo realizado con esta triple
terapia no se han observado efectos secundarios en ningún animal , aunque el
bajo número de animales tratados en este estudio no permite descartarlos.
Conclusiones
|
|
- La citología hepática como medio de diagnóstico de
atoxoplasmosis en aves pequeñas, ha resultado ser un método muy sensible para
el diagnóstico de la enfermedad, siendo al mismo tiempo muy sencillo de
realizar, mínimamente invasivo y considerablemente seguro.
- El resultado positivo a Atoxoplasma en los cuatro
jilgueros silvestres recién capturados, aún teniendo en cuenta el bajo número
de individuos evaluados, confirma la existencia de la atoxoplasmosis en la
naturaleza y que esta adquiere un considerable relevancia en animales
capturados, ya que un factor de estrés como la cautividad, puede favorecer el
desarrollo de la enfermedad.
- Los resultados negativos a las citologías hepáticas y la
ausencia de ooquistes en heces durante un largo período de tiempo, no confirma
la eliminación completa del parásito, como ha ocurrido en el jilguero 2.
Teniendo en cuenta que los animales se han mantenido aislados en jaulas
individuales para evitar que se puedan volver a contagiar, los resultados
negativos en las citologías durante tanto tiempo podrían deberse a la
distribución multifocal de las lesiones hepáticas como ya se ha comentado y a
la reducción del número de merozoitos como respuesta al tratamiento, tratándose
por tanto de un falso negativo durante todo ese tiempo.
- Tanto la reducción de parásitos de las fases intestinales
como extraintestinales con los tratamientos administrados pueden ayudar a superar el
período crítico, hasta que los jilgueros puedan hacerse inmunes a las
infecciones por el coccidio, como puede haber ocurrido en todos los jilgueros, ya que se
han mantenido asintomáticos desde el inicio de los tratamientos y durante un
largo período de tiempo.
- Con el protocolo administrado en este estudio, aún resultando efectivo
contra las etapas extraintestinales (disminución de merozoitos y reducción del
tamaño hepático) no se puede confirmar que se haya eliminado totalmente el
parásito en el jilguero 3. El pequeño número de animales ensayados y la
posibilidad de tratarse de un falso negativo hacen necesarias nuevas
investigaciones para comparar diferentes protocolos y confirmar los resultados
de los estudios.
- El aumento de la dosis de la sulfadoxina y pirimetamina en
el ensayo 2, no parece ser más efectiva que la dosis utilizada en el ensayo 1,
aunque tampoco parece haber producido ningún efecto secundario.
Nota
El jilguero (Carduelis carduelis) pertenece a la
familia Fringilidae. Esta familia está compuesta por especies que
pertenecen muchas de ellas a la fauna europea. En nuestro país estas especies
están protegidas por ser fauna autóctona, por tanto cada vez que nos
encontremos en nuestra consulta con uno de estos animales, deberemos preguntar
el origen del mismo. Si ha sido encontrado en estado silvestre, deberemos
aconsejar después de su exploración y/o tratamiento la necesidad de volverlo a
soltar o llevarlo a un centro de recuperación.
Sólo aquellas personas pertenecientes a alguna federación
ornitológica (actividad denominada silvestrismo), pueden adquirir permisos
especiales en algunas épocas del año y según comunidades autónomas, para
realizar capturas controladas en pequeñas cantidades destinadas a la cría en
cautividad(15). Estos animales capturados llevarán una anilla
identificativa (abierta) que quedará registrada en cada federación o asociación
ornitológica. El resto de los animales deberán estar criados en cautividad y
estar identificados con una anilla cerrada inamovible.
Referencias
1. Tully TN,
Dorrestein GM, Jones AK. Passerines and exotic softbills in Handbook of Avian
Medicine. Oxford,
2000. Ed. Saunders Elsevier: 161- 178.
2. Catarossi
D. Paseriformes in Proceedings. XXXIV reunión científica GMCAE-AVEPA, 21-22
noviembre de 2015, Sitges (Barcelona).
3. Léo VF, Campos DF,
Dabus DM, Lima GS, Trentin TC, Negri DD. Farmacocinética e farmacodinâmica da
associaçao das sulfas e trimetoprim. Revista Científica Electrónica de
Medicina Veterinaria- ISSN: 1679-7353. Enero 2009; Año VII (12).
4. Powers LV.
Veterinary care of passerines. Proceedings of The Association of Avian
Veterinarians 32 nd Annual Conference: 140. August 2011, Seattle.
5. Montesinos A, Ardiaca
M. Guía Terapéutica en Animales Exóticos. Barcelona, 2017. Ed. Multimédica
Ediciones Veterinarias: 222- 223, 268- 269.
6. Norton T,
Neiffer DL, Beson K y col. Atoxoplasma medical protocols recommended by the
passerine atoxoplasma working group actualizada 2007. Conferencia de la
Región Oriental AZA en Columbia, Carolina del Sur 27 de marzo de 2003.
http://www.aazv.org/ ?page=545&hhSearchTerms="atoxoplasma"
(visitado 20-3-2016).
7. Soto Piñeiro, C.J.,
Acosta Guevara, I. Hallazgo de Atoxoplasma serini en canarios. REDVET.
Revista electrónica de veterinaria. ISSN: 1695- 7504, 2009. Vol 10, nº 7B.
8. Maínez Ferrández M,
Juan- Sallés C, Cardona T, Such R, Hernández A. Citología hepática para el
diagnóstico y seguimiento de atoxoplasmosis en jilgueros (Carduelis
carduelis major). XV Congreso de Especialidades Veterinarias, 8 y 9 de
abril de 2016, Zaragoza.
9. Carpenter
JW. Exotic Animal Formulary. St Louis, Missouri, 2013. Ed. Elsevier Saunders:
248- 255.
10. Morin AV, Vogelnest L, Dhand NK, Shiels M, Angus W, Slapeta J. Afternoon
shedding of a new species of Isospora (Apicomplexa) in the endangered
Regent Honeyeater (Xanthomyza phrygia). Parasitology, 2011; 138 (6):
713-24. https://doi.org/10.1017/S0031182011000126.
11. Forbes NA, Altman RB.
Autoevaluación ilustrada en Medicina Aviar. Madrid, Grass
edicions, 2002; 175.
12. Jamriska J, Lavilla
L, Thomasson A, Barbon A, López J, Modry D. Treatment of atoxoplasmosis in the
Blue-crowned Laughing Thrush (Dryonastes courtoisi). Avian Pathology,
2013 Vol. 42, No. 6, 569-571. https://doi.org/10.1080/03079457.2013.854309
13. Goldsmith R.
Antiprotozoarios en: Farmacología básica y clínica. 7 ª ed México DF. El manual
moderno, 1998; 972- 973.
14. Alvear J. Agentes
usado para combatir plasmodios en: Fundamentos de farmacología médica. Quito,
1999. Ed. Ed. Universidad Central de Ecuador: 1160-1161.
15. Atienza JC, Bermejo
A, Del Moral JC, Escandell V, Palomina D, Iñigo A. Sociedad Española de
Ornitología. Evaluación del concepto "Pequeñas Cantidades" y demanda
de Aves para Silvestrismo en relación a las excepciones contempladas en la
directiva 79/409 CEE de aves. Expendiente: 290910601. Informe final. Abril
2010.
![]()














