ORIGINAL
Medición de glicemia en hurones: evaluación de tres métodos portátiles de uso humano
Measurement of glucose in ferrets: accuracy of three human portable meters
Daniel Alejandro Gómez Pizano1, Ángela Rodríguez Hernández1, Adriana Margarita Ducoing Watty2, Delia Arlette Castillo Mata3, Ricardo Itzcóatl Maldonado Reséndiz1
1 Departamento de Etología, Fauna Silvestre y Animales de Laboratorio, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México. México
2 Departamento de genética y bioestadística, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México. México
3 Departamento de Patología, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México. México
* Autor para correspondencia.
![]()
This work is licensed
under a Creative
Commons
Attribution-NonCommercial-ShareAlike 4.0 International License
La revista no cobra tasas por el envío de trabajos,
Resumen
Objetivos. En los hurones los equipos portátiles podrían subestimar los valores de glucosa en sangre, se pretende evaluar la exactitud de los equipos mencionados.
Materiales y Métodos. En el presente trabajo se comparó el valor de la glicemia obtenido con tres glucómetros portátiles digitales de uso humano. Se evaluaron 11 muestras sanguíneas de hurones.
Resultados. Los resultados obtenidos sugieren que ninguno de los 3 equipos portátiles evaluados es equivalente en la medición de glucosa en sangre en hurones, al compararlos con los resultados obtenidos en un laboratorio de gabinete, ya que los tres métodos subestiman el valor de la glucosa con respecto al valor obtenido en el laboratorio.
Conclusiones. Según lo encontrado, los autores sugieren interpretar con cautela los resultados de equipos portátiles para la medición de glicemia en hurones, se sugiere corroborar los resultados con los obtenidos en laboratorio de gabinete.
Palabras clave
Glucosa; glucómetros portátiles; glicemia; Mustela
Abstract
Aims. In ferrets, portable equipment could underestimate blood glucose values, this study evaluate the accuracy of these meters.
Methods and Material. Blood samples were obtained from 11 ferrets to compare glycemia values obtained with 3 portable blood glucometers.
Results. The 3 point-of-care glucometers tested underestimated the
glycaemia values when compared with the results obtained with the
automated biochemical analyzer. Therefore, the results suggest that none
of the 3 portable blood glucometers are reliable for measuring blood glucose in
ferrets, also indicates an average underestimation in relation to the laboratory
analyzer.
Conclusions. The clinicians should be cautious when interpreting glycemia values in ferrets obtained with these 3 point-of-care glucometers, and always corroborate the results with an automated biochemical analyzer.
Keywords
Glucose; point-of-care glucometers; glycemia; Mustela
Introducción
Los equipos portátiles para medición de glucosa están estandarizados para humanos y algunos para perros y gatos. En la práctica clínica veterinaria se ha considerado como una herramienta confiable el uso de equipos digitales portátiles que determinan la glucosa por medio del método de colorimetría diseñados para humanos(1–3).
Sin embargo, algunos estudios recientes han cuestionado la certeza de estos métodos portátiles, ya que se han podido demostrar algunas diferencias de medición entre las marcas comerciales existentes(4–6), a pesar de que han sido calibrados para ser utilizados en las especies indicadas. Por ejemplo, en hurones, se ha comprobado que los equipos portátiles de medición de glucosa de uso humano tienden a subestimar los valores, al compararlos con los valores obtenidos en el laboratorio de gabinete(7) (Figura 1).
Figura 1. Ejemplar de hurón (Mustela putorius furo) en evaluación física previa a la extracción de la muestra sanguínea.
Petritz et al(7), reportó que los equipos portátiles de uso veterinario diseñados para perros y gatos, tienen una mayor precisión que los utilizados en humanos para medir glucosa en sangre en hurones cuando se comparan con los resultados obtenidos con el equipo de laboratorio de gabinete. El equipo para perros que se utilizó en ese estudio, a pesar de que tiende a sobreestimar los valores de glucosa, es el que tuvo menores variaciones en los resultados con respecto a la medición de laboratorio. En este estudio los autores asociaron las variaciones a que la glucosa en sangre es inestable y esto pudo estar generado las variaciones reportadas.
Con base en lo anterior, planteamos un estudio clínico prospectivo preliminar con el objetivo de establecer la confiabilidad de la medición de glucosa en sangre de hurones usando equipos portátiles diseñados para humanos de diferentes marcas, ya que los equipos calibrados para su uso en clínica veterinaria no son específicos para hurones y en ocasiones pudieran no estar al alcance de todos los cínicos. Consideramos que los métodos portátiles usados en México para la medición de glucosa en humanos subestiman la medición de glucosa sanguínea en hurones, al compararlos con los valores obtenidos por la medición en suero en un laboratorio de gabinete veterinario especializado.
Población y Métodos
Sujetos de estudio: Se incluyeron 11 hurones (Mustela putorius furo) que asistieron a consulta al Hospital Veterinario de Especialidades en Fauna Silvestre y Etología Clínica (HVE FS EC) de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional Autónoma de México (FMVZ-UNAM), sin importar sexo, edad o estado de salud.
Obtención de muestras: Se colectaron muestras sanguíneas de cada uno de los individuos. La muestra se obtuvo de vena cava craneal por medio de contención física apoyándonos de la técnica de sujeción por “scruffing”(8,9). La venopunción se realizó con una jeringa de 3ml, con agujas calibre 20 o 22 G. La sangre se colocó en Microtainer ® Brand Tubes ™ sin anticoagulante, obteniéndose un mínimo de 0.5 ml de sangre.
Medición de glucosa sanguínea: A cada muestra sanguínea se le realizaron 4 mediciones de glucosa, usando cuatro equipos diferentes. Para las primeras tres mediciones se usaron equipos portátiles de uso humano. La cuarta medición se realizó en el laboratorio de patología clínica del Departamento de Patología de la FMVZ-UNAM.
Los equipos portátiles de uso humano que se utilizaron fueron: One Touch® Ultra 2® – Life scan Inc (OTU), One Touch® UltraMini® Life scan Inc (OTM) y Contour TS ® de Bayer (CTS). La medición entre cada uno de los equipos se realizó con un intervalo máximo de 1 minuto. Para cada medición se utilizaron las tiras reactivas propias de cada marca y del equipo correspondiente. En los equipos de marca Life Scan Inc®, se utilizaron tiras One Touch® Ultra-Life Scan Inc®, y para el equipo de marca Bayer® se utilizaron las tiras Contour TS® marca Bayer®.
La sangre restante se colocó en un Microtainer simple y se llevó inmediatamente al departamento de patología de la FMVZ-UNAM para realizar el centrifugado de la muestra y separar el suero. En todos los casos este procedimiento se realizó en un tiempo menor a 15 minutos. En el laboratorio, la medición de glucosa se realizó por técnica de química húmeda en un espectrofotómetro de marca Randox® línea Rx Imola de uso humano con el método: Glucosa (GLUC-PAP) – GOD/PAP de Rx series®.
Método de análisis estadístico: Para cada muestra se obtuvo la diferencia entre el valor de glucosa que determino cada equipo y el valor de glucosa que se obtuvo en el laboratorio de gabinete y con estas diferencias se obtuvo: una gráfica de dispersión de las diferencias para cada muestra del valor que arroja el método menos el resultado de laboratorio contra el promedio de dichos valores, los límites de concordancia y el intervalo de confianza de 95%. Para este fin se utilizó el paquete SPSS 16.0 desarrollado por IBM(10,11).
Resultados
Se obtuvieron muestras
sanguíneas de 11 ejemplares, de las cuales se obtuvieron valores de glucosa
sanguínea con los tres equipos digitales portátiles y con el equipo de gabinete
de patología clínica. (Tabla 1). Donde es posible observar que de manera general
los tres métodos subestimaron el valor de la glucosa con respecto al valor
obtenido en el laboratorio. (Figura 2).
Tabla 1. Tabla con las mediciones obtenidas con los diferentes equipos de medición de glucosa en sangre en las 11 muestras. (Unidades en mg/ml)
|
Muestra |
OTU |
OTM |
CTS |
Laboratorio |
|
1 |
72 |
67 |
75 |
71.8 |
|
2 |
89 |
83 |
81 |
115.12 |
|
3 |
127 |
118 |
86 |
103.2 |
|
4 |
100 |
70 |
63 |
124.3 |
|
5 |
100 |
97 |
82 |
119.2 |
|
6 |
96 |
82 |
78 |
99.6 |
|
7 |
104 |
107 |
97 |
119.2 |
|
8 |
65 |
65 |
57 |
57.2 |
|
9 |
60 |
65 |
56 |
73.8 |
|
10 |
72 |
75 |
66 |
95.48 |
|
11 |
73 |
76 |
64 |
100.9 |
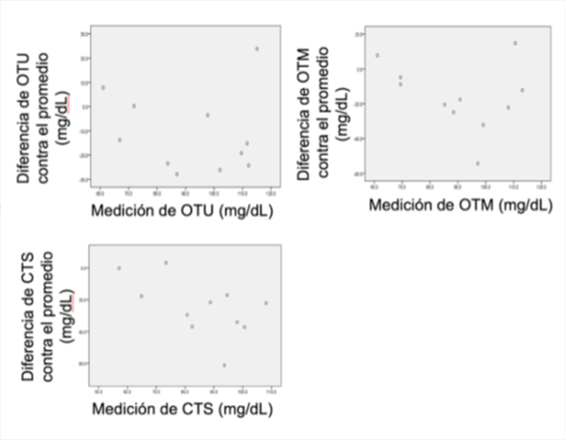
Figura 2. Gráficas de dispersión donde se representa la diferencia del equipo OTU (A), OTM (B) y CTS( C), cada una menos los resultados de laboratorio contra el promedio.
En la Tabla 2 se muestran los resultados del análisis de concordancia donde se incluyen los resultados de los cálculos de límites de confianza, precisión de los límites de confianza e intervalo de confianza.
Tabla 2. Resultados del análisis de concordancia. Límite inferior (LI). Límite superior (LS). (Valores en mg/dl)
|
Método |
Limites de confianza 95% |
Precisión de los límites de confianza 95% |
Intervalo de confianza para sesgo de 95% |
|||||
|
LI |
LS |
LI 95% |
LS 95% |
LI |
LS |
|||
|
LI |
LS |
LI |
LS |
|||||
|
OTU |
-43.84 |
21.69 |
-62.90 |
-24.78 |
2.63 |
40.76 |
-22.08 |
-0.06 |
|
OTM |
-53.70 |
21.92 |
-75.70 |
-31.70 |
-0.08 |
43.91 |
-28.59 |
-3.19 |
|
CTS |
-61.06 |
11.09 |
-82.05 |
-40.07 |
-9.89 |
32.08 |
-37.09 |
-12.86 |
En cuanto a los límites de concordancia, ninguno de los equipos tuvo un rango aceptable de error en la medición de glucosa respecto al laboratorio. Con respecto a la precisión de los límites de concordancia, resultó ser muy pobre para los tres equipos. (Tabla 2)
Discusión
Los resultados obtenidos sugieren que los 3 equipos digitales portátiles para medición de glucosa sanguínea que fueron utilizados subestiman los valores de glicemia al compararlos con los valores obtenidos al evaluar la misma muestra en el laboratorio clínico. Además, ninguno de los 3 equipos digitales portátiles tuvo una buena concordancia en los valores de glicemia al compararlos con los valores estimados en el laboratorio, pues los intervalos fueron muy amplios, esto se puede deber a que los equipos una gran variabilidad al medir la misma muestra sanguínea, además, el tamaño de muestra puede impactar en los resultados.
El equipo CTS es el que demuestra una menor variabilidad, pero fue en el que más difirieron sus resultados en promedio con respecto a los obtenidos en el laboratorio. En cuanto al equipo OTU aunque no se obtuvo una congruencia muy cercana con respecto a la medición de laboratorio, fue el que mejores resultados arrojó de los tres equipos, aunque conserva la subestimación del valor.
Estos resultados concuerdan con lo reportado por Petritz et al(7), en donde detectaron una subestimación de la medición de glucosa en sangre por 2 equipos diseñados para uso humanos, mientras que el equipo diseñado para gatos fue el que mostro la mayor concordancia con respecto a los resultados de laboratorio de gabinete. En este estudio plantean una serie de variables que pudieron afectar la medición de glucosa en sangre, como es el porcentaje del hematocrito, el orden en que se realizaron las pruebas en los equipos portátiles y sugieren aumentar el número de muestra para tener mayor peso estadístico. En cuanto al procesamiento de las muestras, el protocolo que estos autores siguieron es equiparable con el realizado en este estudio, solo con la diferencia de que la sangre se conservó con heparina de litio.
Entre el estudio de Petritz et al(7) y éste solo hay coincidencia en uno de los equipos utilizado, el OneTouch® Ultra 2®, de LifeScan Inc, el cual se comportó de una manera similar, ya que demostró en ambos que la concordancia con respecto a la medición de laboratorio es pobre.
Otro estudio publicado por Summa et al(12), evaluó el equipo Contour® Bayer®, donde se puede observar que este equipo subestima la medición de glucosa en sangre. De igual manera en este caso también se le adjudica mucho peso al tamaño de muestra pequeño (n=20). En este estudio la muestra también se conservó con heparina de litio. Cabe mencionar que en los dos estudios la medición en laboratorio se llevó con la misma técnica que en el estudio actual(12).
Estos resultados se suman a la evidencia en hurones pero difieren con la evidencia generada en otras especies, sobretodo en perros y gatos en los cuales se les ha asignado un alto grado de confianza a los equipos portátiles(2,3,13). Sin embargo, también se han publicado otros estudios(1,5,6), en donde los resultados en perros y gatos usando equipos portátiles digitales para la medición de glucosa en sangre diseñados para humano , generando poco grado de confiabilidad en el uso de estos equipos portátiles. Lo anterior se pudiera explicar en gran medida por los diferentes modelos de medición portátiles que se utilizan. Sin embargo, parece ser evidente que ninguno genera información contundente y confiable cuando se utiliza en alguna otra especie diferente para lo cual fue calibrado.
En cuanto a su evaluación en mascotas no convencionales, incluyen estudios realizados en conejos, en donde se consideró confiable el uso de equipos portátiles diseñados para humanos, mientras que a los equipos diseñados para perros y gatos no se les recomienda para su uso en mediciones de glucosa en sangre de conejos ya que sus intervalos de confianza son mayores(14). Existe también un reporte en Amazonas ventralis donde definitivamente no recomiendan los métodos portátiles de medición de glucosa en sangre en este tipo de aves, ya que en su mayoría subestimo la medición de glucosa y en algunos casos tuvo una variación de hasta 140 mg/dL(15).
Comparando nuestros resultados con los obtenidos por Petritz et al(7) y Summa et al(12), y los demás referenciados en otras especies, puede observarse que se comportaron de manera muy similar, aunque los tres tuvieron un tamaño de muestra diferente. En dos estudios el tamaño de muestra fue pequeño y no es posible descartar que la subestimación de los valores de glucosa sanguínea, pudiera ser explicado por el tamaño de muestra; por lo que sugerimos repetir este diseño experimental con una número mayor de animales (>50) según lo indicado por Altman(11), para poder reducir los intervalos en los límites de confianza principalmente. Cabe mencionar que los autores consideramos que aumentando el tamaño de muestra se podría evidenciar con mayor contundencia los resultados, como ha sido sugerido por otros estudios anteriores(7,12). Aunque en perros y gatos es muy discutido(2,3,5,6,13) y en conejos parece haber una mayor confiabilidad con respecto a su uso(14). En hurones los resultados limitan la confiabilidad sobre el uso de equipos portátiles.
Con la información que se obtuvo en este estudio no es posible concluir de manera definitiva que alguno de los 3 equipos portátiles puede otorgar mayor confianza para la medición de glucosa en hurones en el consultorio, ya que todos tuvieron una amplia variabilidad en la lectura de este analito. Esto es muy importante para la interpretación y aplicación clínica de estos resultados, ya que en algunos equipos el valor obtenido llega a variar hasta 40 mg/dL con respecto al método de laboratorio de gabinete.
Aunque el tamaño de muestra de este trabajo fue reducido y no se realizaron repeticiones de las mediciones para ver la variabilidad de cada equipo; los resultados sugieren que existe una variación importante entre los valores de glicemia obtenidos al utilizar estos tres equipos digitales portátiles al compararlos con los obtenidos en el laboratorio. Los autores sugieren a los clínicos interpretar con cautela los resultados de las pruebas rápidas para la medición de glicemia en hurones y, en la medida de lo posible, corroborar los resultados con los análisis de laboratorio de gabinete. Hasta que se lleven a cabo estudios con un mayor tamaño de muestra y en donde se repitan las mediciones con cada equipo en cada hurón por lo menos dos veces para descartar que la falta de concordancia con el laboratorio de gabinete se deba a que los equipos presentan en sí mismos gran variabilidad en sus mediciones.
Reconocimiento
Gracias al Hospital Veterinario de Especialidades en Etología Clínica y Fauna Silvestre FMVZ-UNAM, y al personal que participo en el momento del estudio.
Conflicto de interés
Sin conflicto de interés.
Referencias
1. Cohn LA, Mccaw DL, Tate DJ, Johnson JC. Assessment of five portable blood glucose meters, a point-of-care analyzer, and color test strips for measuring blood glucose concentration in dogs. J Am Vet Med Assoc 2000; 216: 198-202.
2. Wess G, Reusch C. Assessment of five portable blood glucose meters for use in cats. Am J Vet Res 2000; 61: 1587-1592.
3. Wess G, Reusch C. Evaluation of five portable blood glucose meters for use in dogs. Am J Vet Res 2000; 216: 203-209.
4. Domori A, Sunahara A, Tateno M, Miyama TS, Setoguchi A, Endo Y. The clinical utility of two human portable blood glucose meters in canine and feline practice. Vet Clin Pathol 2014; 43: 55-62.
5. Cohen TA, Nelson RW, Kass PH, Christopher MM, Feldman EC. Evaluation of six portable blood glucose meters for measuring blood glucose concentration in dogs. J Am Vet Med Assoc 2009; 235: 1-5.
6. Brito-Casillas Y, Figueirinhas P, Wiebe JC, López-Ríos L, Pérez-Barreto D, Melián C et al. ISO-Based Assessment of Accuracy and Precision of Glucose Meters in Dogs. J Vet Intern Med 2014; 28: 1405-13.
7. Petritz OA, Antinoff N, Chen S, Kass PH, Paul-murphy JR. Evaluation of portable blood glucose meters for measurement of blood glucose concentration in ferrets. J Am Vet Med Assoc 2013; 242: 350-354.
8. Lewington JH. Ferret handling, hospitalization and diagnostic techniques. En: Lewington JH, editor. Ferret Husbandry, Medicine and Surgery 2da ed, Philadelphia: ElServier Saunders; 2007, p. 151-165.
9. Siperstein LJ. Ferret hematology and related disorders. Vet Clin North Am Exot Anim Pract 2008; 11: 535-50, vii.
10. Bland JM, Altman DG. Statistical methods for assessing agreement between two methods of clinical measurement. Int J Nurs Stud 2010; 47: 931-936.
11. Altman DG. Practical Statistics for Medical Research. 1st ed. London: Chapman and Hall/ CRC; 1990.
12. Summa NM, Eshar D, Lee-chow B, Larrat S, Brown DC. Comparison of a human portable glucometer and an automated chemistry analyzer for measurement of blood glucose concentration in pet ferrets. Can Vet J 2014; 55: 865-869.
13. Johnson BM, Fry MM, Flatland B, Kirk CA. Comparison of a human portable blood glucose meter, veterinary portable blood glucose meter, and automated chemistry analyzer for measurement of blood glucose concentrations in dogs. JAVMA 2009; 235: 1309-1313.
14. Selleri P, Girolamo N Di, Novari G. Performance of two portable meters and a benchtop analyzer for blood glucose concentration measurement in rabbits. JAVMA 2014; 245: 87-97.
15. Acierno MJ, Mitchell MA, Schuster PJ, Freeman D, Guzman DS, Jr TNT. Evaluation of the agreement among three handheld blood glucose meters and a laboratory blood analyzer for measurement of blood glucose concentration in Hispaniolan Amazon parrots (Amazona ventralis). AJVR 2009; 70.
