EDITORIAL
“Ante la duda, usad Haloperidol”. ¿O no?
"When in doubt, use Haloperidol." Or not?
Ignacio Jáuregui-Lobera1, Jesus M. Culebras2
1 Ignacio Jáuregui-Lobera Instituto de Ciencias de la Conducta y Universidad Pablo de Olavide de Sevilla. España
2 De la Real Academia de Medicina de Valladolid y del IBIOMED, Universidad de León Académico Asociado al Instituto de España AcProfesor Titular de Cirugía Director, Journal of Negative & No Positive Results Director Emérito de NUTRICION HOSPITALARIA. España
* Autor para correspondencia.
![]()
This work is licensed
under a Creative
Commons
Attribution-NonCommercial-ShareAlike 4.0 International License
La revista no cobra tasas por el envío de trabajos,
Introducción
Ya han pasado más de 10 años desde el fallecimiento de Paul Janssen (1926-2003), director del laboratorio en el que se sintetizó el Haloperidol. El interés de Janssen por la psicofarmacología fue paradójico ya que tenía un mal concepto de los psiquiatras al haber oído decir a su padre que eran “raros” y porque su experiencia personal no fue mejor, ya que alguno con el que topó en la Universidad estaba, según el propio Janssen, “bastante loco” y sólo fue a una de sus clases. En su laboratorio se sintetizaron cientos de productos y una clave para el uso clínico del Haloperidol estuvo en las ratas y en los ciclistas. Los ciclistas de la época se dopaban con anfetamina y algunos desarrollaban síntomas paranoides. Janssen y su equipo provocaron en ratas intoxicaciones anfetamínicas que eran revertidas con Haloperidol. Quedaba la clínica humana. Suministraron viales de 10 mg de Haloperidol a un hospital de Lieja. Aquellos viales se llenaron de polvo hasta que un día llegó un paciente psicótico, le inyectaron y mejoró. El jefe de psiquiatría (Dr. Bobon) entusiasmado, ensayó el Haloperidol en todo tipo de pacientes con cuadros de agitación, obteniendo siempre resultados excelentes, que se publicaron a finales de 1959. “Ante la duda, usad Haloperidol” parece que fue la frase que calaría en todos los residentes de psiquiatría del mundo(1,2).
En el último trimestre de 2018, la prestigiosa revista The NEW ENGLAND JOURNAL of MEDICINE publicaba un artículo con el sugerente título de Haloperidol and Ziprasidone for Treatment of Delirium in Critical Illness. Los autores eran T.D. Girard y cols., todos ellos miembros de afamadas facultades de medicina y centros clínicos de Estados Unidos. En el estudio, aleatorizado, doble ciego, controlado con placebo, participaron pacientes con fallo respiratorio agudo o shock y delirium (hipoactivo o hiperactivo), que recibieron bolos intravenosos de Haloperidol (hasta 20 mg/día), Ziprasidona (hasta 40 mg/día) o placebo. El volumen y dosis de droga o placebo fueron reducidos a la mitad o duplicados a intervalos de 12 horas en función de la presencia o ausencia de delirium, detectado mediante el Confusion Assessment Method para UCI, y de los efectos adversos. Se consideró el número de días sin delirium o coma durante le periodo de intervención de dos semanas. Se valoró la supervivencia a 30 y 90 días, tiempo necesario para quedar libres de ventilación mecánica y tiempo de estancia en UCI y alta hospitalaria. Otros análisis fueron la presencia de sintomatología extrapiramidal y la excesiva sedación. Lo relevante del artículo son las conclusiones a las que llegan los autores, resaltando que el uso de Haloperidol o Ziprasidona, comparado con el uso de placebo, en pacientes con fallo respiratorio agudo o shock, así como delirium hipoactivo o hiperactivo, en la UCI no hizo variar significativamente la duración del delirium(3).
Un hallazgo como ese merece algunas reflexiones, teniendo en cuenta que el Haloperidol ha sido el fármaco más utilizado, con diferencia, en situaciones de delirium, especialmente para control de la agitación en diversos contextos hospitalarios. Años de uso “eficaz” parecen quedar ahora en entredicho. Es cierto que, como suele decirse, los que no son cuentas son cuentos. Tal vez la eficacia del Haloperidol en el delirium era cosa de cuentos y ahora las cuentas dicen algo distinto. ¿O no? La metodología es muy importante y, como señala Bleck en un Editorial de la misma publicación, la mayoría de los pacientes del estudio de Girrad et al. presentaban delirium hipoactivo. ¿Puede no ser efectivo en esos casos?, ¿Hay menos autolesiones en pacientes con delirium hiperactivo tras administrar Haloperidol? Estas y otras cuestiones deben debatirse antes de “desechar”, por ineficaz, el uso del Haloperidol. Aunque puede que ya no debamos tenerlo en un pedestal de la psicofarmacología del delirium.
Haloperidol y delirium
Siendo la Clorpromazina el primer antipsicótico introducido en la terapéutica de las psicosis, fue, sin duda, el Haloperidol el que marcó una época hasta la llegada de la Clozapina, primer antipsicótico de los denominados atípicos. Llamados antipsicóticos, neurolépticos o tranquilizantes mayores, desde su aparición no han dejado de utilizarse(4).
La clave de su acción está en su antagonismo sobre determinados receptores de neurotransmisores. Inicialmente, en 1974-1975, Seeman, utilizando preparaciones de estriado cerebral de ratas, descubrió que el Haloperidol bloqueaba selectivamente los receptores dopaminérgicos D2. Durante años se sostuvo que la relación entre el antagonismo D2/5-HT2A era muy favorable a los receptores D2, algo que posteriormente se vio que no era tan evidente. Tomando como estándar el Haloperidol, es cierto el mayor predominio del antagonismo D2, con menor acción sobre otros receptores dopaminérgicos y serotonérgicos, así como sobre receptores M1, alfa 1 y H1(5).
Aparte de en la esquizofrenia y otras psicosis, el Haloperidol ha sido habitualmente utilizado en el tratamiento del delirium hiperactivo en contextos como las Unidades de Cuidados Intensivos (UCI),aunque en menor medida también se ha usado en los casos de delirium hipoactivo(5).
Ciertamente, ante una situación urgente como la que representa el delirium, la selección de un tratamiento apropiado que ataje las alteraciones perceptivas, cognitivas y conductuales es crucial. La lista de enfermedades, fármacos y condiciones médicas que pueden causar delirium es muy amplia y hay controversia acerca de cómo el cerebro llega a verse atrapado en el estado que representa el delirium, existiendo implicación tanto cortical como subcortical. Con mayor o menor evidencia, en el delirium se ve implicada una disminuida actividad de la acetilcolina, hiperactividad del sistema dopaminérgico y probablemente la serotonina y el ácido gamma-amino-butírico (GABA) tanto por aumento como por déficit de actividad. Y más aún, una excesiva actividad del glutamato y un descenso de la actividad de la histamina podrían ser factores etiológicos intervinientes(6).
En concreto, el exceso de dopamina origina alteraciones neuroconductuales observadas en pacientes con delirium hiperactivo como son la agitación, inquietud, irritabilidad, aumento de actividad psicomotora distraibilidad, hiperalerta o síntomas psicóticos. Ello explica que drogas agonistas dopaminérgicas puedan precipitar el delirium (Levo-dopa por ejemplo), mientras que las antagonistas (como el Haloperidol y otros antipsicóticos) puedan controlar algunos de dichos síntomas(5).
El fármaco “apropiado” para el delirium, teniendo en cuenta las consideraciones previas, ha sido clásicamente el Haloperidol. Este antipsicótico típico ha sido el más usado y mejor estudiado dados sus escasos efectos anticolinérgicos, escasez de metabolitos activos y baja probabilidad de causar excesiva sedación. Una pauta habitual ha sido administrar, por ejemplo, desde 0,25-0,5 mg cada 4 horas, en pacientes mayores y/o polimedicados, hasta 2-3 mg al día en pacientes menos comprometidos. En casos de gran agitación, la administración endovenosa de 5-10 mg a la hora ha sido una pauta frecuente. En todo caso, siempre se ha tenido en cuenta que el uso, en general, de antipsicóticos en el delirium puede asociarse a un aumento de mortalidad en pacientes mayores con gran deterioro cognitivo-demencia, algo bastante frecuente por lo demás. En algún estudio se ha comprobado un riesgo de mortalidad aumentado 2,4 veces con el uso de antipsicóticos típicos (como el Haloperidol) y 1,9 veces con el uso de antipsicóticos atípicos, con respecto a placebo. La primera vez que se utilizó el Haloperidol por vía endovenosa en la UCI fue en los años 80, justo tras publicarse la definición de delirium en la DSM-III. Desde entonces ha sido el fármaco más utilizado para el control del delirium en la UCI(4,5).
Siendo el Haloperidol el fármaco más usado tradicionalmente, sin embargo, algunos estudios apuntan a que su utilización no acorta la duración del delirium más que un simple placebo. En concreto, el trabajo recientemente publicado por Girard et al. (3) hace referencia a que el uso de hasta 20 mg de Haloperidol al día o el uso de placebo alcanzaron similares resultados en cuanto a la duración del delirium. Se trataba de una muestra de 566 pacientes (89% con delirium hipoactivo, 11% con delirium hiperactivo).
Así las cosas, parece quedar en entredicho el gold standard que ha venido representando el Haloperidol(6). No resultó mejor que el placebo y no redujo el uso de otros fármacos opioides o sedantes. En el estudio citado el delirium fue evaluado mediante el ConfusionAssesmentMethod for the ICU, según los autores, una herramienta que identifica el delirium en función de un “cambio agudo o un curso fluctuante del estado mental, además de inatención y nivel de conciencia alterado o pensamiento desorganizado”.
El delirium es un constructo adoptado para abordar el caos existente antes de la aparición de la DSM-III (1980). El caos pasaba por hacer referencia a “estado confusional agudo”, “encefalopatía”, “fallo cerebral agudo”, “psicosis de UCI” e incluso “desconcierto agudo”. Todos esos términos eran usados con poca base científica y hacían más referencia a lo que les ocurría a algunos pacientes en determinados contextos. Finalmente se unificó la idea bajo el término delirium. Desde 2013 está en vigor la DSM-5, edición que marca sustanciales diferencias con respecto a las anteriores DSM. En éstas, las alteraciones del contenido (atención) y/o nivel (arousal) de conciencia eran nucleares para el diagnóstico. Clínicamente el delirium se podía manifestar como estado hipoactivo o hiperactivo y fluctuar entre ambos (la DSM-III usaba, por ejemplo,el término “clouding of consciousness”). Las ediciones DSM-III-R y DSM-IV mantenían el término “consciousness” operativizando el término como “déficit atencional”. Este cambio hacia lo atencional fue causado por el hecho de que “consciousness” era difícil de evaluar objetivamente. Además, debía considerarse que para “consciousness” atención y arousal había un vínculo jerárquico: puede existir pleno arousal y profunda inatención (por ejemplo, en un estado de hipervigilancia) pero no a la inversa. Con la DSM-5 el término “consciousness” queda en desuso. Ahora el término delirium es más restrictivo y se define en términos de hechos cognitivos, el término nivel de arousal desparece. De hecho, se insiste en que la inatención o los cambios en cognición no deben ocurrir en el contexto de una severa reducción del nivel de arousal como, por ejemplo, el caso del coma. En cuanto a la asociación delirium-agitación proveniente del delirium tremens, ya fue omitida desde la DSM-IV(7).
El estado de apatía o hipoactividad es frecuente en las UCI y viene a resultar en reverso del concepto clásico de delirium (hiperactivo). El solapamiento entre delirium hipoactivo y estados de bajo nivel de arousal resulta, entre otras cosas, en la existencia de numerosos pacientes en que no es posible la evaluación de sus estado cognitivo con pruebas habituales, como puede verse en la Figura 1 tomada de la European Delirium Association y American Delirium Association (2014)(7).
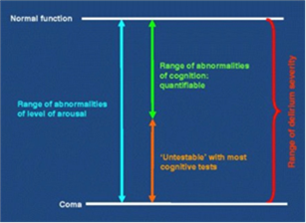
Figura 1. Delirium hipoactivo y reducción de arousal
Como se ha señalado, la mayoría de pacientes del estudio de Girard et al., presentaban delirium hipoactivo. Tal vez la clave de la falta de “eficacia” visible en estos pacientes se deba al tipo de delirium. En casos hiperactivos, agitación, violentos, ¿habría mejorado, al menos, la contención? Tal vez el concepto de delirium sigue sin estar bien delimitado, lo que con el estudio de Girard et al., debería considerarse si el Haloperidol sigue siendo un gold standard en estos casos(6).
En todo caso, la controversia continúa. También recientemente, en una revisión sistemática y meta-análisis, Ying-ziShen et al. (2018) concluyen que el uso profiláctico de Haloperidol a dosisde ≥5 mg/día puede reducir el delirium en pacientes quirúrgicos. Un resumen de los datos encontrados por los citados autores puede verse en la Figura 2(8).
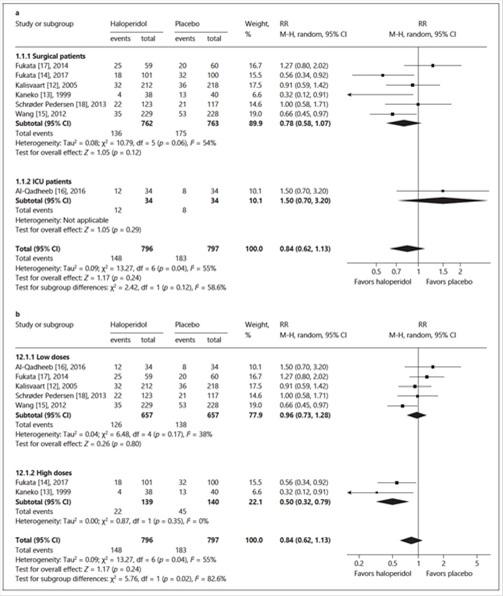
Figura 2. Meta-análisis Haloperidol vs placebo para la incidencia de delirium.
[Pacientesquirúrgicos vs UCI (a) y bajas vs altas dosis (b)]
Incluso más concluyente parece Nicola Latronico (2018) cuando nos recuerda que “Haloperidolisindicated in hyperactive (agitated) delirium, not in hypoactive delirium. Hallucinations and delusions can be an indication to use Haloperidol even in hypoactive delirium, but they are exceedingly difficult to assess in the ICU patient. Moreover, Haloperidol should be administered until agitation is controlled and no longer thereafter”(5).
Desde febrero de 1958, añode la síntesis del Haloperidol, este antipsicótico llegó a estar incluido en la lista de “medicamentos esenciales” de la OMS(4). El reciente estudio de Girard et al. pone de manifiesto que tal vez haya que repensar el uso del Haloperidol(3).
Pero es cierto que la mayoría de pacientes de dicho estudio presentaban delirium hipoactivo y el fármaco ha estado indicado, fundamentalmente, en el delirium hiperactivo, siendo la agitación el objetivo fundamental a atajar.
Además de lo sostenido por Latronico(5), en un reciente editorial de Bleck(9), el autor señala que en el citado trabajo de Girard et al.(3) cabría investigar a fondo si el uso de Haloperidol podría reducir, por ejemplo, el riesgo de autolesiones en pacientes con delirium hiperactivo. Concluye el autor, no obstante, que tal vez a partir de ahora no quepa expresar tanta rotundidad a la hora de defender la eficacia del Haloperidol (y otros antipsicóticos) en estas situaciones.
En todo caso, da la impresión de que, a pesar de los resultados no positivos del trabajo de Girard et al.(3), seguiremos usando Haloperidol, tal vez con mejor criterio y todavía durante un tiempo (¿mucho tiempo?).

Figura 3. Paul Janssen (izquierda) y Prof. Dr. Bobon (derecha)
Referencias
1. Oransky I. Paul Janssen (Obituary). The Lancet 2004;363:251.
2. Medrano J. Boticarium. Rev Asoc EspNeuropsiq2014;34:175-194.
3. Girard TD, Exline MC, Carson SS, Hough CL, Rock P, Gong MN, et al. Haloperidol and Ziprasidone for treatmentof delirium in critical illness. NEnglJMed 2018;379;2506-16.
4. López-Muñoz F, Alamo C. The consolidation of neuroleptic therapy: Janssen, the discovery of haloperidol and its introduction into clinical practice. Brain Res Bull 2009; 79:130-41.
5. Latronico N. Haloperidol and delirium in the ICU: thefinger pointing to the moon. Intensive Care Med 2018;44:1346-48.
6. Markowitz JD, NarasimhanM. Delirium and antipsychotics:A systematic review of epidemiology and somatic treatment options. Psychiatry (Edgemont) 2008;5:29-36.
7. European Delirium Association y American Delirium Society. The DSM-5 criteria, level of arousal and delirium diagnosis: inclusiveness is safer. BMC Medicine 2014;12:141.
8. Shen Y. • Peng K. • Zhang J. • Meng X. • Ji F. Effects of Haloperidol on Delirium in Adult Patients: A Systematic Review and Meta-Analysis. Med Princ Pract 2018;27:250-259 https://doi.org/10.1159/000488243
9. Bleck TP. Dopamine antagonists in ICU delirium. NEnglJMed 2018;379;2569-70.
