ORIGINAL
Estudio expermimental del lidocaína intravenosa en Trachemys scripta
Prospective study of intravenous lidocaine in Trachemys scripta
Elia Esquivel Fernández
Departamento de Farmacología y Toxicología de la Facultad de Veterinaria de la Universidad Complutense de Madrid, España
Centro Veterinario "Los Sauces" de Madrid. España
* Autor para correspondencia.
![]()
This work is licensed
under a Creative
Commons
Attribution-NonCommercial-ShareAlike 4.0 International License
La revista no cobra tasas por el envío de trabajos,
Resumen
Introducción. La lidocaína administrada por vía intravenosa a una dosis de 2 mg/kg ha demostrado tener efecto analgésico en seres humanos y mamíferos sin causar efectos adversos. En reptiles no existen estudios publicados en Trachemys scripta, siendo una de las especies de reptiles más habituales en clínicas veterinarias de animales exóticos. Por ello se propone estudiar el efecto analgésico de la lidocaína, que podría resultar beneficioso para proporcionar analgesia reduciendo la dosis de opioides como la morfina.
Objetivo. Estudiar el efecto analgésico de un bolo de lidocaína intravenosa a 2 mg/kg en Trachemys scripta.
Configuración y Diseño. Se trata de un estudio prospectivo doble ciego con una muestra de siete tortugas (n=7), divididas en dos grupos, uno compuesto por tres machos y una hembra (n=4) y otro compuesto por tres hembras (n=3). Se ha usado un diseño cruzado 2x2 con un periodo de lavado de 14 días entre administración de lidocaína o suero salino fisiológico NaCl 0,9% (SS), considerando Grupo Control al que se le administraba el SS, y Grupo Lidocaína, al que se le administraba el fármaco.
Materiales y Métodos. Para evaluar el efecto analgésico, se ha medido la respuesta al dolor en nalgas y extremidades, provocado por un objeto de punción automática. Además, se han obtenido muestras de sangre para estudiar posibles efectos colaterales en parámetros sanguíneos. El nivel de consciencia se puntuaba monitorizando el reflejo palpebral y retracción de cuello y extremidades, por último, la frecuencia cardiaca se contaba empleando un doppler, y la respiratoria mirando el número de veces que se contraía el músculo serrato en la fosa cervical, teniendo en cuenta las apneas y/o posibles arritmias.
Análisis estadístico utilizado. Para la frecuencia cardiaca, respiratoria, temperatura corporal en fosa inguinal y cervical, temperatura media y parámetros sanguíneos, al seguir una distribución no normal se ha empleado el test estadístico de Wilcoxon. Para la incidencia de apneas, arritmias, respuesta al dolor en nalgas, respuesta al dolor en extremidades y nivel de consciencia, se ha empleado el test estadístico Chi cuadrado. En la incidencia de apneas y arritmias, también se ha aplicado el test estadístico de McNemar y en respuesta al dolor en nalgas y extremidades el test estadístico de Cochran-Arritage. En todos los casos, el intervalo de confianza era del 95%, considerando valores significativos aquellos en los que p<0,05.
Resultados. La respuesta al dolor en extremidades y la conciencia disminuyen significativamente en el Grupo Lidocaina. Las constantes vitales no varían entre grupos. Tanto en el Grupo Lidocaina como en el Grupo Control, hay diferencias entre la muestra de sangre extraída antes y después de inyectar la sustancia, posiblemente por la técnica de obtención de datos del estudio.
Conclusiones. La lidocaína tiene efecto analgésico y tranquilizante, sin alterar constantes vitales o parámetros sanguíneos. Sin embargo, en nalgas no se ha obtenido este resultado, posiblemente por un fallo en la detección del dolor o por una menor sensibilidad de la zona.
Palabras clave
Lidocaína; analgesia; Trachemys scripta; dolor
Abstract
Introduction, The intravenous administration of a 2 mg/kg bolus of lidocaine has been shown to have analgesic effects without adverse effects in humans and mammals. In reptiles, there are no published studies on Trachemys scripta, which is one of the most common reptile species in exotic veterinary clinics. Thus, this study proposes to investigate lidocaine’s analgesic effect, which could be beneficial for good analgesia, decreasing the use of doses of opioids such as morphine.
Objective. To study the analgesic effect of a 2 mg/kg intravenous bolus of lidocaine in Trachemys scripta.
Settings and Design. This is a prospective double-blind study with a sample of seven turtles (n=7) divided in two groups: one group with three males and one female (n=4) and another group with three females (n=3). This is a crossover 2x2 design with a wash-out period of 14 days between lidocaine and normal saline NaCl 0.9% administration, where the turtles that received normal saline were the Control Group and the turtles that received the drug were the Lidocaine Group.
Methods and Material. In order to test the analgesic effects, the pain response in buttocks and limbs was measured after causing pain with an automatic puncturing device. Furthermore, blood samples were taken to study possible side effects in blood parameters. Consciousness level was graded by monitoring the palpebral reflex and neck and limb retraction. Finally, the heart rate was measured using a doppler device and the respiratory rate by counting the number of serrato muscle contractions in the cervical pit, considering apneas and/or possible arrhythmias.
Statistical Analysis Used. Since heart rate, respiratory rate, body temperature at the inguinal and cervical pit, average temperature and blood parameters do not follow a normal distribution, the Wilcoxon test was used. A Chi-square test was used for apnea and arrhythmia incidence, consciousness level and pain response in buttocks and limbs. The McNemar test was also used for apnea and arrhythmia incidence and the Cochran-Arritage test was also used for pain response in limbs and buttocks. In all cases, the confidence interval was 95%, with values being considered statically significant when p<0.05.
Results. Both pain response in limbs and consciousness level were significantly decreased in the Lidocaine Group. Vital signs didn’t change between groups. Both groups, the Lidocaine Group and the Control Group, show changes between the blood samples taken before and after injecting the substance, possibly due to the data collection technique used in this study.
Conclusions. Lidocaine has analgesic and soothing effects without affecting vital signs or blood parameters. However, this was not the result for the buttocks, possibly due to failure detecting pain, the technique used to cause pain or lower sensitivity in the buttocks.
Keywords
lidocaine; analgesia; Trachemys scripta; pain
Dentro de la medicina veterinaria, los reptiles son una clase de animales con numerosas especies, que acuden a consultas clínicas y se tratan en otros ámbitos como en zoológicos o centros de recuperación. Una parte fundamental en la medicina es la analgesia y para ello se debe comprender como son los mecanismos nociceptivos y diferenciarlo del dolor. Cada vez más, aparecen estudios de distintas familias de fármacos analgésicos en distintas especies de reptiles, por ello, es necesario conocer su mecanismo de acción, su farmacodinamia y las particularidades farmacocinéticas.
Un fármaco que ha demostrado tener efectos analgésicos en medicina humana y animales de compañía es la lidocaína, comúnmente empleada para realizar bloqueos anestésicos de corta duración y analgesia intralesional en cirugías. En medicina humana, también se están planteando otras vías de administración, como la intravenosa. No conocemos estudios farmacodinámicos de lidocaína en reptiles, por lo que en este estudio se plantea su administración por vía intravenosa en una de las especies más habituales en las clínicas veterinarias de animales exóticos, la Trachemys scripta.
Introducción
Un aspecto muy importante de un tratamiento es el abordaje del dolor, el cual se tiene que diferenciar de la nocicepción. El dolor es una sensación inherente subjetiva, es una experiencia sensorial y emocional desagradable asociada con daño tisular real o potencial o descrito en términos de tal daño, mientras que la nocicepción son los mecanismos fisiológicos que se desencadenan de un estímulo nocivo(1). Los reptiles tienen tanto los mecanismos fisiológicos como las estructuras neuroanatómicas necesarias para poder percibir y procesar un estimulo doloroso(1).
Por lo tanto, el dolor se tiene que abordar mediante tratamientos analgésicos, ya que ha demostrado tener efectos negativos sobre el organismo tales como inmunosupresión, cambios de comportamiento o retrasos en las recuperaciones post-quirúrgicas(1,2). Para evaluar el efecto analgésico de los medicamentos, las técnicas de detección del dolor se han ido modificando con el tiempo, anteriormente se inyectaban sustancias químicas como la capsaicina o la formalina, las cuales se han dejado de emplear por ser métodos invasivos que causan lesiones graves en el animal(3) además, una vez inyectados no se pueden extraer del animal aunque el analgésico no funcione. Actualmente han sido sustituidas por la aplicación de una placa térmica automática que cuenta los segundos que tarda el animal en retirar la extremidad(4,5,6,7,8,9,10,11,12).
Las familias de fármacos analgésicos estudiadas hasta el momento son los antiinflamatorios no esteroideos (AINEs)(2,13,14), opioides(5,6,7,8,9,10,11,12) y α-2 agonistas(15), sin embargo, en cuanto a la familia de los anestésicos locales todavía se desconoce su efecto como analgésico en reptiles(2,16). Los anestésicos locales son fármacos ampliamente utilizados en medicina veterinaria(17) porque son capaces de proporcionar una buena analgesia y anestesia local en un amplio rango de especies(2,18,19,20,21,22). Esta versatilidad se debe a su mecanismo de acción(25,26,27). Se trata de amidas que bloquean los canales de sodio dependientes de voltaje, por ello, tienen muchas propiedades farmacológicas(20,21,22,23).
La Lidocaína es uno de los anestésicos locales más empleados(17). Tiene propiedades anestésicas y antiinflamatorias, además, es beneficiosa en infusiones intravenosas para el post-quirúrgico en humana y en caballos(20,22). A parte, previene el dolor neuropático crónico post-quirúrgico por sus propiedades anti hiperalgésicas(19). Disminuye el periodo de duración del íleo paralítico post-quirúrgico y acorta el periodo de hospitalización(20). En perros, se ha descrito un efecto sedante administrando dosis superiores a las consideradas terapéuticas, desencadenando efectos adversos como náuseas o vómitos(22). En medicina humana también se han descrito efectos adversos. Tanto en animales de compañía, como en personas también se han descrito focos ectópicos ventriculares, que producen disritmias y pueden desencadenar fibrilación ventricular(17,20,22), aun así, los estudios indican que los casos de toxicidad reportados son poco frecuentes y que solamente se dan cuando las concentraciones plasmáticas son muy superiores a las consideradas terapéuticas(19,22), por lo que aconsejan proporcionar una correcta dosificación y frecuencia de perfusión(19).
En perros se han testado bolos de lidocaína a 2 mg/kg sin ver efectos adversos(24). La dosis empleada en este supuesto experimental ha sido de 2 mg/kg, precisamente, por no haber mostrado signos de posible toxicidad en otras especies(23,24). En tortugas, los analgésicos más empleados son los opioides, concretamente la morfina, la cual produce una marcada depresión respiratoria y prolonga el tiempo de recuperación anestésico(6,25). El empleo de lidocaína intravenosa a 2 mg/kg en protocolos anestésicos o de analgesia multimodal, posiblemente ayude a reducir las dosis de opioides y tenga otros beneficios que todavía son poco conocidos en la medicina veterinaria, por ello, se ha decidido evaluar su posible efecto como analgésico en Trachemys scripta en este supuesto experimental.
Objetivos
Analizar la respuesta al dolor mediante la técnica de punción automática en extremidades posteriores y nalgas. Evaluar los cambios de la frecuencia cardiaca y respiratoria tras la administración de un bolo de 2 mg/kg de lidocaína endovenosa. Analizar los cambios en los parámetros bioquímicos, hemograma y gasometría de las tortugas, tras la administración de un bolo de 2 mg/kg de lidocaína endovenosa.
Materiales y Métodos
El estudio se ha desarrollado en el Centro Veterinario "Los Sauces", especializado en animales exóticos, el cual, ha durado un total de cuatro semanas.
Los materiales empleados han sido: jeringas desechables, agujas 25G, gasas, lanceta de insulina (One Touch Ultrasoft®), lidocaína (Lidocaine®), suero fisiológico NaCl 0,9% (Braunn®), heparina (Calciparine®), esparadrapo de papel, guantes de látex, doppler (Vet BP Doppler®), termómetro infrarrojo (Exo Terra®), instrumento portátil de diagnóstico clínico (i-Stat®), cartuchos del instrumento portátil (CG8+®), software estadístico (MedCalc 18.6®).
Se ha realizado un estudio prospectivo doble ciego con un grupo de 7 tortugas de especie Trachemys scripta, Se han dividido en dos grupos al azar, uno compuesto por tres machos y una hembra (n=4) y el segundo compuesto por tres hembras (n=3). Para la realización del estudio, tras haber informado del procedimiento y objeto del estudio a la propietaria de las tortugas, se ha contado con el consentimiento. Cinco de las tortugas estaban alojadas en un acuario, las dos restantes estaban en compartimentos individuales, todos los individuos estaban expuestos a una temperatura de 25 ºC. Previamente al estudio, se cogían las tortugas correspondientes al grupo, se pesaban y se apuntaban los pesos en kg.
Se ha realizado un diseño cruzado 2x2, con un periodo de supresión de 14 días. De forma que todos los animales recibían lidocaína y suero fisiológico salino NaCl 0,9% (SS) como control. Antes de empezar cada prueba, se cargaba en una jeringa desechable de 1 ml, la cantidad correspondiente a cada tortuga en función de su peso, a una dosis de 2 mg/kg de lidocaína, o el mismo volumen de SS. Tras cargar estas jeringas, otros dos operantes se encargaban de tomar unos datos basales de las constantes vitales, cuyo orden era: 1º frecuencia cardiaca, 2º frecuencia respiratoria, 3º temperatura en la fosa cervical e inguinal, 4º respuesta al dolor, 5º nivel de consciencia. De esta forma, cada tortuga servía de referencia de sí misma, evitando las posibles variaciones interindividuales.
Una vez establecidos los valores basales, se realizaba una extracción de sangre de la vena yugular derecha de cada animal. Las agujas se heparinizaban manualmente para evitar la coagulación de la muestra. Los datos se obtenían con los cartuchos CG8+. Para la gasometría, se analizaba la presión parcial de oxígeno y saturación de oxígeno; para el hemograma y los parámetros bioquímicos, se analizaban los siguientes analitos: hematocrito, hemoglobina, calcio iónico, glucosa, sodio y potasio. Finalmente, para los valores de ácido base se obtenían: el potencial de hidrógeno, presión parcial de dióxido de carbono, bicarbonato, dióxido de carbono total, exceso de base. Con objeto de llevar a cabo una evaluación ciega, las personas que evaluaban la respuesta de las tortugas, eran diferentes a las que cargaban la sustancia al azar en las jeringas.
Tras la obtención de sangre, se inyectaba la dosis de lidocaína o SS, según correspondiera, en la vena yugular izquierda. A partir de este momento comenzaba el tiempo del estudio. Se contaban 90 minutos desde la inyección del fármaco o suero y cada 10 minutos se tomaban las constantes vitales por el orden establecido. Una vez finalizado el estudio, se volvía a extraer una muestra de sangre de la vena yugular derecha para obtener los mismos parámetros hematológicos obtenidos en la muestra sanguínea previa a comenzar el estudio.
A continuación, se expone el criterio de obtención de datos, tanto de constantes vitales, como de nivel de consciencia, respuesta al dolor en nalgas y extremidades y temperatura.
Frecuencia Cardiaca (FC).- Medida con Doppler posicionado en la fosa cervical, en el lado izquierdo. Para la medida inicial se contaban los latidos en 15 segundos y se multiplicaban por cuatro para obtener un minuto. Una vez iniciado el estudio, para poder acompasar el tiempo entre las tortugas, se contaban los latidos en 10 segundos y se multiplicaban por seis. Durante la toma de frecuencia cardiaca también se consideraba si había presencia o ausencia de disritmias, puesto que al no emplear electrocardiograma, solamente se podían considerar las irregularidades en los latidos por minuto escuchadas con el Doppler. Se asignaban valores de 0, si no había disritmias, o 1, si había disritmias.
Frecuencia Respiratoria (FR).- Se obtenían las respiraciones por minuto, contando el número de veces que se contraía el músculo serrato en la fosa cervical de las tortugas, para la medida inicial se contaban las respiraciones en 15 segundos y se multiplicaban por cuatro para obtener un minuto. Una vez iniciado el estudio, para poder acompasar el tiempo entre las tortugas, se contaban los latidos en 10 segundos y se multiplicaban por seis. También se consideraban las apneas, se asignaba el valor 0, si no había apnea, y 1, si había apnea.
Temperatura.- Mediante infrarrojos, se medía la temperatura en la fosa cervical derecha, con el fin de evitar posibles interferencias del gel empleado para la medición de FC con el doppler en la fosa cervical izquierda, y en la fosa inguinal izquierda. Al comienzo del estudio, también se tomaba nota de la temperatura de la superficie de trabajo.
Respuesta al dolor en nalgas y extremidades.- Mediante una lanceta de fuerza regulable, a modo de dispositivo automático, se esperaba a que la tortuga apoyase la extremidad para disminuir, en lo posible, el error que puede causar el reflejo de retirada al contacto. Se iniciaba el estímulo, primero, en la extremidad posterior derecha, después en la nalga ipsilateral y se repetía el procedimiento de forma simétrica en el lado izquierdo. Las medidas de la respuesta al dolor se puntuaban del 0 al 2, evaluando por separado la respuesta de la extremidad y la respuesta de la nalga, siendo: 0 en caso de no haber ninguna respuesta, 1 en caso de observar retirada de la extremidad o contracción de la nalga y 2 respuesta de huida.
Nivel de consciencia.- Se evaluaba aplicando 3 niveles de puntuación, siendo: 0 inconsciente, 1 consciencia disminuida y 2 consciente o activo. Estos parámetros se puntuaban viendo si existía reflejo palpebral y/o si encogían extremidades y cuello ante la respuesta táctil de un bolígrafo en la nariz.
Análisis estadístico con MedCalc® 18.6.- Los datos a comparar se han incluido en dos grupos diferentes, comprendidos como Grupo Control, al que se le ha administrado SS, y Grupo Lidocaína, al que se le ha administrado lidocaína. Para comparar la FC, FR, temperatura corporal medida en la fosa cervical (Tc), temperatura corporal medida en la fosa inguinal (Ti) y temperatura media (Tm) entre ambos grupos, al tener una distribución no normal en la mayoría de los casos, se ha empleado el test estadístico de Wilcoxon (no paramétrico).
Para comparar la incidencia de apnea y arritmia entre los grupos Control y Lidocaína se han empleado el test estadístico de McNemar y Chi cuadrado. En el caso del test estadístico de Chi cuadrado, se han analizado estos datos empleando un grado de libertad.
Para comparar el estado de consciencia y la respuesta al dolor tanto en extremidades como en nalgas, entre ambos grupos, se ha empleado el test estadístico Chi cuadrado. Los datos han sido analizados con un grado de libertad en el nivel de consciencia, y dos grados de libertad en la respuesta al dolor en nalgas y en la respuesta al dolor en extremidades. En la respuesta al dolor de nalgas y extremidades, también se ha empleado el test de Cochran-Arritage donde los datos han sido analizados con un grado de libertad.
En cuanto a los parámetros sanguíneos, al tener una distribución no normal en la mayoría de los casos, se ha empleado el test estadístico de Wilcoxon (no paramétrico). Se han comparado las muestras de sangre tomadas antes de inyectar el fármaco, nombradas como muestra 1, y después de inyectar el fármaco tras 90 minutos de toma de constantes, llamada muestra 2. Se han comparado los resultados tanto de la muestra 1 como de la muestra 2 entre el Grupo Control y el Grupo Lidocaína, así como, las diferencias entre la muestra 1 y la muestra 2 dentro del Grupo Control y el Grupo Lidocaína.
En todos los test estadísticos se empleaba un intervalo de confianza del 95% y se consideraban valores significativos aquellos en los que la p<0,05.
Resultados
No se han encontrado diferencias estadísticamente significativas entre FC, FR, Tc, Ti o Tm (Wilcoxon, P>0,05).
No se encontraron diferencias significativas entre la incidencia de apnea (McNemar, P= 0,33; Chi cuadrado, P= 0,26) y arritmia (McNemar, P= 0,69; Chi cuadrado, P=0,44) entre los dos grupos.
Los resultados obtenidos en el nivel de consciencia, respuesta al dolor en nalgas y respuesta al dolor en extremidades, están expresados en las figuras 1, 2 y 3 del anexo.
En cuanto a los parámetros sanguíneos, en la comparación de las muestras 1 y 2 entre el Grupo Control y el Grupo Lidocaína no se han encontrado diferencias significativas entre grupos (Wilcoxon, P>0,05). Los resultados de las diferencias entre la muestra 1 y la muestra 2 dentro del Grupo Control están expresados en la Tabla 1, y los del Grupo Lidocaina están expresados en la Tabla 2.
Tabla 1. Comparación de resultados obtenidos en las muestras 1 y 2 en el grupo Control (Test de Wilcoxon).
|
Datos Hematológicos |
n |
Variable Muestra 1 |
Variable Muestra 2 |
Diferencia entre muestras |
||
|
Muestra 1 |
Muestra 2 |
Media |
Media |
Media |
P |
|
|
Hto |
Hto |
7 |
31 |
32 |
-1 |
0.69 |
|
Hgb |
Hgb |
7 |
10.5 |
10.9 |
-0.3 |
0.69 |
|
Glu |
Glu |
7 |
71 |
171 |
83 |
0.02 |
|
Na |
Na |
7 |
135 |
136 |
1 |
0.31 |
|
K |
K |
7 |
4 |
3.5 |
-0.5 |
0.69 |
|
iCa |
iCa |
7 |
1.49 |
1.52 |
0.02 |
0.3 |
|
pH |
pH |
7 |
7.17 |
7.28 |
0.9 |
0.16 |
|
pH_corr |
pH_corr |
7 |
7.36 |
7.46 |
0.11 |
0.31 |
|
PCO₂ |
PCO₂ |
7 |
73.7 |
62.3 |
-21.5 |
0.22 |
|
pCO₂_corr |
pCO₂_corr |
7 |
42.2 |
35.3 |
-9.6 |
0.47 |
|
HCO₃ |
HCO₃ |
7 |
25.5 |
30.9 |
0.3 |
0.94 |
|
TCO₂ |
TCO₂ |
7 |
32.1 |
33 |
-0.1 |
0.84 |
|
BEecf |
BEecf |
6 |
-3 |
4 |
-3 |
0.69 |
|
PO₂ |
PO₂ |
7 |
67 |
44 |
-14 |
0.03 |
|
PO₂_corr |
PO₂_corr |
7 |
28.5 |
20 |
-5.5 |
0.03 |
|
SO₂ |
SO₂ |
7 |
84.5 |
83.5 |
-3.5 |
0.31 |
|
Lact |
Lact |
6 |
92.7 |
77.6 |
-2.4 |
0.69 |
Tabla 2. Comparación de resultados obtenidos en las muestras 1 y 2 en el grupo Lidocaína (Test de Wilcoxon).
|
Datos Hematológicos |
n |
Variable Muestra 1 |
Variable Muestra 2 |
Diferencia entre muestras |
||
|
Muestra 1 |
Muestra 2 |
Media |
Media |
Media |
P |
|
|
Hto |
Hto |
7 |
33 |
25 |
-2 |
0.38 |
|
Hgb |
Hgb |
7 |
11.2 |
8.5 |
-0.7 |
0.16 |
|
Glu |
Glu |
7 |
79 |
104 |
34 |
0.02 |
|
Na |
Na |
7 |
137 |
137 |
1 |
0.84 |
|
K |
K |
7 |
4.3 |
4.2 |
-0.2 |
0.38 |
|
iCa |
iCa |
7 |
1.41 |
1.55 |
0.09 |
0.05 |
|
PCO₂ |
PCO₂ |
7 |
96.2 |
54.7 |
-34.4 |
0.08 |
|
pCO₂_corr |
pCO₂_corr |
7 |
57.7 |
31.6 |
-22.8 |
0.08 |
|
HCO₃ |
HCO₃ |
7 |
32 |
32.8 |
0 |
0.69 |
|
TCO₂ |
TCO₂ |
7 |
35 |
34 |
-2 |
0.81 |
|
BEecf |
BEecf |
7 |
2 |
8 |
5 |
0.06 |
|
PO₂ |
PO₂ |
7 |
70 |
49 |
-22 |
0.16 |
|
PO₂_corr |
PO₂_corr |
6 |
28.5 |
21 |
-5 |
0.31 |
|
SO₂ |
SO₂ |
7 |
83 |
83 |
-4 |
0.94 |
|
Lact |
Lact |
7 |
114.2 |
61.7 |
-40.2 |
0.02 |
|
pH |
pH |
7 |
7.11 |
7.35 |
0.23 |
0.02 |
|
pH_corr |
pH_corr |
6 |
7.23 |
7.49 |
0.24 |
0.03 |
Discusión
En el presente estudio se ha empleado una lanceta de fuerza regulable como método alternativo de detección del dolor, de esta forma, se pueden atravesar las escamas, evitando el contacto con una superficie carente de terminaciones nerviosas(26,27,28) y hay más probabilidad de estimular las fibras nerviosas A ∂, implicadas en una respuesta rápida al dolor(1,2). El objeto es comprobar si el bolo de lidocaína tiene efecto analgésico ante un estímulo doloroso agudo, similar al provocado en una incisión quirúrgica.
Este método se ha empleado con el objeto de aplicar la misma fuerza, excluyendo errores de operario, sin embargo, se ha visto a lo largo del estudio que resulta difícil poder dejar la lanceta a la misma distancia de las extremidades o nalgas, que la fuerza empleada depende de la distancia a la que se queda la zona del cuerpo a pinchar del dispositivo punzante y en ocasiones podía dar lugar a confusión, ya que el sonido del objeto, en ocasiones provocaba la retracción de las extremidades. El reflejo de huída, además, se daba con mayor frecuencia cuando el operador no estaba a la vista de los animales, pero al no haber hecho un estudio estadístico que lo corrobore, es un hecho empírico que habría que considerar en futuros estudios, ya que la influencia del observador en la respuesta al dolor ha sido descrita en otro estudio realizado en Iguana iguana(9). Los resultados obtenidos indican una reducción significativa de la respuesta al dolor en extremidades entre el grupo Control y el Grupo Lidocaína, lo que indica un efecto analgésico del fármaco tras la administración de un bolo intravenoso de 2mg/kg. En nalgas no ha resultado significativo, pudiendo deberse a un error en la evaluación al dolor o una menor sensibilidad de la zona al estímulo doloroso en comparación con la extremidad, por lo que este hecho se debería considerar en futuros estudios, evitando la sujeción del dispositivo punzante por parte de un operario.
Al estar descrito el efecto sedante en perro, se ha decidido evaluar el estado de conciencia en Trachemys scripta tras la administración del bolo de lidocaína a 2mg/kg. Utilizando como referencia el reflejo palpebral, la retracción del cuello y extremidades dentro del caparazón. El estado de conciencia ha resultado significativamente reducido tras la administración de lidocaína. Sin embargo, no ha producía un efecto sedante, sino una disminución de la respuesta. Esto supone una ventaja en tratamientos post-quirúrgicos, donde se quiere proporcionar una tranquilización sin un efecto sedante o anestésico(25,29).
Los hallazgos referentes a posibles cambios en las constantes vitales estudiadas, siendo estas FC y FR, indican que el fármaco no produce cambios significativos. Para monitorizar las arritmias, se descartó el empleo de un electrocardiograma, puesto que el movimiento del animal ocasiona artefactos que impiden la evaluación de esta prueba. Por ello, se consideraban las disrritmias según el cambio del ritmo cardiaco o fluctuaciones de sonido emitidos por el doppler, hecho que hay que interpretar con cautela, porque los propios movimientos del animal pueden producir artefactos a la hora de interpretar el ritmo cardiaco.
También se realizaba un registro de las apneas como posible alteración de la frecuencia respiratoria. Los reptiles, en este caso las tortugas semi-acuáticas como es la Trachemys scripta, sufren apneas de forma fisiológica cuando se sumergen en el agua y resisten la acidosis metabólica que se produce como consecuencia(26,27,28). Existen otros detonantes de apneas, tales como estrés o fármacos opioides, en especial la morfina, aunque también se han descrito con la administración de butorfanol, tramadol y tapentadol(6,8,10,11,12,25). La lidocaína, no ha producido un aumento o disminución significativo de apnea, por lo tanto, la administración de este fármaco podría ser una alternativa para reducir la dosis de los opioides y proporcionar analgesia sin prolongar la recuperación post-anestesia. Aun así, para una valoración más exacta, se debería emplear un capnógrafo.
La temperatura no se debería considerar, ya que son poiquilotermos y las variaciones serían consecuencia de cambios en la temperatura ambiental(27), sin embargo, son datos que nos permiten corregir ciertos parámetros sanguíneos tales como: la presión parcial de O₂, el pH y la presión parcial de CO₂ que se calculan en base a la temperatura del animal. Su metabolismo basal depende de la temperatura ambiental al carecer de mecanismos termorreguladores, por lo tanto, los valores obtenidos se tienen que corregir en base a su temperatura corporal óptima para evitar posibles errores en la interpretación de los datos(26,27).
En el análisis de parámetros sanguíneos, no se han observado diferencias significativas entre el Grupo Control o el Grupo Lidocaína. Las diferencias observadas han sido dentro del mismo grupo, entre la primera toma de muestra, antes de inyectar el fármaco, y la segunda, una vez finalizado el estudio, al no haber diferencias entre grupos, posiblemente estos cambios sean consecuencia de los métodos de realización del estudio.
En el grupo Control, existe un aumento significativo de glucosa y una disminución de presión arterial de oxígeno (pO₂) y presión arterial de oxígeno corregida (pO₂_corr). Una disminución indica una bajada de niveles de oxígeno en sangre. Los reptiles tienen mayor tolerancia que los mamíferos a la hipoxia(27), esto se debe a su respiración activa que disminuye la presión arterial de oxígeno de forma fisiológica en comparación con mamíferos. Además, son capaces de cambiar el sentido del flujo cardiaco, este fenómeno se conoce como shunt cardiaco. Cuando se produce, aumenta la resistencia de los vasos sanguíneos en el pulmón, evitando la pérdida de oxígeno, el cual, se sigue consumiendo(26,27,28). Tanto las apneas como el shunt cardiaco se pueden dar en situaciones de estrés.
También se da un aumento significativo de la glucosa, llegando a superar el límite superior descrito en Trachemys scripta presente en la Tabla 3. Este fenómeno de hiperglucemia puede indicar estrés por parte del animal, consecuencia de la liberación de catecolaminas o cortisol. También podría deberse a la ingesta de comida antes de recoger a las tortugas y a su posterior metabolismo, provocando un pico de glucemia post-pandrial, sin embargo, este hecho no es probable porque estaban en ayuno.
Tabla 3. Rangos de normalidad hematológicos y bioquímicos sanguíneos en Trachemys scripta James W. W. Carpenter. Exotic animal formulary. Reptiles: Eric Klaphake; Paul M. Gibbons; Kurt K. Sladkly; James W. Carpenter: editors. Fith edition; St. Louis, Missouri: Elsevier; 2018.
|
Hematología |
Trachemys scripta spp. |
|
Hemoglobina (g/dL) |
11.1 (10-12.2) |
|
Hematocrito (%) |
26 (8-44) |
|
Bioquímica |
Trachemys scripta spp. |
|
Glucosa (mg/dl) |
54 (21-143) |
|
Sodio (mEq/L) |
134 (123-147) |
|
Potasio (mEq/L) |
3.8 (2.4-7.5) |
|
Calcio (mg/dl) |
12.6 (6.5-22.6) |
En el grupo Lidocaína se ven otros cambios. Se da un aumento significativo de glucosa, ión cálcico, pH, pH_corregido (pH_corr) y disminución de lactato. Tomando como referencia parámetros de normalidad de la especie Trachemys scripta hasta ahora registrados, que se resumen en la tabla 3, el aumento de glucosa detectado en la muestra dos del grupo Lidocaína, alcanza el valor de 104 mg/dl que no llega a superar el límite superior del rango de normalidad de glucosa, aunque sí que se aprecia una tendencia a la hiperglucemia compatible con una liberación puntual de catecolaminas o cortisol, causadas por el estrés durante la extracción de sangre.
Por otro lado, el ión calcio, medido en mmol/l, pasa de 1.4 mmol/l a 1.5 mmol/l, la diferencia es mínima y es probable que no tenga significación clínica. Las variaciones relacionadas con el aumento puntual de calcio se pueden deber a un artefacto de la muestra, ya que las jeringas se han heparinizado manualmente y la heparina empleada contenía calcio, pudiendo dar un falso aumento. También podría explicarse como un artefacto estadístico como consecuencia del tamaño de muestra.
En cuanto al pH y pH_corr, se interpreta el pH_corr, por ser el parámetro corregido en base a la temperatura corporal de las tortugas. Los valores pasan de un pH de 7.2 a 7.5 aproximadamente. No hay cambios en el bicarbonato, sin embargo, en los valores de la presión arterial de CO₂ hay una tendencia a disminuir, lo que es compatible con una alcalosis respiratoria provocada por hiperventilación. Al suceder en un momento puntual, justifica que no se hayan dado cambios significativos en otros parámetros sanguíneos.
La disminución significativa de lactato puede deberse a la alcalosis respiratoria, por un metabolismo del lactato en el hígado para mantener las concentraciones de bicarbonato o por el esfuerzo muscular que realizaban las tortugas retrayendo el cuello antes de la extracción de sangre. Ante una actividad muscular que requiera gran esfuerzo, consumen los depósitos de glucógeno, y con el fin de reponer ese depósito, consumen el lactato en sangre(30), lo que a su vez puede contribuir a un aumento de pH. De todas formas, las consecuencias clínicas de la disminución del lactato en sangre no están estudiadas en reptiles. Por tanto, los cambios producidos en la muestra dos del grupo Control y del grupo Lidocaína, posiblemente, sean una señal de estrés en la manipulación de los animales que deberían ser considerados a la hora de interpretar los parámetros sanguíneos en futuros estudios.
Se tiene que puntualizar, que a pesar de los resultados obtenidos, deberían valorarse en una muestra con más animales, puesto que el aumento o disminución de la respuesta al dolor se dan en relación a una población de siete individuos, tal y como se observa en las Figuras 1, 2 y 3, lo cual da un amplio margen de error. Además, también habría que valorar otro método de manipulación, para evitar artefactos provocados por el estrés en los parámetros sanguíneos medidos en los animales. Otras consideraciones serían, el empleo de un capnógrafo para medir apneas, o provocar un disparo automático por parte del dispositivo punzante sin la sujeción de otro operario.
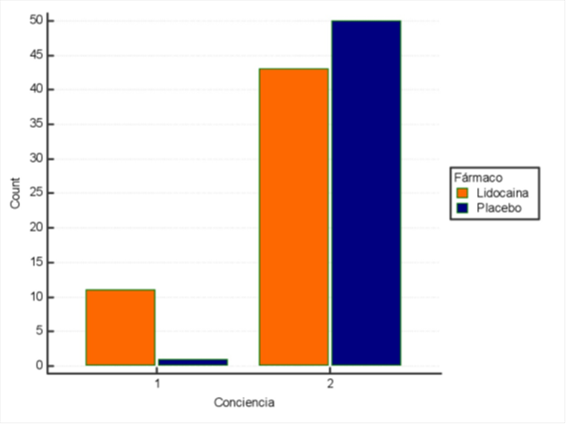
Figura 1. Diagrama de barras que representa el estado de conciencia en individuos del grupo Lidocaína y Control. El valor 1 se asigna para estado de conciencia disminuido y el valor 2 para el estado de conciencia normal o alerta. El eje de ordenadas representa el número de veces, en total, que se han asignado los valores 1 (conciencia disminuida) o 2 (ausencia de conciencia), en el grupo Lidocaína o en el grupo Control.
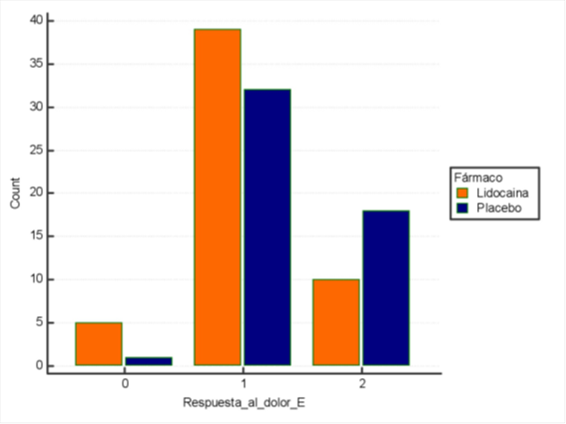
Figura 2. Diagrama de barras que representa la respuesta al dolor en extremidades en individuos del grupo Lidocaína y Control. El eje de ordenadas representa el número de veces, en total, que se han asignado los valores 0 (ausencia de respuesta), 1 (retirada de extremidad) o 2 (reflejo de huída), en el grupo Lidocaína o en el grupo Control.
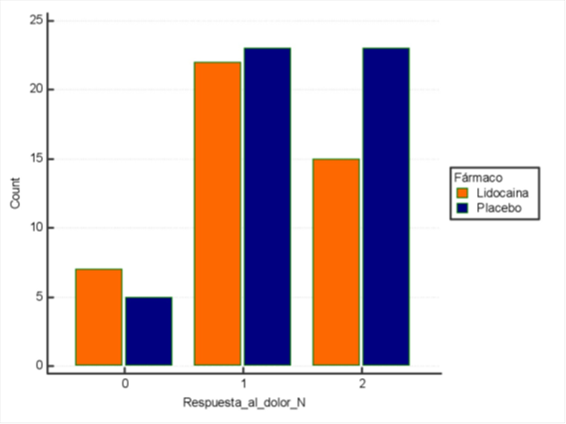
Figura 3. Diagrama de barras que representa la respuesta al dolor en nalgas en individuos del grupo Lidocaína y Control. El eje de ordenadas representa el número de veces, en total, que se han asignado los valores 0 (ausencia de respuesta), 1 (contracción de la nalga) o 2 (reflejo de huída), en el grupo Lidocaína o en el grupo Control.
Conclusiones
La lidocaína por vía intravenosa en un bolo de 2 mg/kg tiene efecto analgésico en Trachemys scripta, sin embargo, la presencia de un observador puede modificar la respuesta de las tortugas, debido al comportamiento etológico de estos animales.
Las pruebas de dolor provocado mediante aguja en lugares distintos a la extremidad, como es en el caso de nalgas, no son adecuadas para evaluar la respuesta de huida, pudiendo ser necesario emplear otros métodos de detección de dolor, para poder descartar una menor sensibilidad, o un fallo en la interpretación de la respuesta al dolor. También se ha observado que la lidocaína produce un efecto tranquilizante, sin afectar a las constantes vitales y/o parámetros sanguíneos analizados en el presente estudio, lo que le hace ser un buen candidato en tratamientos de analgesia multimodal, sin embargo, se debe continuar investigando en esta materia, con el objeto de corroborarlo, en vista a las dificultades encontradas en el presente estudio.
Agradecimientos
Al Centro Veterinario los Sauces, en especial a María Ardiaca García y a mis tutores, Andrés Montesinos Barceló y Manuel Ignacio San Andrés Larrea.
Financiación
Centro Veterinario "Los Sauces".
Referencias
1. Mosley C. Pain and Nociception in Reptiles. Veterinary Clinics of North America: Exotic Animal Practice. enero de 2011;14(1):45-60.
2. Perry SM, Nevarez JG. Pain and Its Control in Reptiles. Veterinary Clinics of North America: Exotic Animal Practice. enero de 2018;21(1):1-16.
3. T.I. Kanui, K.Hole, J. O. Miaron. Nociception in Crocodiles: Capsaicin Instillation, Formalin and Hot Plate Test. Zoological Science. 1990 (7):537-540.
4. Sladky KK, Kinney ME, Johnson SM. Effects of opioid receptor activation on thermal antinociception in red-eared slider turtles (Trachemys scripta ). American Journal of Veterinary Research. septiembre de 2009;70(9):1072-8.
5. Mans C, Lahner LL, Baker BB, Johnson SM, Sladky KK. Antinociceptive Efficacy of Buprenorphine and Hydromorphone in Red-eared-slider Trutles (Trachemys scripta elegans). Journal of Zoo and Wildlife Medicine. 20 de septiembre de 2012;43(3):662-5.
6. Sladky KK, Miletic V, Paul-Murphy J, Kinney ME, Dallwig RK, Johnson SM. Analgesic efficacy and respiratory effects of butorphanol and morphine in turtles. Journal of the American Veterinary Medical Association. mayo de 2007;230(9):1356-62.
7. Sladky KK, Kinney ME, Johnson SM. Analgesic efficacy of butorphanol and morphine in bearded dragons and corn snakes. Journal of the American Veterinary Medical Association. 15 de julio de 2008;233(2):267-73.
8. Baker BB, Sladky KK, Johnson SM. Evaluation of the analgesic effects of oral and subcutaneous tramadol administration in red-eared slider turtles. Journal of the American Veterinary Medical Association. 15 de enero de 2011;238(2):220-7.
9. Fleming GJ, Robertson SA. Assessments of thermal antinociceptive effects of butorphanol and human observer effect on quantitative evaluation of analgesia in green iguanas (Iguana iguana ). American Journal of Veterinary Research. octubre de 2012;73(10):1507-11.
10. Baker BB, Sladky KK, Johnson SM. Evaluation of the analgesic effects of oral and subcutaneous tramadol administration in red-eared slider turtles. Journal of the American Veterinary Medical Association. 15 de enero de 2011;238(2):220-7.
11. Giorgi M, Salvadori M, De Vito V, Owen H, Demontis MP, Varoni MV. Pharmacokinetic/pharmacodynamic assessments of 10 mg/kg tramadol intramuscular injection in yellow-bellied slider turtles (Trachemys scripta scripta). Journal of Veterinary Pharmacology and Therapeutics. octubre de 2015;38(5):488-96.
12. Giorgi M, Lee H-K, Rota S, Owen H, De Vito V, Demontis MP, et al. Pharmacokinetic and Pharmacodynamic Assessments of Tapentadol in Yellow-Bellied Slider Turtles (Trachemys Scripta Scripta) after a Single Intramuscular Injection. Journal of Exotic Pet Medicine. julio de 2015;24(3):317-25.
13. Uney K, Altan F, Aboubakr M, Cetin G, Dik B. Pharmacokinetics of meloxicam in red-eared slider turtles ( Trachemys scripta elegans ) after single intravenous and intramuscular injections. American Journal of Veterinary Research. mayo de 2016;77(5):439-44.
14. Di Salvo A, Giorgi M, Catanzaro A, Deli G, della Rocca G. Pharmacokinetic profiles of meloxicam in turtles (Trachemys scripta scripta) after single oral, intracoelomic and intramuscular administrations. Journal of Veterinary Pharmacology and Therapeutics. febrero de 2016;39(1):102-5.
15. Laura G. Bunke, Kurt K. Sladky, Stephen M. Johnson. Antinociceptive efficacy and respiratory effects of dexmedetomidine in ball pythons (Python regius). American Journal of Veterinary Research. Julio 2018; 79(7):718-725.
16. Craig Morsley. Clinical Approaches to Analgesia In Reptiles. James S. Gaynor, William W. Muir: editors. Handbook of Veterinary Pain Management. St. Louis, Mo. : Mosby/Elsevier, 2009. p. 481-493.
17. James S. Gaynor, William W. Muir. Local Anesthesics. James S. Gaynor, William W. Muir: editors. Handbook of Veterinary Pain Management. St. Louis, Mo. : Mosby/Elsevier, 2009. p. 231-248.
18. Machin KL. Fish, Amphibian, and Reptile Analgesia. Veterinary Clinics of North America: Exotic Animal Practice. enero de 2001;4(1):19-33.
19. Soto G, Naranjo González M, Calero F. Intravenous lidocaine infusion. Revista Española de Anestesiología y Reanimación (English Edition). mayo de 2018;65(5):269-74.
20. Pasero C. Intravenous Lidocaine for Acute Pain Treatment. Journal of PeriAnesthesia Nursing. junio de 2011;26(3):166-9.
21. Hanck DA, Makielski JC, Sheets MF. Lidocaine alters activation gating of cardiac Na channels. Pflügers Archiv - European Journal of Physiology. abril de 2000;439(6):814-21.
22. Johnson RA, Kierski KR, Jones BG. Evaluation of gastric emptying time, gastrointestinal transit time, sedation score, and nausea score associated with intravenous constant rate infusion of lidocaine hydrochloride in clinically normal dogs. American Journal of Veterinary Research. mayo de 2017;78(5):550-7.
23. Estebe J-P. Intravenous lidocaine. Best Practice & Research Clinical Anaesthesiology. diciembre de 2017;31(4):513-21.
24. Cerasoli I, Nannarone S, Schauvliege S, Duchateau L, Bufalari A. The effects of intravenous lidocaine before propofol induction in premedicated dogs: The effects of intravenous lidocaine before propofol induction. Journal of Small Animal Practice. agosto de 2016;57(8):435-40.
25. Kinney ME, Johnson SM, Sladky KK. Behavioral Evaluation of Red-eared Slider Turtles (Trachemys scripta elegans) Administered Either Morphine or Butorphanol Following Unilateral Gonadectomy. Journal of Herpetological Medicine and Surgery. junio de 2011;21(2-3):54-62.
26. Megan Kirchgessner, Mark A. Mitchell. Chelonians. Mark A. Mitchell, Thomas N. Tully, Jr: editors. Manual of Exotic Pet Practice. St. Louis, Mo. : Saunders Elsevier; 2009. p 201-249.
27. Bairbre. O´Malley. General anatomy and physiology of reptiles. Bairbre. O´Malley: editor. Clinical anatomy and physiology of exotic species: structure and function of mammals, birds, reptiles, and amphibians. Edinburgh; New York: Elsevier Saunders, 2005. p 17-39. Clinical Anatomy and Physiology of Exotic Species. :23.
28. Bairbre. O´Malley. Tortoises and Turtles. Bairbre. O´Malley: editor. Clinical anatomy and physiology of exotic species: structure and function of mammals, birds, reptiles, and amphibians. Edinburgh; New York: Elsevier Saunders, 2005. p 41-56. Clinical Anatomy and Physiology of Exotic Species. :16.
29. Mosley CAE. Anesthesia and Analgesia in Reptiles. Seminars in Avian and Exotic Pet Medicine. octubre de 2005;14(4):243-62.
30. Steven J. Wickler, Todd T. Gleeson. Carbohydrate Metabolism in Mouse and Anole Muscle. The American Physiology Society. 1993; 93(0363-6119): 487-491.
