REVISIÓN
El Síndrome de Sensibilidad Central: un nuevo reto para el Dietista-Nutricionista
The Central Sensitivity Syndrome: a new challenge for the Dietitian-Nutritionist
Lucía Aumesquet García
Universidad Pablo de Olavide, Sevilla. España
* Autor para correspondencia.
Los artículos publicados en esta revista se distribuyen con la licencia:
Articles published in this journal are licensed with a:
Creative Commons Attribution 4.0.
https://creativecommons.org/licenses/by-nc-nd/4.0/
La revista no cobra tasas por el envío de trabajos,
Resumen
El Síndrome de Sensibilidad Central (SSC) se define como un estado fisiológico dónde se encuentran alterados el sistema endocrino, el sistema nervioso y el sistema inmunológico con el desarrollo hiperexcitabilidad de las neuronas y como consecuencia el organismo se encuentra hipersensibilizado a estímulos nocivos o no nocivos. Durante los últimos 30 años los estudios relacionados al SSC van en aumento. La comprensión de la fisiopatología que comparten los distintos síndromes que lo componen es una herramienta eficaz para poder desempeñar un papel eficiente como profesionales sanitarios. No solo los médicos deben estar capacitados para abordar pacientes con estos problemas, los nutricionistas, entre otros, deben de tener las herramientas necesarias para intentar mejorar la calidad de vida de estas personas. Esta revisión bibliográfica cuenta con el apoyo de una gran cantidad de estudios aceptados por la comunidad científica acerca de los componentes, fisiopatología y síntomas de este síndrome, pero también con la relación y el papel que juega a nivel nutricional. Actualmente, España cuenta con diversos equipos de profesionales trabajando e investigando sobre la evidencia científica de ciertos tratamientos nutricionales para este problema, como por ejemplo la función de la histamina en SSC. Finalmente concluye con la importancia que posee la dieta y la microbiota en el desarrollo y en el mantenimiento de los síntomas.
Palabras clave
Síndrome de sensibilidad central; Sensibilidad central; Fibromialgia; Histamina; Microbiota
Abstract
The Central Sensitivity Syndrome is defined as a physiological condition where the endocrine system, the nervous system and the immunological systems are altered causing the overexcitement of the neurons and consequently the organism is oversensitive to harmful or harmless stimuli. In the last 30 years there have been an increase in the research related to CSS. The understanding of the common physiopathology shared by the different syndromes which form it is a useful tool to be able to play an efficient role as health professionals. Not only doctors should be enable to treat patients with such symptoms but also nutritionists, among others, must have the necessary tools to try to improve the quality of these people's lives. This bibliographic review is supported by a number of researches approved by the scientific world regarding the components, physiopathology and symptoms of this syndrome, even so with the relationship and the role played on a nutritional level. Currently, Spain has several teams of professionals working and looking into the scientific evidence of some nutritional treatments for this problem, as for example the function of the Histamine in CSS. Finally it finishes with the importance diet and microbiota have in the development and maintenance of the symptoms.
Keywords
Central Sensitivity Syndrome; Central sensitivity; Fibromyalgia; Histamine; Microbiota
Introducción
Esta revisión es importante para la literatura científica debido a que hay pocos artículos que traten únicamente sobre este síndrome y que aporten soluciones nutricionales.
El objetivo principal es hacer una revisión bibliográfica acerca del SSC para que los futuros nutricionistas-dietistas y profesionales sanitarios se familiaricen con este concepto que nace hace muy poco tiempo y para mejorar el conocimiento sobre la realidad que viven estos pacientes.
Por otro lado, se pretende enfocar el trabajo al campo nutricional de esta patología, explicando el papel que juega la histamina, la enfermedad celiaca, las funciones de la microbiota, nuevos conceptos sobre sensibilidad alimentaria etc para que los nutricionistas tengan algunas herramientas eficaces para poder tratar a estos pacientes.
Resultados
Definición
El síndrome de sensibilidad central (SSC) es un estado fisiopatológico que engloba distintos procesos con características comunes, con causa desconocida, pero con una fisiopatología común(1). Anteriormente estas personas eran diagnosticadas de fibromialgia (FM), síndrome de fatiga crónica (SFC), síndrome de intestino irritable (SII) etc. Pero eran diagnósticos hechos de forma aislada o incluso ha habido personas diagnosticadas de trastornos mentales. En 1984, el Doctor Muhammad B. Yunus(2) hace mención a un único concepto: El Síndrome de sensibilidad central (SSC) y engloba distintos trastornos debido a que los mecanismos de producción son los mismos y por lo tanto esta persona no padece diferentes patologías sino que posee un desencadenante común con sintomatología diferente en las distintas zonas del organismo(3). En estos últimos años cada vez más personas se ven afectadas, sobre todo las mujeres(4). La etiología de este Síndrome es desconocida y la fisiopatología, no está completamente definida pero los diferentes artículos científicos que presentaré a lo largo de la revisión comienzan a señalar un mecanismo común: la sensibilidad central(5).
Se puede comparar los distintos síndromes que componían el SSC en 1984 (Figura 1) y ver aquellas patologías que se han añadido en 2007 (Figura 2). Existen gran número de estudios que relacionan claramente la sensibilidad central con la FM(7-12) SII(13-14) el SFC(15), la migraña o cefalea tensiona(16) o el síndrome de dolor miofacial, son los síndromes con más evidencias científicas(6). También se han encontrado otros trastornos donde el dolor no es el síntoma primario, como por ejemplo en el síndrome de piernas inquietas(17) o el síndrome de estrés post-traumático(18).
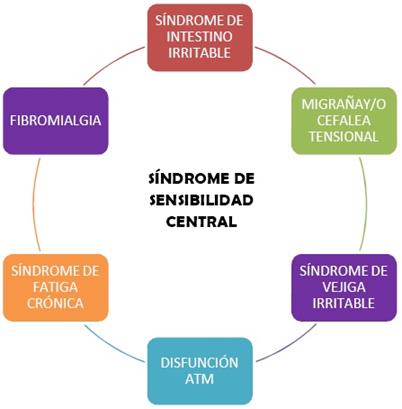
Figura 1: Modificado de Junus(2), 1984. Componentes del SSC presentados en 1984.
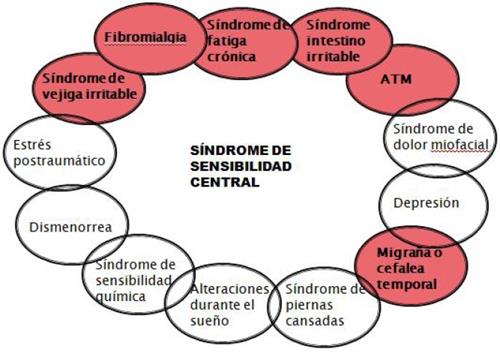
Figura 2: Modificado de Junus(6), 2007.
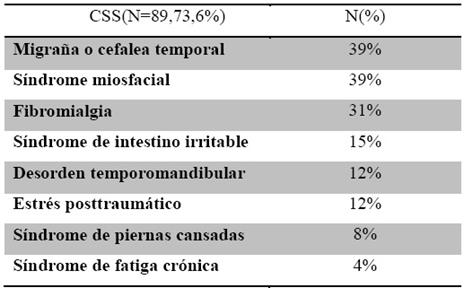
En el siguiente estudio, realizado por Randy et al(4) se comunica la presencia de uno o varios de estos síndromes en 89 pacientes (74%) de 121 que refieren poseen dolor central. La prevalencia mediante porcentajes que obtienen como resultado en estas 89 personas es la que se observa en la Tabla 1.
Tabla 1.Modificado de Neblett et al(4)
Kato et al(19) analizan a un total de 31318 gemelos entre 41-64 años de edad y donde se evaluaron cuatro síndromes crónicos: dolor generalizado crónico, SFC, SII y cefalea recurrente y dos trastornos psiquiátricos: depresión y ansiedad. Se revela la importancia de las influencias genéticas y ambientales en los mecanismos de estas patologías. Además demuestra claramente que los síndromes somáticos funcionales como por ejemplo la FM, o el SII, tienen síntomas compartidos que difieren de aquellos síndrome psiquiátricos como la ansiedad y la depresión.
Fisiopatología del SSC
Indagando un poco más en la fisiopatología de este síndrome puede decirse que el correcto funcionamiento del organismo depende de una correcta homeostasis, comunicación y plasticidad entre los sistemas. Una desregulación puede provocar diferentes alteraciones que desembocan en patologías. Estas son las características que poseen los sistemas adaptativos:
-Son dinámicos y responden a las diferentes perturbaciones que se producen en el medio y siempre tienden hacia la homeostasis entre los distintas partes del organismo.
-La comunicación y la interacción entre los sistemas es mucho más importante que los propios componentes. Esta comunicación se produce mediante mecanismos de feed-back positivos o negativos entre diferentes zonas.
-La plasticidad para tener la capacidad de responder a las alteraciones del ambiente (20).
En el caso del SSC no solo está afectado el sistema nervioso central (SNC) y el sistema inmunológico, también el sistema endocrino. La comunicación entre ellos no es correcta y como se menciona anteriormente esto puede ser más importante que los propios componentes del sistema.
Se ha descubierto que las neuronas del sistema nervioso de los pacientes con este síndrome se hiperexcitan y desarrollan una hipersensibilidad que provoca la sensibilización central a los distintos estímulos periféricos nocivos o no nocivos: olor ruidos, alimentos, productos químicos... y además presentan hipersensibilidad inmunológica a distintos antígenos alimentarios, o químicos, y por lo tanto al producirse una desregulación entre estos sistemas, provoca la alteración en el sistema endocrino(3,4). (Figura 3)

Figura 3: Alteraciones en los distintos sistemas.
Por razones que no se conocen bien, la exposición a un agente tóxico primario (sustancia que es reconocida como extraña por el sistema inmune) que puede ser químico, biológico, un implante de cirugía, radiación, entre otros, provoca en el organismo la iniciación de un proceso de hipersensibilidad y de mala tolerancia hacia estos compuestos. A esto se le suma un tercer proceso en el cual participa un desencadenante: productos de limpieza, polen, antígenos alimentarios como gluten o caseína, maquillaje, pinturas, la exposición a una radiación, entre otras. Toda esta sucesión finaliza en una reacción exagerada del sistema inmune que puede estar mediada por IgG, IgA, IgE, o citoquinas provocando síntomas y signos multisistémicos(21). Puede verse más claro en la Figura 4:
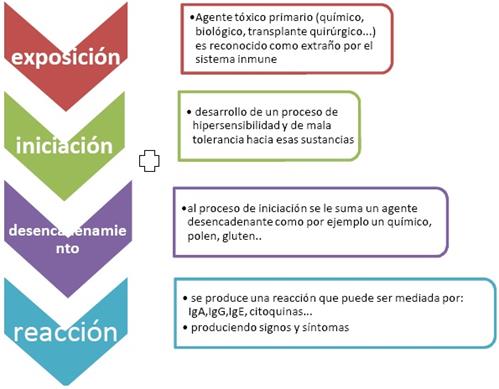
Figura 4: Esquema modificado de Stephen, 2010(21).
Para explicar la fisiopatología es importante entender este esquema (Figura 5) porque la fisiopatología de este síndrome es muy compleja. Lo principal es la alteración neuroinmuneendocrina, provocando que la liberación de péptidos, hormonas, neurotransmisores y citoquinas no sea correcta y produciendo a nivel del sistema nervioso una transmisión nociceptiva alterada, en el sistema endocrino una continua excitabilidad y por último en el sistema inmunológico la liberación de sustancias anti-inflamatorias y pro-inflamatorias. Ningún sistema actúa de forma independiente y hay que comprender la fisiopatología de forma completa para realizar un buen tratamiento.
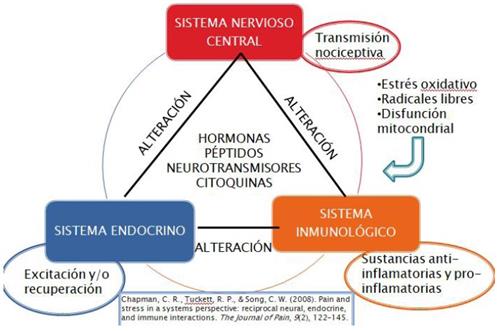
Figura 5: Modificado de Chapman et al, 2008(20).
Alteración neuroinmuoendocrina
La nocicepción está definida como el proceso neuronal mediante el cual se reconocen y procesan los estímulos que causan daños en los tejidos. De esto se encargan unas terminaciones nerviosas llamadas nociceptores o "receptores del dolor"(22). La percepción anormal del dolor implica la activación de una gran variedad de nociceptores periféricos tanto en los tejidos somáticos como en el visceral. Esta activación produce un proceso de inflamación que provoca la liberación de mediadores inflamatorios (serotonina, histamina, sustancia P, prostaglandinas etc)(6,23).
Los impulsos nociceptivos periféricos viajan a través de las fibras A-Delta y C(6), es decir existen dos tipos de nociceptores: los de bajo-umbral (se conectan a las fibras delta) y las de alto umbral (se conectan a las fibras C)(23). En la médula espinal, mediante transmisión sináptica, estas fibras conectan con las neuronas espinales, llegando a producir la alodinia (percepción anormal del dolor) y la hiperalgesia (excesiva sensibilidad al dolor)(12) siendo las fibras A-Delta las encargadas del dolor agudo y las fibras C las encargadas de hacer crónico este dolor. Finalmente las fibras post-sinápticas situadas en el asta dorsal de la medula espinal manda señales hacia el tálamo, hipotálamo, sistema límbico... que son estructuras involucradas en el procesamiento del dolor las cuales están hiper-excitadas(6). También se ha observado una disminución en la sustancia gris del cerebro. En el estudio realizado por Robinson et al(24) analizaron 19 zonas diferentes del cerebro en 14 mujeres con FM y 11 mujeres sanas como control y concluyeron que las mujeres con FM poseen una disminución del contenido de la sustancia gris, pero que los mecanismos por los cuales se producen estos cambios no están claros. Por otro lado, Seminowicz et al(25) analizaron 55 pacientes con IBS y 48 pacientes sanos y también observaron una disminución en la materia gris.
La activación de los c-receptores produce la expresión de ciertos neurotransmisores y neuromoduladores (Tabla 2) en los terminales nerviosos del asta dorsal de la médula espinal (Figura 6). Estas sustancias químicas envían impulso provocando la hiper-excitación de las neuronas post-sinápticas(6). Es decir, si el estímulo tóxico primario descrito en la Figura 3, se estimula de forma repetida ante los nociceptores puede producir la sensibilización (respuesta exagerada). A este proceso se le denominada wind-up.
Tabla 2: Neuroquímicos y neuroreceptores implicados en la sensibilidad central. Modificado de Volchck, 2010(12).
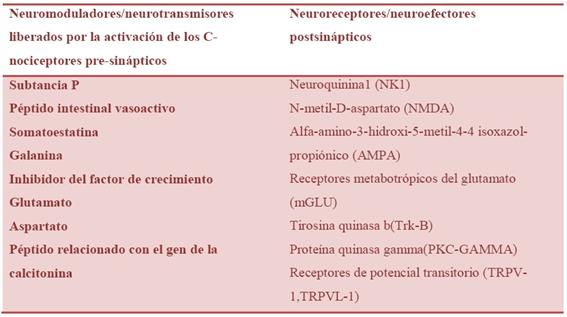
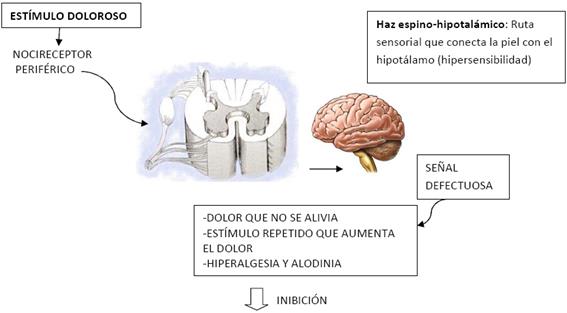
Figura 6: Modificado de Langford et al, 2010(26).
Muchos de estos neurotransmisores, como por ejemplo el glutamato, son capaces de modular las respuestas post-sinápticas. El glutamato es un trasmisor rápido de las neuronas aferentes primarias que se une a receptores en las neuronas post sinápticas en el asta dorsal de la médula espinal, por ejemplo el AMPA, NMDA y mGLUR(27). Cada uno de estos receptores poseen distintas subunidades, por ejemplo para el receptor AMPA se han identificado unidades que son permeables al calcio, como la GluR1 y otras que no son permeables al calcio(28).
La activación de NMDAR es un paso fundamental para iniciar y mantener la sensibilidad central. En condiciones normales el canal NMDAR está bloqueado de forma dependiente al ion magnesio, pero la liberación de nociceptores como el glutamato, o sustancia P contribuyen a la desporalización de la membrana y dejar que la actividad del NMDAR no esté bloqueada, esto provoca uno de los pasos fundamentales en la sensibilización central: la entrada de calcio en las neuronas, además de la activación de diferentes vías intracelulares que contribuyen al mantenimiento de la sensibilidad central(29).
Un aumento del calcio intracelular más allá de los niveles normales, puede ser clave para desencadenar la sensibilización central. Además la entrada de calcio induce la activación del óxido nítrico y este puede también interviene en la sensibilización central(30).
Pall(31) hace referencia a la importancia del complejo ciclo del óxido nítrico/peroxinitrito (NO/ONOO). Los estresores provocan un incremento en el NO y en otros elementos del ciclo. El óxido nítrico aumentado actúa a través de su producto oxidante: el peroxinitrito. Los tres productos químicos principales del ciclo NO/ONOO (óxido nítrico, peroxinitrito y superóxido) tienen una vida media corta y por lo tanto no pueden desplazarse en distancias largas desde donde son producidos hasta donde son destruidos. Así pues, si el ciclo del NO/ONOO se produce en determinados tejidos del organismo, los síntomas se desencadenan en sitios próximos a estos tejidos y pocas veces se producirán en los mismos lugares que otros pacientes, por eso los sitios donde se produce dolor son diversos, es decir, la tolerancia de cada paciente para esta cadena es diferente.
La Figura 7 representa aquellas sustancias que están implicadas en este ciclo. La parte del ciclo más importantes es donde el oxido nítrico es convertido en peroxinitrito, aumentando el calcio y activando un factor de transcripción llamado NF-k-B y este activando la enzima óxido nítrico sintetasa (iNOS) que produce a su vez más cantidad de óxido nítrico por eso la cantidad de óxido nítrico es siempre creciente.
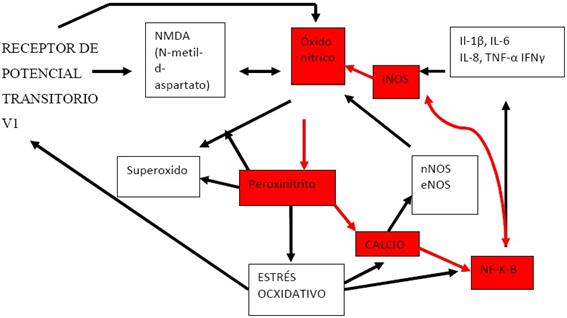
Figura 7. Modificado de Pall, 2010(31).
En un estudio realizado recientemente por Chiara de Luca et al(32) se llega a la conclusión de que la producción creciente del ácido nítrico, la oxidación lipídica y una baja concentración de glutatión, junto con el aumento de las citoquinas inflamatorias se deben de considerar como el proceso desarrollado en pacientes con síndrome químico múltiple, patología englobada dentro del SSC.
Por último, uno de los desarreglos bioquímicos producidos en esta patología es la disfunción mitocondrial. La principal función de la mitocondria es la producción de ATP (adenosintrifosfato), es decir, la producción de energía para que el organismo funcione adecuadamente. Pero si las mitocondrias no funcionan correctamente el organismo se fatiga(33).
En estos pacientes hay una disfunción en el metabolismo mitocondrial que provoca que el organismo no produzca la cantidad de energía necesaria para su correcto funcionamiento. Muchas veces el problema está en el sistema digestivo ya que gran parte del sistema inmunológico se encuentra aquí. Si a esto le sumamos que es donde el organismo produce gran parte de los compuestos energéticos como la glucosa, lo ácidos grasos o el glicerol, nos encontramos con una disminución de dichos compuesto y el desarrollo de fatiga.
Un mecanismo específico que produce la disfunción del metabolismo mitocondrial/energético es el ataque del peroxinitrito contra importantes proteínas mitocondriales, es decir el ciclo del NO/ONOO afecta también a nivel mitocondrial, por ejemplo mediante la nitroxidación de residuos de proteínas(31).
Sintomatología
La sintomatología de esta enfermedad puede resumirse en(12,34):
• Fatiga y/o cansancio que no se resuelve
• Dolor que no parece estar relacionado con ningún daño específico
• Dolor de cabeza
• Odinofagia o dolor al tragar
• Dolor en el tórax o palpitaciones
• Adenopatias cervicales o axilares dolorosas
• Dolor en el tórax o palpitaciones
• Debilidad muscular
• Problemas e concentración y otras alteraciones cognitivas
• Infecciones de repetición
• Alteraciones gastrointestinales sin causa concreta
• Dolor/calambres en el abdomen
• Diarreas
• Estreñimiento
• Distención o hinchazón abdominal
• Nauseas y/o vómitos
• Nerviosismo, ansiedad y tristeza
• Picores, urticarias y piel seca
• Pérdida de cabello, uñas
• Palma de manos o plantas de pies amarillas
• Detección de zumbidos o ruidos
• Hipersensibilidad a muchas sustancias sin que existan alergias
• Sueño y cansancio
• Hormigueo en las extremidades
• Ojos y boca secos
• Fiebre o febrícula
• Temperatura bajas en las extremidades
• Sensación de ahogo
• Dolor en la vejiga o zona pélvica
• Micciones frecuentes y/o dolorosas
• Dismenorrea
• Insomnio
• Dolor mandibular
• Necesidad de ayuda en actividades diarias
Estas personas pueden ser especialmente sensibles a:
ü El sol o la luz
ü Los ruidos
ü Alimentos
ü Alcohol
ü Exposición a pólenes, polvos, moho, pelo de animales
ü Fármacos y/o vacunas
ü Productos químicos (productos de limpieza, maquillajes, perfumes...
ü Teléfonos móvil, dispositivos electrónicos, antenas wifi...
Síndromes asociado con SSC:
Los síndromes más correlacionados con el SSC son la FM, SFC, el SII y la migraña o cefalea temporal(4):
Fibromialgia (FM)
Es un síndrome de etiología desconocida que se caracteriza por dolor y cansancio crónico generalizado que el paciente localiza en el aparato locomotor. Además del dolor, otros síntomas, como fatiga intensa, alteraciones del sueño, parestesias en extremidades, depresión, ansiedad, rigidez articular, cefaleas y sensación de tumefacción en manos, son algunas de las manifestaciones clínicas más comunes. Los pacientes con FM presentan con frecuencia una hipersensibilidad al dolor que produce una sensación dolorosa en diversos "puntos sensibles". Alguno de estos puntos los podemos encontrar en el cuello, hombros, espalda, cadera, brazos y piernas(35).
En la actualidad, ni la etiología ni la patogenia están determinadas, pero se piensa que hay una base genética. Por lo tanto si una persona posee está base genética y se expone a un factor desencadenante, como puede ser una infección, una cirugía, exposición a químicos etc. provoca el desarrollo de la sensibilidad central(36).
En 1992, la Organización Mundial de la Salud (OMS, 1992) reconoció la FM y la clasifica como una enfermedad reumatológica. La prevalencia en la población española es del 2,73% con una prevalencia mucho mayor en las mujeres que en los hombres, exactamente un ratio 20:1(37).
Síndrome de fatiga crónica (SFC)
También llamado encefalomielitis miálgica, es una enfermedad crónica y multisistémica que afecta a distintos sistemas del organismo. Las personas con esta enfermedad no pueden realizar las actividades cotidianas, produce una reducción de la actividad del paciente entre el 50% y el 80% de la que realizaba antes de desarrollar la enfermedad. Uno de los síntomas más relevantes es la fatiga, además es muy característico que esta fatiga no se alivia con descanso(38). Ha sido clasificada por la OMS como una enfermedad neurológica grave. Estas personas padecen síntomas como la pérdida de memoria y de concentración, dolor en articulaciones, inflamaciones, alteraciones en el sueño etc(39).
La prevalencia del SFC a nivel mundial es del 0.8-3.5% según un estudio realizado en 2011(40).
La predisposición genética de esta enfermedad es importante, pero de nuevo, sobre esta base genética debe de actuar un desencadenante externo que provoca una reacción excesiva del sistema inmune, produciendo disfunción en distintas zonas del organismo(41).
Síndrome de intestino irritable (SII)
Es una de las enfermedades gastrointestinales más comunes ya que afecta a un 10-20% de la población. Esta patología tiene una sintomatología marcada compuesta por: Diarrea alternada con estreñimiento, gases intestinales, distensión y retortijones, calambres abdominales, evacuaciones intestinales dolorosas, secreción de etc. Es más común que lo padezcan las mujeres, con un ratio mujer-hombre de 2:1 y la causa de este síndrome es desconocida, al igual que no existe una prueba que determine su presencia(42). El SII aparece en el 50% de los casos entre los 11-17 años(43). Al igual que la migraña, está caracterizado por ataques que vuelven a su normal fisiología por una causa que aún no está determinada y está asociada con una disminución en la densidad de la materia gris en el cerebro(24,25). El diagnóstico se realiza mediante los criterios Roma III realizado por un consenso entre expertos.
Un estudio realizado por
Noriaki et al, 2010(44) a 287 pacientes con
desordenes gastrointestinales, entre ellos el SII, llegan a la conclusión de
que un aumento en el índice de masa corporal mayor de 30( ![]() ) se asocia con un tránsito
colónico significativamente acelerado, es decir el peso de los pacientes afecta
al SII.
) se asocia con un tránsito
colónico significativamente acelerado, es decir el peso de los pacientes afecta
al SII.
Migraña y/o cefalea tensional
El dolor de cabeza, la cefalea tensional y la migraña son encargados de un gran impacto económico en salud pública(45). El estudio "American Prevalence and Prevention" (AMPP)(46) proporciona estimaciones comparativas basadas en la población Estadounidense sobre la prevalencia de la migraña y la cefalea tensional y en un segundo estudio realizado por Stovner et al(47) donde analizan 107 publicaciones concluyen con un 46% de adultos que sufren dolor de cabeza,42% tiene cefalea tensional y 11% migraña. Además las mujeres están más afectadas en un ratio de 2:3 que los hombres.
La migraña es un tipo de dolor de cabeza que puede desencadenarse por muchos factores debido a que el cerebro tiene una actividad anormal y está sensibilizado a ciertos alimentos, a la luz, al sonido etc.(48). Los ataques de migraña suelen ser a última hora del día y se resuelve de forma espontánea. Durante estos ataques se produce una serie de síntomas y signos como por ejemplo nausea, vómitos, dolor muscular, etc.(49).
Sin embargo, la cefalea tensional es el tipo de dolor de cabeza más común causando dolor en diferentes zonas como por ejemplo en la cabeza, en el cuero cabelludo o en el cuello. Este dolor es producido en respuesta a la tensión o contracción de ciertos músculos debido al estrés, ansiedad, traumatismos, etc.(50).
Wilcox et al(51) estudiaron a 23 pacientes con migraña y 23 pacientes sanos señalan una mayor actividad funcional sobre todo en áreas cortico-límbicas en respuesta a estímulos negativos y que la carga de ataques repetidos puede conducir a una sensibilidad generalizada a los estímulos adversos. Explican que la gran mayoría de los modelos que muestran los mecanismos que participan en la fisiopatología de la migraña incluyen la sensibilización central y periférica y la hiperexcitabilidad.
Un estudio donde se realizaron encuestas a 4421 personas diagnosticadas con FM, de las cuales contestaron correctamente al cuestionario 1730(52), llegaron a la conclusión de que estos pacientes también experimentan migraña en el 55,8% de los casos, además estos pacientes también experimentaban otros síndromes como por ejemplo el SII, SFC, ansiedad, etc. Debido a estos resultados sugieren que la fisiopatología es común incluyendo alteraciones neuroendocrinas, plasticidad neuronal, alteraciones neuroquímicas, modulaciones de los nocireceptores neuronales tanto centrales como periféricos, influencia hormonal y cambios vasculares.
Relación del Síndrome de Sensibilidad Central con la alimentación
Reacciones adversas a los alimentos
Según la nueva clasificación publicada en 1995 por la Academia Europea de Alergia e Inmunología clínica, se incluye en el esquema aquellas reacciones inmunológicas no mediadas por IgE(53):
El término de reacción adversa hace referencia a cualquier reacción desfavorable que se presente por el contacto, la inhalación o la ingesta de un alimento o de un componente de ellos. Puede haber:
-Reacciones tóxicas: son dosis-dependiente, esto quiere decir que depende de la cantidad ingerida y no de la susceptibilidad del paciente ya que produce trastornos en todas las personas. Pueden ser producidos por toxina de origen bacteriano, por metales pesados, sustancias químicas, contaminantes naturales,etc.
-Reacciones no tóxicas: son aquellas que no son dependientes de la dosis y depende de la susceptibilidad del paciente. Se pueden encontrar:
• Reacciones alérgicas: está involucrado el sistema inmunológico y puede producirse incluso con cantidades muy pequeñas de alimentos. Pueden ser inmunoglobulina E mediada o no. Dentro de las no mediadas por la IgE podemos encontrar la celiaquía y la intolerancia a la histamina.
• Intolerancias: su prevalencia es mucho mayor y el sistema inmunológico no interviene. La causa de las intolerancias puede ser enzimática, farmacológica o indeterminada.
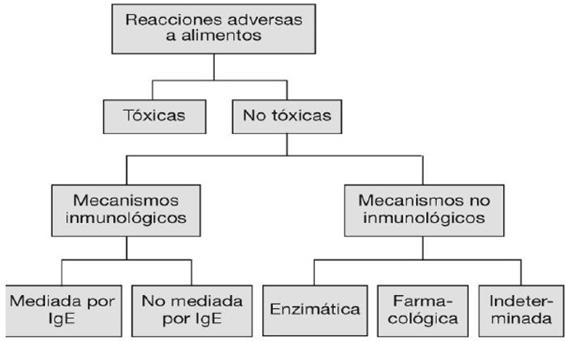
Figura 8: Clasificación de las reacciones adversas a los alimentos publicado por la Academia Europea de Alergia e Inmunología Clínica (1995).
Histamina
Son las células cebadas o mastocitos las que sintetizan y almacenan la histamina en el organismo. Estas células poseen funciones secretoras que actúan de forma local en los tejidos periféricos para modular la activación de los nociceptores y el dolor(54). Los mastocitos participan en reacciones inflamatorias y el número de células decrece a medida que aumenta la edad y hay más cantidad en mujeres que en hombres.
La desgranulación de estas células produce(55):
- Enzimas como por ejemplo las fosfolipasas, proteasas....
- Citoquinas como la interleuquina-1, el interferón
- Metabolitos lipídicos: leucotrienos, prostaglandinas...
- ATP: adenosín trifosfato
- Neuropéptidos: VIP
- Factores de crecimiento
- Ácido nítrico
- Aminas biógenas: serotonina e histamina
La histamina liberada por las células cebadas, cambia la permeabilidad de la barrera hematoencefálica y permite la entrada de todas las sustancias liberada por los mastocitos, en respuesta a estímulos inflamatorios o una lesión(56). A su vez las fibras nociceptivas liberan los neuromoduladores como por ejemplo la sustancia P, el péptido relacionado con el gen de la calcitonina (CGRP), Péptido intestinal vasoactivo (VIP), que actúan como un feedback positivo para los mastocitos y además activan otras células inmunomoduladoras como los neutrófilos, macrófagos y las células T que mantienen la respuesta inflamatoria, causando hiperalgesia y alodinia(57). Por lo tanto, los mastocitos junto con los basófilos pueden interaccionar con el sistema nervioso, creando la sensibilidad inmunológica.
La histamina es una amina biógena derivada de la descarboxilación del aminoácido histidina. Es uno de los mediadores más importantes no solo de la inmunoglobulina E (IgE), sino también de reacciones adversas no dependiente de IgE(58). El exceso de histamina en el organismo es una enfermedad llamada histaminosis y según su origen puede clasificarse en origen exógeno y endógeno. Dentro de la histaminosis de origen exógeno encontramos la intoxicación por exceso de histamina, las más comunes son por la putrefacción del pescado o la carne(59) o el déficit en el catabolismo de la histamina, por un déficit de la enzima que cataboliza la histamina denominada enzima DiaminoOxidasa (DAO) o por el consumo de fármacos que disminuyen su actividad(60). En las de origen endógeno encontramos la histaminosis alérgica mediada por anticuerpo IgE unidos a ciertas proteínas del alimento. Los síntomas se producen de manera inmediata(21). Por último encontramos la histaminosis no alérgica producida por la liberación lenta y parcial de la histamina inducida específicamente por un antígeno(61).
Cuando hablamos de intolerancia a la histamina nos adentramos en un concepto con muchas cuestiones en la literatura científica, ya que le faltan pruebas de laboratorio para definirlo y describirlo mejor(58).
No se ha podido determinar si la causa de la intolerancia a la histamina se debe a un defecto enzimático(62). Propone Zagasti(63) que la intolerancia puede estar causado por un inadecuado funcionamiento de los sistemas de eliminación de la histamina que puede tener origen genético o patológico (relacionado con enfermedades intestinales) o por inhibición farmacológica de las enzimas implicadas en el metabolismo de la histamina. También menciona que la aparición de los síntomas no está ligada al consumo de un alimento en concreto, sino que puede asociarse a distintos alimentos con concentraciones diferentes de histamina.
Sin embargo nuevas líneas de investigación se están abriendo sobre el tema de histaminosis alimentaria, pero todavía no disponemos de artículos científicos validados. El equipo de SHC medical (Hospital Santa Ángela de la Cruz de Sevilla) continua investigando acerca de la histaminosis crónica de origen endógeno en el que se produce un aumento lento, gradual y duradero de la cantidad de histamina cuando el organismo se pone en contacto con ciertos antígenos alimentarios provocando una respuesta inmunológica y la activación de las células implicadas(3). No solo este equipo está investigando acerca de este tema también desde la Sociedad Andaluza para la Investigación de Intolerancias Alimentarias, explica la existencia de la "Histaminosis alimentaria no alérgica" (HANA).
En el estudio realizado por el Instituto de ciencias biomédicas en el área de mastocitos de Atlanta(64) se describe que los mastocitos están implicados en la homeostasis energética del organismo, mediante la tolerancia de la glucosa y en los mediadores del sueño. Es decir, las células cebadas que mencioné anteriormente comienzan a ser relacionadas con la homeostasis energética y como está expuesto anteriormente, una de las principales células almacenadas y liberadas por estas células es la histamina, por lo tanto controlar los alimentos liberadores de histamina en cada organismo es una estrategia interesante para disminuir la sintomatología en el SSC.
Enfermedad celiaca
De forma errónea, la celiaquía ha sido considerada como un desorden de malabsorción caracterizado por diarrea, fatiga, dolor abdominal etc. Sin embargo actualmente se clasifica como un desorden autoinmune y multisistémico. Estos pacientes poseen una predisposición inicial con sensibilidad hacia el gluten (en la mayoría de los casos a la gliadina). La respuesta inmune iniciada se considera responsable de gran cantidad de síntomas producidos fuera del tracto gastrointestinal como diversos cambios estructurales en el cerebro(65). Hay desórdenes neuronales que pueden afectar al tracto digestivo. La activación de la respuesta inmune y la inflamación en el tracto gastrointestinal está muy relacionada, entre otros factores, con la producción de serotonina por el sistema nervioso entérico, encargado de activar células inmunológica y estas liberar mediadores proinflamatorios(66). Un estudio realizado por Zhishan et al(67) en ratones descubren que el desarrollo del Sistema nervioso entérico y la motilidad del tracto gastrointestinal depende principalmente de las células serotoninérgicas y la falta de estas células complica la motilidad de los animales.
Es cierto, como es mencionado al comienzo del trabajo, que el SNC controla el organismo mediante señales de feed-back con los distintos órganos para mantener la homeostasis y responder a los distintos cambios en el medio, pero está función no sería posible sin el sistema nervioso periférico, sistema nervioso entérico, sistema nervioso y sistema nervioso autonómo(43). El sistema nervioso entérico (SNE), descrito por Gershon(68) como "el segundo cerebro con funciones autónomas e integrativa en la función neurológica". El SNE posee neuronas que secretan de forma propia neurotransmisores como la dopamina, serotonina,etc.,en respuesta a distintos estímulos. La sensibilidad del SNC también afecta a este sistema ya que están en continua conexión.
Por último, se pone de manifiesto la relación entre SII y enfermedad celiaca. Por ejemplo en el estudio sistemático realizado por Ford et al(69) revisan la prevalencia de la enfermedad celiaca mediante un estudio aleatorio que cumplían los criterios para el diagnóstico de SII. El número de individuos recogidos en los catorce estudios que se revisaron era de 4204 personas, de las cuales el 54% combinaban la presencia de anticuerpos antigliadina positivo y los criterios para el diagnóstico de SII.
Nutrición y microbiota
Como proponen Maslowki et al(70) "Si la dieta afecta a la composición de la microbiota y la microbiota regula las respuestas inmutarías e inflamatorias, la dieta debería de tener efectos fácilmente cuantificables sobre la respuesta inmune". La microbiota se desarrolla en el recién nacido durante el parto y luego se va modificando con factores como la dieta, los antibióticos, la genética, factores ambientales etc(71). La microbiota posee una gran importancia en multitud de funciones, como por ejemplo la síntesis de vitaminas, la digestión de la fibra y sobre la regulación de respuestas inflamatorias. Anteriormente se hace referencia a la importancia de la comunicación entre el SNC y el intestino, y actualmente comienza también a hablarse del eje microbiota-intestino-cerebro(72).
La dieta occidental moderna se caracteriza actualmente por la ingesta de un gran número de alimentos procesados, una baja cantidad de vegetales y fibras. Sin embargo, la fermentación de la fibra por parte de los microorganismos que componen la microbiota produce grandes cantidades de productos como el propionato, acetato, butirato, y ácidos grasos de cadena corta y estas sustancias se ha comprobado que producen efectos beneficiosos en el organismo, por ejemplo, los ácidos grasos de cadena corta poseen una importante función en la inmunoregulación(70). Si las dietas occidentales son carentes en este tipo de compuestos supone un problema para muchas personas.
En el estudio realizado por Turnbaugh et al(73) en ratones modificados genéticamente comprueban el paso de una dieta rica en polisacáridos y baja en grasas, a una dieta rica en azúcares, grasas y baja en polisacáridos hiciera cambiar la microbiota de estos ratones en solo un día, cambios en las vías metabólicas y la expresión génica, y en dos semanas la generación de una mayor adipocidad.
La relación entre el SSC y la microbiota es muy importante para las recomendaciones del nutricionista-dietista al paciente ya que el desajuste neuroinmunoendocrino mantiene un estado de mala-absorción, de mayor permeabilidad de la membrana, la producción de ciertos neurotransmisores y neuromoduladores que desajustan la homeostasis de la microbiota y que mantienen un estado de dolor.La activación de los nociceptores del dolor se pueden aliviar mediante modulación probiótica del microbioma y estos son los microorganismos estudiados con efectos positivos.(74) Todos de la especie lactobacillus:
-L.farciminis y L.reuteri: mejora la hipersensibilidad en el colon mediante la inhibición de la contracción epitelial y el óxido nítrico(75,76).
-L.paracasei: mejoro la hipersensibilidad visceral(77).
-Lactobacillus acidophilus: efectos analgésicos en el dolor intestinal(78).
Consejos nutricionales para pacientes con SSC
Se pueden dar una serie de consejos nutricionales como guía para poder tratar a estos pacientes:
1. En primer lugar para aquellas personas que sufren ataques de migraña se aconseja eliminar de la dieta: chocolate, productos lácteos, cafeína, alimentos que contienen tiramina (vino rojo, queso curado, pescado ahumando, o higos), algunas frutas como el aguacate o las frutas cítricas, carnes que contengan nitrato (sobre todo aquellas carnes ultraprocesadas), cebolla, maní, nueces. Evitar los alimentos procesados, fermentados, adobados o marinado(79).
2. La relación entre el SII y la enfermedad celiaca es positiva(69), por lo tanto es común encontrar personas que poseen el SSC y enfermedad celiaca. Así pues, se debe recomendar eliminar de la dieta aquellos alimentos con gluten para las personas que dan positivo a las pruebas diagnosticas de la enfermedad celiaca.
3. Debido a la permeabilidad intestinal alterada de alguno de estos pacientes pueden causar la dificultad para sintetizar ciertas proteínas u absorber ciertos minerales o vitaminas obtenidas a través de la dieta, por lo tanto para evitar el SFC por falta de energía, son recomendable los siguientes suplementos alimentarios:
-Ubiquinol: como se ha mencionado anteriormente, en este síndrome la función mitocondrial está alterada por lo tanto el ubiquinol, que es la forma activa más biodisponible de la coenzima Q10, ayuda a las células a obtener la cantidad necesaria de energía para realizar sus funciones(80).
-Magnesio: es el cuarto catión más abundante en el organismo, contribuye al equilibrio electrolítico, al proceso de división celular, al metabolismo energético a la síntesis de proteínas y a la estabilidad de las membranas celulares. La fuente principal es la dieta (cereales, germen de trigo, nueces, almendras, pescados, diversos vegetales de hoja verde...) pero también se puede aportar en forma de sal con fines terapéuticos. El sulfato de magnesio es la más utilizada porque entre sus funciones se encuentra la de controlar la excitabilidad neuromuscular y la contracción muscular y actúa contra la migraña u el estreñimiento, entre otros(81).
Y los siguientes alimentos:
-Alimentos ricos en vitamina B12, como por ejemplo la proteína de origen animal.
-Alimentos ricos en antioxidantes: frutas y verduras.
-Los ácidos omega-3 de cadena larga poseen un papel antiinflamatorio importante: pescados azules, semillas etc.
-Alimentos ricos en vitamina C: pimientos, fresas, kiwi etc.
4. La relación que posee la microbiota con el SNC y la importancia de la dieta en la modulación de esta están establecidos(73), por lo tanto es importante mantener una microbiota sana y poblada, para ello:
-Consumir alimentos ricos en fibra.
-Evitar alimentos procesados y ultraprocesados.
-Consumir alimentos de origen vegetal.
-Evitar grandes cantidades de grasas no saludables y de azúcares refinados.
Como se ha planteado anteriormente, hay estudios que aprueban que el bajo consumo de polisacáridos, y alto consumo de grasas y azúcares, pueda modificar la microbiota y aumentar la adipocidad.
5. Anteriormente se ha explicado la importancia de la histamina en todo el proceso de sensibilidad central y por lo tanto se debe cumplir:
-Evitar un exceso de alimentos ricos en histamina como el marisco, el chocolate, las fresas etc.
Los nutricionistas deben estar atentos a próximas publicaciones acerca de la sensibilidad alimentaria y HANA (histaminosis alimentaria no alérgica) porque eliminar aquellos alimentos que produzcan sensibilidad central supondrá un alivio de los síntomas en muchos pacientes. Para ello se hace un Test de liberación de histamina modificada (TMH) para conocer a que antígenos alimentarios está sensibilizado el paciente y realizar una dieta con la eliminación de esos alimentos(3).
6. Hay gran relación entre el sobre-peso y obesidad con el desencadenamiento de un tránsito intestinal acelerado y SII, por lo tanto en estos pacientes una pérdida de peso controlada es una herramienta eficaz para evitar sintomatología.
7. El nutricionista-dietista debe tener en cuenta el compromiso que tienen estas personas en relación a la dieta, que están dispuestos a hacer para mejorar su sintomatología y que no, para llegar a un acuerdo común entre ambas partes.
8. Es recomendable que estas personas tengan una dieta variable, alternar siempre los alimentos.
Conclusiones
El SSC supone un nuevo reto para los profesionales socio-sanitarios debido a que es una enfermedad crónica multi-sistémica descrita hace poco tiempo y desconocida por la población. El manejo de esta patología debe ser interdisciplinario actuando sobre las razones multifactoriales que lo componen. Si a la complejidad bioquímica, endocrina, neuroinmunológica, y ambiental, le sumamos el desconocimiento, provoca que muchas de estas personas no sean diagnosticadas adecuadamente y por lo tanto tampoco dispongan de un tratamiento eficaz para ellas. En primer lugar, los profesionales sanitarios deben aumentar los conocimientos sobre esta nueva patología para tratar a estos pacientes de la forma más eficaz posible, reduciendo la sensibilidad y los síntomas y aumentando su calidad de vida.
Los últimos 30 años han supuesto un gran avance en aportaciones de distintos investigadores sobre el SSC. Actualmente poseemos un gran número de estudios los cuales explican la fisiopatología, las relaciones entre los síndromes que lo componen, los desencadenantes, las vías mediantes las cuales se desarrolla y los efectos que produce, es decir, es aceptado por la comunidad científica.
Por último, la alimentación juega un papel fundamental en la mejoría de los pacientes, entendiendo que no existe un alimentación establecida para estas patologías, ya que aunque comparten fisiopatología, cada paciente posee unas características únicas y un estilo de vida diferente que pueden mejorarse a través de buenos consejos nutricionales. En España solo hay tres centros especializados en este trastorno, por lo tanto tenemos que mentalizarnos sobre un nuevo cambio, seguir investigando y estar al día de nuevas publicaciones, para mejorar la atención sanitaria.
Referencias
1. Lindsay L, Robert M, Kim D. Central sensitivity syndromes: Mounting pathophysiologic evidence to lunk fibromyalgia with other common chronic pain disorders. Pain management nursing 2011;12: 15-24.
2. Yunus MB.Primary fibromyalgia syndrome:current concepts. Comprehensive therapy 1984 ;10: 8-21.
3. Blanco M. SHC MEDICAL[página web]. Síndrome de sensibilidad central. 2018[Consultado 23 mayo 2018]
4. Neblett R, Cohen.H, Choi Y et al. The central sensitization inventory (CSI): establishing clinically significant values for identifyng central sensitivity syndromes in an outpatient chronic pain sample. The Journal of Pain 2013; 14: 438-455.
5. Dennis C, Leah MA. Psychosocial Factors and Central Sensitivity Syndromes. Curr Rheumatol Rev 2016; 11: 96-108.
6. Yunus MB. Fibromyalgia and Overlapping Disorders: The Unifying Concept of Central Sensitivity Syndromes. Seminars in Arthritis and Rheumatism 2007; 36: 339-356.
7. Gracely RH, Petzke F, Wolf JM, Clauw DJ et al. Funtional magnetic resonance imaging evidence og augmentd pain processing in fibromyalgia. arthritis RHEUM 2002;46:1333-43.
8. Montoya P, Sitges C, García-Herrrero M. Reduced brain habituation to somatosensory stimulation in patient with fibromyalgia. Arthritis Rheum 2006;54:1995-2003.
9. Banic.B, Petersen -Félix S, Andersen OK, Radabou BP et al.Evidence for spinal cord hypersensivity in chronic pain after whiplsh injury and in fybromialgya. J.rheumatology 2004;107:7-15.
10. Vaneneste S, Ost V, Van Havenbergh T, De Ridder D. Resting state electrical brain activity and connectivity in fibromyalgia. PLOS one 2017; 12.
11. Hsiao FJ, Wang SJ, Lin YY, Fuh JL et al. Altered insula-default mode network connectivity in fibromyalgia: a resting-state magnetoencephalographic study. The journal of headache and pain 2017.
12. Volchck MM, Fleming CF. Central Sensitization Syndrome and the initial Evaluation of a Patient with Fibromyalgia: A review. Rambam Mainmonides Medical Journa Abril 2015;6.
13. Whitehead E, Moltkotter B, Erick P et al.Tolerance for rectosigmoid induces rectal hyperalgesia in patient with irritable bowel syndrome. Gastroenterology 1997; 112:55-63.
14. Lembo T, Naliboff BD, Matin K, Munakata J et.al. Irritable bowelsyndrome patients show altered sensitivity to exogenous opioids. Pain 2000;87: 137-47.
15. Vecchiet, Montahari G, Pizzigallo E, Lezzi S et al. Sensory characterization of somatic parietal tissues in humans with chronic fatigue syndrome. 1996;208.
16. Burtein R. An association between migraine and cutaneous allodynia. Annals of neurology 2001;47.
17. Stiasny-Kolster K, Magerl W, Oertel WH, Möller JC, Treede R. Static mechanical hyperalgesia without dynamic tactile allodynia in patient with restless legs syndrome.Brain 2004;127:773-782.
18. Dansie et al.The comorbidity of self-reported chronic fatigue syndrome, post-traumatic stress disorder and traumatic symptoms. Psychosomatics 2012;53:250-257.
19. A population- based twin study of funtional somatic syndromes. Phychological Medicine 2009;39:497-505.
20. Chapman CR, Tuckett PR, Song CW. Pain and stress in a systems Perspective: Reciprocal Neural, endocrine and immune interaction. The journal of pain Febrero 2008;9:122-145.
21. Stephen JG. Sensitivity related illnes: the escalating pandemic of allergy, food intolerance and chemical sensitivity. Science of the total enviorenment 2010;408:6047-6061.
22. Treeder RR, LoeserDJ. The kyoto protocol of IASP basic pain terminology. 2008; 137:473-470.
23. Nijs J, Meeus M. Central sensitization: a biopsychosocial explanation for chronic widespread pain in patinent with fybromialgia and chronic fatigue syndrome. Clinical rheumatology 2006;26: 465-473.
24. Robinson ME, Craggs J, Price D et al. Gray matter volumes of pain-related brain areas are decreased in fibromyalgia syndrome. The journal of pain 2011;12: 436-443.
25. Seminowicz DA, Labis JS, Bueller JA, Tillisch K et al. Regional gray matter density changes in brains of patients with irritable bowel syndrome. Gastroenterology 2010; 139: 48-57.
26. Bourke HJ, Langford, White DP.The common link between funtional somatic syndromes may be central sensitisation. Journal of Psychosomatic Research 2015;78:228-236.
27. Woolf JC, Lantremoliere A.Central sensitization: a generator of pain hypersensitivity by central neural plasticity. The journal of pain septiembre 2009;10:895-926.
28. Polgar et al. Expression of AMPA receptor suunits at synaoses in laminae I-III of the rodent spinal dorsal horn.Molecular Pain 2008; 4: 5.
29. Mayer ML, Westbrook GL, Guthrie PB. Voltage-dependent bock by Mg2+ of NMDA responses in spinal cord neurones. Nature 1984;309:261-263.
30. Wu.J, Fang L, Willis WD. Nitric oxide synthase in spinal cord central sensitization following intradermal injection of capsaicin. Pain 2001;94:47-58.
31. Pall ML.The NO/ONOO-Vicious Cycle Mechanism as the Cause of Chronic Fatigue Syndrome/Myalgic Encephalomyelitis. 2010.
32. De Luca C et al. Biological definition of multiple chemical sensitivity from redox state and cytokine profiling and not from polymorphisms of xenobiotic-metabolizing enzymes. Toxicology and Applied Pharmacology 2010;248:285-292.
33. Mclaren-Howard J, Myhill S. Chronic fatigue syndrome and mitocondrial dysfunction. Int J Clin Exp Med 2009:1-16.
34. Visiers C, Valverde C, Markez I. Nuevos retos en la consulta ¿Qué hacer ante la fibromialgia, el síndrome de la fatiga crónica-EM y la sensibilidades químicas múltiples?.
35. Rivera J et al.Documento de consenso de la Sociedad Española de Reumatología sobre la fibromialgia. 2006, I sinopsio de dolor en reumatología .
36. Yunus MB, Inanici F. History of fibromyalgia: past to present. 2004:369-78.
37. Carona L et al. Proyecto EPISER2000: Prevalencia de enfermedades reumáticas en la población española.Metodología, resultados del reclutamiento y características de la población. Revista Española de reumatología2001;28:2-18.
38. Restrepo J et al. Síndrome de fatiga crónica. Instituto Nacional de Salud 1993;13.
39. Mccully K, Black C. Time course of exercise induced alterations in daily activity in chronic fatigue syndrome. Dynamic medicine 2005;4.
40. Bhui K, Dinos S, Ashby D, Nazroo J, Wessely S, Whit PD. Fatigue syndrome in an ethnically diverse population: the influence of psychosocial adversity and physical inactivity. BMC medicine 2011.
41. Landay A et al.Chronic fatigue syndrome: Clinical condition associated with inmune activation. Lancet 1991;338: 707-712.
42. MedlinePlus[página web]. Bliblioteca nacional de medicina de los EE.UU. Síndrome del intestino irritable. [consultado 23 mayo 2018]
43. Cady KR, Farmen K, Dexter JK, Hall J. The bowel and Migraine: Update on Celiac Disease and Irritable Bowel Syndrome. Curr Pain Headache 2012;16:278-286.
44. Noriaki M, Wong BS, Camilleri M, Burton D, Mckinzie S et al. Lower Funtional Gatrointestinal Disorders: Evidence of Abnormal Colonic transit in a 287 Patient Cohort. Neurogastreoenterol motil Marzo 2010; 22:293-e82.
45. Lanteri-Minet M. Economic burder and costs of chronic migraine. Curr Pain Headache 2014;18:385.
46. Smitherman TA, Burch R, Loder et al.The prevalence, impact and treatment of migraine ans severe headaches in the Unit States: a review of statistics from national surveilllance studies. Headache 7 marzo 2013:427-36.
47. Stovner LJ,agen K, Jensen R et al. The Global Burder of Headache: a documentation of headache prevalence and disability worldwide. Cephalalgia 2007.
48. MEDLINEPLUS (Biblioteca Nacional de Medicina de los EEUU) [página web]. MIGRAÑA. [ consultado 24 Mayo 2018.] https://medlineplus.gov/spanish/ency/article/000709.htm.
49. Redell AW et al. Patient-centered strategies for effective management og migraine. Springfield: Primary Care Network 2000.
50. MEDLINE (Biblioteca Nacional de Medicina de los EE.UU)[página web]. Cefalea Tensional . [consultado 24 mayo 2018.] Disponible en: https://medlineplus.gov/spanish/ency/article/000797.htm
51. Wilcox L, Veggebers R, Lenne J, Hockinson DJ et al. Increases Funtional Activation of Limbic Brain Regions During Negative Emotional Processing in Migraine. Frontiers in human neuroscience 2016.
52. Brinder Vij MD, Whipple MO, Tepper SJ, Muhabbat AB, Stillman M, Vicent A et al. Frequency of migraine Headaches in patients with fibromyalgia. Brief Communication 2015.
53. Bruimjnzeel k, Ortolani C, Aas K. Adverse reactions to food. European Academy of Allergology and clinical Inmmunology Sybcommittee 1995;50:623-35.
54. Dubayle D, Heron A. A focus on mast cells and pain. Journal of Neuroimmunology 2013.
55. Lawrence B, Austen KF.Enzymes of the mast cell granule. The journal of investigative dermatology 1980;7:, 349-353.
56. Esposito P et al. Acute stress increases permeability of the blood-brain-barrier through activation of brain mast cells. Brain research 2001;888:117-127.
57. Matsuda H et al. Substance P induces granulocyte inflamation through degranulation of mast cells. Journal of immunology 1989;142:927-931.
58. Immunology, german society for allergology and clinical. German guideline for the management of adverse reactions to ingested histamine. Allego journal international 2017;26:72-79.
59. Hungerford, Jamen M. Scombroid poisoning: a review. Toxicon 2010;56:231-246.
60. Schwelberger H. Histamine intolerance: Overestimated or underestimated?. Inflammation research 2009;58:51-52.
61. Yoseph A, Bachelet, Ido, Leviñ-Schaffer, Francesca, Mekori. Mast cells: not only in allergy. Immunology and allergy clinics of North America 2006;26:407-425.
62. Komeri P et al. Oral verebreichte diaminoxidase (DAO) bei patient mit Verdacht auf histamin-intoleranz. Allergologie 2008;31:190.
63. Zagasti A.Intolerancia alimentaria. Endocrinología y nutrición 2009;56:241-50.
64. Mast cells; findings from institute of biomedical Sciences in the area of mast cells described (mast cell involvement in glucose tolerance impairment caused by chorinic mild strss with sleep disturbance. Health and medicine week 2017.
65. Hadjivassiliou M, Sanders DS, Grünewald RA, Woodroofe et al. Gluten sensivity: from gut to brain. Lancet.Neurol 2010;9: 318-30.
66. Ghia JE, Kanh WI. Gut hormones: emerging role in inmune activation and inflammation. Clin.Exp.Immunol 2010;161:19-27.
67. Zhishan LI, Chalazoitis A, Huang YY, Manin J, Gross K.Esential roles of enteric neuronal serotonin in gastrointestinal motility and the development/survival of enteric dopaminergic neurons. Journal of neuroscience 2011;31:8998-9009.
68. Gershoon MD. The second brain: a groundbreaking neu understanding of nervous disorders of the stomach and intestine 1998.
69. Ford A et al. Yield of diagnostic tests for celiac disease in individuals with symptoms suggestive of irritable bowel syndrome:systematic review and meta-analysis. MEDLINE 2009; 169.
70. Charles R, Kendle M. Diet, gut microbiota and inmune responses. Nature immunology 2011;12:5-9.
71. Sekirov I, Russell SL, Antunes LC, Finlay BB et al. Gut microbiota in health and disease. physiol 2010;90:859-904.
72. Sang HR, Pothoulakis C, Emeran A.M. Principles and clinical implication of the brain-gut-enteric microbiota axis. Nature Reviews gastroenterology and hepatology 2009:306-314.
73. Turnbaugh P. The effect of diet on the human gut microbiome: a metagenomic analysis in humanized gnotobiotic mice. American Association for the advencement of science. Medline 2009;1.
74. Kasper, Yan Wang, Lloyd H. The role of microbiome in central nervous system disordes. Brain, behavior and immunity 2014;38:1-12.
75. Ait-Belgnaoui et al. Lactobacillus farciminis tratment suppresses stres induced visceral hypersensitivity: a possible action though interaction with epithelial cell cytoskeleton contraction. 2006: 1090-1094.
76. Kamiya TW, Wang L,Forsythe P, Goeltsohe G, Mao Y et al. Inhibitory effects of lactobacillus reuteri on visceral pain induced by colorectal distension in SRAGYE-DAWLEY RATS. 2006;55:191-196.
77. Verdu EF, Bercik P, Verma-Gandhu M, Huang X-X et al. Specific probiotic therapy attenuates antibiotic induced visceral hypersensitivity in mice. 2006;55:182-190.
78. Rousseaux et al.Lactobacillus acidophilus modulates intestinal pain and induces opioid and cannabinoid receptors. Nature medicine 2006;13:35-37.
79. MEDLINE [PÁGINA WEB].Medicine National Library of U.S. 4 junio 2018[23 de mayo 2018]. Disponible en:https://medlineplus.gov/spanish/ency/article/000709.htm.
80. Fakuda S, Nojima J, Kajimoto O, Yamaguti K, Nakatomi Y et al. Ubiquinol-10 supplementation improves autonomic nervous function and cognitive function in chronic fatigue syndrome. Biofactors 2016; 42:431-440.
81. Cilia A, Piñero S, Proverbio T et al. Sulfato de magnesio:¿una panacea?. Interciencia 2005;30.
