ORIGINAL
Efecto de la fermentación y del tostado sobre el contenido de aminas biogénicas en semillas de cacao
Effect of fermentation and roasting on the content of biogenic amines in cacao beans
José David Mejía-Reyes, Rito Coronel-Niño, Didiana Gálvez-López, Raymundo Rosas-Quijano, Alfredo Vázquez-Ovando
Instituto de Biociencias, Universidad Autónoma de Chiapas. Boulevard Príncipe Akishino sin número, Colonia Solidaridad 2000, CP. 30798, Tapachula, Chiapas, México
* Autor para correspondencia.
Los artículos publicados en esta revista se distribuyen con la licencia:
Articles published in this journal are licensed with a:
Creative Commons Attribution 4.0.
https://creativecommons.org/licenses/by-nc-nd/4.0/
La revista no cobra tasas por el envío de trabajos,
Resumen
Introducción. Las aminas biogénicas (AB) pueden encontrarse en alimentos sometidos a fermentación, en cantidades considerables pueden llegar a causar intoxicaciones al consumidor.
Objetivo. Evaluar el efecto de la fermentación y el tostado sobre la producción-degradación de AB en semillas de cacao.
Métodos. En una primera etapa (E1), bajo un diseño completamente al azar se verificó el papel de la fermentación sobre las AB mediante cuatro tratamientos, inhibición del crecimiento de levaduras; inhibición del crecimiento bacteriano; fermentación tradicional y semillas sin fermentar. En una segunda etapa (E2), con un diseño factorial 3X2 con medidas repetidas se evaluaron seis tratamientos, resultado de la combinación de dos bacterias ácido lácticas (BAL) (L. plantarum, L. fermentum, L. plantarum + L. fermentum) y dos concentraciones de cultivo iniciador (106 UFC/g, 108 UFC/g) para investigar el papel de BAL exógenas en la producción-supresión de AB.
Resultados. En la E1 se comprobó la presencia de tres AB de interés, encontrándose putrescina en mayor cantidad (37 - 45,2 μg/g de semilla). Histamina y tiramina se encontraron en menores concentraciones sin efecto de la fermentación sobre la producción de AB. La E2 permitió observar un efecto de las BAL en la producción de putrescina, alcanzando valores hasta 41,1 μg/g cuando se inoculó la concentración más alta de BAL durante la fermentación. Histamina se redujo en las semillas después del tostado cuando se inoculó L. plantarum a 108 UFC/g.
Conclusión. Las BAL exógenas no tienen un papel fundamental en la producción-degradación de AB durante la fermentación de semillas de cacao.
Palabras clave
Tostado; amino oxidasas; levaduras; fermentación tradicional; granos sin fermentar
Abstract
Introduction. Biogenic amines (BA) can be found in foods subject to fermentation, in considerable quantities can cause poisoning to the consumer.
Objective. The aim of this study was to evaluated the effect of fermentation and the roasting on the production-degradation of BA of cocoa seeds.
Methods. In a first phase (P1), under a completely randomized design, the role of fermentation on BA was verified by four treatments, inhibition of yeast growth; inhibition of bacterial growth; traditional fermentation and unfermented seeds. In a second phase (P2), through a repeated measure factorial design 3X2, six treatments were evaluated, product of the combination of two lactic acid bacteria (LAB) (L. plantarum, L. fermentum, L. plantarum + L. fermentum) and two concentrations of starter culture (106 CFU/g, 108 CFU/g) to investigate the effect of exogenous LAB in the production-suppression of BA.
Results. In the P1, the presence of three AB of interest was confirmed, with putrescine being found in greater quantity (37 - 45.2 μg/g). Histamine and tyramine were found in lower concentrations without effect of fermentation on AB production. The E2 showed an effect of the LAB in the production of putrescine, reaching values up to 41.1 μg/g when the highest LAB concentration was inoculated during the fermentation. Histamine was reduced in the beans after roasting when L. plantarum was inoculated to 108 CFU/g.
Conclusion. The exogenous LAB do not have a essential role in the production-degradation of AB during the fermentation of cocoa seeds.
Keywords
Roasting; amino oxidases; yeast; traditional fermentation; unfermented beans
Aportación a la literatura científica
En este trabajo analizamos el efecto de la fermentación y el tostado además del papel que juegan las bacterias ácido lácticas en la posible producción o degradación de aminas biogénicas. Derivado de este trabajo encontramos que, en semillas de cacao fermentadas y tostadas, las aminas biogénicas no exceden de las dosis consideradas permitidas en los productos alimenticios. Además, reportamos que las bacterias ácido lácticas no tienen un efecto real ni en la producción ni en la degradación de aminas biogénicas durante la fermentación de cacao.
Introducción
Las semillas obtenidas de las plantas de cacao (Theobroma cacao L.) que se emplean para elaborar chocolate y otros productos derivados, son fermentadas, secadas y tostadas para promover cambios químicos que tienen como resultado final la producción de sustancias que imparten las características de sabor y aroma característico(1). Durante la fermentación, la cual puede realizarse en cajas, costales o pilas, la pulpa que envuelve a las semillas es degradada por levaduras y bacterias con la consecuente producción de alcohol, ácido láctico y ácido acético(2). Estas sustancias migran de la pulpa al interior de los cotiledones y, aunadas a las enzimas endógenas y el incremento de temperatura producido por la misma fermentación, propician la rápida degradación de proteínas y carbohidratos, dando lugar a péptidos, aminoácidos libres y azúcares reductores. Los ésteres, cetonas, aldehídos y alcaloides, son ejemplo de metabolitos que también pueden estar sujetos a la acción de los microorganismos(2,3). Otros productos de nula importancia sensorial pero que también pueden producirse durante la fermentación de alimentos ricos en proteínas (como las semillas de cacao) son las aminas biogénicas (AB)(4).
Las AB son compuestos nitrogenados de bajo peso molecular que se producen y se encuentran de forma natural en animales, plantas y microorganismos. Desempeñan funciones como estabilizadores de macromoléculas, precursores de hormonas y neurotransmisores(5,6). Algunas de las AB más reportadas en los alimentos son espermina (ESP), espermidina (ESPE) triptamina (TRIP), cadaverina (CAD) feniletilamina (FEN), histamina (HIS), tiramina (TIR) y putrescina (PUT)(7); mismas que pueden encontrarse en queso, carne, pescados, calamar, vino, cerveza y algunas semillas como soya y café(8,9). Sin embargo, el consumo de AB en cantidades elevadas por humanos puede llevar a intoxicaciones que van acompañadas de nauseas, mareos, dolor de cabeza, nausea, palpitaciones cardiacas, incremento o decremento de la presión arterial e inclusive la muerte(6,10-12).
Las AB pueden ser sintetizadas y degradadas de manera normal como resultado de la actividad metabólica en humanos, animales, plantas y microorganismos. Sin embargo, una ruta de producción muy común es vía descarboxilación de aminoácidos mediada por las amino-descarboxilasas de los microorganismos presentes en la fermentación(13), en esos casos la cantidad total y variedad de AB, dependerá de la naturaleza de la proteína que predomina en el alimento y de los microorganismos que participan en la fermentación(11,14,15). Las bacterias ácido lácticas (BAL) que participan frecuentemente en las fermentaciones de alimentos son ejemplo de esto, pues se han reportado bacterias específicamente del genero Lactobacillus tanto productoras(16,17) como degradadoras de AB(18-20) acción generada a través de enzimas amino oxidasas. Aunado a esto, otro mecanismo de producción de las AB es la descarboxilación oxidativa de los aminoácidos precursores mediado por procesos térmicos(21), reacción conocida como degradación de Strecker, la cual es secundaria a la reacción de Maillard(22). La degradación de Strecker se ve favorecida durante el tostado de las semillas de cacao.
Para conocer el tipo y cantidad de AB presente en los alimentos se puede recurrir a varios métodos, los más empleados son los enzimáticos(16) y los cromatográficos; de éstos últimos, la cromatografía líquida de alta resolución (HPLC) es la más empleada por su reproducibilidad y sensibilidad. Sin embargo, métodos sencillos como la cromatografía de capa fina (TLC) pueden ser una alternativa que permite detectar y cuantificar presuntivamente las AB, cuando no es posible recurrir a otros métodos instrumentales. La TLC es un procedimiento simple, rápido y económico, además permite el procesamiento simultáneo de una gran cantidad de muestras en un período corto de tiempo(23). Los procedimientos de TLC se han aplicado para determinar diferentes AB, como HIS, PUT, CAD y FEN, permitiendo la separación, identificación(24,25) y cuantificación(23).
Las semillas de cacao, por su contenido de proteínas [10,27-18,54 %](26) y por los procesos a los que son sometidas (fermentación, secado y tostado), pueden contener AB, tal como se ha reportado que ocurre en semillas de soya(27). Se ha reportado la presencia de histamina, tiramina y otras AB en productos procesados de cacao(9,28) y se argumenta que las condiciones del procesamiento influyen sustancialmente en la cantidad de AB presentes, así mientras más procesado un producto mayor contenido de AB(9). Desafortunadamente, no existe información del efecto que pueda tener la fermentación de las semillas crudas sobre la composición de AB. La presente investigación buscó analizar el papel de la fermentación espontánea en la producción-degradación de aminas biogénicas, así como evaluar el efecto de la adición de bacterias acido lácticas exógenas durante la fermentación y del tostado de las semillas en la concentración final de aminas biogénicas.
Métodos
Reactivos
Se emplearon dihidrocloruro de putrescina (No. P7505-25G), dihidrocloruro de tiramina (No. T2879-5G), dihidrocloruro de histamina (No. H7250-10G), cloruro de dansilo (No. 03641-100 MG) y trietilamina (T0886-1L) de la marca Sigma Aldrich®, todos de grado analítico. Además, se empleó etanol al 70% (Reproquifin®), nisina (Alimatec®), natamicina (Shandong Freda Biotechnology Co.), acetona (Química Binden®), cloroformo (J.T. Baker 917-03, Fisher Scientific) y éter etílico anhidro (Química Meyer®).
Diseño experimental y tratamientos
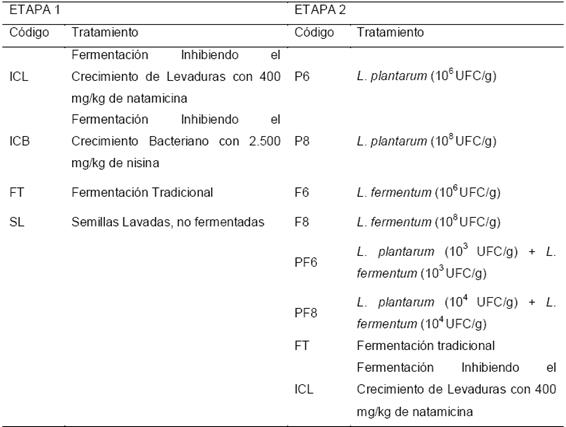
El estudio se desarrolló en dos etapas, en la primera etapa (E1) se exploró el papel de las bacterias ácido lácticas (BAL) sobre la presencia de AB y, en la segunda etapa (E2) se evaluó el potencial de BAL exógenas adicionadas a la fermentación sobre la producción-supresión de AB (Tabla 1).
Tabla 1. Tratamientos evaluados en dos etapas durante la fermentación de semillas de cacao
con y sin adición de bacterias ácido lácticas exógenas.
a Con excepción de FT, previo a la fermentación y adición de las BAL, a los demás tratamientos
se agregó natamicina (400 mg/kg) para inhibir el crecimiento de levaduras.
Para la E1, bajo un diseño de bloques completos al azar se establecieron los siguientes tratamientos: 1) fermentación inhibiendo el crecimiento de levaduras mediante la adición de 400 mg/kg de natamicina a la masa de fermentación (ICL); 2) fermentación inhibiendo el crecimiento bacteriano con la adición de 2.500 mg/kg de nisina (ICB); 3) fermentación tradicional (FT) y 4) semillas frescas lavadas, no fermentadas (SL).
Posteriormente, para la E2 bajo un diseño factorial 3 X 2 con medidas repetidas atraves del tiempo, se evaluaron seis tratamientos (Tabla 1) que resultaron de la incorporación individual y combinada (primer factor) de BAL del género Lactobacillus (L. plantarum, L. fermentum y L. plantarum + L. fermentum) y dos concentraciones finales (segundo factor) de inóculo (106 UFC/g o 108 UFC/g). Las bacterias empleadas fueron seleccionadas por dos criterios, son de las BAL, las que mayor actividad en la producción o degradación de AB se ha reportado(29), así también se ha demostrado que son bacterias predominantes en fermentaciones espontáneas de cacao proveniente de diversas partes del mundo(30).
Fermentaciones y procesamiento de semillas
Para ambas etapas (E1 y E2) se emplearon semillas frescas de frutos de cacao (Theobroma cacao L.) var. Trinitario provenientes de los municipios de Tuxtla Chico y Tapachula, Chiapas, México. Se seleccionaron frutos maduros y sanos, los cuales fueron transportados al laboratorio y procesados el mismo día de corte. Se lavaron con agua corriente y se desinfectaron con etanol al 70%. Los frutos fueron cortados de manera transversal por el centro con un cuchillo (desinfectado con etanol al 70%). Los granos fueron retirados manualmente de las mazorcas hasta completar la masa requerida de semilla con mucílago en función del número de tratamientos. Los granos fueron homogenizados completamente y posteriormente distribuidos en porciones de 250 g por tratamiento, los cuales fueron colocados en bolsas con cierre hermético (23 cm x 18 cm) para su posterior fermentación siguiendo el procedimiento descrito en la patente WO2013025621A1(31) simulando temperaturas para una curva de fermentación "típica"(32) utilizando una incubadora con control digital Ecoshel 9052.
Las BAL exógenas adicionadas en las fermentaciones de la E2 fueron adquiridas de la Colección Nacional de Cepas Microbianas y Cultivos Celulares del CINVESTAV, México. Se emplearon Lactobacillus plantarum ATCC 8014 y Lactobacillus fermentum ATCC 9338, las cuales se cultivaron en caldo MRS durante 48 h hasta lograr una concentración aproximada de 1X109 UFC/mL estimada por densidad óptica (DO= 1,8) a una longitud de onda de 560 nm con un espectrofotómetro (Thermo Scientific Genesys™ 20 modelo 4001/4) basado en datos preliminares (no mostrados) de una curva de crecimiento. Los volúmenes de caldo de cultivo adicionados se calcularon en base a la cantidad de semillas (250 g) y las concentraciones de BAL requeridas para cada tratamiento (Tabla 1). El volumen respectivo de caldo fue adicionado a la masa de fermentación, misma que previamente fue tratada con natamicina a una concentración de 400 mg/kg de masa de fermentación.
Para la etapa E1 se determinó cada 24 h el pH y la acidez titulable (AT) de los cotiledones de cacao durante 6 días a partir del inicio de la fermentación. El proceso de fermentación se detuvo cuando se alcanzaron los valores más bajos de pH y más altos en la AT tal como reporta Apriyanto(32). Para la etapa E2, además del pH y la AT se monitoreó el contenido de azucares reductores (AR) de los cotiledones. Para las determinaciones de pH y AT se pesaron 2 g de cotiledones sin testa, se maceraron y se disolvieron en 50 mL de agua destilada, la suspensión fue centrifugada a 3000 rpm por 10 min (centrífuga Eppendorf 5403); el pH se midió con un potenciómetro (OHAUS Starter 2100) y la AT fue determinada por titulación de 10 mL de solución con NaOH 0.1 N; ambas determinaciones siguiendo métodos descritos por la AOAC(33). Para los AR, se pesaron 0.2 g de cotiledón y se maceraron en 1 mL de agua destilada, posteriormente se centrifugó a 8,800 g por 15 min, el sobrenadante recuperado se usó para la determinación por el método de DNS(3).
Completadas las fermentaciones, las semillas de todos los tratamientos, junto con las que no fueron fermentadas (SL) se secaron en estufa de aire forzado (Felisa® FE291) a 60 °C hasta que la humedad de los granos alcanzó un valor de 7-8% (durante aproximadamente cuatro días). Después, las semillas fueron tostadas en parrilla eléctrica (Thermo Scientific™ SP88857100 Cimarec +) a 150 °C durante 15 min(26), posteriormente se eliminó la cascarilla y, los cotiledones sin testa fueron empleados para el análisis de AB. Dichas determinaciones se realizaron por triplicado.
Extracción y derivatización de aminas biogénicas
Se emplearon 5 g de semillas para la extracción de las AB. Las muestras fueron tomadas para los tratamientos de la E1 al inicio del estudio (día 0), terminada la fermentación (día 5) y después del tostado de las semillas; mientras que para la E2 las muestras fueron tomadas desde el inicio de la fermentación (día 0) y cada 24 h hasta el día 5 de fermentación, así como después del tostado. Para todas las muestras (sin fermentar, fermentadas o tostadas), los cotiledones sin testa fueron macerados y homogenizados durante 2 min con 30 mL de ácido tricloroacético (ATA) al 5% previamente calentado (80-90 °C), posteriormente la mezcla se dejó enfriar y centrifugó a 3000 rpm durante 10 min (Eppendorf Centrifuge 5415 D). El sobrenadante de la solución se filtró con papel Whatman No. 41 y el filtrado se usó para la derivatización (dansilación)(34) con algunas modificaciones. Se colocaron 100 μL de cada extracto en un tubo vial de 2 mL de capacidad, posteriormente se agregaron 100 μL de buffer fosfatos 0.1 M pH 9, 50 μL de NaOH 4 N y 200 μL de cloruro de dansilo (0,005 g en 1 mL de acetona). La mezcla fue agitada vigorosamente usando un vortex por 1 min, después el tubo fue cubierto con papel aluminio y puesto a incubación en baño seco (Kit-Lab DB-005) a temperatura de 55 °C por 1 h, posteriormente el tubo fue enfriado y almacenado a 5 °C hasta su uso.
Como estándares se prepararon soluciones con concentración de 20 mg/mL de cada una de las AB, histamina, tiramina y putrescina, posteriormente 100 μL de cada solución estándar fueron dansiladas siguiendo el procedimiento antes descrito.
Análisis semi-cuantitativo de aminas biogénicas
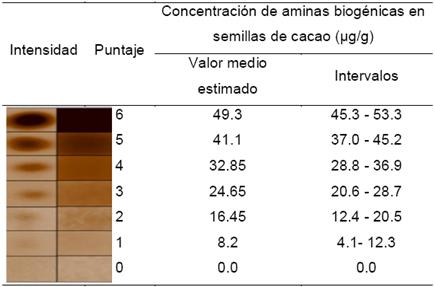
La identificación y cuantificación de las AB se realizó mediante cromatografía de placa fina (TLC)(23). Primeramente, en cromatoplacas de silica gel (GF254 TLC 6,6 cm X 20 cm, 0,25 mm de espesor, Merck®), se depositaron 10 μL de la solución de dansilado (estándar de amina o extracto de semilla) a distancia de 1 cm de la base con espacios de 1,3 cm entre cada muestra (por triplicado). Las cromatoplacas se eluyeron con dos sistemas (mezclas) de disolventes diferentes, el primer sistema contenía cloroformo:éter etílico:trietilamina (6:4:1, v/v), y el segundo sistema, cloroformo:trietilamina (4:1, v/v)(8). Terminadas las dos eluciones, las cromatoplacas fueron observadas y fotografiadas bajo luz UV en un fotodocumentador de imágenes Gel Doc™ XR+ (Bio-Rad) usando el software Image Lab ™. Obteniendo las distancias recorridas de cada uno de los estándares se calcularon los respectivos Rf (factor de retención) con ayuda del software Image J™ v. 1.51r para ubicar las manchas obtenidas en los distintos tratamientos. Este mismo procedimiento se repitió con soluciones (0 - 20 mg/mL) de los estándares de cada amina(35), y a partir de la intensidad de las manchas se construyó una escala colorimétrica, a la cual se le asignó un valor numérico codificado en el intervalo de 0 a 6, las equivalencias se muestran en la Tabla 2. Los valores mostrados en la escala se presentan como intervalos, toda vez que la intensidad corresponde a la concentración media entre dos puntos de concentración conocida.
Tabla 2. Escala de intensidad, puntaje otorgado y concentración aproximada de aminas biogénicas detectadas mediante ensayo por cromatografía de capa fina.
Análisis de datos
Los datos de pH, AT y AR fueron sometidos a análisis de la varianza y posterior comparación de medias con la prueba de Tukey (α = 0,05). Los valores de la concentración de AB fueron considerados como datos no continuos y sometidos a análisis de varianza no paramétrica (prueba de Kruskal Wallis; α = 0,05). Todos los análisis fueron realizados empleando el programa InfoStat versión 2015l.
Resultados
Etapa 1
Durante la etapa E1 del estudio, los parámetros de pH y AT fueron monitoreados para establecer el final de la fermentación. La Figura 1 muestra los resultados obtenidos de estos parámetros, mismos que no presentaron diferencias significativas (P>0,05) entre tratamientos. Se puede apreciar que al inicio de la fermentación se registraron valores para AT cercanos a 0,45% de ácido acético, mismos que descendieron en el día 2 para luego ir aumentando gradualmente y en función del tratamiento. Los días 2 y 3, los tratamientos FT e ICL presentaron un incremento en el valor de AT. Los valores de AT disminuyeron después del día 5 de fermentación (pico más alto observado para la mayoría de los tratamientos) El tratamiento ICB (donde solo crecieron levaduras) no mostró aumento en el contenido de AT el día 5, por el contrario, la AT descendió a partir del día 4. Respecto al pH los valores encontrados estuvieron cercanos a 5 desde el inicio de la fermentación y disminuyeron a partir del primer día con valores por debajo de 4. Posteriormente se observó un ligero incremento en los tratamientos ICB y FT.
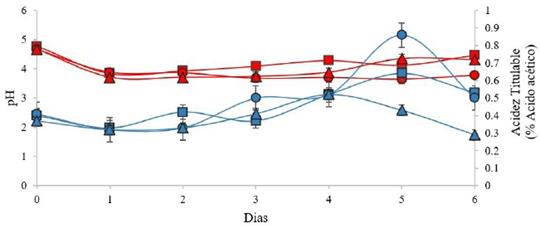
Figura 1. Comportamiento del pH (líneas rojas) y acidez titulable (líneas azules) durante la fermentación de semillas de cacao sometidos a diferentes tratamientos. Fermentación tradicional, FT (cuadros); fermentación inhibiendo el crecimiento de levaduras, ICL (círculos); fermentación inhibiendo el crecimiento de bacterias, ICB (triángulos).
El análisis de las cromatoplacas para la detección de AB de los tratamientos de la etapa E1 reveló la presencia de tres AB. Los valores de Rf de los estándares fueron HIS: 0,78±0,01, TIR: 0,23±0,01 y PUT: 0,06±0,01, los cuales se usaron como referencia para ubicar las AB en las muestras derivatizadas (Figura 2). Las variaciones del día inicial (previo a la fermentación), hacia el día final (después de 5 días de fermentación) mostraron que la TIR disminuyó tanto en FT como en ICL, mientras que en ICB se mantuvo sin cambios. Por su parte, la HIS presentó descenso en ICL, pero no en ICB, mientras que en FT hubo incremento pasando de 8,20 μg/g a 16,45 μg/g (Tabla 3). De manera similar, la PUT mostró un descenso en FT, mientras que ICL e ICB se mantuvieron sin cambios. Esta última AB fue encontrada en mayor concentración respecto a las demás (mayor intensidad de señal); con cantidades aproximadas de entre 41,10 y 49,35 μg/g de semilla (Tabla 3).
Para la mayoría de las AB (a excepción de la HIS en SL e ICB después de la fermentación) la cantidad de AB no aumentó con el proceso de tostado de las semillas (fermentadas durante 5 días). Aún después del tostado, la PUT fue la AB más abundante en la mayoría de los tratamientos (Figura 2).
Etapa 2
De manera similar a como se realizó en la E1, para los seis tratamientos de la etapa 2 (E2) se monitorearon el pH, la AT y el contenido de AR. Esta vez los parámetros fueron monitoreados hasta el día 7 de fermentación (Figura 3) para verificar los hallazgos de la E1, independientemente que las semillas para ser tostadas fueron retiradas del proceso el día 5 de fermentación. Los resultados correspondientes a AT no presentaron diferencias significativas (P>0,05), mostrando un incremento gradual similar a la E1, con valores debajo del 0,1% de ácido acético durante el inicio de fermentación, y posteriormente variaciones que van desde 0,22 hasta 0,52% para el día 6. De igual manera, para el pH todos los tratamientos mostraron resultados similares al encontrado en la E1, además de no presentar diferencias significativas (P>0,05). Los valores disminuyeron conforme avanzó la fermentación, mostrando variaciones en el día 6, tal como ocurrió en AT (Figura 3). Para el contenido de AR de igual manera no se presentaron diferencias significativas (P>0,05), se encontraron valores oscilantes y en aumento conforme avanzó la fermentación (Figura 3).

Figura 2. Cromatoplacas de los estándares utilizados y los tratamientos (por triplicado) evaluados en la E1 de la investigación (4 muestras por placa). Tiramina: flecha roja (Rf: 0,78±0,01); Histamina: flecha blanca (Rf: 0,23±0,01), Putrescina: flecha amarilla (Rf: 0,06±0,01). Para la elución se emplearon dos sistemas de solventes de manera secuencial; primer sistema, cloroformo:éter etílico:trietilamina (6:4:1), segundo sistema, cloroformo:trietilamina (4:1). Las cromatoplacas fueron observadas y fotografiadas bajo luz UV.
Tabla 3. Concentración de aminas biogénicas (μg/g) en semillas de cacao previo y posterior a la fermentación, así como después del tostado.
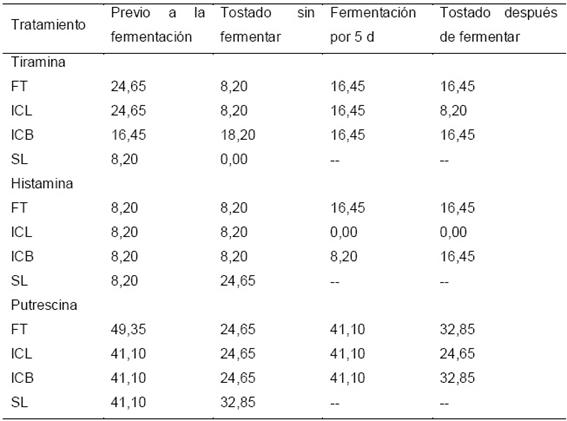
FT: Fermentación tradicional, ICL: Inhibición de crecimiento de levaduras, ICB: Inhibición de crecimiento de bacterias, SL: Semilla lavada, sin fermentar. --: no aplica.
Respecto al análisis de AB, en la E2 se encontró valores similares a los encontrados en la E1, la PUT fue la AB con mayor presencia en las semillas, tanto durante la fermentación, como después del tostado (Figura 4C) alcanzando picos de 41,1 μg/g para los días 2 (ICL), 5 (FT) y posterior al tostado (ICL), encontrándose en la mayoría de los tratamientos. TIR e HIS se produjeron en menor concentración y exhibieron valores promedio de 24,5 μg/g en sus picos más altos de producción (día 1) de fermentación en los tratamientos FT e ICL respectivamente (Figura 4A-4B).
Sobre el efecto de las dos cepas de Lactobacillus que se inocularon durante la fermentación (tratamientos P6, P8, F6, F8, PF6, PF8), no fue posible evidenciar de manera clara su acción productora o degradadora de AB (Figura 4), debido a que las fluctuaciones que se presentaron en las concentraciones de AB fueron muy similares entre estos tratamientos y con los que no se adicionaron las BAL (ICL y FT), además de que no se observaron diferencias estadísticas entre tratamientos (P>0,05). Los menores valores de las AB se encontraron en los tratamientos inoculados con L. plantarum (P6, P8) en semillas tostadas.
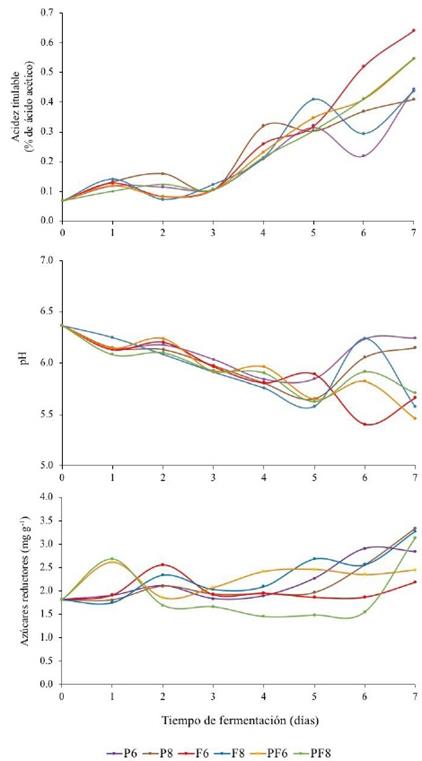
Figura 3. Cinética de acidez titulable, pH y azucares reductores de semillas de cacao sometidos a diferentes tratamientos de fermentación. P6: L. plantarum (106 UFC/g), P8: L. plantarum (108 UFC/g), F6: L. fermentum (106UFC/g), F8: L. fermentum (108UFC/g), PF6: L. plantarum (103UFC/g) + L. fermentum (103 UFC/g), PF8: L. plantarum (104UFC/g) + L. fermentum (104UFC/g).
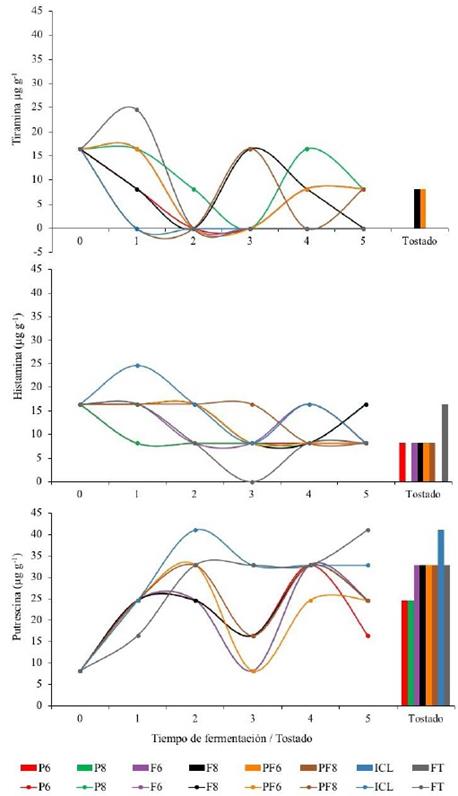
Figura 4. Cinética de aminas biogénicas en semillas de cacao sometidas a distintos tratamientos de fermentación por 5 días y su posterior tostado.
Después del tostado de las semillas, se observó que la PUT fue la única AB con presencia en todos los tratamientos independientemente de su concentración, respecto al día final de fermentación (día 5). Solo el tratamiento ICL mostró un aumento en la concentración posterior al tostado (llegando a 41,1 μg/g), mientras que en los tratamientos F6, F8, PF6, PF8 y FT no hubo cambios y, en dos tratamientos (P6 y P8) se observó disminución de la concentración respecto al día 5 de la fermentación. TIR se encontró solo en dos tratamientos (F8 y PF6), los cuales mostraron valores más altos respecto al final de la fermentación, mientras que HIS se observó en seis tratamientos (P6, F6, F8, PF6, PF8 y FT), de los cuales FT fue quien tuvo un aumento considerable respecto al día final de fermentación (Figura 4).
Discusión
De acuerdo con los resultados de la primera etapa (E1), el día óptimo para finalizar la fermentación fue el día 5, ya que el descenso posterior en los valores de AT puede resultar poco deseable en semillas de cacao de acuerdo con lo reportado por Apriyanto(32) quien observó un resultado similar al reportado en el presente estudio. La acidez y el pH son parámetros críticos en la calidad del cacao usado por la industria chocolatera. El exceso de ácido acético producido por una mala fermentación causa efectos adversos sobre el sabor del chocolate(36). El descenso en la AT del tratamiento ICB (Figura 1) posiblemente se debe a la producción de ácidos orgánicos volátiles; mismos que de estar presentes desaparecieron en los días siguientes ingresando solo una pequeña porción a las semillas tal como reporta Apriyanto(32). Así mismo el incremento de pH de los tratamientos ICB y FT puede deberse a que en ambos tratamientos predominan las levaduras, las cuales, aunque participan en la producción de algunos ácidos orgánicos y etanol, no son tan eficientes como las bacterias en la producción de sustancias que disminuyen el pH(37).
Los resultados obtenidos cuando se adicionaron BAL en la masa de fermentación (E2) aumentaron la producción de ácidos orgánicos cuantificados como AT y de la que se ha reportado la fracción prioritaria en cacao son ácido láctico y ácido acético(38). Debido a que en todos los tratamientos de la E2 se adicionó natamicina, el comportamiento no se puede atribuir a levaduras y puede ser debido a la aparición de bacterias acido acéticas (del ambiente), ya que estas aparecen en las fermentaciones de cacao a medida que avanza el proceso(2). Los valores de pH en la E2 para el día 5 (entre 5,58-5,89) coinciden con lo reportado previamente para cacaos mexicanos con valores de pH cercanos a 5(38). Valores muy bajos de pH en los cotiledones de cacao son indicio de sobrefermentación y se debe a la sobreproducción de ácidos carboxílicos y potencialmente de aminas biogénicas por descarboxilación enzimática de los correspondientes aminoácidos(39). El valor de pH de la pulpa de cacao, el calor y la alta aireación en la masa de cacao hacia las últimas etapas de la fermentación a menudo se asocian con un aumento en el número de bacterias aeróbicas formadoras de esporas. Si la fermentación continúa durante demasiado tiempo, estas bacterias y el crecimiento de mohos no deseados pueden causar algunos efectos negativos(40).
Los valores encontrados en el contenido de AR para la E2 (entre 1,5-3,5 mg/g) son inferiores a los reportados en otros estudios (valores de entre 3,57-10,69 mg/g) para semillas de cacao(41), pero independientemente de los tratamientos, la tendencia es similar a lo reportada, donde la concentración de AR aumentó durante la fermentación. Este aumento puede ser atribuido a la degradación enzimática de los azucares(42). Los contenidos de AR encontrados en las semillas de cacao muestran un efecto limitado de las BAL adicionadas, debido a que las diferencias entre tratamientos son pequeñas y la degradación de la sacarosa puede ser exclusivamente debida a la activación de las invertasas presentes en las mismas semillas(37). El contenido de AR puede ser importante en el contexto de la producción de AB, pues durante el tostado se promueven reacciones de degradación de Strecker, en presencia de α-dicarbonilos formados durante la reacción de Maillard(21,22), donde se sabe participan aminoácidos libres, oligopéptidos y AR(40).
No es extraño encontrar AB en frutas o vegetales de manera natural, pero su concentración generalmente es baja(28), por lo que las concentraciones encontradas en las semillas de cacao podrían estar revelando alta actividad descarboxilasa endógena, de lo cual existe escasa información para cacao y es difícil realizar una comparación; otra posibilidad que explique estas concentraciones es que durante el secado (para analizar las semillas) se promovió esta actividad, fenómeno que ya se ha reportado ocurre en semillas de café(43). Los resultados de la concentración de AB en la E1, sugieren una posible degradación de AB promovida por las bacterias presentes en la fermentación pues se ha reportado que bacterias del género Lactobacillus y Pediococcus son capaces de degradar simultáneamente HIS, TIR y PUT(20). Cualquier producto que contiene proteínas o aminoácidos libres y que este propenso a la acción microbiana es susceptible de poseer AB. Las AB generalmente se encuentran en productos fermentados y en concentraciones tan altas como quesos (5-4.500 mg/kg), vinos (5-50 mg/L), cervezas (2,8-13 mg/L), chucrut (110-300 mg/kg), aunque también pueden encontrarse en alimentos que no se almacenan adecuadamente, como el pescado (2.400-5.000 mg/kg), hígado de vaca (340 mg/kg), carnes preparadas (10-700 mg/kg)(44). Existe mucha discordancia sobre los límites máximos permitidos de AB, al respecto la Unión Europea ha establecido que la histamina y la tiramina son las AB más toxicas y relevantes desde el punto de vista de inocuidad. El mismo organismo sugiere que se pueden ingerir dosis de hasta 50 mg de histamina y 600 mg de tiramina por persona por alimento sin riesgo aparente(45). Aunque no existe normativa para cacao o productos derivados de esta semilla, la mayoría de los resultados obtenidos en el presente estudio están dentro del intervalo permisible para otros alimentos, suponiendo un consumo promedio de 250 g de cacao por persona. Los valores de AB encontrados en la E2 del presente estudio (intervalos de 0-24,65 μg/g para TIR, 0-24,65 μg/g para HIS y 8,2-41,1 μg/g para PUT) son similares a otros estudios(9) donde se reportan concentraciones de AB en productos elaborados a partir de cacao en los intervalos de 1,7-31,7 μg/g para TIR, 1,9-38,1 μg/g para HIS y 0,9-32,7 μg/g para PUT.
Los resultados de la cantidad de AB encontrados en la E2 pueden deberse a que las BAL adicionadas no tienen efecto sobre las AB y, en los tratamientos donde se adicionaron el efecto de otras bacterias que crecen de manera espontánea durante de la fermentación fue mayor. Es posible que otras condiciones de fermentación en cacao muestren efecto de esta BAL sobre las AB. Ensayos in vitro han demostrado que cepas de Lactobacillus y Pediococcus son capaces de degradar HIS, PUT y TIR encontrando que algunas de ellas son capaces de degradar simultáneamente más de una amina(19,20), específicamente L. plantarum, la cual al ser inoculada junto con Zygosaccharomyces rouxii en col fermentada disminuyó la concentración de PUT, CAD y TIR(46). Si los microorganismos no están ejerciendo efecto en la producción/degradación de AB, las fluctuaciones observadas también pueden atribuirse a la acción de las enzimas (endógenas) mono y diamino-oxidasas (degradadoras de AB) y amino descarboxilasa implicadas en la producción de AB(10,19). Las condiciones de pH y temperatura a la que fueron sometidas las fermentaciones en el presente estudio (pH 5-7, temperatura 37-50 °C) son óptimas para que las enzimas antes mencionadas actúen sobre su sustrato (pH de 5 -10 e intervalos de temperatura de 20 - 63 °C)(47). Otra posibilidad es que las BAL adicionadas puedan ejercer efecto específico sobre la producción/degradación de otras AB no analizadas en el presente estudio(17), tal es el caso cuando la producción de estas viene acompañada de otras moléculas como es el ácido gama-aminobutírico(48), además de que también influye la naturaleza de la proteína que predomina en el alimento(14,15). Otro factor a considerar es la concentración de los aminoácidos libres precursores de las AB analizadas y cuyas concentraciones oscilan en semillas de cacao de diversas partes del mundo alrededor de 0-2,1 mg/g para histidina (precursor de histamina), 3,9-5,7 mg/g para tirosina (precursor de tiramina) y 6,5-12,6 mg/g para el acido glutámico que puede convertirse en ornitina, precursor de putrescina(49).
En cacao se ha reportado que los tratamientos térmicos incrementan la cantidad de las AB(13), por el contrario, en la E1 del presente estudio, el tratamiento térmico (tostado) parece provocar disminución de la concentración de AB en la mayoría de los casos (Tabla 3). Lo anterior también ha sido reportado que ocurre para algunas AB en muestras de soya fermentada(50) y puede atribuirse a la pirólisis de las AB promovida por altas temperaturas (150-240 °C) tal como se ha reportado previamente(51). Los resultados de la concentración de PUT son similares a los encontrados en semillas de café donde después del tostado se encontró que la PUT era la AB predominante en las muestras, representado aproximadamente el 75% del contenido total(52). En el mismo estudio también se reporta disminución significativa en el contenido total de AB durante el tostado, con la degradación de PUT, ESP, HIS y TIR. Se han identificado varias AB (2-FEN, TIR, TRIP, serotonina y dopamina) en semillas de cacao tostadas(13) y se ha reportado que estos compuestos dieron las concentraciones más altas cuando el tostado se realiza a temperaturas de 150 °C y contenido de humedad de 5.0 %, lo anterior coincide con lo reportado en la E2 el estudio actual, donde PUT e HIS siguieron presentes en la mayoría de los tratamientos posterior al tostado (150 °C), esto se puede atribuir a la descarboxilación de aminoácidos o por aminación y transaminación de las cetonas y aldehídos producidos durante las degradaciones de Strecker(13).
Referencias
1. Camu N, De Winter T, Takrama JS, Verbrugghe K, Vancanneyt M, Cleenwerck I, et al. Dynamics and biodiversity of populations of lactic acid bacteria and acetic acid bacteria involved in spontaneous heap fermentation of cocoa beans in Ghana. Appl. Environm. Microbiol. 2007; 73: 1809-1824.
2. Kadow D, Niemenak N, Rohn S, Lieberei R. Fermentation-like incubation of cocoa seeds (Theobroma cacao L.)- Reconstruction and guidance of the fermentation process. LWT - Food Sci. Technol. 2015; 62: 357-361.
3. Rodríguez-Campos J, Escalona-Buendía HB, Orozco-Ávila I, Lugo-Cervantes E, Jaramillo-Flores ME. Dynamics of volatile and non-volatile compounds in cocoa (Theobroma cacao L.) during fermentation and drying processes using principal components analysis. Food Res. Int. 2011; 44: 250-258.
4. Jae-Hyung M. Fermented soybean foods: Significance of biogenic amines. Austin J. Nutr. Food Sci. 2015; 3: 1058.
5. Baranowska I, Plonka J. Simultaneous determination of biogenic amines and methylxanthines in foodstuff-sample preparation with HPLC-DAD-FL analysis. Food Anal. Methods 2015; 8: 963-972.
6. Flasarová R, Pachlová V, Buňková L, Menšíková A, Georgová N, Dráb V, et al. Biogenic amine production by Lactococcus lactis subsp. cremoris strains in the model system of Dutch-type cheese. Food Chem. 2016; 194: 68-75.
7. Romano A, Klebanowski H, La Guerche S, Beneduce L, Spano G, Murat ML, et al. Determination of biogenic amines in wine by thin-layer chromatography/densitometry. Food Chem. 2012; 135: 1392-1396.
8. Lapa-Guimarães J, Pickova J. New solvent systems for thin-layer chromatographic determination of nine biogenic amines in fish and squid. J. Chromatogr. A. 2004; 1045: 223-232.
9. Restuccia D., Spizzirri U. G., Puoci F. & Picci N. 2015. Determination of biogenic amine profiles in conventional and organic cocoa-based products. Food Additives & Contaminants: Part A. 32(7): 1156-1163.
10. Alvarez M, Moreno-Arribas M. The problem of biogenic amines in fermented foods and the use of potential biogenic amine-degrading microorganisms as a solution. Trends Food Sci. Technol. 2014; 39: 146-155.
11. Şanlibaba P, Uymaz B. Biogenic amine formation in fermented foods: cheese and wine. Eur. Int. J. Sci. Technol. 2015; 4: 81-92.
12. Spano G, Russo P, Lonvaud-Funel A, Lucas P, Alexandre H, Grandvalet C, et al. Biogenic amines in fermented foods. Eur. J. Clin. Nutr. 2010; 64: S95-S100.
13. Oracz J, Nebesny E. Influence of roasting conditions on the biogenic amine content in cocoa beans of different Theobroma cacao cultivars. Food Res. Int. 2014; 55: 1-10.
14. Lázaro CA, Conte-Júnior CA, Canto AC, Guerra MML, Costa-Lima B, Gomes DA, et al. Biogenic amines as bacterial quality indicators in different poultry meat species. LWT - Food Sci. Technol. 2015; 60: 15-21.
15. Loizzo MR, Menichini F, Picci N, Puoci F, Spizzirri UG, Restuccia D. Technological aspects and analytical determination of biogenic amines in cheese. Trends Food Sci. Technol. 2013; 30: 38-55.
16. Elsanhoty RM, Ramadan MF. Genetic screening of biogenic amines production capacity from some lactic acid bacteria strains. Food Control 2016; 68: 220-228.
17. Lorencová E, Buňková L, Matoulková D, Dráb V, Pleva P, Kubáň V, et al. Production of biogenic amines by lactic acid bacteria and bifidobacteria isolated from dairy products and beer. Int. J. Food Sci. Technol. 2012; 47: 2086-2091.
18. Callejón S, Sendra R, Ferrer S, Pardo I. Identification of a novel enzymatic activity from lactic acid bacteria able to degrade biogenic amines in wine. Appl. Microbiol. Biotechnol. 2014; 98: 185-198.
19. Capozzi V, Russo P, Laredo V, Fernandez M, Fiocco D, Alvarez AM, et al. Biogenic amines degradation by Lactobacillus plantarum: toward a potential application in wine. Front. Microbiol. 2012, 3: 122.
20. García-Ruiz A, González-Rompinelli EM, Bartolomé B, Moreno-Arribas MV. Potential of wine-associated lactic acid bacteria to degrade biogenic amines. Int. J. Food Microbiol. 2011; 148: 115-120.
21. Martins ACCL, Gloria MBA. Changes on the levels of serotonin precursors - tryptophan and 5-hydroxytryptophan - during roasting of Arabica and Robusta coffee. Food Chem. 2010; 118: 529-533.
22. Zamora R, Delgado RM, Hidalgo FJ. Formation of ß-phenylethylamine as a consequence of lipid oxidation. Food Res. Int. 2012; 46: 321-325.
23. Latorre-Moratalla ML, Bover-Cid S, Veciana-Nogués T, Vidal-Carou MC. Thin-layer chromatography for the identification and semi-quantification of biogenic amines produced by bacteria. J. Chromatogr. A. 2009; 1216: 4128-4132.
24. Bäumlisberger M, Moellecken U, König H, Claus H. The potential of the yeast Debaryomyces hansenii H525 to degrade biogenic amines in food. Microorganisms 2015; 3: 839-850.
25. García-Moruno E, Carrascosa AV, Muñoz R. A rapid and inexpensive method for the determination of biogenic amines from bacterial cultures by thin-layer chromatography. J. Food Prot. 2005; 68: 625-629.
26. Vázquez-Ovando A, Chacón-Martínez L, Betancur-Ancona D, Escalona-Buendía H, Salvador-Figueroa M. Sensory descriptors of cocoa beans from cultivated trees of Soconusco, Chiapas, Mexico. Food Sci. Technol. 2015; 35: 285-290.
27. Farah DMH, Zaibunnisa AH, Misnawi A. Optimization of cocoa beans roasting process using Response Surface Methodology based on concentration of pyrazine and acrylamide. Int. Food Res. J. 2012; 19: 1355-1359.
28. Spizzirri UG, Parisi OI, Picci N, Restuccia D. Application of LC with evaporative light scattering detector for biogenic amines determination in fair trade coco-based products. Food Anal. Methods. 2016; 9: 2200-2209.
29. Pugin B, Barcik W, Westermann P, Heider A, Wawrzyniak M, Hellings P, et al. A wide diversity of bacteria from the human gut produces and degrades biogenic amines. Microb. Ecol. Health Dis. 2017; 28: 1353881.
30. Schwan RF, Wheals AE. The microbiology of cocoa fermentation and its role in chocolate quality. Crit. Rev. Food Sci. Nutr. 2004; 44: 205-221.
31. Seguine E, Mills D, Marelli JP, Motamayor-Arias JC, Silva CIDA. Micro-Fermentation of cocoa. Patente Internacional No. WO2013025621A1. 2013.
32. Apriyanto M. Changes in chemical properties of dried cocoa (Theobroma cacao) beans during fermentation. Int. J. Fermented Foods 2016; 5: 11-16.
33. Horwitz W, Latimer GW. Official methods of analysis of AOAC international, 18th ed., 3rd rev. Gaithersburg, Maryland, USA. 2010.
34. Jeya SR, Vasundhara TS, Kumudavally KV. A comparison of the TLC-densitometry and HPLC method for the determination of biogenic amines in fish and fishery products. Food Chem. 2001; 75: 255-259.
35. Shakila RJ, Nasundhara TS, Kumudavally KV. A comparison of the TLC-densitometry and HPLC method for the determination of biogenic amines in fish and fishery products. Food Chem. 2001; 75: 255-259.
36. Luna F, Crouzillat D, Cirou L, Buchelli P. Chemical composition and flavor of Ecuatorian cocoa liquor. J. Agric. Food Chem. 2002; 50: 3527-3532.
37. Afoakwa EO, Kongor JE, Takrama J, Budu AS. Changes in nib acidification and biochemical composition during fermentation of pulp pre-conditioned cocoa (Theobroma cacao) beans. Int. Food Res. J. 2013; 20: 1843-1853.
38. Hernández-Hernández C, López-Andrade PA, Ramírez-Guillermo MA, Guerra RD, Caballero PJF. Evaluation of different fermentation processes for use by small cocoa growers in Mexico. Food Sci. Nutr. 2016; 4: 690-695.
39. Cros E, Jeanjean N. Cocoa quality: effect of fermentation and drying. Plantations, Recherche, Développement 1995; 24: 25-27.
40. Aprotosoaie AC, Luca SV, Miron A. Flavor chemistry of cocoa and cocoa products-an overview. Compr. Rev. Food Sci. Food Saf. 2016; 15: 73-91.
41. Afoakwa EO, Budu AS, Mensah-Brown H, Dan Felix J. Changes in biochemical and physico-chemical qualities during drying of pulp preconditioned and fermented cocoa (Theobroma cacao) beans. J. Nutr. Health Food Sci. 2014; 2: 1-8.
42. De Vuyst L, Weckx S. The cocoa bean fermentation process: from ecosystem analysis to starter culture development. J. Appl. Microbiol. 2016; 121: 5-17.
43. Dias EC, Pereira RG, Borém FM, Mendes E, de Lima RR, Fernandes JO, et al. Biogenic amine profile in unripe Arabica coffee beans processed according to dry and wet methods. J. Agric. Food Chem. 2012; 60: 4120-4125.
44. Papageorgiou M, Lambropoulou D, Morrison C, Kłodzińska E, Namieśnik J, Płotka-Wasylka J. Literature update of analytical methods for biogenic amines determination in food and beverages. Trends Analyt. Chem. 2018; 98: 128-142.
45. EFSA. Panel on Biological Hazards (BIOHAZ); Scientific Opinion on Scientific Opinion on risk based control of biogenic amine formation in fermented foods. EFSA J. 2011; 9: 2393.
46. Wu C, Zheng J, Huang J, Zhou R. Reduced nitrite and biogenic amine concentrations and improved flavor components of Chinese sauerkraut via co-culture of Lactobacillus plantarum and Zygosaccharomyces rouxii. Ann. Microbiol. 2013; 64: 847-857.
47. Dapkevicius MLNE, Nout MJR, Rombouts FM, Houben JH, Wymenga W. Biogenic amine formation and degradation by potential fish silage starter microorganisms. Int. J. Food Microbiol. 2000; 57: 107-114.
48. Kim NY, Ji GE. Characterization of the production of biogenic amines and gamma-aminobutyric acid in the soybean pastes fermented by Aspergillus oryzae and Lactobacillus brevis. J Microbiol. Biotechnol. 2015; 25: 464-468.
49. Rohsius C, Matissek R, Lieberi R. Free amino acid amounts in raw cocoas from different origins. Eur. Food Res. Technol. 2006; 222: 432-438.
50. Yoon SH, Kim MJ, Moon B. Various biogenic amines in Doenjang and changes in concentration depending on boiling and roasting. Appl. Biol. Chem. 2017; 60: 273-279.
51. Amorim HV, Basso LC, Crocomo OJ, Teixeira AA. Polyamines in green and roasted coffee. J. Agric. Food Chem. 1977; 25: 957-958.
52. Oliveira SD, Franca AS, Gloria MBA, Borges MLA. The effect of roasting on the presence of bioactive amines in coffees of different qualities. Food Chem. 2005; 90: 287-291.
